健骨颗粒通过G1/S期调控蛋白对成骨细胞增殖的影响
2016-10-19贾晓康黄云梅李超雄林煜林向全黄美雅吴银生
贾晓康 黄云梅 李超雄 林煜 林向全 黄美雅 吴银生

[摘要] 目的 观察健骨颗粒对成骨细胞G1/S期调控的影響,探讨健骨颗粒促进成骨细胞增殖的作用机制。 方法 制备健骨颗粒血清组、模型血清组和雌二醇血清组。采用酶消化法培养SD大鼠成骨细胞,健骨颗粒含药血清干预,以模型血清和雌二醇血清为对照。运用流式细胞术检测成骨细胞增殖周期,荧光定量PCR法检测成骨细胞G1/S期调控蛋白Cyclin E、CDK2、p21和转录因子E2F-1 mRNA的表达。 结果 15%的雌二醇血清与健骨颗粒血清干预48 h,成骨细胞增殖速度均明显快于模型血清组(P < 0.01);G0/G1期成骨细胞比例明显降低(P < 0.01),S期、G2/M期细胞比例及增殖指数则明显高于模型血清组(P < 0.01);与模型血清组比较,雌二醇血清组与健骨颗粒血清组能提高成骨细胞Cyclin E、CDK2及转录因子E2F-1 mRNA的表达(P < 0.01),而降低p21的表达(P < 0.01)。 结论 健骨颗粒通过调节成骨细胞G1/S期调控机制,推进成骨细胞顺利通过G1/S检测点,促进成骨细胞增殖。
[关键词] 绝经后骨质疏松症;成骨细胞;细胞周期;G1/S期;健骨颗粒
[中图分类号] R285.5;R681 [文献标识码] A [文章编号] 1673-7210(2016)03(c)-0009-05
[Abstract] Objective To observe the effects of Jiangu Granules on the G1/S phase cell-cycle regulated proteins of osteoblasts, so as to reveal the mechanism of Jiangu Granules in promoting osteoblasts proliferation. Methods The Jiangu Granules-serum group, model-serum group and estradiol-serum group were prepared. Osteoblasts of SD rats were cultivated by enzymatic digestion and intervened with Jiangu Granules-serum, model-serum and estradiol-serum (as control) respectively. The cell cycles were analyzed by flow cytometry, while the fluorescence quantitative PCR was applied to measure cyclin E, CDK2, p21 and E2F-1 mRNA. Results The cell proliferation rates of osteoblasts intervened with estradiol serum and Jiangu Granules-serum for 48 hours were faster than that with the same concentration model-serum (P < 0.01). Compared with the model-serum group, the proportion of osteoblasts in the G0/G1 phase were significantly reduced after intervention with 15% of estradiol serum and Jiangu Granules-serum for 48 hours (P < 0.01), while the proportion of cells in S phase, G2/M phase and proliferation index was much higher (P < 0.01). The expression of cycling E, CDK 2 and transcription factor E2F-1 mRNA of osteoblasts in the Jiangu Granules-serum group and the estradiol-serum group was higher than that of model-serum group (P < 0.01), while the expression of p21 mRNA was lower than the model-serum group (P < 0.01). Conclusion Jiangu Granules-serum can adjust the G1/S phase cell-cycle regulated mechanism in osteoblast, so as to push the cells passing G1/S checkpoint and accelerate the proliferation of osteoblast.
[Key words] Postmenopausal osteoporosis; Osteoblast; Cell cycle; G1/S phase; Jiangu Granules
骨质疏松症形成的主要原因是骨形成、骨吸收偶联的破坏,使骨形成减少、骨量降低。成骨细胞在骨代谢、骨形成和维持成年骨骼系统正常中有着主要作用[1],而成骨细胞增殖周期的进程受周细胞周期蛋白的调控,其中G1/S期检测点是细胞周期进程中最重要的检测点[2],主要受Cyclin E、CDK2、p21和转录因子E2F等G1/S期调节蛋白的调控。前期研究表明,健骨颗粒可以促进成骨细胞增殖,对防治骨质疏松症有积极的作用[3-4]。本研究以成骨细胞G1/S期调控为切入点,观察补肾健脾中药健骨颗粒对体外培养成骨细胞G1/S期调控蛋白Cyclin E、CDK2、p21和转录因子E2F mRNA的影响,探讨健骨颗粒促进成骨细胞增殖的作用机制,对于进一步认识成骨细胞增殖的机制,治疗和预防骨质疏松症有着重要意义。
1 材料与方法
1.1 实验药物
健骨颗粒由煅狗骨、淫羊藿、山茱萸、山药、党参等药物组成,原药材购自福建省医药公司,由福建中医药研究院中试车间负责加工制备,每克健骨颗粒含原生药2.9 g。戊酸雌二醇(德国BAYER公司生产,批号:199A2),购自福州回春医药连锁有限公司。
1.2 实验动物
6 月龄清洁级雌性SD大鼠30只[购自上海斯莱克实验动物有限责任公司,实验动物合格证号:SCXK(沪)2007-0005,编号:2007000514856],大鼠体重(250±20)g。医学实验动物环境设施为福建中医药大学动物实验中心鼠类实验室,清洁级[许可证号:SYXK(闽)2009-0001]。新生24 h内的SD大鼠4只[购自福建医科大学实验动物中心,动物合格证号:SCXK(闽)2004-00023],以酶消化法分离其颅盖骨成骨细胞进行体外培养。
1.3 实验试剂
Ⅰ型胶原酶、0.25%胰蛋白酶、MTT噻唑藍(Sigma公司);胎牛血清、青链霉素双抗溶液、低糖DMEM 培养基(新西兰Hyclone公司);细胞碱性磷酸酶(CAKP)染色试剂盒(南京建成生物工程研究所);TRIZOL(美国Invitrogen公司);反转录试剂盒、SYBR GREENⅠ 荧光定量试剂盒(TaKaRa公司);PCR引物合成(上海生工生物技术有限公司);CycleTESTTM Plus DNA Reagent Kit(美国Becton Dickinson公司)。
1.4 仪器与设备
AIR TECH无菌操作台(苏净集团安泰公司);二氧化碳恒温培养箱(BB16/BB5060型,德国Heraus公司);超低温冰箱MDF-U4086s型(日本三洋公司);Olympus倒置相差显微镜(日本奥林巴斯株式会社);紫外分光光度计Du650型、低温高速离心机64R型(美国BECKMAN公司);Milli-Q超纯水系统(美国MILIPORE公司);流式细胞仪FACSCalibur(美国Becton Dickinson公司);7500型实时荧光定量PCR仪(美国Applied Biosystems公司)。
1.5 方法
1.5.1 含药血清制备 30只6月龄SD雌性大鼠,按照随机数字表法随机分成模型血清组、雌二醇血清组和健骨颗粒血清组,每组各10只。各组大鼠行双侧卵巢切除术并于术后第13周开始灌胃,雌二醇血清组、健骨颗粒血清组分别给予戊酸雌二醇100 μg/(kg·d)或健骨颗粒2 g/(kg·d),模型血清组喂服生理盐水2 mL/d。各组动物灌胃12周,于最后1次灌胃1 h后腹主动脉无菌取血,离心分离血清,灭火、过滤除菌后,-20℃冰箱中保存备用。
1.5.2 成骨细胞培养 取新生SD大鼠4只,采用酶消化法分离收集颅骨成骨细胞进行传代培养,差速贴壁法进行纯化。
1.5.3 MTT法检测成骨细胞增殖 取第3代细胞以2×103/孔接种于96孔板中,分别加入含5%、10%、15%、20%、25%、30%健骨颗粒血清、雌二醇血清或模型血清的DMEM培养基,每个浓度设6孔,干预48 h后MTT法检测比较不同浓度含药血清和模型血清对细胞增殖的影响,并得出最佳含药血清浓度。
1.5.4 成骨细胞的分组干预 取第3代细胞以1×105/mL传代接种于培养瓶中,根据不同的分组分别加入不同含药血清,各组分别加入含最佳浓度健骨颗粒血清的DMEM培养基、相应浓度模型血清或雌二醇血清培养基,每组设6孔,于干预培养48 h后,采用流式细胞术分析成骨细胞的细胞周期,采用实时荧光定量PCR SYBR GREEN法检测Cyclin E、CDK2、p21和转录因子E2F-1 mRNA的表达。
1.5.5 流式细胞术检测 按试剂说明书提供的实验步骤进行上机前处理,上流式细胞仪检测,应用CellQuest软件获取细胞100个,ModFit软件分析DNA数据,读取G0/G1期、S期、G2/M期细胞数,计算细胞增殖指数(proliferation index,PI)。
1.5.6 实时荧光定量PCR法检测Cyclin E、CDK2、E2F-1、p21 mRNA表达 采用Trizol法提取细胞总RNA,根据反转录试剂盒提供实验步骤进行逆转录,合成Cyclin E、CDK2、E2F-1、p21扩增引物,根据两步法标准Real Time PCR扩增程序进行扩增,用参照基因β-actin对所有样品进行校正,7500型实时定量PCR仪软件分析时,以模型血清组中某一样本mRNA的表达量作为“1”,计算出各组其他样本的相对表达量(即RQ值),利用各组样本的RQ值进行统计,比较组间mRNA相对含量[5]。
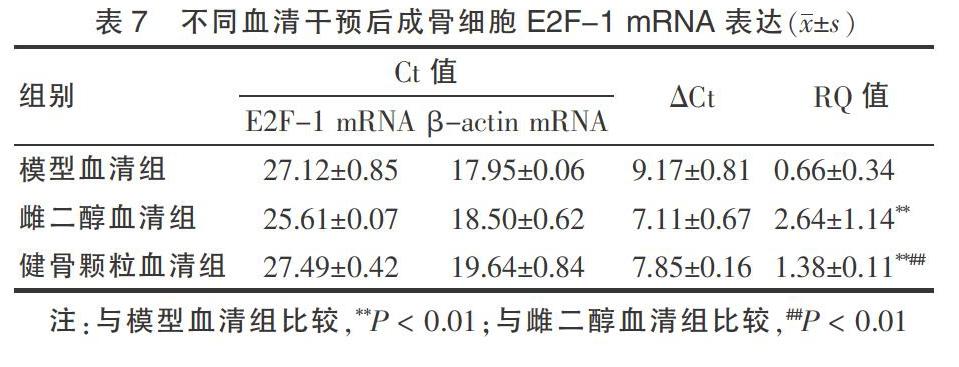
Cyclin E、CDK2、E2F-1、p21引物序列见表1。
1.6 统计学方法
实验数据运用SPSS 15.0软件包进行处理分析,实验数据采用均值±标准差(x±s)表示,各组间数据比较采用One-way ANOVA(单向方差分析)法。以P < 0.05为差异有统计学意义。
2 结果
2.1 不同浓度含药血清干预后成骨细胞增殖情况
采用MTT检测成骨细胞增殖,给予不同浓度模型血清、雌二醇血清和健骨颗粒血清干预48 h后,模型血清组、雌二醇血清组和健骨颗粒血清组成骨细胞增殖速度因干预浓度的不同而差异明显。在血清浓度低于20%前,成骨细胞随血清浓度的增加而增殖加快;当血清浓度达到20%时,各组成骨细胞增殖最快;血清浓度继续升高则细胞增殖逐渐降低。其中,雌二醇血清组和健骨颗粒血清组细胞增殖速度明显快于同浓度模型血清组,以15%浓度时增殖速度与模型血清组差异有高度统计学意义(P < 0.01);健骨颗粒血清组成骨细胞增殖速度与雌二醇血清组相近,差异无统计学意义(P > 0.05)。见表2。取15%血清作为干预成骨细胞的最佳浓度,进行后续实验。
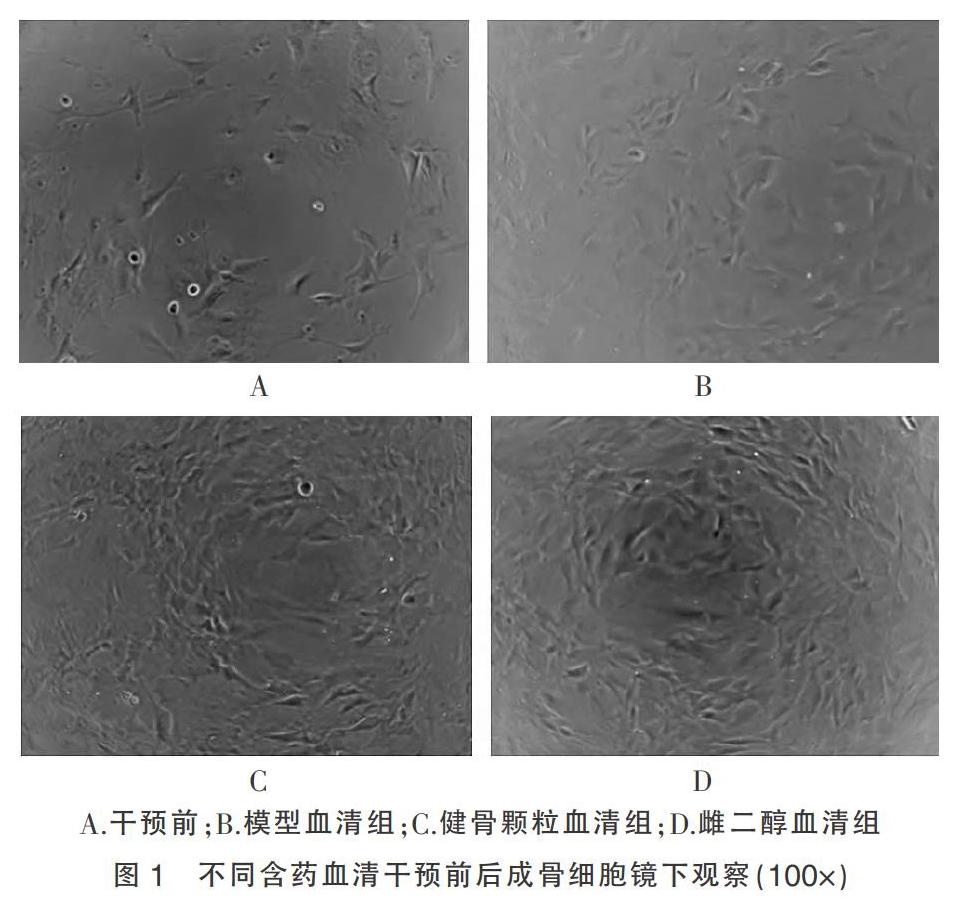
2.2 不同含药血清干预48 h前后成骨细胞镜下观察
不同含药血清干预前后成骨细胞的镜下观察,可见干预前成骨细胞排列不整齐,细胞数量少,且细胞间隙大,见图1A。而干预后三组细胞数量都有增加,但模型血清组干预48 h后的,细胞间隙较大,见图1B。而健骨颗粒血清组与雌二醇血清组干预48 h后细胞形态较一致,排列较整齐,细胞间隙较窄,同视野下细胞数量明显比模型血清组密度大,见图1C~D。
2.3 不同含药血清干预后成骨细胞细胞周期的分布
流式细胞术检测结果显示,与模型血清组比较,15%的雌二醇血清与健骨颗粒血清干预48 h后,G0/G1期成骨细胞比例明显降低(P < 0.01),而S期、G2/M期细胞比例及PI则明显高于模型血清组(P < 0.01);雌二醇血清组与健骨颗粒血清组二组的成骨细胞周期分布情况相近,二者比较差异无统计学意义(P > 0.05)。此外,模型血清组细胞周期分布图中G0/G1期之前出现明显的凋亡峰,而雌二醇血清组与健骨颗粒血清組细胞凋亡峰明显降低,甚至消失。见图2、表3。
2.4 不同含药血清干预后成骨细胞G1/S期调控蛋白mRNA表达
2.4.1 成骨细胞Cyclin E mRNA的表达 以15%浓度的不同血清干预成骨细胞48 h后,荧光定量PCR检测显示,与模型血清组比较,雌二醇血清组与健骨颗粒血清组成骨细胞Cyclin E mRNA表达(RQ值)升高,组间比较差异有统计学意义(P < 0.05);雌二醇血清组与健骨颗粒血清组Cyclin E mRNA表达相近,二者差异无统计学意义(P > 0.05)。见表4。
2.4.2 成骨细胞CDK2 mRNA的表达 荧光定量PCR检测15%血清干预48 h后模型血清组、雌二醇血清组和健骨颗粒血清组成骨细胞CDK2 mRNA结果显示,与模型血清组比较,雌二醇血清组与健骨颗粒血清组成骨细胞CDK2 mRNA表达大大增加,组间比较差异有高度统计学意义(P < 0.01);而雌二醇血清组与健骨颗粒血清组CDK2 mRNA表达差异无统计学意义(P > 0.05)。见表5。
2.4.3 成骨细胞p21 mRNA的表达 荧光定量PCR检测成骨细胞p21 mRNA结果显示,15%模型血清、雌二醇血清和健骨颗粒血清分别干预模型血清组、雌二醇血清组和健骨颗粒血清组成骨细胞48 h后,雌二醇血清组与健骨颗粒血清组成骨细胞 p21 mRNA表达情况相近(P > 0.05),均明显低于模型血清组(P < 0.01)。见表6。
2.4.4 成骨细胞转录因子E2F-1 mRNA 的表达 以15%浓度的不同血清干预成骨细胞模型血清组、雌二醇血清组和健骨颗粒血清组48 h后,荧光定量PCR检测显示,健骨颗粒血清组成骨细胞转录因子E2F-1 mRNA表达明显高于模型血清组,但逊于雌二醇血清组,组间比较差异均有高度统计学意义(P < 0.01)。见表7。
3 讨论
祖国医学认为肾亏脾虚是绝经后骨质疏松症的发病基础[6-7],肾虚为骨质疏松症发生的根本,而脾虚是骨质疏松症产生的重要病机,在治疗上以补肾健脾之法作为开药法则,可有效防止人体骨量的丢失[8]。用补肾方药探讨骨质疏松症分子生物学机制为基础医学研究的热点[9-11]。复方中药能够促进成骨细胞增殖分化,提高骨密度[12],针对“肾亏脾虚”的病机特点,补肾健脾中药健骨颗粒以“补先后天”的理论为组方原则,选用煅狗骨、淫羊藿、山茱萸、党参、山药等药,以补肾健脾,强筋壮骨。前期研究表明,健骨颗粒能通过调节去卵巢骨质疏松大鼠垂体-肾上腺轴的功能[13],明显提高去卵巢大鼠血清E2水平[14];提高体外培养成骨细胞G1期调节蛋白正性调节因子Cyclin D1、CDK4蛋白的表达,促进成骨细胞增殖周期G1期进程[15]。
本研究用成骨细胞为新生SD大鼠颅骨培养,纯度较高,生物学特征稳定,成骨活性和细胞增殖良好。镜下观察48 h血清干预后,健骨颗粒血清组与雌二醇血清组增殖明显优于模型血清组。MTT法检测不同浓度含药血清对成骨细胞增殖的影响,雌二醇血清组和健骨颗粒血清组细胞增殖速度明显快于同浓度模型血清组,以15%浓度时增殖速度与模型血清组差异最显著(P < 0.01);健骨颗粒血清组成骨细胞增殖速度与雌二醇血清组相近(P > 0.05)。流式细胞术检测结果显示,与模型血清组比较,15%的雌二醇血清与健骨颗粒血清干预48 h后,G0/G1期成骨细胞比例明显降低(P < 0.01),而S期、G2/M期细胞比例及PI则明显高于模型血清组(P < 0.01);雌二醇血清组与健骨颗粒血清组的成骨细胞周期分布情况相近,二者比较无显著性差异(P > 0.05)。研究表明,雌激素缺乏导致了骨代谢中骨形成及骨吸收的失衡,最终造成骨质疏松的发生[16-17]。雌激素具有促进成骨细胞增殖的作用,这是通过激活G1/S期的调节蛋白促进细胞周期的G1进程来实现的[18-19]。本研究采用不同含药血清干预后成骨细胞G1/S期调控蛋白 mRNA表达发现:用雌二醇作用于体外培养的成骨细胞,能使成骨细胞Cyclin E、CDK2和转录因子E2F-1 mRNA的表达明显提高,而p21 mRNA的表达降低,提示雌二醇能大量激活Cyclin E、CDK2,活化转录因子E2F-1,促进G1/S期转换,推动细胞周期进程,促进成骨细胞增殖;并能抑制G1/S期负性调节因子p21表达,减少成骨细胞G1周期阻滞,进而抑制成骨细胞G1期凋亡,这可能是雌激素保护成骨细胞凋亡的作用机制之一[20]。而健骨颗粒在促成骨细胞增殖和保护成骨细胞凋亡上,均能发挥与雌二醇相近的作用。健骨颗粒在推进成骨细胞增殖周期G1期进程后,能进一步激活Cyclin E、CDK2,活化转录因子E2F-1,促进G1/S期转换,使细胞增殖进入S期,从而促进成骨细胞增殖;同时抑制p21,减少成骨细胞G1周期阻滞,进而抑制成骨细胞G1期凋亡。健骨颗粒的这一作用可能与其能提高E2水平有关,通过调控G1/S期相关蛋白来促进成骨细胞增殖。
[参考文献]
[1] 靳慧,葛娅娜,张成仁,等.成骨细胞中基因表达的调控[J].中国组织化学与细胞化学杂志,2011,20(5):499-502.
[2] 秦光明,黄晓俊,魏义胜.Cyclin E与结直肠癌的研究进展[J].世界华人消化杂志,2012,20(2):131-134.
[3] 吴银生,林燕萍,卢天祥,等.健骨颗粒含药血清对大鼠成骨细胞G1期调节蛋白的影响[J].中国中西医结合杂志,2010,30(9):966-969.
[4] 林燕萍,周瑞祥,张爱平,等.健骨颗粒对去卵巢骨质疏松模鼠骨组织结构的影响[J].解剖学杂志,2001,24(6):521-526.
[5] 林海鸣,林燕萍,吴银生.健骨颗粒含药血清对成骨样细胞OPG、RANKL mRNA表達的影响[J].福建中医药大学学报,2012,22(1):19-21.
[6] 陈丽娜,朱伍,黄健萍,等.温肾育宫汤治疗绝经后骨质疏松症疗效观察[J].光明中医,2010,25(7):1152-1154.
[7] 姚新苗,徐禄基,冷涛,等.益骨口服液对去势大鼠骨密度与骨生物力学的影响[J].浙江中医药大学学报,2010, 34(2):142-143.
[8] 曹亚飞,刘红敏,刘庆思.骨质疏松症的中医证型与治疗原则探讨[J].中国骨质疏松杂志,2002,8(4):367-369.
[9] 林煜,卢天祥,吴银生,等.健骨颗粒促进成骨细胞增殖的分子机制[J].中国组织工程研究,2013,17(15):2677-2684.
[10] 贾英民,李瑞玉,武密山,等.补肾方药有效成分不同比例配伍对成骨细胞增殖和分化的影响[J].中国组织工程研究,2015,19(24):3773-3777.
[11] 许兵,金红婷,王萧枫,等.补肾活血含药血清对成骨细胞经典Wnt/β-catenin通路的影响研究[J].中国骨伤,2015,28(6):553-558.
[12] 颜军礼,李蒙,李瑞玉,等.中药复方对成骨细胞增殖及骨密度的影响[J].中国组织工程研究,2013,17(33):6055-6060.
[13] 林燕萍,周瑞祥,马建华,等.健骨颗粒对骨质疏松模型大鼠垂体-肾上腺轴的影响[J].中国骨伤,2004,17(1):19-21.
[14] 林燕萍,周瑞祥,冯尔宥,等.健骨颗粒对去卵巢骨质疏松模型鼠钙调节激素的影响[J].中国骨伤,2005,18(1):22-24.
[15] 程浩,张延芳,许巍.新生大鼠成骨细胞原代培养与鉴定[J].中国组织工程研究,2013,17(41):7199-7204.
[16] 李洪亮,司家文,沈国芳.骨代谢过程中雌激素的影响与作用[J].中国组织工程研究,2015,19(7):1077-1081.
[17] 李传洁,王俊成,刘娜,等.雌激素缺乏对大鼠成骨细胞细胞形态及增殖的影响[J].中华老年口腔医学杂志,2015, 13(3):132-137.
[18] Kashima H,Shiozawa T,Miyamot T,et al. Autocrine stimulation of IGF1 in estrogen-induced growth of endometrial carcinoma cells:involvement of the mitogen- activated protein kinase pathway followed by up-regulation of cyclin D1 and cyclin E [J]. Endocr Relat Cancer,2009,16(1):113-122.
[19] Prall OW,Sarcevic B,Musgrove EA,et al. Estrogen-induced activation of Cdk4 and Cdk2 during G1-S phase progression is accompanied by increased Cyclin D1 expression and decreased Cyclin-dependent Kinase inhibitor association with Cyclin E-Cdk2 [J]. J Biol Chem,1997,272(16):10882-10894.
[20] 邹世恩,张绍芬.雌激素对成骨细胞和破骨细胞凋亡的调节机制[J].现代妇产科进展,2006,15(7):547-548.
(收稿日期:2015-10-28 本文编辑:张瑜杰)
