低温胁迫下白菜型冬油菜差异蛋白质组学及光合特性分析
2016-10-19刘自刚袁金海孙万仓曾秀存王志江武军艳园李学才
刘自刚 袁金海 孙万仓 曾秀存 方 彦 王志江 武军艳 方 园李学才 米 超
甘肃省油菜工程技术研究中心 / 甘肃省干旱生境作物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室 / 甘肃农业大学农学院, 甘肃兰州730070
低温胁迫下白菜型冬油菜差异蛋白质组学及光合特性分析
刘自刚 袁金海 孙万仓 曾秀存 方 彦 王志江 武军艳 方 园李学才 米 超
甘肃省油菜工程技术研究中心 / 甘肃省干旱生境作物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室 / 甘肃农业大学农学院, 甘肃兰州730070
分离鉴定白菜型冬油菜低温差异表达蛋白质, 从蛋白质组角度为揭示白菜型冬油菜抗寒机理奠定基础。以强抗寒白菜型冬油菜陇油 7号为材料, 采用双向电泳和质谱分析技术, 比较低温(4℃、-4℃)和常温(25℃/20℃)下叶片蛋白质组差异; 对差异蛋白进行KO和KEGG功能分析。结果表明, 低温下陇油7号生长点下陷、植株匍匐, 气孔处于关闭或半关闭状态。2-DE和PDQuest8.0.1软件分析表明, 常温和4℃低温下叶片蛋白质斑点数分别726、738; 相对于常温处理, 4℃低温下陇油7号叶片10个蛋白点特异表达、5个蛋白点未表达; MALDI-TOF-TOF MS质谱分析鉴定出11个蛋白质, 参与碳水化合物代谢、糖代谢、氨基酸代谢、有机酸代谢、核酸代谢、信号转导与细胞通讯等细胞过程。冰晶形态显微观察结果表明低温处理后陇油7号叶片蛋白质提取液中含有高活性抗冻蛋白(antifreeze proteins,AFPs)。鉴定的 11个蛋白质中, 有 5个蛋白质点与光合作用有关, 低温下陇油 7号叶片 1,5-二磷酸核酮糖羧化酶(RuBPCase)活性和净光合速率Pn下降。叶片Pn下降与RuBPCase表达抑制和活性降低有关, 非气孔限制是Pn下降的主要因素; 高活性抗冻蛋白在白菜型冬油菜抗寒中发挥重要作用。
白菜型油菜; 低温胁迫; 蛋白质组学; 光合特性
中国北方寒旱区冬季严寒漫长, 生态条件严酷,属传统的春油菜区[1]。春油菜在春季 3月下旬至 4月上中旬播种, 8月下旬至9月中下旬成熟。这种气候条件给春油菜产区带来两方面的问题, 一是春耕春播等农事措施很容易形成农田尘源, 增加了中国北方沙尘气候形成频率[2]; 二是春油菜收获后由于光热限制难以发展复种, 造成大量资源浪费。种植冬油菜可在冬春季地表形成厚的枯叶覆盖层, 有效利用光热水等自然资源。因此, 发展复种, 实现油粮增产和农田生态协同改善的有机结合[3]。据测算, 中国北方寒旱区适宜发展冬油菜的面积约3226.7万公顷, 近期可发展冬油菜333.3万公顷, 对国家油粮稳定供应和生态改善均有重要意义[4]。冬油菜北移至北方寒旱区后该区越冬期持续低温成为影响油菜生长发育和产量的重要环境限制因子。北方寒旱区冬油菜一般8月下旬至9月上旬播种, 幼苗生长至第4至第 5叶期即经历明显的降温过程, 随后进入冬前低温生长阶段。低温伤害可能是幼苗低温阶段生长的主要限制因素。冬油菜能否有效利用冬前低温阶段有限的光热资源进行光合作用, 进而积累充足有机物是越冬期根部抵御冬季严寒而安全越冬, 以及翌年返青进行地上部营养体迅速重建的物质基础[5]。蛋白质是生物学功能的主要执行者, 在低温下植物有机体蛋白质组成和表达水平发生变化, 是植物低温适应的重要策略[6]。
低温下强抗寒冬油菜品种冬前叶片贴地生长、深绿色、生长点低于地表等形态特征明显不同于常温条件下的[7]。低温诱导下白菜型冬油菜抗氧化酶系活性升高, 可溶性糖、游离脯氨酸等渗透调节物积累, 抗寒性不同的材料在低温下生理特性变化存在差异[1]。张腾国等[8]在白菜型冬油菜中克隆了BnMKK2、BnMKK4[9]、BnMPK6[10]、BnHMGB2[11]等基因 cDNA全长, 并分析了基因结构、功能及低温诱导下的表达情况, 结果表明这些基因在响应低温、盐胁迫中发挥重要作用。
作物通过光合作用形成有机物质, 光合作用也是作物受低温影响最明显的生理过程之一[5]; 利用冬前低温阶段有限光热资源进行光合积累, 是其抵御冬季严寒的物质基础。低温下强抗寒冬油菜基因的差异表达是其重要的抗寒适应特征, 利用差异蛋白质组学可以获得植物抗寒调控的关键差异蛋白质[6]。本研究为了解低温下白菜型冬油菜光合特性变化,采用质谱鉴定分析, 探讨差异表达蛋白在低温适应过程中的生物学功能, 寻找抗寒相关蛋白质, 阐明白菜型冬油菜抗寒分子机制。
1 材料与方法
1.1 试验材料
以超强抗寒白菜型冬油菜品种陇油 7号为材料。选取籽粒饱满、大小一致的油菜种子, 用 10%过氧化氢处理30 min, 后用无菌水冲洗2~3次, 播于装有育苗基质的盆钵中, 以培养箱培养(光照 14 h,25℃, 黑暗10 h, 20℃), 每盆留苗4株。五叶期进行处理, 对照为光/暗 25℃/20℃(CK), 低温处理温度为4℃和-4℃(光照14 h, 黑暗10 h), 处理72 h后,分别观察形态变化, 测定光合气体交换参数、BuBPCase活性等。取对照及4℃处理的叶片提取总蛋白, 进行双向电泳(two-dimensional gel electrophoresis, 2-DE)分离; 并在-20℃下显微观察蛋白提取液冰晶形态。
1.2 形态特征观察
处理后观察记载幼苗叶片状态、叶色、真叶刺毛、叶柄状态、植株生长习性等变化; 低温处理后取新展开叶片, 采用水封片法观察叶片表皮及气孔的形态。用镊子轻轻撕下叶片表皮, 于加 1~2滴I2-KI染液的载玻片上展开表皮, 盖上盖玻片, 显微观察气孔形态并照相。
1.3 白菜型冬油菜叶片总蛋白提取与蛋白质浓度测定
采用 TCA-丙酮沉淀法提取冬油菜叶片总蛋白[12],Bradford[13]法测定蛋白质浓度; 对低温胁迫处理组和对照(CK)进行双向电泳, 第一向等点聚焦(IEF)使用17 cm的IPG胶条, 按照GE Healthcare双向电泳操作手册, 上样量为 900 μg, 将样品与水化液按体积比1∶4混匀, 总体积不超过500 μL, 第二向采用12%丙烯酰胺凝胶的 SDS-PAGE, 经考马斯亮蓝染色、脱色后通过UMAX的Powerlook 2100XL扫描采集图像, 用PDQuest 8.0分析软件对凝胶图谱标准化处理, 蛋白质点匹配和生物统计, 确定差异表达蛋白点, 实验重复3次; 对差异表达蛋白点回收、酶解[14], 送往上海中科新生命生物科技有限公司进行MALDI-TOF-TOF MS鉴定和数据库检索; 根据Uniprot Knowledgebase (http://www.uniprot.org/)、NCBI (http://www.ncbi.nlm.nih.gov/)和 Gene Ontology Database (GO)的注释, 按照其细胞组分、生物学过程和分子功能对已鉴定的蛋白质比较分析。利用在线分析工具 KEGG (Kyoto Encyclopedia of Genes and Genomes) Automatic Annotation Server (简称 KAAS) (http://www.genome.jp/tools/kaas/), 提交蛋白质序列, 采用BBH (bi-directional best hit)方法比对相似性, 找到最相似的蛋白质, 确定检索蛋白质的KO (KEGG ORTHOLOG)分类, 并获得参与的代谢通路。
1.4 光合气体交换参数测定
低温处理后选新展开叶片, 采用 LI-6400便携式光合仪测定叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等, 设定叶室(2 cm ×3 cm)内温度20℃, 光强600 μmol m-2s-1; 同时采用叶绿素仪测定叶片叶绿素含量、氮素含量、水分含量。每个处理选5株, 每株读数3次。
1.5 RuBPCase活性测定
参照龚富生等[15]的方法测定 RuBPCase活性。称取冬油菜完全展开的新叶 0.5 g, 用预冷的Tris-HCl缓冲液(pH 7.4), 冰浴研磨后转移至离心管,4℃下离心力1317 ×g离心15 min, 取上清液为酶液。根据NADPH的氧化或NADP+的还原, 于340 nm测定光吸收值的变化, 计算酶活力。
1.6 质外体蛋白的提取与其活性检测
用显微镜观察冰晶消长以检测蛋白活性, 参照Deveris的方法[16]。
2 结果与分析
2.1 低温下白菜型冬油菜幼苗和叶片气孔形态特征
常温下白菜型冬油菜陇油 7号幼苗呈半匍匐状生长, 叶色深绿, 完全展开的叶片叶柄与地面间夹角小于45°。低温下陇油7号幼苗呈匍匐生长状态,生长点和心叶深陷入地表之下, 叶柄由斜上生变为几乎与地面平行, 叶片紧贴地面; 叶色加深为浓绿色, 叶面密被刺毛(图1)。
叶片气孔是植物体与外界环境气体等物质交换的重要通道, 通过改变自身开闭状态控制 CO2、O2等的进出, 对光合效率产生重要影响。在光/暗温度为25℃/20℃时, 超强抗寒品种陇油7号叶片气孔均处于完全开放状态, 保卫细胞叶绿体淀粉粒较多;温度下降至4℃时, 大部分气孔开放度减小, 处于半关闭状态, 少数气孔已完全关闭, 保卫细胞内仍保留较多淀粉粒; 当在-4℃下时叶片大部分气孔处于完全关闭或半关闭状态, 淀粉颗粒变小、淀粉粒明显减少(图1)。

图1 低温下白菜型冬油菜幼苗及气孔形态变化Fig.1 Changes of seedling and stomatal morphology of winter rape under low temperature
2.2 白菜型冬油菜不同温度处理叶片蛋白质图谱及差异表达蛋白质分析
选用pH 4~7、17 cm的IPG胶条, 对白菜型冬油菜陇油 7号常温(25℃/20℃)和低温(-4℃)处理的幼苗叶片总蛋白质进行分离, 经考马斯亮蓝G-250染色后, 得到分辨率和重复性较好的2-DE图谱(图2)。采用PDQuest8.0.1软件对2个处理的图谱进行斑点检测, 对检测出的蛋白质斑点的总浓度均一化处理, 在等电点为4.0~7.0, 分子质量为9.0~100.0 kD的图谱上可分别鉴定出平均726和738个清晰的蛋白质点, 2个处理的蛋白质点图谱匹配率为91.5%。
经凝胶比对分析发现, 陇油 7号常温和低温 2个处理间表达量2倍以上差异蛋白质点共有113个,上调表达蛋白质点61, 下调表达蛋白质点52; 表达量差异在4倍以上的蛋白质点36个, 包括表达量上的差异蛋白质点和有无表达(抑制/诱导)的差异蛋白点, 其中表达量差异蛋白点21个 (增量表达蛋白质点 12, 减量表达蛋白质点 9; 有无表达的差异蛋白点15个, 其中低温完全抑制表达蛋白质点5个(spot 1~5), 低温诱导表达蛋白质点10个(spot 6~15)。
2.3 差异表达蛋白质斑点的质谱鉴定与分析
将重复性好的 15个低温诱导/完全抑制差异表达蛋白质斑点进行MALDI-TOF-TOF MS质谱分析,11个点鉴定出蛋白质(表2), 4个点未能鉴定出结果。在质谱数据分析的基础上, 用 MASCOT搜索NCBInr绿色植物数据库, 对应的蛋白质分别为放氧增强蛋白(spot 1)、核酮糖-1,5-二磷酸羧化酶/加氧酶(spot 5)、光系统II 23 kD外周蛋白(spot 15)、β碳酸酐酶2 (spot 8)、果糖-1,6-二磷酸醛缩酶(spot 7)、转录调控锌指蛋白(spot 2)、膜联蛋白(spot 6)、巯基蛋白酶抑制剂(spot 9、spot 10)、类甜蛋白(spot 13)、抗病毒蛋白(spot 14)。
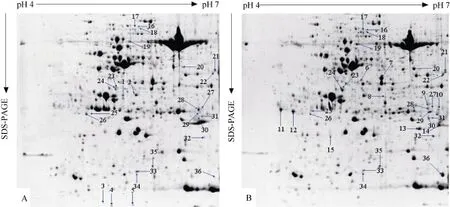
图2 白菜型冬油菜陇油7号双向电泳图Fig.2 Coomassie-stained 2-D gel protein profiles of leaves from Longyou 7
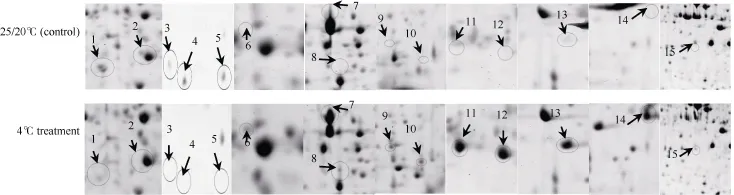
图3 完全抑制和诱导表达差异蛋白点局部放大图Fig.3 Completely inhibited and induced expression differential proteins
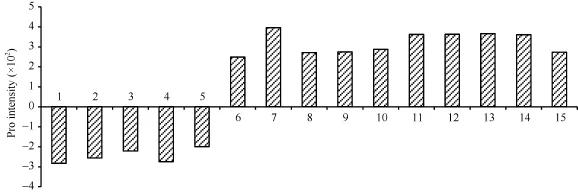
图4 差异蛋白表达强度Fig.4 Differential protein expression intensity
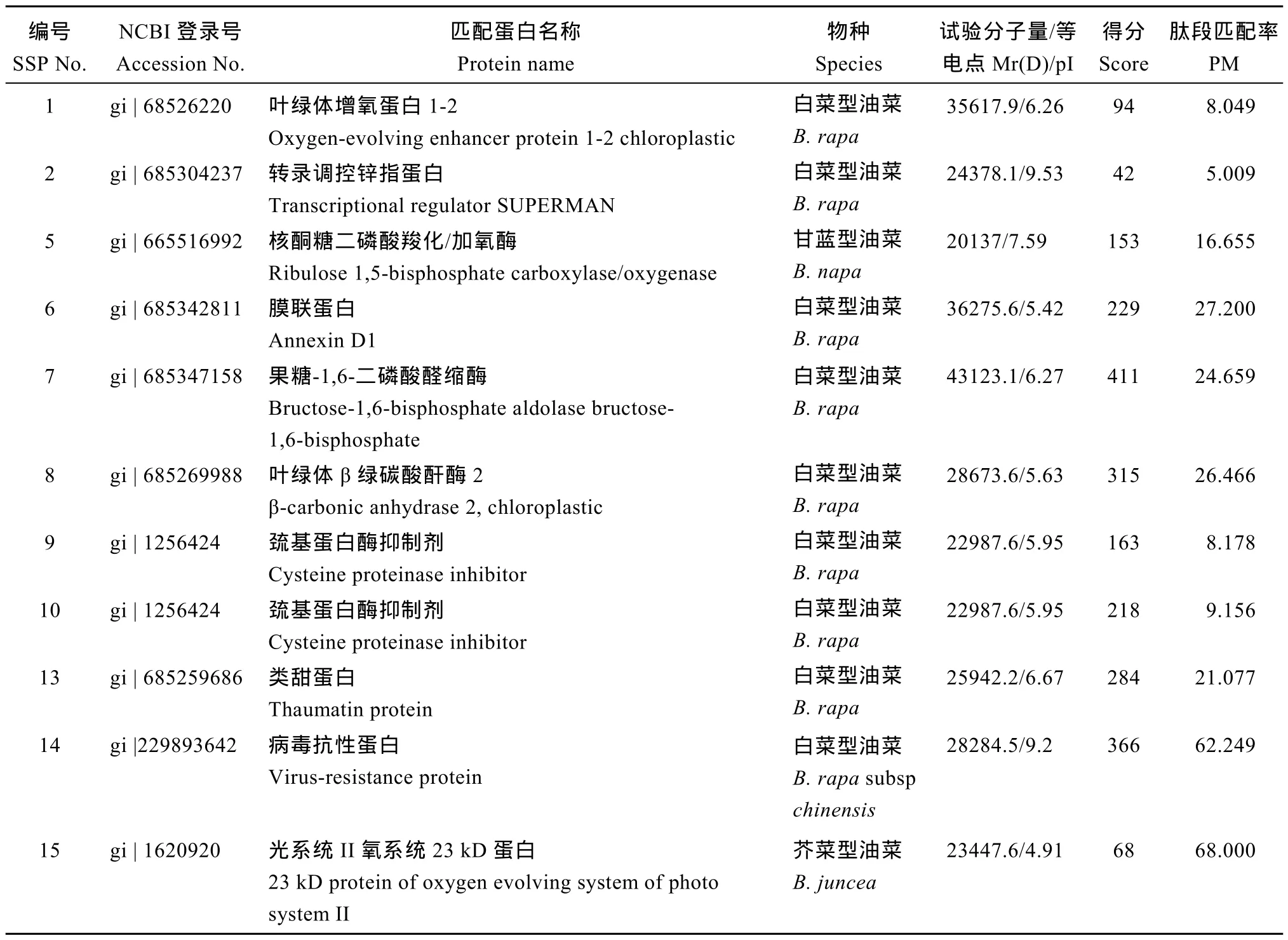
表1 特异蛋白点MALDI-TOF-TOF MS质谱鉴定结果Table1 Identification of special proteins by MALDI-TOF-TOF MS
2.4 差异表达蛋白质的功能分析
对获得的差异表达蛋白质进行 Gene Ontology 和KEGG功能注释。将GO注释成功的9个蛋白质在三大类群(生物学过程BP、细胞组分CC和分子功能 MF)下进行进一步分类。这些蛋白质分别参与碳同化过程(spot 5), 具有单加氧酶活性、羧化酶活性;参与肽酶活性调控过程(spot 9), 具有肽酶抑制剂活性; 参与光呼吸、碳同化过程(spot 14), 具有单加氧酶活性、水解酶活性; 参与光合作用(spot 15), 具有金属离子结合活性; 参与逆境响应(spot 6), 具有钙依赖磷脂结合活性; 参与糖代谢(spot 7), 具有醛缩酶活性; 参与MAPK级联反应、水杨酸生物合成、茉莉酸介导的信号转导通路、光合作用(spot 8), 具有含锌水合酶活性; 参与光合水裂解(spot 1), 具有氧化还原酶活性; 参与低温响应(spot 2), 调控抗寒靶基因表达。这些蛋白从“细胞组分”分类来看, 分别是细胞膜、细胞基质、胞外基质、质体的组分。
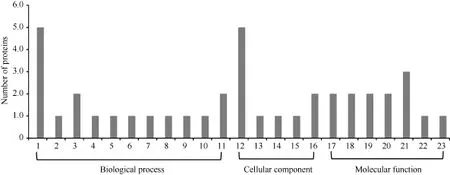
图5 差异表达蛋白的GO分类图Fig.5 Histogram showing Gene Ontology functional analysis of differentially expressed protein
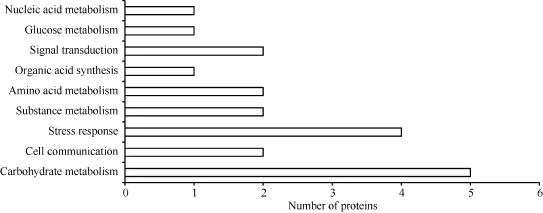
图6 差异表达蛋白KEGG分类图Fig.6 Histogram showing KEGG pathway analysis of differentially expressed protein
经KO注释的9个蛋白参与了碳水化合物代谢、糖代谢、氨基酸代谢、有机酸代谢、核酸代谢、信号转导与细胞通讯, 其中 5个蛋白参与光合碳水化合物代谢相关过程(spot 1、spot 2、spot 5、spot 8和spot 15), 占KO注释蛋白总数的55.6%, 表明光合作用是受低温影响的重要代谢途径之一。
2.5 低温下白菜型冬油菜质外体蛋白提取液冰晶形态
将2种温度处理(25℃/20℃和-4℃处理7 d)的陇油7号叶片蛋白提取液在-20℃放置12 h后, 观察到常温处理的叶片质外体蛋白质提取液已完全结冰呈固态, 而低温处理的叶片质外体蛋白提取液仍保持液体状态。常温处理叶片的蛋白提取液形成的小晶体颗粒间相互快速融合, 冰晶迅速生长、相互挤压形成不规则较大冰晶体; 而低温处理的叶片蛋白提取液冰晶颗粒较小, 形态多为六边形、双棱锥形, 表现出明显的饰晶活性和抑制重结晶活性。
2.6 低温下白菜型冬油菜光合气体交换参数

图7 低温下白菜型冬油菜叶片蛋白提取液的冰晶形态Fig.7 Ice crystal morphology of winter rapeseed leaf protein extract

表2 低温对白菜型冬油菜品种陇油7号光合气体交换参数的影响Table2 Photosynthetic gas exchange parameters of winter rapeseed variety Longyou 7 at low temperature
随着温度下降, 白菜型冬油菜叶片 Gs、Tr、Pn明显降低, 而Ci呈先降后升趋势。当温度降为20℃/5℃时, 叶片Gs显著下降, Pn略有降低、但变化未达到显著水平, 表明此时叶片仍保持较高的光合 CO2同化能力, 胞间 CO2浓度的减少主要由气孔限制因素引起, 即 CO2通过气孔阻力增加, 向叶片胞间输入量减少, 导致了胞间 Ci降低; 当温度降低到-5℃时, 陇油7号叶片Pn显著降低, 此时Pn仅为常温时的48.7%, 表明叶片光合同化消耗CO2能力减弱, 通过气孔进入叶片的 CO2在胞间积累, 导致 Ci升高,说明此时叶片Pn下降的主要原因是非气孔限制, 即光合系统效率降低所致。
2.7 低温下白菜型冬油菜Rubisco酶活性及表达分析
低温对白菜型冬油菜叶片光合固碳过程产生显著影响, 本试验鉴定的11个差异表达蛋白质中, 5个蛋白点与光合作用相关, 选择光合固碳关键酶Rubisco检测了其羧化酶活性。随着温度降低, 白菜型冬油菜叶片 RuBPCase活性显著逐渐降低, 但处理间降低幅度不同。与常温对照(25℃/20℃)相比, 4℃下叶片RuBPCase活性下降了21.1%; 而-4℃处理的叶片RuBPCase活性下降了71.6%, 与其他2个处理间差异达极显著水平。
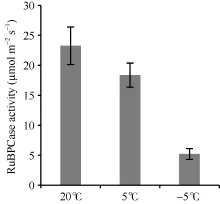
图8 低温下叶片RuBPCase活性Fig.8 RuBPCase activity at low temperature
3 讨论
3.1 低温对白菜型冬油菜光合的影响
光合作用是植物体内复杂的生理生化代谢过程,包括光能的捕获与转化、水光解、电子传递、光合磷酸化、碳同化及同化物的转化与运输等过程[17],涉及多种酶及其他物质, 这些光合过程及涉及物质对环境温度变化敏感性有所不同, 其中光能捕获与转化等受温度影响较小[18]。低温下白菜型冬油菜幼苗生长点、心叶下陷, 叶片颜色、着生状态等发生明显改变; 采用MALDI-TOF-TOF MS质谱法鉴定出的11个叶片差异蛋白质, 有5个蛋白点(spot 1、spot 5、spot 7、spot 8、spot 15)与光合作用有关, 占鉴定差异蛋白质总数的45.5%, 其中核酮糖1,5-二磷酸羧化酶/加氧酶(spot 5)、叶绿体增氧蛋白(spot 1)下调表达; 叶绿体β调碳酸酐酶2 (spot 8)、光系统II氧系统23 kD蛋白(spot 15)上调表达。核酮糖1,5-二磷酸羧化酶/加氧酶是调节光合和光呼吸, 决定净光合速率的关键酶[19]。在低温下该酶编码基因转录降低、活性下降; 虽然低温下叶片气孔关闭或半关闭, 通过气孔进入叶片的 CO2量减少, 但由于低温下Rubisco酶活性降低, CO2同化消耗能力减弱, 导致-5℃下白菜型冬油菜叶片Ci升高, 而光合速率Pn明显降低, 因此, 此时 Pn的降低主要由非气孔限制引起。
3.2 植物激素与抗寒性的关系
水杨酸(salicylic acid, SA)是一种植物内源简单酚类化合物, 在信号转导、逆境胁迫响应等过程中具有广泛的生理活性[20]。SA可诱导增强植物体抗氰呼吸代谢过程, 具有产热效应, 提高植物体内温度,对低温下保持有机体正常生理状态、酶系活性和代谢过程等具有重要意义[21]。适宜浓度的外源 SA可提高大叶黄杨[22]、厚皮甜瓜[23]等的抗寒性。本研究在白菜型冬油菜陇油 7号中鉴定到一个低温诱导表达蛋白质(spot 8), GO分析表明该蛋白具有含锌水合酶活性, 参与SA生物合成过程。
3.3 渗透调节物与抗寒性关系
低温下植物细胞积累可溶性糖, 具有组织保护效用[24]; 特别是在胞间结冰温度下, 结冰引起胞外水势降低, 胞内自由水能沿水势梯度大量外渗造成细胞严重脱水, 导致植物类似干旱胁迫危害症状[25]。植物在长期进化过程中也形成冷冻防御机制[26], 如在低温下植物细胞积累可溶性糖等渗透调节物质,以保持低温下植物细胞内外水势平衡[27], 从而使植物体在严寒环境中能保持良好的胞内代谢状态, 增强植物抗寒适应性[28]。本研究从低温处理后的白菜型冬油菜叶片中鉴定出果糖-1,6-二磷酸醛缩酶(spot 7), 在低温下诱导表达, 参与糖酵解、糖异生、磷酸戊糖循环、卡尔文循环等代谢途径, 是植物体糖代谢、可溶性糖积累的关键酶之一。低温下白菜型冬油菜果糖-1,6-二磷酸醛缩酶表达上调, 细胞中可溶性糖浓度提高, 可有效降低细胞溶液冰点, 防止细胞内低温结冰损失; 同时较高的可溶性糖浓度还可降低胞内水势, 增加细胞持水能力, 在低温胞间结冰情况下, 维持细胞内外水势相对平衡, 避免在水势逆差的促动下细胞过度脱水受损。
3.4 抗冻蛋白与抗寒性关系
在严寒环境中, 植物体通常遭遇冰冻威胁[29],体内形成的冰晶会对细胞产生机械损伤, 甚至导致细胞破裂[30], 许多寒地植物经冷诱导可产生高活性抗冻蛋白(antifreeze proteins, AFPs), 是有机体适应低温胁迫的重要策略[31], AFPs具有降低细胞溶液冰点的热滞活性、修饰冰晶形态和抑制重结晶活性[32],AFPs与冰晶表面高亲和结合, 阻隔水分子在晶格面吸附, 抑制冰晶生长和重结晶过程, 防止有机体冰晶形成和生长对细胞造成的机械损伤[26]。目前分离测序的植物AFPs包含近30个物种中鉴定的100多条数据[33], 植物AFPs主要有类甜蛋白、β-1,3-葡聚糖酶、几丁质酶和多聚半乳糖醛酸酶抑制蛋白4种[34]。本研究中白菜型冬油菜幼苗低温处理后, 其叶片蛋白质提取液在-20°C下仍不结冰, 保持溶液状态,表明该提取液中可能含有高活性抗结冰物质。采用显微冰晶形态观察法, 检测了蛋白提取液的结冰过程和晶冰形态, 对照溶液形成大量无规则大冰晶,而低温处理叶片蛋白液形成体积较小的六边形、双棱锥形冰晶, 这两种晶型是在 AFPs作用下形成的典型冰晶类型, 可以确定在低温处理后的白菜型冬油菜叶片总蛋白质提取液中存在高活性 AFP。MALDI-TOF-TOF MS质谱法鉴定出低温诱导白菜型冬油菜表达类甜蛋白(spot 13), 目前已鉴定出低温诱导黑麦产生的类甜蛋白具有AFP活性[35], 但白菜型冬油菜低温诱导表达的类甜蛋白是否具有 AFP活性, 仍需进一步分离鉴定。
4 结论
低温下白菜型冬油菜叶色加深、植株匍匐、生长点下陷, 叶片气孔逐渐关闭; 其叶片蛋白质组发生明显变化, 15个低温特异诱导或完全抑制蛋白点中, 质谱鉴定出差异表达蛋白11个, 分别是细胞膜、细胞基质、胞外基质、质体的组分; 参与碳水化合物代谢、糖代谢、氨基酸代谢、有机酸代谢、核酸代谢、信号转到与细胞通讯等细胞过程。低温下白菜型冬油菜叶片Pn下降与RuBPCase表达抑制和活性降低有关, 非气孔限制是 Pn下降的主要因素; 低温处理后叶片中存在高活性抗冻蛋白, 在白菜型冬油菜抗寒中发挥重要作用。
References
[1] 刘自刚, 张长生, 孙万仓, 杨宁宁, 王月, 何丽, 赵彩霞, 武军艳, 方彦, 曾秀存.不同生态区冬前低温下白菜型冬油菜不同抗寒品种(系)比较.作物学报, 2014, 40: 346-354 Liu Z G, Zhang C S, Sun W C, Yang N N, Wang Y, He L, Zhao C X, Wu J Y, Fang Y, Zeng X C.Comparison of winter rapeseed varieties (lines) with different cold resistance planted in the northern-extending regions in China under low temperature before winter.Acta Agron Sin, 2014, 40: 346-354 (in Chinese with English abstract)
[2] 王学芳, 孙万仓, 李孝泽, 武军艳, 马维国, 康艳丽, 曾潮武,蒲媛媛, 叶剑, 刘红霞, 曾军, 张亚红.河西走廊种植冬油菜的环境效应.作物学报, 2008, 34: 2210-2217 Wang X F, Sun W C, Li X Z, Wu J Y, Ma W G, Kang Y L, Zeng C W, Pu Y Y, Ye J, Liu H M, Zeng J, Zhang Y H.The environment effect of planting winter rape in Hexi Corridor.Acta Agron Sin,2008, 34: 2210-2217 (in Chinese with English abstract)
[3] 王学芳, 孙万仓, 李孝泽, 武军艳, 刘红霞, 曾潮武, 蒲媛媛,张朋飞, 张俊杰.我国北方风蚀区冬油菜抗风蚀效果.生态学报, 2009, 29: 6572-6577 Wang X F, Sun W C, Li X Z, Wu J Y, Liu H X, Zeng C W, Pu Y Y,Zhang P F, Zhang J J.Wind erosion-resistance of fields plante with winter rapeseed in the wind erosion region of northern China.Acta Ecol Sin, 2009, 29: 6572-6577 (in Chinese with English abstract)
[4] 孙万仓, 马卫国, 雷建民, 刘秦, 杨仁义, 武军艳, 王学芳, 叶剑, 曾军, 张亚宏, 康艳丽, 郭秀娟, 魏文惠, 杨杰, 蒲媛媛,曾潮武, 刘红霞.冬油菜在西北旱寒区的适应性和北移的可行性研究.中国农业科学, 2007, 40: 2716-2726 Sun W C, Ma W G, Lei J M, Liu Q, Yang R Y, Wu J Y, Wang X F,Ye J, Zeng J, Zhang Y H, Kang Y L, Guo X J, Wei W H, Yang J,Pu Y Y, Zeng C W, Liu H X.Study on adaptation and introduction possibility of winter rapeseed to dry and cold areas in northwest china.Sci Agric Sin, 2007, 40: 2716-2726 (in Chinese with English abstract)
[5] 刘自刚, 孙万仓, 方彦, 李学才, 杨宁宁, 武军艳, 曾秀存, 王月.夜间低温对白菜型冬油菜光合机构的影响.中国农业科学, 2015, 48: 672-682 Liu Z G, Sun W C, Fang Y, Li X C, Yang N N, Wu J Y, Zeng X C,Wang Y.Effects of low temperature on the photosynthetic apparatus of winter oilseed rape.Sci Agric Sin, 2015, 48: 672-682 (in Chinese with English abstract)
[6] Kumar A, Bimolata W, Kannan M, Kirti P B, Qureshi I A, Ghazi I A.Comparative proteomics reveals differential induction of both biotic and abiotic stress response associated proteins in rice during Xanthomonas oryzae pv.oryzae infection.Funct Integr Genom, 2015, 15: 425-437
[7] 刘自刚, 孙万仓, 杨宁宁, 王月, 何丽, 赵彩霞, 史鹏飞, 杨刚,李学才, 武军艳, 方彦, 曾秀存.冬前低温胁迫下白菜型冬油菜抗寒性的形态及生理特征.中国农业科学, 2013, 46:4679-4687 Liu Z G, Sun W C, Yang N N, Wang Y, He L, Zhang C X, Shi P F,Yang G, Li X C, Wu J Y, Fang Y, Zeng X C.Morphology and physiological characteristics of cultivars with different levels of cold-resistance in winter rapeseed (Brassica campestris L.)during cold acclimation.Sci Agric Sin, 2013, 46: 4679-4687 (in Chinese with English abstract)
[8] 张腾国, 王圆圆, 王娟, 王宁, 张艳, 孙万仓, 陈琼琼, 夏惠娟.油菜 BnMKK2基因的克隆及表达分析.植物研究, 2012, 32:578-583 Zhang T G, Wang Y Y, Wang J, Wang N, Zhang Y, Sun W C,Chen Q Q, Xia H J.Cloning and real-time expression analysis of a novel MAPK kinase gene BnMKK2 in Brassica napus.Bull Bot Res, 2012, 32: 578-583 (in Chinese with English abstract)
[9] 张腾国, 王宁, 王娟, 王圆圆, 张艳, 孙万仓, 常燕, 夏惠娟.油菜 BnMKK4全长基因的克隆及表达分析.植物生理学报,2012, 48: 491-498 Zhang T G, Wang N, Wang J, Wang Y Y, Zhang Y, Sun W C,Chang Y, Xia H J.Cloning and expression analysis of a BnMKK4 gene from Brassica napus L.Plant Physiol J, 2012, 48: 491-498 (in Chinese with English abstract)
[10] 贾凌云, 张腾国, 王娟, 王圆圆, 夏惠娟.陇油 6号油菜BnMPK6基因启动子分离及序列分析.西北师范大学学报(自然科学版), 2012, 48: 86-90 Jia L Y, Zhang T G, Wang J, Wang Y Y, Xia H J.Isolation and sequence analysis of BnMPK6 gene promoter from Brassica napus (rape) Longyou 6.J Northwest Nor Univ (Nat Sci), 2012,48: 86-90 (in Chinese with English abstract)
[11] 张腾国, 王娟, 王圆圆, 王宁, 常燕, 张艳, 陈琼琼, 孙万仓.油菜BnHMGB2基因的克隆及表达分析.植物研究, 2012, 32:724-730 Zhang T G, Wang J, Wang Y Y, Wang N, Chang Y, Zhang Y, Chen Q Q, Sun W C.Cloning and expression analysis of BnHMGB2 gene in Brassica napus.Bull Bot Res, 2012, 32: 724-730 (in Chinese with English abstract)
[12] 黄甫海燕, 官春云.甘蓝型油菜抗菌核病近等基因系和感病亲本蛋白差异初步研究.中国农业科学, 2010, 43: 2000-2007 Huang-pu H Y, Guan C Y.A preliminary analysis of differential proteins between Brassica napus resistance to sclerotinia sclerotiorum near-isogenic lines and susceptible parent.Sci Agric Sin,2010, 43: 2000-2007 (in Chinese with English abstract)
[13] Bradford M M.A rapid method for the quantification of microgram quantities of protein utilizing the principle of protein.dye binding.Anal Biochem, 1976, 72: 248-254
[14] Katayama H, Nagasu T, Oda Y.Improvement of in-gel digestion protocol for peptide mass fingerprinting by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry.Rapid Commun Mass Spectr, 15: 1416-1421
[15] 龚富生, 张嘉宝.植物生理学实验(第 2版).北京: 高等教育出版社, 1995.pp 90-92 Gong F S, Zhang J B.Plant Physiology Experiment, 2nd edn.Beijing: Higher Education Press, 1995.pp 90-92
[16] Deveris A L.Antifreeze glycopeptides: Interaction with ice and water.Method Enzym, 1986, 127: 293-303
[17] Liu Z, Dreybrodt W.Significance of the carbon sink produced by H2O-arbonate-CO2-aquatic phototroph interaction on land.Sci Bull, 60: 182-191
[18] Majeran W, Zybailov B, Ytterberg A J, Dunsmore J, Sun Q, van Wijk K J.Consequences of C4differentiation for chloroplast membrane proteomes in maize mesophyll and bundle sheath cells.Mol Cell Proteom, 2008, 7: 1609-1638
[19] Guo L, Sui Z, Zhang S, Ren Y, Liu Y.Comparison of potential diatom “barcode” genes (18S and ITS rDNA, COI, rbcL) and their effectiveness in discriminating and determining speciestaxonomy in bacillariophyta.Int J System Evol Microbiol, 2015,65: 1369-1380
[20] Tiong W H C, Kelly E J.Salicylic acid burn induced by wart remover: A report of two cases.Burns, 2009, 35: 139-140
[21] da Silveira Novelino A M, Daemon E, Soares G L.Evaluation of the acaricide effect of thymol, menthol, salicylic acid, and methyl salicylate on Boophilus microplus (Canestrini 1887) (Acari:Ixodidae) larvae.Parasitol Res, 2007, 101: 809-811
[22] 李亚, 张钢, 张玉星, 郝征.水杨酸对大叶黄杨茎抗寒性和电阻抗图谱参数的影响.生态学杂志, 2010, 29: 460-466 Li Y, Zhang G, Zhang Y X, Hao Z.Effect of salicylic acid on Euonymus japonicus stem cold resistance and electrical impedance spectroscopy parameters.Chin J Ecol, 2010, 29: 460-466 (in Chinese with English abstract)
[23] 范存斐, 毕阳, 王云飞, 任亚琳, 杨志敏, 王毅.水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响.中国农业科学, 2012,45: 584-589 Fan C F, Bi Y, Wang Y F, Ren Y L, Yang Z M, Wang Y.Effect of salicylic acid on Muskmelon postharvest diseases and phenylpropanoid metabolism.Sci Agric Sin, 2012, 45: 584-589 (in Chinese with English abstract)
[24] 李春燕, 陈思思, 徐雯, 李东升, 顾骁, 朱新开, 郭文善, 封超年.苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响.作物学报, 2011, 37: 2293-2298 Li C Y, Chen S S, Xu W, Li D S, Gu X, Zhu X K, Guo W S, Feng C N.Seedlings to low temperature stress of Yangmai 16 leaves antioxidant enzymes and osmotic adjustment substances.Acta Agron Sin, 2011, 37: 2293-2298 (in Chinese with English abstract)
[25] Bahari L, Yashunsky V, Braslavsky I.Microscopic investigation of antifreeze proteins activity at cryogenic temperatures.Cryobiology, 2015, 71: 570-573
[26] Braslavsky, Drori R, Celik Y, Dolev M B, Davies P L.Characteristics of the interaction of antifreeze proteins with ice crystals.Cryobiology, 2015, 71: 540
[27] Beck E H, Heim R, Hansen J.Plant resistance to cold stress:mechanisms and environmental signals triggering frost hardening and dehardening.J Biosci, 2004, 29: 102-109
[28] Szechyńska-Hebdaab M, Wąseka I, Gołębiowska-Pikaniac G,Dubasa E, Żura I, Wędzonyac M.Photosynthesis-dependent physiological and genetic crosstalk between cold acclimation and cold-induced resistance to fungal pathogens in triticale (Triticosecale Wittm.).J Plant Physiol, 2015, 177: 30-43
[29] Hagiwara Y, Aomatsu H.Supercooling enhancement by adding antifreeze protein and ions to water in a narrow space.Int J Heat Mass Transfer, 2015, 86: 55-64
[30] Sun T, Davies P L, Walker V K.Structural basis for the inhibition of gas hydrates by α-helical antifreeze proteins.Biophys J, 2015,109: 1698-1705
[31] Gupta R, Deswal R.Antifreeze proteins enable plants to survive in freezing conditions.J Biosci, 2014, 39: 931-944
[32] Wilkensa C, Poulsena J C N, Ramløvb H, Leggioa L L.Purification, crystal structure determination and functional characterization of type III antifreeze proteins from the European eelpout Zoarces viviparus.Cryobiology, 2014, 69: 163-168
[33] Ustun N S, Turhan S.Antifreeze proteins: characteristics, function, mechanism of action, sources and application to foods.J Food Proc Preserv, 2015, 39: 3189-3197
[34] Todde G, Hovmöller S E, Laaksonen A.Influence of antifreeze proteins on the ice/water interface.J Physical Chem, 2015, 119:2407-3413
[35] Lauersen K J, Brown A, Middleton A, Davies P L, Walker V K.Expression and characterization of an antifreeze protein from the perennial rye grass, Lolium perenne.Cryobiology,2011, 62: 194-201
Differential Proteomic Analysis and Photosynthetic Characteristics of Winter Rapeseed under Low Temperature Stress
LIU Zi-Gang, YUAN Jin-Hai, SUN Wan-Cang, ZENG Xiu-Cun, FANG Yan, WANG Zhi-Jiang, WU Jun-Yan,FANG Yuan, LI Xue-Cai, and MI Chao
Gansu Research Center of Rapeseed Engineering and Technology / Improvement and Key Laboratory of Crop Genetics and Germplasm Enhancement of Gansu Province / Gansu Provincial Key Laboratory of Arid Land Crop Sciences / Agronomy College, Gansu Agricultural University, Lanzhou 730070, China
Isolation and identification of the differentially expressed proteins in winter rapeseed at low temperature, laid a foundation for revealing the mechanism of cold resistance of winter rapa.The strong cold resistant winter rape Longyou 7 was used as experimental material.Two dimensional electrophoresis, mass spectrometry and retrieval techniques were used to compare the proteomic differences at low temperature (4℃,-4℃) and normal atmospheric temperature (25℃/20℃), and functions were analyzed by KO and KEGG.It was observed that Longyou 7 had subsided growth point, creeping stem, and closed or semi-closed stomata under low temperature.The 2-DE and PDQuest8.0.1 software analysis showed that the number of protein spots were 726 and 738, respectively.Compared with the normal temperature treatment, at the 4℃ treatment showed differential expression at 10 protein spots while didn’t at five protein.Eleven proteins were identified by MS MALDI-TOF-TOF mass spectrometry analysis.They are involved in carbohydrate metabolism, rugan metabolism, amino acid metabolism, organic acid metabolism, nucleic acid metabolism, signal transduction in cell and communication and other cellular processes.we found the high activity of antifreeze
Winter rape; Low temperature stress; Protein proteomics; Photosynthetic characteristics
10.3724/SP.J.1006.2016.01541
联系方式: E-mail: lzgworking@163.com
Received(): 2016-01-18; Accepted(接受日期): 2016-06-20; Published online(网络出版日期): 2016-07-28.
本研究由国家自然科学基金项目(31460356), 国家农业科技成果转化资金项目(2014G10000317), 国家现代农业产业技术体系建设专项(CARS-13)和国家重点基础研究发展计划项目(2015CB150206)资助。
This study was supported by the National Science Foundation of China (31460356), the National Agricultural Science and Technology Achievements Transformation Fund of China (2014G10000317), the China Agriculture Research System (CARS-13), and the National Basic Research Program of China (973 Program) (2015CB150206).
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160728.0817.020.htmlprotein in Longyou 7 leaf protein extraction solution after low temperature treatment through ice crystal morphology microscopic observation.Five out of the 11 proteins identified were associated with photosynthesis.Under low temperature, ribulose 1,5-bisphosphate carboxylase (RuBPCase) activity and photosynthetic rate decreases in leaves of Longyou 7.Under the low temperature, the proteome of winter rape was significantly changed, and the specific protein was expressed.The decrease of Pnin leaves was related to the expression inhibition and the activity decrease of RuBPCase.The decrease of Pnin leaves was mainly caused by non stomatal limitation.High activity of antifreeze protein plays an important role in cold resistance of winter rape.
