葡萄糖苷酶酶解香草兰的工艺条件优化研究
2016-10-18康林芝唐惠奇
康林芝,王 娜,秦 艳,唐惠奇,云 帆
(广州市澳键丰泽生物科技有限公司,广东广州 510760)
葡萄糖苷酶酶解香草兰的工艺条件优化研究
康林芝,王 娜,秦 艳,唐惠奇,云 帆*
(广州市澳键丰泽生物科技有限公司,广东广州 510760)
[目的]优化葡萄糖苷酶酶解香草兰的工艺条件。[方法]以香草兰为材料,研究葡萄糖苷酶酶解提取香兰素的工艺。在单因素试验的基础上选取试验因素与水平,设计3因素3水平的响应面分析法,依据回归分析确定工艺条件的影响因素,以香兰素含量为响应值作响应面分析试验。[结果]葡萄糖苷酶酶解香草兰的最佳工艺条件为:反应温度 44 ℃,料液比1∶14 g/mL,加酶量16 U/g,香兰素含量实际得率为17.80 mg/g。[结论]葡萄糖苷酶可水解香兰素的前体物质,释放出香草兰中潜在的香气成分,从而大幅度提高香气成分含量。
葡萄糖苷酶;香草兰; 香兰素; 酶解
香草兰原产墨西哥,是高级食用香料,有“食用香料之王”之称,广泛用于食品工业、烟、酒和高级化妆品[1-2]。香兰素是香草兰豆荚中最主要的生香物质,但刚成熟的香草兰豆荚并不具有特征香气,其豆荚经过生香加工后才具有浓郁的香味[3]。香草兰豆荚加工过程中生香的原因主要是因为豆荚中的β-葡萄糖苷酶会催化香兰素葡萄糖苷分解形成香兰素和葡萄糖,生成的香兰素赋予香草兰香味。江明等[4]研究了香草兰果荚内源β-葡萄糖苷酶在不同加工条件下的活性变化,结果表明,香草兰在经过杀青及干燥处理后,β-葡萄糖苷酶的活性有所升高。但是香草兰自身含有的葡萄糖苷酶非常有限,导致香草兰的传统生香周期长达1年,耗费大量的人力物力[5]。Ranadive[6]及浦帆等[7]在成熟香草兰果荚中添加外源β-葡萄糖苷酶,研究发现豆荚中的香兰素含量明显提高,证明β-葡萄糖苷酶在香草兰的生香过程中起着重要的作用,同时也证明了酶促生香的可行性。笔者采用响应面优化了利用葡萄糖苷酶酶解香草兰原料的工艺条件,为工业化高效生产纯天然香兰素奠定基础。
1 材料与方法
1.1材料香草兰,产地海南,海南兴科兴隆热带植物园开发有限公司。β- 葡萄糖苷酶:酶活力5.5 U/mg,上海Sigma试剂公司。标准产物香兰素,分析纯,购买于上海生物工程有限公司。
1.2方法
1.2.1香草兰中香气成分的提取方法。香草兰豆荚低温干燥、粉碎,取20 g粉末置于500 mL三角烧瓶中,然后在粉碎豆荚中加入20单位的葡萄糖苷酶,置于37 ℃恒温水浴中反应18 h,之后进行熟化。取酶解后的样品用95%的乙醇索式抽提16 h,提取物定容至100 mL,然后进行紫外分光光度测定。
1.2.2香兰素含量的定量分析方法。利用紫外分光光度法分析酶促生香样品中香兰素的含量[8]。
1.2.2.1标准溶液的配制。称取0.01 g香兰素于10 mL容量瓶中,加无水乙醇溶解后定容至刻度,备用。其浓度为1.0 mg/mL。
1.2.2.2试样液的制备。准确称取试样约0.01 g,制备方法与上述标准溶液的制备相同。取上述各溶液分别放入1 cm石英池中,在最大吸收波长约308 nm处测定吸光度,计算香兰素含量。
1.2.3香草兰的酶促生香研究[9]。根据酶促反应动力学可知,香草兰酶促生香过程中各项影响酶促反应的参数均将影响酶促反应的速度与强度,从而影响香草兰酶促生香的加工时间长短以及产品中香兰素含量。酶促生香加工以产品中香兰素含量为指标,对提取物进行紫外分光光度法测定分析。由于反应温度、时间、 体系 pH等工艺参数是影响酶促反应的主要因素。因此,该试验从加酶量、酶解温度、酶解时间、料液比等方面研究β-葡萄糖苷酶的酶解作用对香草兰中香兰素含量的影响,并以传统生香方法生香的香草兰豆荚提取物作为对照。
1.2.3.1不同反应温度对香草兰酶促生香研究的影响。取杀青后的香草兰豆荚50 g切碎至均匀大小,加入pH 5.0的磷酸盐缓冲液200 mL进行匀浆。在匀浆液中加入20 U/g的β-葡萄糖苷酶,在35、40、45、50、55 ℃的酶解温度下,搅拌酶解18 h后进行熟化。熟化完全的香草兰豆荚利用“1.2.1”方法提取,对香兰素进行紫外分光光度计测定分析。
1.2.3.2不同反应时间对香草兰酶促生香研究的影响。取杀青后的香草兰豆荚50 g切碎至均匀大小,加入pH 5.0的磷酸盐缓冲液200 mL进行匀浆。在匀浆液中加入20 U/g的β-葡萄糖苷酶,在35 ℃的酶解温度下,搅拌酶解4、12、18、24、32 h后进行熟化。熟化完全的香草兰豆荚利用“1.2.1”方法提取,对香兰素进行紫外分光光度计测定分析。
1.2.3.3不同料液比对香草兰酶促生香研究的影响。取杀青后的香草兰豆荚50 g切碎至均匀大小,加入pH 5.0的磷酸盐缓冲液200、300、400、500、600、700 mL(料液比依次为1∶4、1∶6、1∶8、1∶10、1∶12、1∶14 g/mL)进行匀浆。在匀浆液中加入20 U/g的β-葡萄糖苷酶,在35 ℃的酶解温度下,搅拌酶解18 h后进行熟化。熟化完全的香草兰豆荚利用“1.2.1”方法提取,对香兰素进行紫外分光光度计测定分析。
1.2.3.4不同加酶量对香草兰酶促生香研究的影响。取杀青后的香草兰豆荚50 g切碎至均匀大小,加入pH 5.0的磷酸盐缓冲液200 mL进行匀浆。在匀浆液中加入15、20、25、30、35 U/g的β-葡萄糖苷酶,在35 ℃的酶解温度下,搅拌酶解18 h后进行熟化。熟化完全的香草兰豆荚利用“1.2.1”方法提取,对香兰素进行紫外分光光度计测定分析。
1.2.4β-葡萄糖苷酶酶解香草兰的工艺条件优化。通过对加酶量、酶解温度、酶解时间、料液比等方面进行了单因素试验考察,采用响应面法在3因子3水平上对β-葡萄糖苷酶酶解香草兰工艺条件进行优化。选取酶解温度、料液比和加酶量作为响应面试验设计的分析因子,同样条件下制备一个不加酶的空白对照样,之后进行熟化,熟化完全的香草兰豆荚以产品中香兰素含量为指标对提取物进行分析。
2 结果与分析
2.1不同单因素对香兰素含量的影响
2.1.1不同反应温度对香兰素含量的影响。在酶解温度不同的条件下提取香兰素,其他条件(料液比1∶12 g/mL,反应时间18 h,加酶量为20 U/g)相同,计算不同酶解温度条件下香兰素含量。
对50 g香草兰豆荚进行酶解温度的单因素试验,分别测定各处理组中的香兰素含量。由图1可以看出,酶解温度处于50 ℃时,提取的香兰素相对含量达到最大值。在50 ℃之前,随着温度的升高,酶的水解效果不断提高;但在50 ℃以后,香兰素含量开始下降。因此,该试验采用50 ℃的酶解温度。
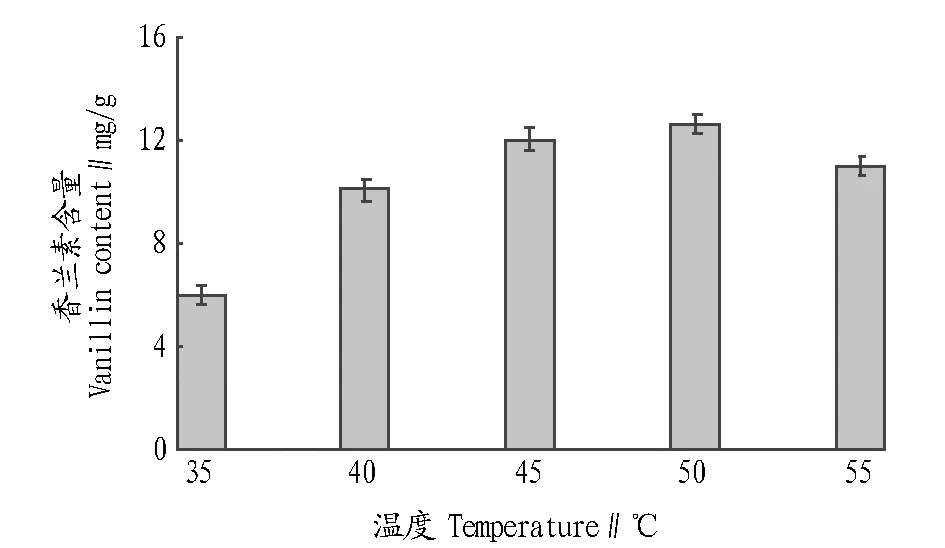
图1 酶解温度对香兰素含量的影响Fig.1 Effects of enzymolysis temperature on the vanillin content
2.1.2不同反应时间对香兰素含量的影响。在酶解时间不同的条件下提取香兰素,其他条件(料液比1∶12 g/mL,反应温度45 ℃,加酶量为20 U/g)相同,计算不同酶解时间条件下香兰素含量。
对50 g香草兰豆荚进行酶解时间的单因素试验,分别测定各处理组中的香兰素含量。由图2可以看出,随着酶解时间的不断增加,香兰素含量逐步增加,当酶解时间达到24 h时,提取的香兰素相对含量达到最大值。但在24 h之后,香兰素含量又随着酶解时间的增加而降低,这是因为随着时间的不断延长,一些香气成分挥发造成测到的香兰素有所降低。因此,该试验采用24 h为最佳酶解时间。

图2 酶解时间对香兰素含量的影响Fig.2 Effects of enzymolysis time on the vanillin content
2.1.3不同料液比对香兰素含量的影响。在料液比不同的条件下提取香兰素,其他条件(反应时间18 h,反应温度45 ℃,加酶量为20 U/g)相同,计算不同料液比条件下香兰素含量。
对50 g香草兰豆荚进行料液比的单因素试验,分别测定各处理组中的香兰素含量。由图3可以看出,随着料液比中溶剂用量的提高,香兰素含量逐步增加,当料液比为1∶12 g/mL时,提取的香兰素相对含量达到最大值;料液比中溶剂用量继续增加时,香兰素含量没有随之增加。因此,该试验采用1∶12 g/mL为最佳料液比。

图3 料液比对香兰素含量的影响Fig.3 Effects of solid-liquid ratio on the vanillin content
2.1.4不同加酶量对香兰素含量的影响。在加酶量不同的条件下提取香兰素,其他条件(反应时间18 h,反应温度45 ℃,料液比1∶12 g/mL)相同,计算不同加酶量条件下香兰素含量。
对50 g香草兰豆荚进行加酶量的单因素试验,分别测定各处理组中的香兰素含量。由图4可以看出,随着加酶量的增加,香兰素含量逐步增加,当加酶量为20 U/g时,提取的香兰素相对含量达到最大值;加酶量继续增加时,香兰素含量没有明显增加。因此,该试验采用20 U/g为最佳加酶量。

图4 加酶量对香兰素含量的影响Fig.4 Effects of enzyme volume on the vanillin content
2.2提取香兰素工艺的响应面优化试验响应面分析法已经广泛应用于食品工业、化工、生物技术等方面,其目的是在现有的试验基础上寻找到试验范围上的因素的最佳组合和响应值的最优值,以确定最佳提取工艺参数[13]。
2.2.1响应面优化试验设计。根据单因素试验对不同反应温度、不同反应时间、不同料液比、加酶量进行综合考虑,采用3因素3水平,根据Box-Behnken Design(BBD)设计法设计香兰素提取的响应面试验,试验因素与水平设计见表1,共20个试验点,设计方案所得的试验结果见表2。
表1响应面3因素3水平试验设计
Table 1Three factors and three levels test design of response surface analysis
2.2.2响应面试验数学模型的建立。按照Design Expert 软件中的Box-Behnken Design 模型对表2的数据进行多元回归拟合,得到香兰素含量对反应温度(A)、料液比(B)、加酶量(C)的二次多项回归模型为:Y=17.29-0.15A+0.3B+0.95C-0.53AB+0.076AC+0.4BC-1.78A2+0.36B2-2.33C2。对回归模型进行方差分析,结果得出:FA=0.32,PA=0.586 4;FB=1.28,PB=0.284 1;FC=12.91,PC=0.004 9;FA2=12.54,PA2=0.005 3;FB2=0.52,PB2=0.487 6;FC2=21.50,PC2=0.000 9;FAB=3.26,PAB=0.101 3;FAC=0.067,PAC=0.800 9;FBC=1.88,PBC=0.200 2;F模型=11.73,P模型=0.000 3**;F失拟=4.04,P失拟=0.075 8。由此可以看出,模型显著性水平P<0.01,表明二次方程模型达到极显著水平;失拟项P=0.075 8>0.05,即模型差异不显著,说明模型残差均由随机误差引起。
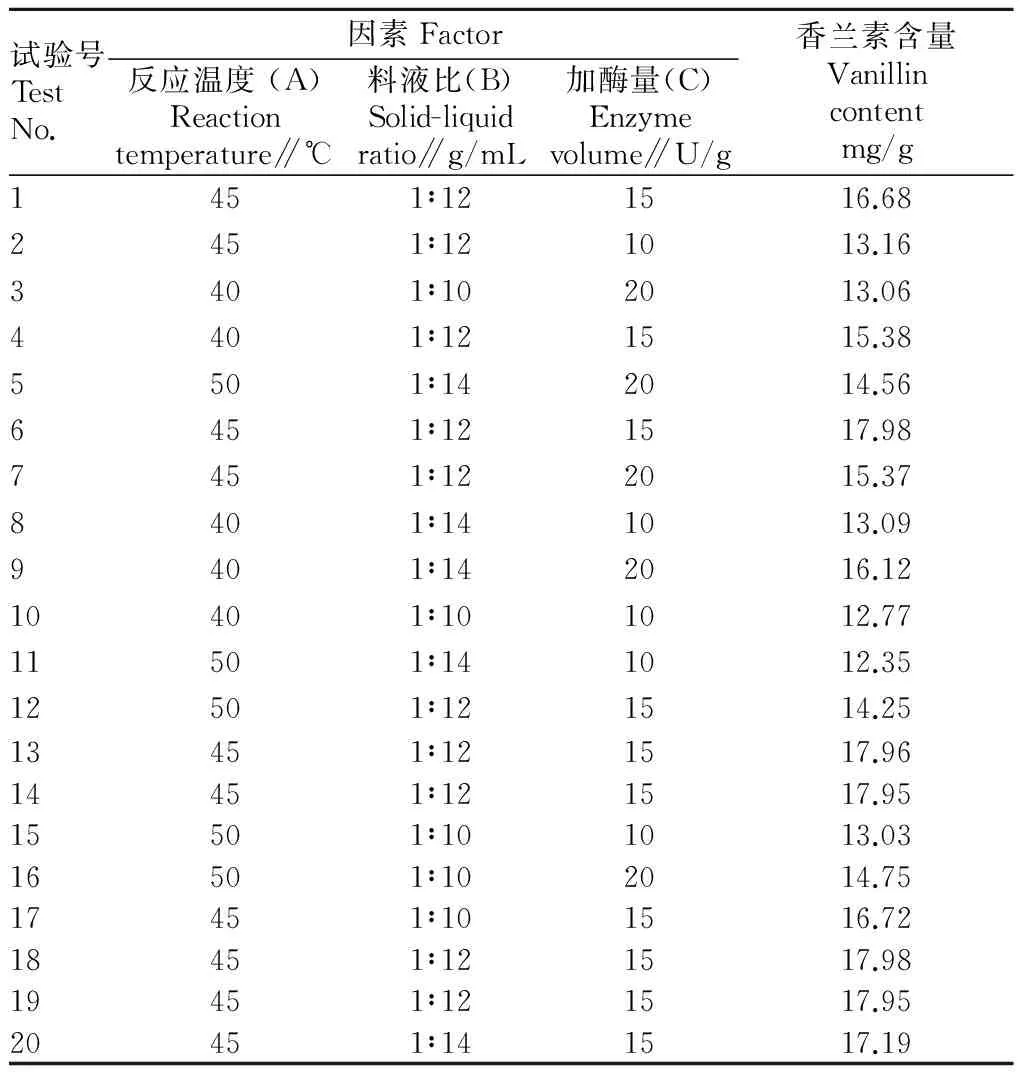
表2 Box-Behnken设计方案及其响应值
综合以上所述,说明模型拟合程度良好,试验误差小。因此,该模型可较好地描述各因素与响应值之间的真实关系,可利用模型来分析和预测制备香兰素的工艺结果。
2.2.3响应面优化与分析。利用Design Expert 7.1.6软件,绘制各影响因素对香兰素的响应曲面图,分析酶解温度(A)、料液比(B)、加酶量(C)对香兰素含量的影响。响应曲面的坡度平缓说明随着处理条件的变化,响应值的大小不受影响,但是,当曲面坡度陡峭时,则说明响应值对处理条件的改变非常敏感。
比较图5、6、7可知,酶解温度(A)、料液比(B)、加酶量(C)对香兰素含量的影响极为显著,表现为曲面较陡,其中加酶量对香兰素含量的影响最大。

图5 料液比与反应温度对香兰素含量的影响Fig.5 Effects solid-liquid ratio and reaction temperature on the vanillin content

图6 加酶量与反应温度对香兰素含量的影响Fig.6 Effects enzyme volume and reaction temperature on the vanillin content
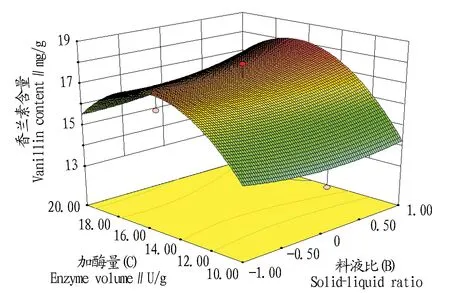
图7 加酶量与料液比对香兰素含量的影响Fig.7 Effects enzyme volume and solid-liquid ratio on the vanillin content
2.2.4优化与验证。由 SAS分析得到香兰素提取的最佳工艺条件为:反应温度 43.81 ℃,料液比1∶13.82 g/mL,加酶量16.3 U/g,此时的理论得率达到了18.188 1 mg/g。为了验证响应面法的可靠性,采用得到的最佳提取工艺条件进行香兰素提取的验证试验,同时考虑到实际生产操作的便利性,以反应温度 44 ℃,料液比1∶14 g/mL,加酶量16 U/g为最佳。3次平行试验得到的实际平均得率为17.80 mg/g,与理论值相差 0.02%。因此,通过响应面法优化得到葡萄糖苷酶酶解香草兰豆荚提取工艺条件是可行的,具有实际生产价值。
3 结论
通过响应面试验优化了葡萄糖苷酶对香草兰进行酶解的工艺,葡萄糖苷酶酶解香草兰的最佳工艺条件为:反应温度 44 ℃,料液比1∶14 g/mL,加酶量16 U/g,此条件下香兰素含量实际得率17.80 mg/g。结果表明,经葡萄糖苷酶处理后得到的香草兰提取物,其中的香兰素含量明显提高,其香气也更加浓郁,说明葡萄糖苷酶可以将香兰素前体物质香兰素葡萄糖苷分解形成香兰素和葡萄糖,生成的香兰素赋予香草兰香味。
[1]WALTON N J,MAYER M J,NARBAD A.Molecules of interestvanillin[J].Phytochemistry,2003,63(5):505-515.
[2]WALISZEWSKI K N,PARDIO V T,OVANDO S L.A simple and rapid HPLC technique for vanillin determination in alcohol extract[J].Food chemistry,2007,101(3):1059-1062.
[3]韩秀山.我国香兰素发展概况[J].四川化工与腐蚀控制,2002,5(1):36-37.
[4]江明,刘涛,杨祖武,等.不同加工处理条件下香荚兰荚果中二种内源酶的活性变化[J].云南植物研究,2005,27(3):310-314.
[5]宋刚,曹劲松,彭志英.香兰素的生物合成[J].食品与发酵工业,2001,27(7):72-74.
[6]RANADIVE A S.Vanillin and related flavour compounds in vanilla extractsmade frombeans of various global origins[J].Journal of agricultural and food chemistry,1992,40(10):1922-1924.
[7]浦帆,江明,张正居,等.香荚兰酶促生香的研究[J].云南植物研究,1998,20(3):355-361.
[8]韦寿莲,赵建芬.紫外分光光度法测定食品中香兰素的含量[J].肇庆学院学报,2008,29(5):31-33.
[9]孙海彦,王茜,彭明.利用黑曲霉β-葡萄糖苷酶催化香兰素葡萄糖苷水解[J].基因组学与应用生物学,2011,30(6):687-690.
Optimization of the Technology Condition of Vanilla Enzyme Digestion by Glycosidase
KANG Lin-zhi,WANG Na,QIN Yan,YUN Fan*et al
(Guangzhou Alchemy Biotechnology Co.,Ltd.,Guangzhou,Guangdong 510760)
[Objective]To optimize the technology condition of vanilla enzyme digestion by glycosidase.[Method]With vanilla as the material,we researched the extraction technology of vanillin by glycosidase enzymolysis.Test factor and level were selected based on single factor test.Response Surface Analysis was designed based on three factors and three levels.According to the regression analysis,influencing factor of technology condition was determined.With vanillin content as the response value,response surface analysis was carried out.[Result]The optimal technology condition of vanilla enzyme digestion by glycosidase was as follows: 44 ℃ reaction temperature,1∶14 g/mL solid-liquid ratio,and 16 U/g enzyme volume.Under this condition,the extraction rate of vanillin content was 17.80 mg/g.[Conclusion]Glycosidase can hydrolyse the precursor of vanillin,release the potential components of vanilla aroma,and greatly improve the aroma composition.
Glycosidase enzyme;Vanilla;Vanillin;Enzymolysis
康林芝(1988- ),女,山东菏泽人,工程师,博士,从事食品生物技术研究。*通讯作者,工程师,硕士,从事食品生物技术研究。
2016-06-29
S 573
A
0517-6611(2016)25-058-04
