高浓度磁共振对比剂钆布醇的理化性质及临床应用
2016-10-18许俊赵茜茜
许俊, 赵茜茜
许乙凯
·综述·
高浓度磁共振对比剂钆布醇的理化性质及临床应用
许俊, 赵茜茜
综述
许乙凯
审校
钆布醇(Gd-BT-DO3A)是一种细胞外分布、非组织特异性的、非离子型、大环类顺磁性钆类螯合剂,因其高浓度、高弛豫率的特点,使得钆布醇在中枢神经系统及其他体部的增强磁共振成像、对比增强磁共振血管成像方面独具优势;其独特的大环状结构,在体内外均具有极高的稳定性,血浆蛋白结合率低,安全性高,不良反应少,患者更耐受。本文主要对钆布醇的理化性质及其用于磁共振成像的相关研究及临床应用进行综述。
钆布醇; 磁共振对比剂; 磁共振成像
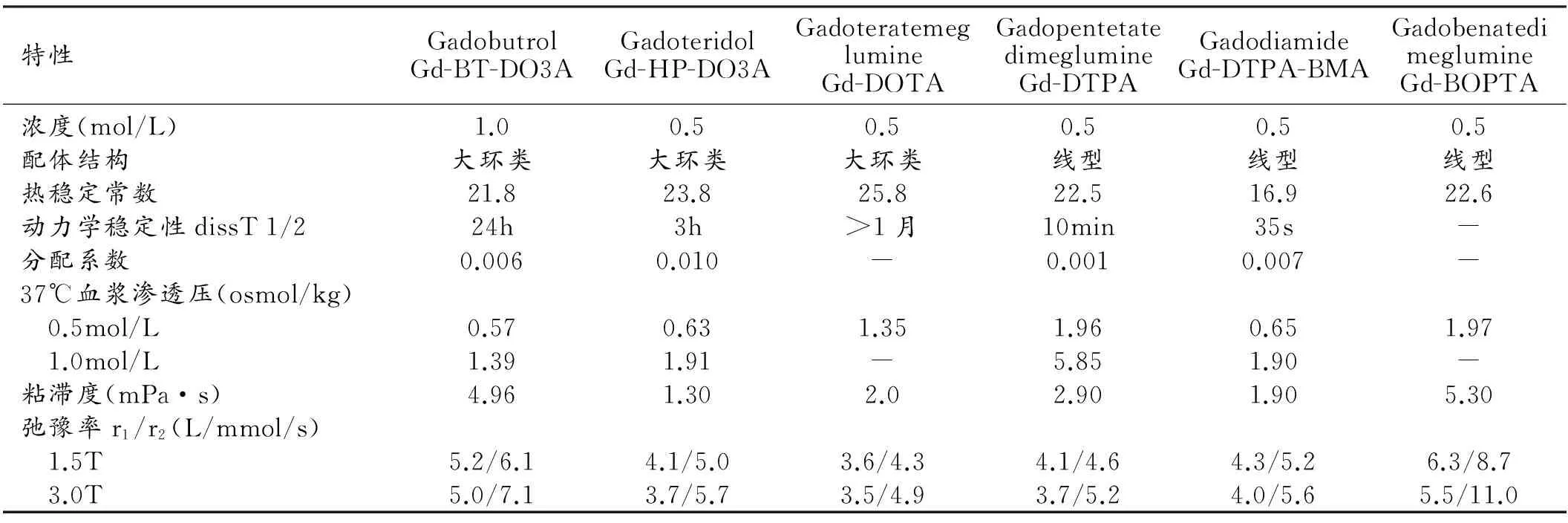
表1 Gadovist与其他钆类对比剂的主要理化特性比较
临床上使用对比剂的根本目的,是最大程度的提高病灶与周围组织的对比度,反映病灶的内部结构、血供水平及组织器官的功能水平,为临床定性、定量诊断提供客观依据。钆类对比剂是目前临床应用最广泛的磁共振对比剂,钆布醇作为第二代钆对比剂,是一种细胞外分布、非组织特异性的、非离子型、大环类顺磁性钆类螯合剂,因其高浓度、高弛豫率的特点,使得钆布醇在中枢神经系统及其他体部的增强MRI、对比增强磁共振血管成像(MRA)方面独具优势。
钆布醇的理化性质
钆布醇(Gd-BT-DO3A,Gadobutrol)商品名为Gadovist,化学名称为10-(2,3-二羟基-1-羟甲基丙基)-1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸,钆复合物,分子式是C18H31GdN4O9,相对分子质量为604.72[1]。Gadovist由钆离子和大环配基二羟基-羟甲基丙基-四氮杂环十二烷-三乙酸构成,Gd3+有9个配位键,其中8个位点结合大环形butrol[1,4,7-三羧甲基-10-(1-羟甲基-2,3-二羟丙基)-1,4,7,10-四氮杂环十二烷],螯合形成窝穴化合物,Gd3+紧紧嵌入这个完整笼形结构的大环中心,相较于线性结构的钆对比剂其稳定性更高。Gadovist在生理条件下稳定常数为log Keq=21.8,金属置换作用非常慢。体外血浆研究发现,不论是37℃生理条件下的血浆还是加入10 mmol/L磷酸盐溶液的血浆,经过15 d孵育,Gd-BT-DO3A几乎没有游离Gd3+释放,而线型结构钆对比剂在生理条件下可以释放出10%~20%的游离Gd3+。体外竞争实验(pH=5.3)发现,Gadovist中金属离子解离半衰期为65年,远远高于其在体内的排泄半衰期[2],意味着Gadovist在被解离之前就已排除体外,因此Gadovist在生理条件下基本是惰性的,不发生代谢。Gadovist水溶性很强,正丁醇-水(PH=7.6缓冲液)分配系数为0.006。它虽有弱蛋白结合效应(2.7%),但组胺释放试验和溶菌酶抑制试验表明其无补体激活及酶抑制作用。Gadovist在0.5 mol/L条件下渗透压为0.57 osmol/kg,与其他等浓度电中性钆对比剂近似,1.0 mol/L条件下渗透压为1.39 osmol/kg,远远低于同等浓度Gd-DTPA;其粘滞度较低,37℃血浆中其粘滞度为4.96 mPa·s[3-4]。Gadovist弛豫率很高,且不依靠蛋白结合,随场强增高弛豫率无明显降低,更适应于高场强MRI;在1.5T和3.0T磁场条件、37℃血浆中,Gadovist纵向弛豫率r1分别为5.2 L/mmol/s、5.0 L/mmol/s,横向弛豫率r2分别为6.1 L/mmol/s、7.1 L/mmol/s[5](表1,图1)。
Gadovist的药代动力学
Gadovist经静脉注射后迅速分布于细胞外间隙,血浆蛋白结合可忽略不计,稳态时血浆分布容积约0.23 L/kg[1]。静脉注射0.1 mmol/L/kg Gadovist,注射2 min后测得其平均血浆浓度为0.59 mmol/L,注射60 min后为0.3 mmol/L。Gadovist在人体内不发生代谢,以原形形式经肾排泄,肾外清除可忽略不计。Gadovist的平均血浆清除半衰期为1.81 h(1.33~2.13 h),相当于菊粉的肾脏清除率,说明Gadovist主要通过肾小球滤过作用排出[6]。Gadovist在儿童及老年人体内的药代动力学模式与成人基本一致。
由于Gadovist主要经肾排泄,肾功能不全患者的血浆清除半衰期会随肾小球滤过率的下降而延长。注射0.1 mmol/L/kg Gadovist,其平均血浆清除半衰期从健康人体内的1.5 h延长到7.4 h(轻度肾功能不全患者)、17.9 h(中重度肾功能不全患者)。但轻、中度肾功能不全患者能在72 h内将其从尿中完全排出;重度肾功能不全者能在120 h内从尿中排出80%以上,而对于接受透析治疗的肾衰患者,三次血液透析之后,Gadovist能够清除98%[7]。
Gadovist的安全性与耐受性
Gadovist是唯一浓度达到1.0 mol/L的钆类对比剂,是目前其他市售胞外对比剂浓度的两倍。与低浓度的对比剂相比,为了得到相同的钆含量,Gadovist的使用剂量可以减半,注射流率可以减慢,不仅团注效果更理想,而且使患者更容易耐受,发生局部不适的可能性更低。
Ⅰ、Ⅱ、Ⅲ期临床试验及超过4百万的临床应用检测显示,Gadovist的副反应发生率低,是一种安全的对比剂。一项多中心大样本临床试验对14299例患者的观察数据显示,Gadovist注射液总体不良反应发生率为0.55%[8]。Gadovist最常见的不良反应是头痛、恶心、注射部位反应、味觉异常和热感等。大部分不良反应为轻度到中度,持续时间很短。此外,尚有严重的不良反应,如心脏停搏、呼吸骤停、过敏性休克和肾源性系统性纤维化(NSF),但其发生非常罕见[9]。2006年12月美国FDA就肾功能不全患者使用钆类对比剂后出现NSF的问题向医务人员提出警告,NSF是一种罕见的特发性疾病,其发生率与钆类对比剂的稳定性有关,低稳定性的钆类对比剂游离出的钆离子会导致患者出现NSF,而Gadovist独特的大环状结构,是目前稳定性最高的对比剂,被欧洲药监局和美国对比剂指南列为低度风险的对比剂产品,也是唯一被允许用于严重肾损害患者的对比剂。
Gadovist的临床应用
1.中枢神经系统增强MRI
Gadovist作为一种非特异性、细胞外分布的钆类对比剂,和传统的细胞外间隙对比剂一样,并不能透过完整的血脑屏障,可以自血脑屏障破坏处进入细胞外液,缩短局部组织T1、T2,使缺乏血脑屏障的正常脑组织、轴外肿瘤和血脑屏障已被破坏的区域出现信号增强,而正常脑组织不强化,从而增加二者信号的对比,提高颅内病灶检出率。Gadovist的高浓度、高弛豫率优势,使得其在中枢神经系统原发性及转移性肿瘤、多发性硬化等的检出方面,可以明显提升病灶细节的显示、较常规对比剂发现更多病灶,提高诊断信心。
Attenberger等[10]利用大鼠胶质瘤模型,在3.0T磁共振扫描仪上对等剂量(0.1 mmol/kg)的三组对比剂1.0 mol/L Gadovist、0.5 mol/L Magnevist及Dotarem用于MRI增强扫描的对照分析,发现Gadovist组图像信噪比(signal noise ratio,SNR)、对比噪声比(contrast to noise ratio,CNR)及病灶强化程度显著高于Magnevist和Dotarem。Anzalone等[11]和Katakami等[12]两项对等剂量的不同钆类对比剂的多中心、大样本、单盲的随机对照III期临床研究结果显示,Gadovist在对比增强MRI前后的CNR、病灶对比增强度及病灶边界显示、病灶检出数目及诊断信心等指标均优于常规0.5 mol/L钆类对比剂。Uysal等[13]对30例多发性硬化患者行1.0 mol/L Gadovist和0.5 mol/L Magnevist增强MRI随机对照研究显示,二者于3个时间点(即刻、5 min、10 min)检出的强化病灶数及检出有多发病灶的患者数目的差异显著(Gadovist: 36、54、55个,16、24、24例;Magnevist:18、32、34个,10、18、18例),说明1.0 mol/L Gadovist可以显著提高多发性硬化患者活动病灶的检出率。总之,Gadovist 增强MRI较常规浓度钆类对比剂更能提高病灶与正常组织之间的对比度,从而提高病变的检出率。
Gadovist用于常规增强MRI时,成人推荐给药剂量为0.1 mmol/kg体重,静脉注射(2 mL/s),足以满足诊断。当临床高度怀疑有CNS病灶存在,而增强扫描未见异常,或需明确病灶数目、大小、范围时,需在首次注射后30 min内,追加0.1~0.2 mmol/kg对比剂。用于诊断乏血病灶、细胞外间隙小病灶,排除肿瘤脑转移或复发时,推荐0.3 mmol/kg。此外,细胞外非特异性对比剂的药代动力学特点,对比剂在人体内的分布过程主要分为α相(即血管相,药物从中央室向周围室分布,持续2~3 min)和β相(即消除相,药物分布平衡后的一段缓慢清除过程,此时药物主要分布于实质间隙内,持续约90 min),因此为了达到充分的病变强化效果,推荐于注药2~3 min后(β相)再开始扫描。
2.三维增强MRA
Gd-BT-DO3A因其弛豫率大、浓度高,在增强磁共振血管成像(congtrast enhanced MRA,CE-MRA)的应用亦明显优于常规浓度(0.5 mol/L)钆类对比剂。注射等摩尔量的磁共振对比剂,所需1.0 mol/L Gadovist的体积仅为所需0.5 mol/L钆类对比剂的一半,从而有利于减少对比剂在血管内的扩散,获得更为紧凑的团注效果,进而使动脉相的峰值更高,也更加提前。峰值增高,使显影更加清晰;峰值提前,可以增加动脉相和静脉相的时间差,减少静脉污染,有更多时间观察动脉的情况,从而提供更理想的血管与周围组织的对比,提高血管尤其小血管的显示能力。Stehling等[14]比较0.1 mmol/kg的Gadovist和0.2 mmol/kg的Magnevist用于腹部CE-MRA中的图像质量,发现Gadovist的血管质量评分优于Magnevist;且发现在三期所有血管,使用Gadovist的CE-MRA均能获得更好的血管-周围组织对比,尤其是在门脉期和静脉期。两项多中心Ⅲ期临床实验比较了使用Gadovist的CE-MRA与血管成像的金标准-动脉数字减影血管造影(DSA)对特定血管段的相关临床诊断符合率,结果显示,使用Gadovist的CE-MRA与DSA对特定血管段相关临床诊断符合率的95%置信区间下限均具有统计学意义,证实了Gadovist在主动脉及外周动脉CE-MRA的诊断效能与DSA相当;且使用Gadovist行CE-MRA诊断大多数血管节段(从颈部到下肢)狭窄的敏感度和特异度均大于90%[15-16]。
Gadovist用于CE-MRA的推荐剂量及扫描规范:一项关于Gadovist剂量探索的临床研究通过比较不同剂量(0.05、0.15、0.25 mmol/kg)Gadovist用于CE-MRA检查的诊断效能,发现剂量为0.05 mmol/kg时,Gadovist CE-MRA的诊断效能不如DSA;用0.15~0.25 mmol/kg时与后者相当;随后的一项Ⅲ期临床实验进一步提示单个FOV范围CE-MRA检查(如主动脉弓上段,主动脉、腹腔盆腔动脉等大血管检查),用0.15 mmol/kg即可,而三倍FOV范围的CE-MRA检查(即外周血管)推荐用0.15~0.20 mmol/kg[15]。基于安全性、有效性、实用价值以及费用的综合考虑,当进行一个FOV成像时推荐剂量为0.10~0.15 mmol/kg体重,当进行多个FOV成像时需要用到0.2~0.3 mol/kg体重,注射流率为1~2 mL/s,即可满足大部分MRA需求,有时为了提高成像质量可以进一步提高剂量,如肝内动脉成像。使用相同钆含量的对比剂时,所需1.0 mol/L Gadovist的体积仅需常规0.5 mol/L对比剂的一半,因此,通常注射Gadovist时可以选择以下方案:①注射流率减半(通常为1.5 mL/s),时间不变;由于注射时间与常规0.5 mol/L对比剂相同,可以获得与常规浓度对比剂一致的团注形态,对成像序列和扫描技术无特殊要求,常规扫描方案即可获得满意的血管图像,因此推荐标准CE-MRA扫描应用这种方案,其优势主要体现在Gadovist本身的高弛豫率,而且注射流率减半,患者会更舒适,适合年老患者及患血管病变者;②注射流率不变(3.0 mL/s),时间减半;与常规0.5 mol/L对比剂相比,团注时间缩短一半,团注更紧凑;这种方案需联合快速采集技术(如时间分辨力磁共振血管成像,time resolved MRA),对操作者经验要求很高,需要严格把握信号采集时机,即当靶血管内对比剂强化达峰值的同时开始填充K空间的中心;因此精确计算对比剂从注射点到达靶血管的循环时间对于确定信号采集时间至关重要。通常采用预注射对比剂(1~2 mL)计算循环时间(图2),或者采用透视触发技术来确定扫描延迟时间。此外,正式扫描时需要额外注射约30 mL生理盐水,且以相同的流率推注,以便维持对比剂的最佳团注形态以及将肘静脉内残存对比剂全部推送至靶血管。
3.脑动态磁敏感对比灌注加权成像
脑动态磁敏感对比灌注加权成像(dynamic susceptibility contrast PWI,DSC-PWI)主要利用对比剂的T2*弛豫效应(T2弛豫效应和磁敏感效应)。其依据的理论基础是首过对比剂的负性增强效应,即对比剂通过兴趣区可引起一过性T2*信号强度减低,信号减低的程度与该区域迅速通过的对比剂容积呈正比;且对比剂剂量越大,灌注图SNR越高,参数越可靠,故DSC-PWI需要高浓度、高横向弛豫率r2的对比剂。Gd-BT-DO3A横向弛豫率较高(3.0T场强条件下,r2=7.1 L/mmol/s),并且兼具首过浓度高的优势,可以弥补超快速成像序列造成的SNR和CNR损失,用于DSC PWI获得满意的脑灌注图。Tombach等[17]在1.5T场强下,对43名健康志愿者使用1.0 mol/L与0.5 mol/L对比剂在脑灌注成像方面的个体优劣比较研究,结果显示使用前者的平均达峰时间和半高宽(full width at half maximum,FWHM)更小,灰白质对比度及CNR更高,横向弛豫速度改变量的最大值ΔR2max显著增加,不同部位灰质强化峰值差异更大;且前者的灌注参数图也更理想,尤其是rrCBF和MTT图;但因剂量相同,故rrCBV图差别不大;因此,1.0 mol/L的Gadovist具有明显优势。此外,Essig等[18]在1.5T场强下,比较Gadobutrol与MultiHance用于DSC PWI的对比研究,结果显示Gadobutrol与MultiHance磁化敏感效应无明显差异(信号降低率分别为29.4%、28.3%,FWHM为6.4 s、7.0 s),但均高于常规钆剂。
Gadovist用于颅脑DSC-PWI的最适剂量:Thilmann等[19]在3.0T场强下给16名健康志愿者分别使用0.1 mmol/kg、0.2 mmol/kg Gadovist及0.1 mmol/kg MultiHance行DSC-PWI检查,发现0.1 mmol/kg Gadovist与MultiHance用于检查可以获得几乎无差别的灌动脉信号曲线和灌注参数图,所得定量评估参数无显著差异,而使用0.2 mmol/kg Gadovist时图像质量更佳,SNR和CNR更高,但0.1 mmol/kg已能满足诊断需要。而2010年Wirestam等[20]的一项研究进一步分析了不同对比剂使用方案(0.1 mmol/kg、0.2 mmol/kg Gadovist及0.1 mmol/kg MultiHance)用于灌注参数评估结果之间的相关性,发现两种剂量Gadovist的结果相关性较好,而Gadovist与MultiHance的评估结果相关性较低。因此,Gadovist用于DSC-PWI推荐给药剂量为0.1 mmol/kg体重,静脉推注流率为4~6 mL/s,随后以相同流率注射20~25 mL生理盐水。
4.其他体部区域CE-MRI的应用
Gadovist除了广泛应用于中枢神经系统增强成像及CE-MRA外,还可应用于其他体部区域增强成像。目前欧洲已有两项盲法的随机对照III期临床试验,对1000多例拟诊肝及肾病变的患者使用等剂量1.0 mol/L Gd-BT-DO3A及0.5 mol/L Gd-DTPA的增强MRI检查进行评估,分别研究Gadovist用于肝、肾病变的诊断效能,结果发现Gd-BT-DO3A的诊断符合率(大于80%)并不低于Gd-DTPA(大于84%);两种对比剂在增强前后敏感度与特异度的改善方面无明显差异[21-22]。
综上所述,Gadovist具有以下优势:①兼具高弛豫率、高浓度的特性,是单位体积的所有磁共振对比剂中,具有最强T1缩短能力的磁共振对比剂;极大的提高了组织的信号强化程度,有利于更全面检出病灶及更清晰显示病灶细节。②高浓度高弛豫率的特点,使其在相同钆含量的对比剂使用时注射剂量减半,团注更紧凑,进而使动脉相的峰值更高,也更加提前;用于CE-MRA可以使显影更加清晰;且动脉相和静脉相的时间差较宽,静脉污染减少,从而提供更理想的血管-周围组织对比,提高血管尤其小血管的显示能力。③独特的大环状结构,稳定性最高,安全性好,不良反应少,患者更耐受。此外,尚有研究者将Gadovist用于间质淋巴CE-MRI、肺扩散功能评价级肺灌注MRI等,但在这些领域的具体应用方案及安全性还有待进一步研究。
[1]Tombach B,Heindel W.Value of 1.0M gadolinium chelates:review of preclinical and clinical data on gadobutrol[J].Eur Radiol,2002,12(6):1550-1556.
[2]Frenzel T,Lengsfeld P,Schirmer H,et al.Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C[J].Invest Radiol,2008,43(12):817-828.
[3]Port M,Idee JM,Medina C,et al.Efficiency,thermodynamic and kinetic stability of marketed gadolinium chelates and their possible clinical consequences:a critical review[J].Biometals,2008,21(4):469-490.
[4]Bellin MF,van der Molen AJ.Extracellular gadolinium-based contrast media:an overview[J].Eur J Radiol,2008,66(2):160-167.
[5]Rohrer M,Bauer H,Mintorovitch J,et al.Comparison of magnetic properties of MRI contrast media solutions at different magnetic field strengths[J].Invest Radiol,2005,40(11):715-724.
[6]Staks T,Schuhmann-Giampieri G,Frenzel T,et al.Pharmacokinetics,dose proportionality,and tolerability of gadobutrol after single intravenous injection in healthy volunteers[J].Invest Radiol,1994,29(7):709-715.
[7]Tombach B,Bremer C,Reimer P,et al.Pharmacokinetics of 1M gadobutrol in patients with chronic renal failure[J].Invest Radiol,2000,35(1):35-40.
[8]Forsting M,Palkowitsch P.Prevalence of acute adverse reactions to gadobutrol——a highly concentrated macrocyclic gadolinium chelate:review of 14,299 patients from observational trials[J].Eur J Radiol,2010,74(3):e186-e192.
[9]Voth M,Rosenberg M,Breuer J.Safety of gadobutrol,a new generation of contrast agents: experience from clinical trials and postmarketing surveillance[J].Invest Radiol,2011,46(11):663-671.
[10]Attenberger UI,Runge VM,Jackson CB,et al.Comparative evaluation of lesion enhancement using 1M gadobutrol vs 2 conventional gadolinium chelates,all at a dose of 0.1mmol/kg,in a rat brain tumor model at 3T[J].Invest Radiol,2009,44(5):251-256.
[11]Anzalone N,Scarabino T,Venturi C,et al.Cerebral neoplastic enhancing lesions:multicenter,randomized,crossover intraindividual comparison between gadobutrol (1.0M) and gadoterate meglumine (0.5M) at 0.1mmol Gd/kg body weight in a clinical setting[J].Eur J Radiol,2013,82(1):139-145.
[12]Katakami N,Inaba Y,Sugata S,et al.Magnetic resonance evaluation of brain metastases from systemic malignances with two doses of gadobutrol 1.0m compared with gadoteridol:a multicenter,phase ii/iii study in patients with known or suspected brain metastases[J].Invest Radiol,2011,46(7):411-418.
[13]Uysal E,Erturk SM,Yildirim H,et al.Sensitivity of immediate and delayed gadolinium-enhanced MRI after injection of 0.5M and 1.0M gadolinium chelates for detecting multiple sclerosis lesions[J].AJR,2007,188(3):697-702.
[14]Stehling MK,Holzknecht N,Laub G.Gadolinium-enhanced magnetic resonance angiography of abdominal blood vessels[J].Radiologe,1997,37(7):539-546.
[15]Hentsch A,Aschauer MA,Balzer JO,et al.Gadobutrol-enhanced moving-table magnetic resonance angiography in patients with peripheral vascular disease:a prospective,multi-centre blinded comparison with digital subtraction angiography[J].Eur Radiol,2003,13(9):2103-2114.
[16]Schaefer FK,Schaefer PJ,Altjohann C,et al.A multicenter,site-independent,blinded study to compare the diagnostic accuracy of contrast-enhanced magnetic resonance angiography using 1.0M gadobutrol (Gadovist) to intraarterial digital subtraction angiography in body arteries[J].Eur J Radiol,2007,61(2):315-323.
[17]Tombach B,Benner T,Reimer P,et al.Do highly concentrated gadolinium chelates improve MR brain perfusion imaging? Intraindividually controlled randomized crossover concentration comparison study of 0.5 versus 1.0mol/L gadobutrol[J].Radiology,2003,226(3):880-888.
[18]Essig M,Lodemann KP,Lehuu M,et al.Comparison of multihance and Gadovist for cerebral MR perfusion imaging in healthy volunteers[J].Radiologe,2002,42(11):909-915.
[19]Thilmann O,Larsson EM,Bj?rkman-Burtscher IM,et al.Comparison of contrast agents with high molarity and with weak protein binding in cerebral perfusion imaging at 3T[J].J Magn Reson Imaging,2005,22(5):597-604.
[20]Wirestam R,Thilmann O,Knutsson L,et al.Comparison of quantitative dynamic susceptibility-contrast MRI perfusion estimates obtained using different contrast-agent administration schemes at 3T[J].Eur J Radiol,2010,75(1):e86-e91.
[21]Tombach B,Bohndorf K,Brodtrager W,et al.Comparison of 1.0M gadobutrol and 0.5M gadopentate dimeglumine-enhanced MRI in 471 patients with known or suspected renal lesions:results of a multicenter,single-blind,interindividual,randomized clinical phase Ⅲ trial[J].Eur Radiol,2008,18(11):2610-2619.
[22]Hammerstingl R,Adam G,Ayuso JR,et al.Comparison of 1.0M gadobutrol and 0.5M gadopentetate dimeglumine-enhanced magnetic resonance imaging in five hundred seventy-two patients with known or suspected liver lesions:results of a multicenter,double-blind,interindividual,randomized clinical phase-Ⅲ trial[J].Invest Radiol,2009,44(3):168-176.
510515广州,南方医科大学南方医院影像中心
许俊(1989-),男,广东潮州人,博士研究生,主要从事分子影像学研究。
许乙凯,E-mail:yikaivip@163.com
R445.2
A
1000-0313(2016)07-0666-04
10.13609/j.cnki.1000-0313.2016.07.021
2015-07-31)
