卵状ε-MnO2的合成及其高活性催化降解亚甲基蓝
2016-10-17黄建智成晓玲
黄建智, 成晓玲
(1.华南理工大学 化学与化工学院,广东 广州 510641;2.广东工业大学 轻工化工学院,广东 广州 510006)
卵状ε-MnO2的合成及其高活性催化降解亚甲基蓝
黄建智1,2, 成晓玲2
(1.华南理工大学 化学与化工学院,广东 广州 510641;2.广东工业大学 轻工化工学院,广东 广州 510006)
通过500℃焙烧卵状MnCO3前驱体,制得了一种高效降解亚甲基蓝的卵状ε-MnO2催化剂.采用扫描电子显微镜、X射线衍射分析仪、紫外可见分光光度计、比表面积测定仪对材料进行了测试.结果显示,卵状ε-MnO2催化剂具有很高的比表面积,为88m2/g.将制得的卵状ε-MnO2材料应用于亚甲基蓝的降解,在H2O2存在下,卵状ε-MnO2对亚甲基蓝的脱色率高达92%,表现出在室温下去除亚甲基蓝的优越能力.
ε-MnO2;卵状;催化降解;亚甲基蓝
亚甲基蓝作为一种常见的水体污染物,其带来的环境污染问题越来越严重.因此,制备一种高效去除亚甲基蓝的催化剂显得尤为必要.二氧化锰作为一种多功能的过渡金属氧化物,由于其特殊的物理化学性质被广泛应用于催化领域.
锰的化合物价格低廉并且无毒,锰的化合物一般有+2,+3和+4价,一般+4价的二氧化锰是最为常见的锰氧化合物.锰氧化合物的晶型结构很多,已知结构的锰氧化合物就多达30多种,但它们的组成结构单元均为[MnO6]八面体.
MnO2存在多种晶型,例如α-,β-,γ-,δ-和ε-形式,基本单元锰氧八面体的连接方式不同[1-2],各自具有独特的性质,被广泛应用在催化剂[3-5]、磁性材料[6-8]、Li/MnO2电池[9]、电极材料[10]、超级电容器[11-13]、水处理[14-15]等领域.
合成ε-MnO2的报道仍然较少[16].DandanHan[17]等人在室温下通过温和的化学方法制备了中空的ε-MnO2微球,实验结果表明中空ε-MnO2微球作为电极材料在高性能超级电容器领域具有潜在的应用价值.FengjuanShi等[18]利用水热法制备了花状六方ε-MnO2,其比表面积为30m2/g,在229℃下对甲苯的催化转化率高达90%.YankuanLiu等[8]通过热分解Mn(NO3)2可控地合成出超顺磁性的ε-MnO2纳米线,在磁性材料领域具有广阔的应用前景.PengYu等[19]通过溶剂热法,以Mn(NO3)2和C2H5NO2为原料合成了ε-MnO2纳米颗粒,将其应用于超级电容器,比电容量相当高.
到目前为止,对亚甲基蓝的脱色研究仍然较少.Cao等[15]制备的核壳结构γ-MnO2/α-MnO2材料对亚甲基蓝的脱色率仅为85%,脱色率不高;而Cheng等[20]制备的β-MnO2材料对亚甲基蓝的脱色率为90%,脱色率有所提高,但反应条件较为苛刻.本文采用卵状MnCO3前驱体焙烧制得的卵状ε-MnO2,在室温条件下对亚甲基蓝的降解具有较高活性,脱色率达92%,不仅反应条件温和,同时脱色率更高.
1 实验部分
1.1材料与仪器
试剂:高锰酸钾、葡萄糖、酒石酸、亚甲基蓝、过氧化氢,以上试剂均为分析纯.
仪器:磁力搅拌器,离心机,反应釜,烘箱,马弗炉,扫描电子显微镜(型号:FEIQuanta650,配备英国OxfordinstrumentINCA350X-Max50 能谱仪),X射线衍射分析仪(型号:UltimaⅢ,生产厂家:日本理学公司),紫外可见分光光度计(型号:UV-2800A,生产厂家:日本日立公司),比表面测定仪(型号:ASAP- 2020,生产厂家:日本日立公司).
1.2测试条件
X射线衍射分析:CuKα辐射,波长λ为0.1542nm,管电压40kV,管电流40mA,扫描步长0.02°/min,扫描角度范围10°~80°,扫描速度4°/min.
紫外分析:测试范围为800~400nm-1,扫描精度为1nm.
1.3卵状ε-MnO2的合成
往反应釜中加入2mmol高锰酸钾、3mmol葡萄糖、1mmol酒石酸,磁力搅拌至澄清,然后将反应釜置于烘箱中,180℃下反应8h,收集黑褐色沉淀,用无水乙醇和去离子水各洗涤3次,最后将产物于烘箱中烘干.
将卵状MnCO3前驱体在马弗炉中于500℃下焙烧8h得到卵状ε-MnO2.
2 结果与讨论
2.1X射线衍射分析
由图1可知,MnCO3经过焙烧后出现ε-MnO2的4个强的特征衍射峰,分别对应(100)、(101)、(102)和(110)晶面,与PDF卡片30-0820吻合,证明该物质确实为ε-MnO2.

图1 卵状ε-MnO2的XRD图谱
2.2扫描电镜分析
由图2可知,本文通过简单的前驱体焙烧法制备出了卵状ε-MnO2,该卵状ε-MnO2形貌规整,粒度均匀,卵状ε-MnO2的粒径约为2μm.比表面积测试结果显示,该卵状ε-MnO2的比表面积为88m2/g.

图2 卵状ε-MnO2扫描电镜照片
2.3对亚甲基蓝的催化降解
在250mL烧杯中加入90mL质量浓度为10mg/L的亚甲基蓝溶液,取第一个样;再加入10mg催化剂,在磁力搅拌器上搅拌吸附30min,取第二个样;往烧杯中加入10mLH2O2后开始计时,2min时取第三个样,然后在10min,20min,30min等时间各取一次样,最后测样品的紫外光谱.
以亚甲基蓝的最大特征吸收峰λmax=665nm的强度变化来判断溶液浓度的变化,由图3可知,加入卵状ε-MnO2吸附30min后对亚甲基蓝的脱色率仅为17.4%,脱色效果不明显;当加入H2O2后,仅2min,脱色率为49.5%,λmax=662nm;10min后脱色率为86.6%,亚甲基蓝的特征吸收峰强度迅速减弱,同时最大吸收峰发生蓝移,吸收峰变宽,证明催化降解过程的发生.亚甲基蓝分子和H2O2吸附到催化剂表面,接着H2O2在催化剂表面分解产生·OH,·OH自由基进攻亚甲基蓝分子,降解成CO2、H2O和其他小分子,与文献[3- 4]报道的相似.随着催化降解时间的延长,在2~100min时间段,由于亚甲基蓝发生降解,导致最大吸收峰发生蓝移,λmax从665nm移向662nm和663nm,吸收峰逐渐变宽;在120min时,λmax红移回665nm,说明催化降解过程趋于终止.

图3 卵状ε-MnO2不同作用时间下亚甲基蓝的紫外光谱
Fig.3UV-Visspectrogramofmethylenebluewithdifferentactingtimebyellipsoid-likeε-MnO2
由图4可知,120min时卵状ε-MnO2对亚甲基蓝的脱色率可高达92%,说明卵状ε-MnO2对亚甲基蓝具有显著的催化降解效果.
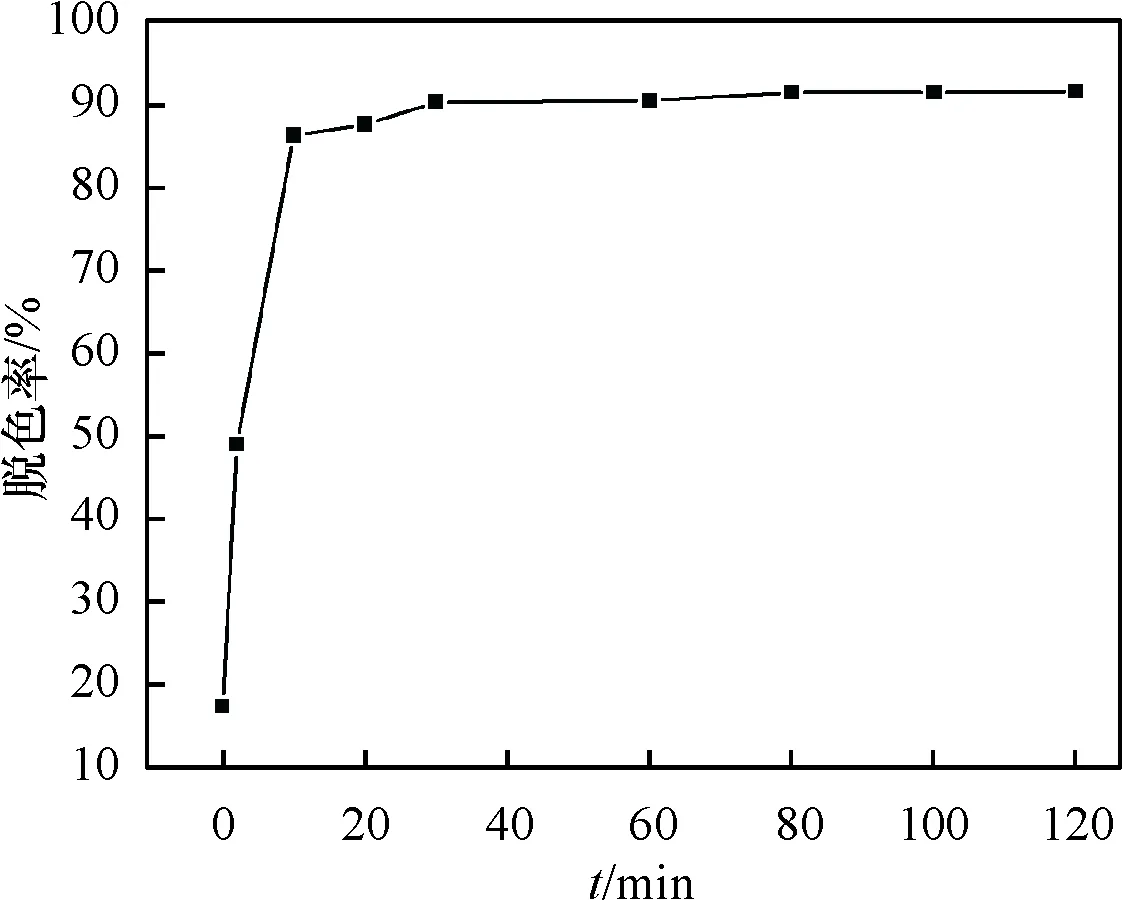
图4 卵状ε-MnO2不同作用时间下对亚甲基蓝的脱色率
Fig.4Degreeofdecolorationofmethylenebluewithdifferentactingtimebyellipsoid-likeε-MnO2
由图5可知,只加入催化剂ε-MnO2时仅发生物理吸附,脱色率仅为17.7%;只加入氧化剂H2O2,但不加入催化剂时,脱色率为38.8%,亚甲基蓝发生少量降解,但脱色效果不明显;而当同时加入催化剂卵状ε-MnO2和氧化剂H2O2时,脱色率高达91%,亚甲基蓝在催化剂的作用下发生大量氧化降解,脱色效果很明显.
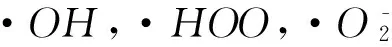

图5 不同物质作用30 min时亚甲基蓝的紫外光谱
Fig.5UV-Visspectrogramofmethylenebluewithdifferentreactantsby30min
3 结论
本文采用水热法可控地制备了卵状MnCO3,通过简单的焙烧MnCO3前驱体制得了卵状ε-MnO2.制得的卵状ε-MnO2催化剂的比表面积为88m2/g.将制得的卵状ε-MnO2催化剂应用于亚甲基蓝的催化降解,室温条件下,在H2O2存在下,卵状ε-MnO2对亚甲基蓝的脱色率为92%,表现出在室温下催化降解亚甲基蓝的高催化活性.
[1]LISH,LIUQH,QIL,etal.Progressinresearchonmanganesedioxideelectrodematerialsforelectrochemicalcapacitors[J].ChinJAnalChem,2012, 40(3):339-346.
[2]WANGHE,QIAND.Synthesisandelectrochemicalpropertiesofα-MnO2microspheres[J].MaterChemPhys, 2008, 109(2-3):399-403.
[3]CUIHJ,HUANGHZ,FUML,etal.Facilesynthesisandcatalyticpropertiesofsinglecrystallineβ-MnO2nanorods[J].CatalCommun, 2011,12 (14):1339-1343.
[4]YUC,LIG.,WEIL,etal.Fabrication,characterizationofβ-MnO2microrodcatalystsandtheirperformanceinrapiddegradationofdyesofhighconcentration[J].CatalToday, 2014, 224(1):154-162.
[5] 符志伟,程高,林婷,等.二氧化锰制备及催化燃烧甲苯性能研究[J].广东工业大学学报,2016,33(2):85.90.
FUZW,CHENGG,LINT,etal.ThepreparationofMnQ2andapplicationincatalyticcombustionoftoluene[J].JourndofGuangdongUniversiyofTechnology,2016,33(2):85-90.
[6]ANK,PARKM,YUJH.SynthesisofuniformlysizedmanganeseoxidenanocrystalswithvarioussizesandshapesandcharacterizationoftheirT1magneticresonancerelaxivity[J].EurJInorgChem,2012,12(3):2148-2155.
[7]GEJC,ZHUOL,YANGF,etal.One-dimensionalhierarchicallayeredKxMnO2(x<0.3)nanoarchitectures:Synthesis,characterization,andtheirmagneticproperties[J].JPhysChemB,2006,110 (36): 17854 -17859.
[8]LIUY,WANGH,ZHUYC,etal.Pyrolysissynthesisofmagneticε-andβ-MnO2nanostructuresandthepolymorphdiscrimination[J].SolidStateCommunications, 2009, 149(37-38):1514-1518.
[9]ARMSTRONGAR,BRUCEPG.SynthesisoflayeredLiMnO2asanelectrodeforrechargeablelithiumbatteries[J].Nature, 1996, 381(4):499-500.
[10]WARDCB,WALKERAI.TheproductionofalkalinegradeEMDatAustralianmanganesecompanylimited[J].ProgBattBattMater, 1992, 11(1):40-45.
[11]WANGG,ZHANGL,ZHANGJJ.Areviewofelectrodematerialsforelectrochemicalsupercapacitors[J].ChemSocRev, 2012 ,41(2):797-828.
[12]BOCKDC,MARSCHILOKAC,TAKEUCHIKJ,etal.Batteriesusedtopowerimplantablebiomedicaldevices[J].ElectrochimActa, 2012, 84(1):155-164.
[13]RUSI,MAJIDSR.Controllablesynthesisofflower-likeα-MnO2aselectrodeforpseudocapacitorapplication[J].SolidStateIonics, 2014, 262(2):220-225.
[14]FEIJB,CUIY,YANXH,etal.ControlledpreparationofMnO2hierarchicalhollownanostructuresandtheirapplicationinwatertreatment[J].AdvMater,2008, 20(3):452-456.
[15]CAOJ,MAOQH,SHIL,etal.Fabricationofγ-MnO2/α-MnO2hollowcore/shellstructuresandtheirapplicationtowatertreatment[J].JMaterChem, 2011, 21(40):16210-16215.
[16]DINGYS,SHENXF,GOMEZS,etal.Hydrothermalgrowthofmanganesedioxideintothree-dimensionalhierarchicalnanoarchitectures[J].AdvFunctMater, 2006, 16(4):549-555.
[17]HANDD,JINGXY,XUPC,etal.Facilesynthesisofhierarchicalhollowε-MnO2spheresandtheirapplicationinsupercapacitorelectrodes[J].JournalofSolidStateChemistry, 2014, 218(2):178-183.
[18]SHIFJ,WANGF,DAIHX,etal.Rod-,flower-,anddumbbell-likeMnO2:Highlyactivecatalystsforthecombustionoftoluene[J].AppliedCatalysisA:General, 2012, 433 (1):206-213.
[19]YUP,ZHANGX,CHENY,etal.Self-templateroutetoMnO2hollowstructuresforsupercapacitors[J].MaterialsLetters, 2010, 64 (13):1480-1482.
[20]CHENGG,YUL,LINT,etal.Afacileone-pothydrothermalsynthesisofβ-MnO2nanopincersandtheircatalyticdegradationofmethyleneblue[J].JournalofSolidStateChemistry, 2014, 217(1):57-63.
[21]CHENHM,CHUPK,HEJH,etal.Porousmagneticmanganeseoxidenanostructures:Synthesisandtheirapplicationinwatertreatment[J].JColloidInterfaceSci, 2011, 359(1):68-74.
[22]ZHANGW,YANGZ,WANGX,etal.Large-scalesynthesisofβ-MnO2nanorodsandtheirrapidandefficientcatalyticoxidationofmethylenebluedye[J].CatalCommun, 2006, 7(6):408-412.
Synthesis of Ellipsoid-like ε-MnO2and Highly Active Catalytic Degradation of Methylene Blue
Huang Jian-zhi1, 2, Cheng Xiao-ling2
(1. School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510641, China;(2.SchoolofChemicalEngineeringandLightIndustry,GuangdongUniversityofTechnology,Guangzhou510006,China)
Inthispaper,throughcalciningtheellipsoid-likeMnCO3precursorsat500°C,theellipsoid-likeε-MnO2catalystswithanexcellentpropertytodecomposemethylenebluecanbeobtained.ε-MnO2ismeasuredbySEM,XRD,UV-VisandBET.Theresultsshowthattheellipsoid-likeε-MnO2catalystspossessahighsurfaceareaofca.88m2/g.Theobtainedellipsoid-likeε-MnO2materialsareusedascatalyststodecomposemethyleneblueinthepresentpropertyofH2O2.Andtheellipsoid-likeε-MnO2canremoveabout92%ofmethyleneblue,whichshowsexcellentpropertytoremovemethyleneblueatroomtemperature.Thisshowsthatellipsoid-likeε-MnO2isahighlyefficientcatalystremovalofmethyleneblue.
epsilon-manganeseoxide(ε-MnO2);ellipsoid-like;catalyticdegradation;methyleneblue
2015- 04- 28
广东省自然科学基金资助项目(10251009001000003).
黄建智(1992-),男,硕士研究生,主要研究方向为纳米材料电化学分析.
10.3969/j.issn.1007- 7162.2016.05.015
TB383
A
1007-7162(2016)05- 0083- 04
