麦冬草对草甘膦耐药性的形态学机制
2016-10-15毛婵娟解洪杰宋小玲强胜
毛婵娟 解洪杰 宋小玲 强胜
摘要:麦冬、土麦冬和阔叶土麦冬都对草甘膦具有较高的天然耐药性,其耐药性的主要机制是由于EPSPS基因结构差异、基因多拷贝以及高表达量,但是,靶标机制并不能完全解释阔叶土麦冬的耐药性最高,麦冬的耐药性最低,土麦冬居于中间。为了进一步揭示其耐药性的非靶标机制,采用光镜和扫描电镜观察了麦冬、土麦冬和阔叶土麦冬的叶表皮显微结构,发现麦冬、土麦冬和阔叶土麦冬的气孔主要分布于叶片下表皮,气孔密度分别为37.6、36.15和23.92个/mm2。但是,土麦冬和阔叶土麦冬的气孔在叶片上表皮也有分布,并且阔叶土麦冬上表皮的气孔明显多于土麦冬。麦冬草气孔带和非气孔带细胞在细胞长度、面积和长宽比等方面均存在差异。麦冬气孔周围的表皮细胞平周壁具明显瘤状突起,导致气孔下陷;土麦冬气孔周围的表皮细胞平周壁呈波浪状突起,使气孔略下陷;阔叶土麦冬气孔周围的表皮细胞平周壁基本无突起,气孔下陷不显。这些结构特征差异可能与麦冬草对草甘膦的耐药性差异有一定的相关性。
关键词:麦冬草;草甘膦耐性;气孔密度;叶表皮;形态学
中图分类号:S451文献标志码:A文章编号:1003-935X(2016)01-0001-07
Abstract:Three lilyturfs,Ophiopogon japonicas (OJ),Liriope spicata (LS) and Liriope platyphylla (LP) were reported to have evolved high natural tolerance to glyphosate. The main mechanism is attributed to a combination of unique EPSPS structure and increased EPSPS gene copy number and expression. This target-site mechanism,however,appears insufficient to explain the differences in glyphosate-tolerance among those three lilyturfs with the highest level observed in LP and the lowest in OJ (LS has intermediate tolerance). To further investigate the non-target site mechanisms conferring glyphosate tolerance in the three lilyturfs,microscopic and submicroscopic structure of leaf epidermis were observed using LM and SEM. The stomata mainly distribute in the lower leaf epidermis of the three species with stomatal densities of 376,36.2 and 23.9 mm-2 in OJ,LS and LP,respectively. Furthermore,there were more stomata in the upper epidermis of LP than that of LS. There are also differences in cell length,area,and length-width ratio of stomatal and non-stomatal bands in the three lilyturfs. The periclinal wall of epidermis cells around stomata forming obviously strumous protuberances resulted in sunken stomata on leaves of OJ. The periclinal wall of LS had wavy protuberances and the stomata were only partially sunken. On the contrary,the periclinal wall of LP almost had no protuberances and the stomata were not sunken. These features may contribute to the different tolerance to glyphosate in three lilyturf species.
Key words:
lilyturf;glyphosate tolerance;stomatal density;leaf epidermis;morphology
草甘膦[N-(膦羧基甲基)甘氨酸]是一种非选择性、广谱、内吸收传导的茎叶处理除草剂,由于其具有广谱、低毒、安全、无土壤残留的特点,一直被认为是迄今为止最为重要和最优秀的除草剂[1]。自1974年美国孟山都公司开发草甘膦以来,由于其非选择性的特点很长一段时间不能作为作物田的主要除草剂。但是,自1996开始,抗草甘膦转基因作物研制和商业化,使得草甘膦被广泛应用于农作物田杂草的防除,草甘膦的用量迅猛增长,成为除草剂市场中的主导产品[2],而且随着全球抗除草剂转基因作物进一步发展,草甘膦在全球除草剂市场中的主导地位将更为加强,随之而来的是以草甘膦为主导的化学除草剂的单一化[3]。这加剧了人们对草甘膦抗性杂草问题的担忧。
植物对草甘膦的抗药性涉及到天然抗性和演化抗性[4],前者是在没有接触过除草剂的情况下天生就有的在除草剂处理后能够生存和繁殖的能力。de Gennaro等在没有草甘膦使用历史的地区发现了草甘膦抗性生物型的田旋花(Convolvulus arvensis)[5];1990年Boerboom等证实了百脉根(Lotus corniculatus)对草甘膦存在耐药性[6];此后几年又陆续发现了饭包草(Commelina benghalensis)[7]、亚洲鸭跖草(Commelina communis)[7]、狗肝菜(Dicliptera chinensis)[9]、藜(Chenopodium album)[10]以及茼麻(Abutilon theophrasti)[4]对草甘膦的耐性。这些种群会占据转基因作物田中其他杂草的生态位,影响草甘膦除草效果,甚至对农作的生产造成巨大的威胁[11]。
草甘膦作用于芳香族氨基酸合成过程中的一种重要酶——EPSP合成酶,莽草酸途径存在于质体中,负责芳香族氨基酸的合成。莽草酸是莽草酸-3-磷酸盐的前体,也是EPSPS酶的底物。研究表明,草甘膦通过EPSPS的抑制引起莽草酸在组织中的积累,这可以用作标记草甘膦药害的一种手段[12]。经草甘膦处理后,抗性和敏感性组织中莽草酸含量均有所提高,说明EPSPS对草甘膦敏感;Mueller等也得到类似的结论[13]。测定植物体内莽草酸的累积量可以知道抗草甘膦酶活性的大小[14-16]。Feng等对抗性和敏感生物型小飞蓬的试验结果进一步证实:敏感型莽草酸/草甘膦的比值越大说明EPSPS受抑程度越高;相反,抗性型两者比值越小说明草甘膦对EPSPS的抑制程度越低[17]。草甘膦的非靶点抗性机制主要包括吸收传导受阻、屏蔽作用和氧化代谢。假高粱(Sorghum halepense)的叶片吸收量减少导致对草甘膦产生抗性[18];抗草甘膦生物型瑞士黑麦草(Lolium rigidum)体内的草甘膦汇聚在植物的叶尖或根部[19-20],同样的抗性机制在几个草甘膦抗性假高粱(Sorghum halepense)生物型中也得到证实[18,21];草甘膦快速在液泡中隔离是小蓬草(Conyza canadensis)产生抗性的主要原因[22-23];此外,小飞蓬(Conyza canadensis)还存在降低草甘膦的传导以及将草甘膦代谢为其他化合物的机制[24]。氨基乙酸氧化酶(GO)也被证实能够将草甘膦氧化成AMPA和乙醛酸,但是,这一代谢途径和GOX有所不同[25-26]。
在之前的研究中,我们发现百合科植物麦冬、土麦冬和阔叶麦冬具有较高的草甘膦耐药性,我们对它们的EPSPS基因进行了克隆、原核表达以及真核表达分析,发现EPSPS基因结构差异、基因多拷贝以及高表达量共同导致了麦冬草对草甘膦的天然耐药性[27]。但是,靶标机制并不能完全解释麦冬草的高草甘膦耐药性的全部,因此,我们对麦冬草叶表皮形态结构进行了观察,以期阐明麦冬草对草甘膦耐性的形态学机制。
1材料与方法
1.1植物材料的准备
草甘膦耐药性和莽草酸积累试验在南京农业大学牌楼温室进行。温室温度维持28~35 ℃,完全自然光照。12月至翌年1月挖取麦冬草的苗并且移栽至花盆中(直径15 cm,高15 cm)。每种植物都是7个处理,每个处理4盆,每盆1株,重复3次。培养基质为商品化的营养土,并且进行适当的浇水和施肥。将老的叶片剪去,长出的新叶用于草甘膦剂量响应及莽草酸的含量测定试验。拟南芥的种子经消毒后种于MS培养基上,1周后,待长出真叶,将幼苗移至盆中,培养基质为营养土 ∶蛭石=3 ∶1,温室温度为23 ℃。
用于叶表皮形态结构观察以及酶活测定的麦冬[Ophiopogon japonicus (Linn. f.) Ker-Gawl.,简称OJ]、土麦冬[Liriope spicata (Thunb.) Lour,简称LS]和阔叶土麦冬(Liriope platyphylla Wang et Tang,简称LP)采自南京农业大学,是人工种植的作为林阴下地表绿化植物的植株,生境一致。于2012年6同时采集麦冬、土麦冬和阔叶土麦冬成熟、健康的叶片,每种植物随机采集叶片20张。
1.2草甘膦剂量响应试验
用不同浓度的草甘膦(农达,41%异丙胺盐水剂,孟山都公司生产)处理麦冬草幼苗,草甘膦浓度设置为0、375、750、1 500、3 000、6 000、12 000和 24 000 g a.i./hm2。由于敏感型麦冬草种群的缺失,采用拟南芥作为对照,草甘膦浓度梯度为0、40、120、240、400和600 g a.i./hm2。每种植物都是7个处理,每个处理4盆,每盆1株,重复3次。处理后3周采用五级目测法进行药害症状调查[28]。所得数据通过SPSS统计软件,用Logistic方程进行回归,得到回归方程:Y=C+(D-C)/{1+exp[b×ln(X/ED50)]}。药害综合指数=1-[∑(该级别代表值×该级别的观察株数)/(所有观察株数×5)]。利用回归方程计算ED50值。
1.3麦冬、土麦冬和阔叶土麦冬叶表皮形态结构的观察
1.3.1叶表皮形态结构的光学显微镜观察参照邢全等的方法[29]用次氯酸钠离析法制样。取叶片中部中脉附近的部分,用FAA固定液固定24 h以上。在室温条件下,用体积分数20%的次氯酸钠溶液离析3 d以上,至叶片变白为止;揭下叶表皮后制成水装片,在Olympus光学显微镜下进行观察并拍照。随机选取3张经过次氯酸钠离析的叶表皮临时装片,在每张装片的叶片上、下表皮随机选5个视野,在10倍物镜下拍照,计算气孔密度;随机选取3张经过次氯酸钠离析的叶表皮临时装片,在每张装片的叶片上、下表皮的气孔带和非气孔带处随机选5个视野,在40倍物镜下拍照,每张照片统计约20个表皮细胞,利用JD801形态学图像分析系统计算表皮细胞的面积及长宽比。气孔密度=每个视野中的气孔个数/视野面积。
1.3.2叶表皮形态结构的常规扫描电镜观察参考Spector等的方法[30]进行叶片常规扫描电镜制样。取叶片中部中脉附近的部分,置于体积分数2%的戊二醛固定液(用0.1 mol/L磷酸钠缓冲液配制,pH值7.2)中,抽气使其下沉,于0e~4e条件下固定3 d;用0. 1 mol/L磷酸钠缓冲液清洗3次,每次约20 min;分别用体积分数30%、50%、70%、90%和95%乙醇溶液及无水乙醇进行系列脱水,每次约20 min,其中用无水乙醇脱水3次;使用醋酸异戊酯代换3次,每次约20 min;最后用CO2临界点法进行干燥。上述步骤完成后,用双面胶带将叶片的上、下表面粘在样品台上,用离子溅射仪镀金膜,最后在XL-30型环境扫描电镜(荷兰飞利浦公司生产)下观察并拍照。
2结果与分析
2.1草甘膦对麦冬草的药效结果
温室麦冬、土麦冬和阔叶土麦冬对草甘膦的剂量反应生测结果列于表1。药后1周,6 000 g a.i./hm2及以下浓度草甘膦处理麦冬、土麦冬和阔叶土麦冬没有发现明显的抑制作用(表1);但是2个最高浓度 12 000 g a.i./hm2 [JP]以及24 000 g a.i./hm2处理产生极显著抑制作用。不过,随着处理时间的延长,抑制现象会加重,抑制的处理浓度下移。药后3周,3 000 g a.i./hm2 及以下浓度处理对麦冬、土麦冬和阔叶土麦冬没有明显的抑制;但是麦冬草对 6 000 g a.i./hm2 草甘膦浓度处理均产生显著受害反应,且三者之间的受抑制程度不存在显著差异,植株大部分仍存活。12 000 g a.i./hm2浓度草甘膦处理时对3种植物的抑制率在62.5%以上。在 24 000 g a.i./hm2 处理下麦冬、土麦冬和阔叶土麦冬基本全部死亡,说明24 000 g a.i./hm2浓度已经超出了麦冬、土麦冬和阔叶土麦冬的最大耐药范围。
对麦冬、土麦冬以及阔叶土麦冬喷施草甘膦后3周抑制率进行Logistic方程回归分析,进一步由此方程计算出它们的ED50值(图1)。麦冬、土麦冬以及阔叶土麦冬对草甘膦的ED50值分别为7 000、7 360和8 230 g a.i./hm2(图1),说明麦冬、土麦冬和阔叶土麦冬已经具有较高的耐药性。
2.2麦冬草叶表皮形态结构观察
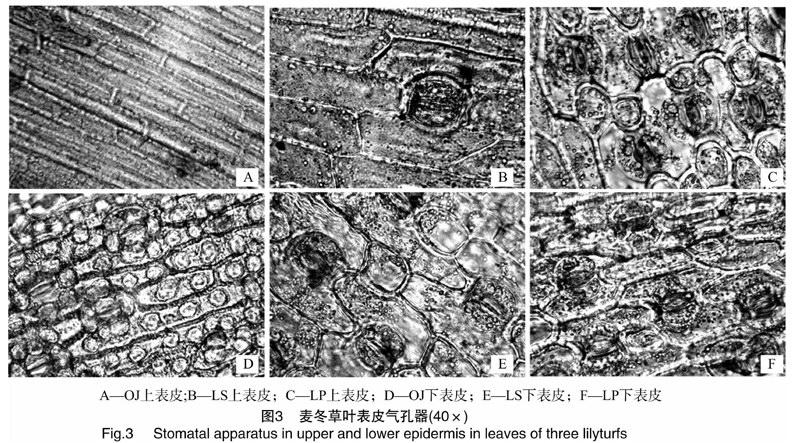
2.2.1光学显微镜下3种植物叶表皮形态结构的比较观察结果表明,麦冬、土麦冬和阔叶土麦冬的叶片气孔均位于叶脉之间,呈带状分布。其中,麦冬的气孔只分布在下表皮上,土麦冬和阔叶土麦冬的气孔在叶片上下表皮均有分布,但下表皮气孔明显较多,阔叶土麦冬上表皮的气孔明显多于土麦冬。土麦冬上表皮气孔带处的表皮细胞呈长方形,排列较规则,而下表皮细胞多数呈多边形,阔叶土麦冬上下表皮气孔带细胞都呈多边形(图2)。
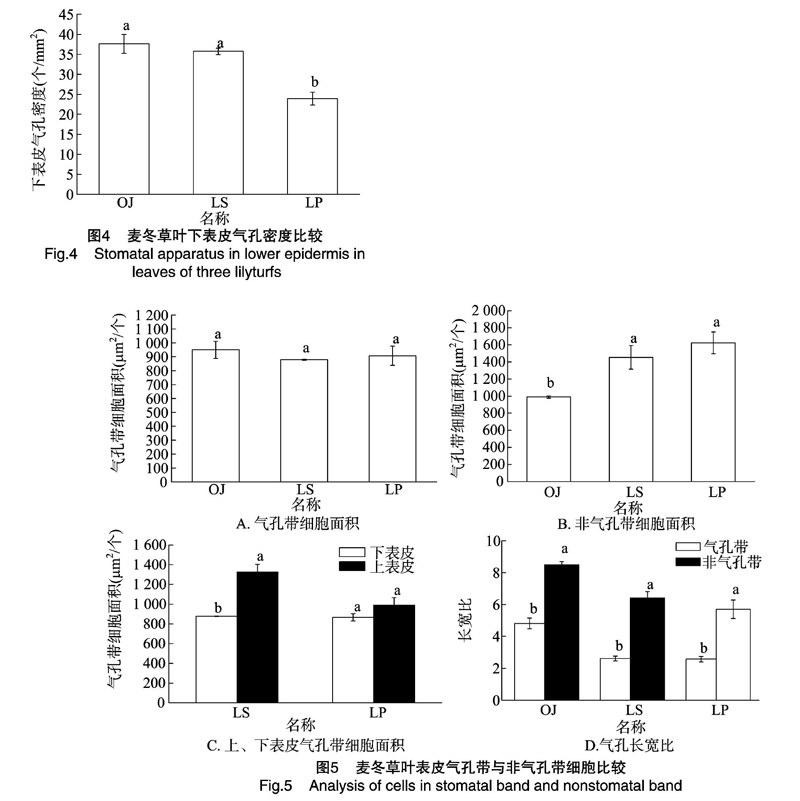
麦冬、土麦冬和阔叶土麦冬叶片上的气孔均呈条带状分布,与叶片平行脉走向相同,处于2条平行叶脉的中间。3种植物的气孔器都是由2个保卫细胞组成,保卫细胞中含有叶绿体。麦冬气孔周围有瘤状突起,由6个左右的瘤状突起组成花环状(图3)。3种植物叶片的气孔密度有一定的差异,麦冬、土麦冬和阔叶土麦冬的叶片下表皮气孔密度分别为37.6、36.15和23.92个/mm2(图4)。
麦冬、土麦冬和阔叶土麦冬下表皮气孔带细胞大小相似,麦冬下表皮非气孔带的细胞面积显著小于土麦冬和阔叶土麦冬。麦冬、土麦冬和阔叶土麦冬叶片气孔带处表皮细胞的长度、面积和长宽比均小于非气孔带处的表皮细胞,表明土麦冬和阔叶土麦冬叶片气孔带处的表皮细胞较小且相对较宽;阔叶土麦冬上下表皮的气孔带细胞面积大小相似,土麦冬下表皮的气孔带细胞面积显著小于上表皮(图5)。
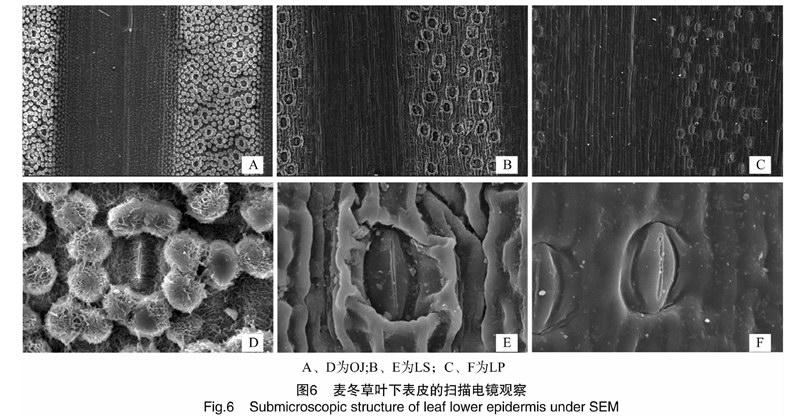
2.2.2叶表皮形态结构的常规扫描电镜观察麦冬叶片下表皮气孔带处的表皮细胞平周壁向外突起形成明显的瘤状突起物,尤其在气孔周围更明显,使气孔下陷;气孔带处表皮细胞的轮廓无法识别,但可以观察到丰富的蜡质纹丝(图6-A、D)。土麦冬叶片下表皮气孔带处的表皮细胞平周壁局部向外呈波浪状突起,尤其在气孔周围波浪状突起非常明显,使气孔相对下陷,但远不如麦冬明显;气孔带处表皮细胞的轮廓勉强可见,蜡质较丰富(图6-B、E)。阔叶土麦冬叶片下表皮气孔带处的表皮细胞平周壁基本没有突起,气孔下陷不明显,气孔带处表皮细胞的轮廓很清楚,气孔器和表皮细胞的表面蜡质也较丰富(图6-C、F)。
3讨论
迄今,世界上已经报道了一系列具有天然草甘膦耐性事例的植物,其耐药性程度不同[4-6,8,10,31-32]。草甘膦天然抗性鸭跖草(Commelina communis)在840 g a.i./hm2处理下得以存活而敏感种群全部死亡[4];另一种草甘膦天然抗性狗肝菜种群在3.3 kg a.i./hm2草甘膦处理下能够存活,温室试验也说明了其GR50值是其他种群的2~7倍[9];4种草甘膦耐型藜种群的GR50值是1.48~322 kg a.i./hm2,而敏感型种群的GR50值是 0.57 kg a.i./hm2[10]。虽然不同国家和地区由于杂草种类及分布以及草甘膦使用历史不同,草甘膦的大田使用剂量有所不同,但是大致的推荐剂量是在900~1 500 g a.i./hm2。因此,麦冬、土麦冬和阔叶土麦冬对草甘膦的耐药程度约为大田用量的5倍(图1),具有较高的耐性,高于其他已报道天然草甘膦耐性植物。
我们在之前的研究中发现,麦冬草存在3处特异的氨基酸,分别是71Met、112Ile和201Met,土麦冬EPSPS的IC50值、Km值和Ki(草甘膦)值都显著高于野生型拟南芥,通过根癌农杆菌介导法将土麦冬EPSPS基因转入野生型拟南芥,发现转基因拟南芥对草甘膦的耐受性提高3.6倍[27],而草甘膦生物测定结果为麦冬草对草甘膦的耐药程度约为大田用量的5倍。由此说明麦冬草的特异EPSPS结构贡献了大部分对草甘膦的耐药性,但是并未完全解释麦冬草对草甘膦的耐药性。并且,3种麦冬草对草甘膦耐药性程度也存在差异,阔叶土麦冬的耐性最高,麦冬的耐性最低,土麦冬居于中间(图1),说明非靶标机制尤其是对草甘膦吸收传导的阻碍或许也在麦冬草中存在作用。
近年来,在假高粱(Sorghum halepense)、瑞士黑麦草(Lolium rigidum)以及小飞蓬(Conyza canadensis)等植物中都发现存在降低对草甘膦的吸收传导的机制[18,20,24]。草甘膦是茎叶吸收型的除草剂,而叶片是最直接最主要的吸收草甘膦的器官。叶片的大小及厚度、气孔、表皮细胞及附属物、栅栏组织、海绵组织、厚角组织和叶脉等形态解剖结构的变异,叶片在不同选择压力下形成了各种适应类型,其结构特征最能体现出环境因子的影响或植物对环境的适应[33]。施用茎叶处理的除草剂时,药液在植物叶面的附着性能是影响药效的重要因素,尤其是对于内吸性茎叶处理的农药而言,叶面附着是药效发挥的必要条件,会直接影响除草剂的作用效果[34]。叶片对除草剂的吸收经2种途径进行,即气孔吸收与角质层吸收。气孔的分布特征、密度和面积等因素都影响除草剂的吸收。
麦冬、土麦冬和阔叶土麦冬叶片的气孔主要分布在叶片下表皮(图2、图3、图6),会显著减少叶片对草甘膦的吸收。气孔下陷会增加草甘膦在叶面的停留,从而更利于对草甘膦的吸收。麦冬叶片表皮细胞平周壁瘤状外突、气孔下陷最为明显(图6-A、D),可能最有利于对草甘膦的吸收;土麦冬叶片表皮细胞平周壁也向外波浪状突起,也导致气孔一定程度的下陷(图6-B、E),也会有利于对草甘膦的吸收;而阔叶土麦冬叶片表皮细胞平周壁突起不明显、气孔下陷也不明显(图6-C、F),表面更加光滑,导致药液在叶表面存留减少,最终会导致对草甘膦吸收减少。这些结构特征差异与3种麦冬草对草甘膦的耐药性水平差异一致,或许可以作为解释麦冬和土麦冬对草甘膦的耐受性低于阔叶土麦冬的形态学原因。
参考文献:
[1]Duke S O,Powles S B. Glyphosate:a once-in-a-century herbicide[J]. Pest Management Science,2008,64(4):319-325.
[2]Powles S B. Evolved glyphosate-resistant weeds around the world:lessons to be learnt[J]. Pest Management Science,2008,64(4):360-365.
[3]强 胜,宋小玲,戴伟民.抗除草剂转基因作物面临的机遇与挑战及其发展策略[J]. 农业生物技术学报,2010,18(1):114-125.
[4]Owen M D,Zelaya I A. Herbicide-resistant crops and weed resistance to herbicides[J]. Pest Management Science,2005,61(3):301-311.
[5]de Gennaro F P,Weller S C. Differential susceptibility of field bindweed (Convolvulus arvensis) biotypes to glyphosate[J]. Weed Science,1984,32:472-476.
[6]Boerboom C M,Wyse D L,Somers D. Mechanism of glyphosate tolerance in birdsfoot trefoil (Lotus corniculatus)[J]. Weed Science,1990,38:463-467.
[7]Culpepper A S,Flanders J T,York A C,et al. Tropical spiderwort (Commelina benghalensis) control in glyphosate-resistant cotton[J]. Weed Technology,2004,18:432-436.
[8]Culpepper A S. Glyphosate-induced weed shifts[J]. Weed Technology,2006,20(2):277-281.
[9]Yuan C,Mou-Yen C,Yih-Ming C. Triple mechanisms of glyphosate-resistance in a naturally occurring glyphosate-resistant plant Dicliptera chinensis[J]. Plant Science Journal,2002,163:543-554.
[10]Westhoven A M,Kruger G R,Gerber C K,et al. Characterization of selected common lambsquarters (Chenopodium album) biotypes with tolerance to glyphosate[J]. Weed Science,2008,56:685-691.
[11]Nandula V K,Reddy K N,Duke S O,et al. Glyphosate-resistant weeds:current and future outlook[J]. Outlooks on Pest Manag,2005,16:183-187.
[12]Lydon J,Duke S O. Glyphosate induction of elevated levels of hydroxybenzoic acids in higher plants[J]. Food Chemistry,1988,36:813-818.
[13]Mueller T C,Massey J H,Hayes R M,et al. Shikimate accumulates in both glyphosate-sensitive and glyphosate-resistant horseweed (Conyza canadensis L. Cronq.)[J]. Journal of Agricultural and Food Chemistry,2003,51(3):680-684.
[14]宋小玲,马波,皇甫超河,等. 除草剂生物测定方法[J]. 杂草科学,2004(3):1-6.
[15]Pline W A,Wu J R,Hatzios K K. Effects of temperature and chemical additivies on the response of transgenic herbicide-resistant soybeans to glufosinate and glyphosate applications[J]. Pesticide Biochemistry and Physiology,1999,65:119-131.
[16]Fuchs M A. Mechanisms of glyphosate toxixity in velvet leaf (Abutilon thephrasti Medikus)[J]. Pesticide Biochemistry and Physiology,2002,74:27-39.
[17]Feng P C,Tran M,Chiu T,et al. Investigations into glyphosate-resistant horseweed (Conyza canadensis):retention,uptake,translocation,and metabolism[J]. Weed Science,2004,52(4):498-505.
[18]Vila-Aiub M M,Balbi M C,Distéfano A J,et al. Glyphosate resistance in perennial Sorghum halepense (Johnsongrass),endowed by reduced glyphosate translocation and leaf uptake[J]. Pest Management Science,2012,68(3):430-436.
[19]Lorraine-Colwill D F,Powles S B,Hawkes TR,et al. Investigations into the mechanism of glyphosate resistance Lolium rigidum[J]. Pesticide Biochemistry and Physiology,2002,74:62-72.
[20]Yu Q,Abdallah I,Han H P,et al. Distinct non-target site mechanisms endow resistance to glyphosate,ACCase and ALS-inhibiting herbicides in multiple herbicide-resistant Lolium rigidum[J]. Planta,2009,230(4):713-723.
[21]Powles S B,Yu Q. Evolution in action:plants resistant to herbicides[J]. Annual Review of Plant Biology,2010,61(61):317-347.
[22]Ge X,DAvignon D A,Ackerman J J,et al. Rapid vacuolar sequestration:the horseweed glyphosate resistance mechanism[J]. Pest Management Science,2010,66(4):345-348.
[23]Ge X,DAvignon D A,Ackerman J J,et al. Glyphosate-resistant horseweed made sensitive to glyphosate:low-temperature suppression of glyphosate vacuolar sequestration revealed by P-31 NMR[J]. Pest Management Science,2011,67(10):1215-1221.
[24]González-Torralva F,Gil-Humanes J,Barro F,et al. Target site mutation and reduced translocation are present in a glyphosate-resistant Lolium multiflorum Lam. biotype from Spain[J]. Plant Physiology and Biochemistry,2012,58:16-22.
[25]Job V,Marcone G L,Pilone M S,et al. Glycine oxidase from Bacillus subtilis. Characterization of a new flavoprotein[J]. Journal of Biological Chemistry,2002,277(9):6985-6993.
[26]Pollegioni L,Schonbrunn E,Siehl D. Molecular basis of glyphosate resistance-different approaches through protein engineering[J]. FEBS Journal,2011,278(16):2753-2766.
[27]Mao C J,Xie H J,Chen S G,et al. Multiple mechanism confers natural tolerance of three lilyturf species to glyphosate[J]. Planta,2015,243:321-335.
[28]Song X L,Wu J J. Zhang H J,et al. Occurrence of glyphosate-resistant horseweed (Conyza canadensis) population in China[J]. Agricultural Sciences in China,2011,10:1049-1055.
[29]邢全,石雷,刘保东,等. 蒙古荚蒾叶片解剖结构及其在城市景观和环境保护中的生态学意义[J]. 植物学通报,2004,21(2):195-200.
[30]Spector D L,Goldman R D,Leinwand L A.细胞实验指南(下册) [M]. 北京:科学出版社,2001:1206-1225.
[31]Huang Z F,Zhang C X,Huang H J,et al. Molecular cloning and characterization of 5-enolpyruvylshikimate-3-phosphate synthase gene from convolvulus arvensis L[J]. Molecular Biology Reports,2014,41:2077-2084.
[32]Yuan C,Chen Y M,Chaing M Y. Responses of dicliptera chinensis to glyphosate[J]. Bull Plant Prot Bull,2001,43:29-38.
[33]李芳兰,包维楷. 植物叶片形态解剖结构对环境变化的响应与适应[J]. 植物学通报,2005,22(增刊1):118-127.
[34]刘支前. 表面活性剂对草甘膦叶面吸收的影响[J]. 农药,1998,37(4):31-34.
