Gd-EOB-DTPA增强MRI定量评估肝脏储备功能的可行性研究
2016-10-15李莉唐鹤菡刘洋洋林丽丽陈国勇蔡磊袁放宋彬
李莉, 唐鹤菡, 刘洋洋, 林丽丽, 陈国勇, 蔡磊, 袁放, 宋彬
·普美显增强MRI专题·
Gd-EOB-DTPA增强MRI定量评估肝脏储备功能的可行性研究
李莉, 唐鹤菡, 刘洋洋, 林丽丽, 陈国勇, 蔡磊, 袁放, 宋彬
目的:以吲哚氰绿(ICG)15、Child-Pugh评分及终末期肝病模型(MELD)评分为金标准,评估Gd-EOB-DTPA增强MRI定量评估肝脏储备功能的可行性。方法:本研究纳入15例肝脏肿瘤患者及12例肝功能正常志愿者。所有受试者在术前(4周内)均进行了Gd-EOB-DTPA增强MRI检查、ICG清除试验、Child-Pugh评分及MELD评分,以肝细胞摄取率(HUI)作为评估肝脏储备功能的指标。采用Spearmanrank相关检验分析HUI与ICG15、Child-Pugh评分及MELD评分的相关性。结果:HUI与ICG15呈负相关(r=-0.718,P=0.003);HUI与Child-Pugh 评分呈负相关(r=-0.663,P=0.007);HUI与MELD评分呈负相关(r=-0.711,P=0.003)。12例小肝癌患者不同部位(肝左叶、右叶、尾叶)的HUI差异有统计学意义(P<0.05)结论:Gd-EOB-DTPA增强 MRI可以定量评估肝脏储备功能,并且能对不同叶段的肝脏储备功能进行分别描述。
肝脏储备功能; 肝肿瘤; Gd-EOB-DTPA; 磁共振成像
随着现代外科手术技术的不断提高以及麻醉药和重症监护的迅速发展,复杂的肝切除成为可能。肝切除是治疗肝脏原发性及继发性肿瘤的首选治疗手段,患者可获得更长的生存时间[1-3]。但是广泛的肝切除增加了术后发生肝功能衰竭的风险,与之伴随的是术后并发症的增多、病死率的提高、住院时间的延长[4]。
目前对术后肝功能衰竭的定义尚无统一的标准,现在被临床广泛接受的是手术后出现的一系列并发症,包括凝血酶原时间延长、高总胆红素血症以及肝性脑病和/或腹水的出现[5-7],术后肝功能衰竭与术后残存肝的体积与功能密切相关。
吲哚氰绿(the indocyanine green,ICG)15清除试验、Child-Pugh评分及终末期肝病模型(the model for end-stage liver disease,MELD)评分是目前评价肝储备功能的金标准。但是这些评估肝储备功能的方法是对全肝储备功能的描述,在肝脏发生某些疾病,如酒精性肝硬化、非酒精性脂肪肝、原发性硬化性胆管炎、原发性胆源性肝硬化、肝内胆管结石时,会导致不同叶段间的肝储备功能不同。因此在这种情况下ICG清除试验、Child-Pugh评分及MELD评分的结果需谨慎解读。
本研究以ICG清除试验、Child-Pugh评分及MELD评分为为金标准,探讨普美显(Gd-EOB-DTPA)增强MRI定量评估肝脏储备功能的可行性及其影响因素。
材料与方法
1.研究对象
搜集2013年11月-2014年2月在四川大学华西医院就诊的17例肝癌患者及12例肝功能正常志愿者。2例肝癌患者因不能屏气而产生呼吸运动伪影被排除,其余15例肝癌患者纳入试验,男6例,女9例,年龄38~68岁,平均年龄(51.3±5.9)岁。所有纳入试验的肝癌患者在术前(4周内)均进行了Gd-EOB-DTPA增强MRI扫描、ICG清除试验、Child-Pugh评分及MELD评分。MRI增强扫描作为常规术前检查确诊原发性小肝癌12例,胆管细胞癌2例,结肠癌肝转移1例。肝癌患者从MRI检查到ICG清除试验、Child-Pugh评分及MELD评分的平均间隔时间为8天(范围2~16 d)。12例肝功能正常志愿者中男7例,女5例,年龄19~56岁,平均年龄(33.1±3.8)岁,所有志愿者血清肌酐均>2.0 mg/dL,所有志愿者均进行了Gd-EOB-DTPA增强MRI检查,志愿者从MRI检查到ICG清除试验、Child-Pugh评分及MELD评分的平均间隔时间为5天(范围1~11 d)。MRI检查前准备情况符合四川大学华西医院磁共振安全扫描规范,扫描前禁食、禁饮6~8 h。本研究获得华西医院伦理委员会批准。
2.检查方法
MRI检查均采用Siemens Trio Tim 3.0T MRI扫描仪,体部相控阵线圈。受检者取仰卧位,行上腹部扫描,扫描范围包括整个肝脏及脾脏。增强扫描动态期包括动脉期及肝胆期,扫描时间分别是注射对比剂后15 s、20 min。对比剂采用Gd-EOB-DTPA,剂量0.025 mmol/kg,注射流率2 mL/s。注射对比剂后立即用40 mL生理盐水以同样流率进行冲洗,以保证所有对比剂全部进入患者体内。
扫描序列及参数:①二维快速扰相梯度回波同相或反相位(2D fast spoiled gradient recaled ech imphase/opposed-phase,2DFSPGR IP/O)T1WI轴面,TR 180 ms,TE 4.76 ms,翻转角75°,矩阵256×224,并行采集因子2,层厚6 mm,层间距1.2 mm,采集时间13 s;②TSE轴面T2WI序列(施加导航条门控),TR 3000 ms,TE 80 ms,矩阵320×240,层厚5 mm,层间距1 mm,并行采集因子2,采集时间14 s;③半傅立叶采集单次激发快速自旋回波(half Fourier acquisition single shot turbo-SE,HASTE)T2WI冠状面,TR 1000 ms,TE 90 ms,矩阵320×256,层厚6 mm,层间距1 mm,并行采集因子2,采集时间15 s;④容积式内插值法屏气检查(three-dimensional volumetric interpolated breath-hold examination,3D-VIBE)T1WI轴面,TR 4.03 ms,TE 1.43 ms,翻转角15°,矩阵256×218,并行采集因子2,层厚2 mm,层厚1 mm,采集时间20 s。
动脉期扫描采用轴面3D-VIBE序列,扫描参数同3D-VIBE T1WI序列,于注射对比剂后15 s开始扫描。肝胆期扫描采用轴面VIBE序列,扫描参数同3D-VIBE T1WI序列,于注射对比剂后20 min开始扫描。
3.肝细胞摄取率(Hepatocellular uptake index,HUI)的计算
整个肝脏的肝细胞摄取率的计算公式为:
肝叶/段的肝细胞摄取率的计算公式为:
(上述公式由EDDA科技曾小兰博士提供,HUI指肝细胞对Gd-EOB-DTPA的摄取率)
其中VL为肝脏体积,L20为肝实质ROI区域的平均信号强度,S20为脾的平均信号强度,L20及S20为上述肝脏及脾脏的平均信号强度在注射Gd-EOB-DTPA后20min所测的值。
本研究采用IQQA-3D 三维影像解读分析系统中(EDDA科技提供)的肝脏局部功能分析工具和自动化的工作流程,先采用即时交互的三维方法分割和确认全肝并进一步划分出肝左、右叶及尾状叶,系统即时自动计算肝左、右叶及尾状叶的体积、平均信号强度值。脾脏的平均信号强度也采用即时交互的三维界面进行用户定义和确认。采用IQQA-3D三维影像解读分析系统进行典型病例的处理、输出(图1)。由两位放射科医生进行图像分析,其从业经验分别为4年和5年。
4.肝储备功能的计算
同一肝癌患者不同叶段间肝储备功能的计算:在同一患者(共15例)的肝左叶、右叶及尾叶分别选取8个ROI,计算ROI的 L20,在脾脏选取1个ROI,计算S20,计算同一患者的肝左叶、右叶及尾叶ROI的肝细胞增强指数(L20/S20)。ROI的选取:在延迟20 min的图像上选取ROI,分别在肝右叶、左叶、尾叶及脾脏连续三个层面勾画ROI,再分别测量ROI区域内信号值,计算其平均值,以减小误差,ROI面积为40~60 mm2,尽量避开周围血管及胆管。
肝左叶肝储备功能的计算(12例肝癌患者的小肝癌都发生在肝右叶);在每一受试者(12例肝癌患者及12例肝功能正常志愿者)的肝左叶分别选取8个ROI,计算ROI区域的L20,并在同一患者的脾脏选取1个ROI,计算S20,计算每位受试者肝左叶ROI的肝细胞增强指数(L20/S20)。ROI的选取:在延迟20 min的图像上选取ROI,分别在肝左叶及脾脏连续三个层面勾画ROI,再分别测量ROI区域内信号值,计算其平均值,以减小误差, ROI面积为40~60 mm2,尽量避开周围血管及胆管。
肝右叶肝储备功能的计算(12例肝癌患者的小肝
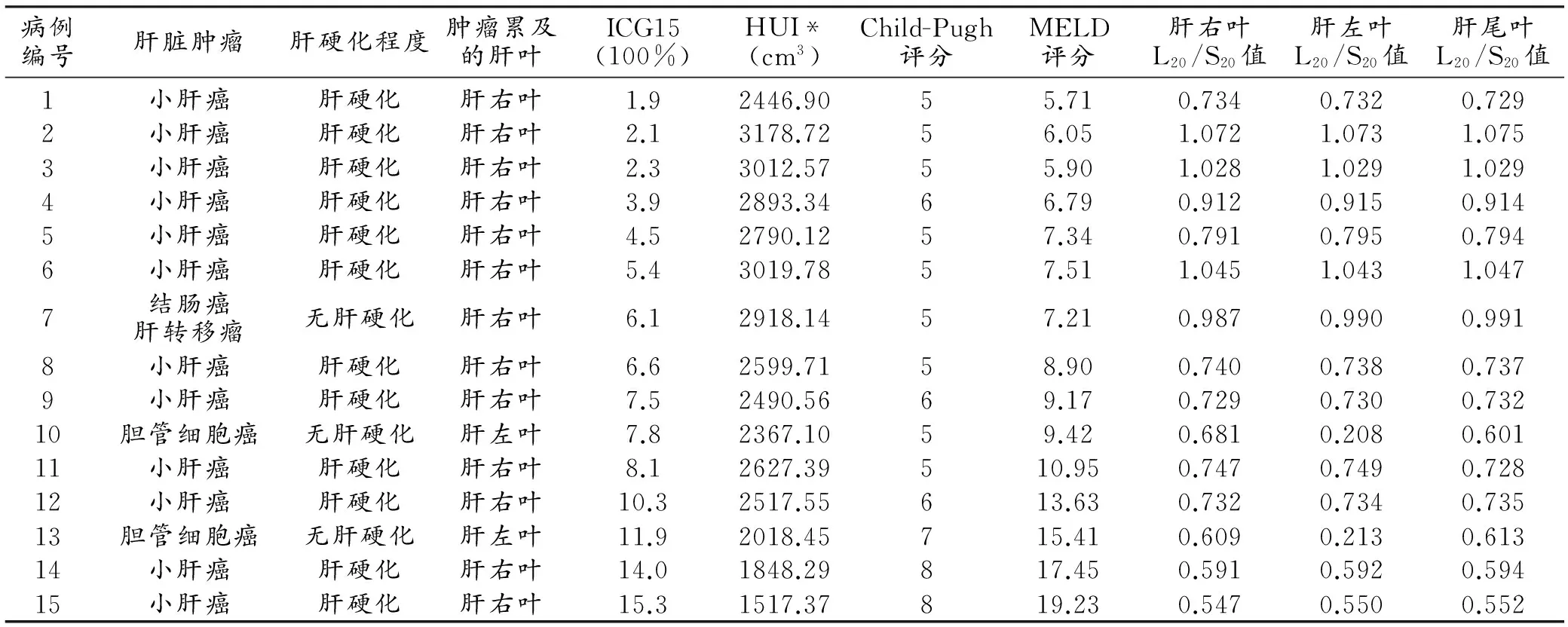
表2 15例患者的肝脏特征及不同肝叶的L20/S20值
注:*HUI为整个肝脏的值。
癌都出现在肝右叶):在每一肝癌患者(共12例肝癌患者)的肝右叶、左叶、尾叶分别选取8个ROI,计算ROI区域的 L20,并在同一患者的脾脏选取1个ROI,计算S20,分别计算12例肝癌患者ROI的肝细胞增强指数(L20/S20)。ROI的选取:在延迟20 min的图像上选取ROI,分别在肝右叶、肝左叶、尾叶及脾脏连续三个层面勾画ROI,再分别测量ROI区域内信号值,计算其平均值,以减小误差, ROI面积为40~60 mm2,尽量避开周围血管及胆管。
5.ICG-15排泄试验
患者入院后测量重量和身高,取患者空腹外周静脉血检测Hb(单位:g/L),将上述所得的指标输入脉冲式色素浓度图像分析仪(DDG)计算ICG的给药量(0.5 mg/kg),患者在空腹安静状态下平卧于床上,将DDG分析仪连接于患者鼻翼处,在6~9 s内将配置好的ICG溶液从患者的肘正中静脉快速注入,测量ICG 15 min时的停滞率和ICG血浆清除率(K)值。
6.Child-Pugh评分
由两位临床医生(非作者,其从业经验分别为4年及5年)在术前依据每个患者的临床指标进行Child-Pugh 评分,评分标准见表1。

表1 Child-Pugh 评分标准
A级为5~6分,B级为7~9分,C级为10~15分。
7.MELD评分
由两位临床医生(非作者,其从业经验分别为4年及5年)在术前依据每个患者的临床指标进行MELD评分。
MELD评分的计算公式为:
MELD=10×(0.957×ln血肌酐+0.378×ln总胆红素+1.12×ln凝血酶原时间)+0.643
为避免MELD评分出现负数,血肌酐、总胆红素及凝血酶原时间的值低于1时,矫正为1。MELD评分≤10时,提示肝储备功能正常;MELD评分>10时,提示肝储备功能异常。
8.统计学分析
采用SPSS 13.0软件进行统计学分析。采用Spearmanrank相关检验分析HUI与ICG15、Child-Pugh评分及MELD评分的相关性。分析同一患者的肿瘤所累及的肝叶与其余肝叶肝储备功能的差异,以评估肿瘤对所累及肝叶的肝储备功能的影响。对15例患者受累肝叶与其余肝叶的肝储备功能进行方差分析,如方差分析提示差异有统计学意义,进一步采用q检验法(Student-Newman-Keuls test)进行两两比较。分析12例小肝癌患者及12例肝功能正常志愿者肝左叶的肝储备功能的差异,以评估肝硬化对肝储备功能的影响。对12例小肝癌患者及12例肝功能正常志愿者肝左叶的肝储备功能差异进行方差分析。分析12例小肝癌患者间肝储备功能的差异,以评估不同的肝硬化程度对肝储备功能的影响。对12例肝癌患者的肝脏不同部位(包括肝右叶、左叶、尾叶)的肝储备功能差异进行方差分析,如方差分析提示差异有统计学意义,进一步采用q检验法进行两两比较。以P<0.05为差异有统计学意义。
结 果
15例肝癌患者的肿瘤特征、HUI值、ICG15值、Child-Pugh评分、MELD评分及不同肝叶的L20/S20值见表2。12例肝功能正常志愿者不同肝叶的L20/S20值见表3。
经统计学分析,HUI与ICG-15呈负相关(r=-0.718,P=0.003)(图2);HUI与Child-Pugh 评分呈负相关(r=-0.663,P=0.007,图3);HUI与MELD评分呈负相关(r=-0.711,P=0.003,图4)。
有2例患者出现肝叶间功能不均一,受累肝叶的(L20/S20)与其余肝叶(L20/S20)的差异有统计学意义(P<0.05)。12例肝癌患者与12例肝功能正常志愿者肝左叶的(L20/S20)差异有统计学意义(P<0.05)。12例肝癌患者肝脏不同部位(包括肝右叶、左叶、尾叶)的(L20/S20)差异有统计学意义(P<0.05)。
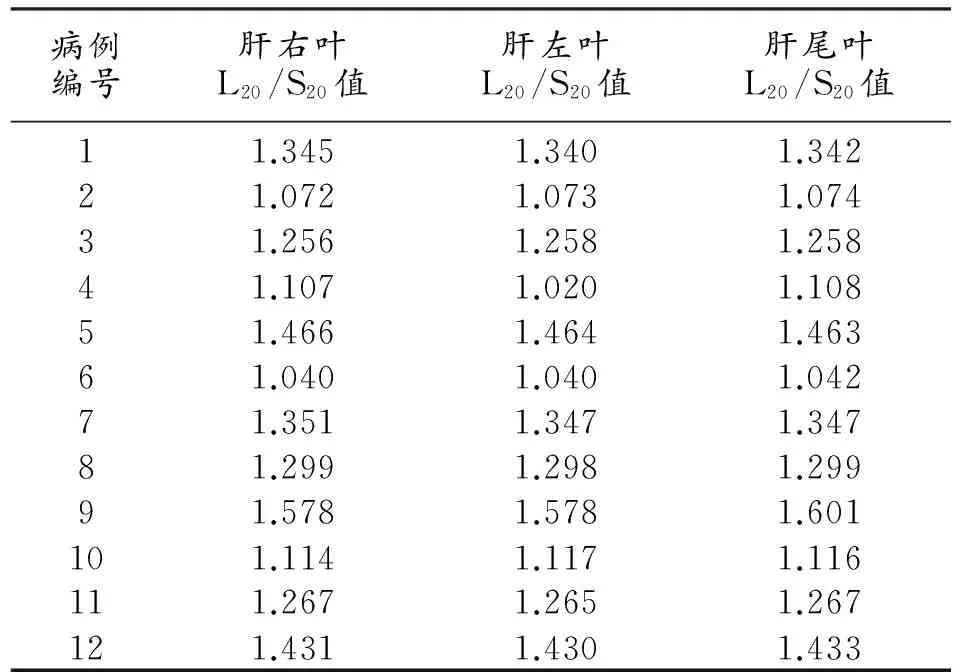
表3 12例肝功能正常志愿者不同肝叶的L20/S20值
讨 论
肝脏具有代谢、合成、分泌、免疫等许多功能,包括碳水化合物、脂质、蛋白质、维生素、胆汁的代谢。肝储备功能是指肝脏的代谢、合成、分泌、免疫潜在能力。肝脏切除是治疗肝脏原发性及继发性肿瘤的金标准,但是当肝实质被大范围切除后,发生术后肝功能衰竭的风险将增加,肝功能衰竭会导致蛋白合成障碍、胆红素的堆积、凝血失常及易于感染,随之而来的是术后并发症的增多、病死率的上升和住院时间的延长。术后肝功能衰竭与术后残存肝的体积和功能密切相关。因此术前准确评价肝储备功能对于选择治疗方式至关重要,它不仅关系到患者是否可以耐受手术,并且外科医生可以根据患者的肝储备功能的情况,制定恰当的手术切除范围。目前评估肝脏储备功能的主要方法是ICG清除试验、Child-Pugh 评分及MELD评分,但这些方法是对全肝功能的评估,当患者伴有酒精性肝硬化、原发性胆源性肝硬化等疾病时,会导致不同叶段间的肝储备功能不同。在这种情况下,需要一种新的方法来评估肝脏储备功能,它需要兼具形态、功能成像两方面的优势,既可以计算肝脏体积,又可以对肝叶段的功能分别进行描述。
1.HUI评估肝储备功能的机制及本研究中关于HUI公式的解读
经静脉注射后,Gd-EOB-DTPA与血液中的白蛋白相结合,但是它们的结合相对较弱,因此对比剂在血液中只作短暂停留后,被肝细胞特异性摄取[8]。进入肝细胞内的Gd-EOB-DTPA大约以相同比例经胆汁(43.1%~53.2%)及经肾小球排泄(41.6%~51.2%)[9]。大量文献报道Gd-EOB-DTPA增强MRI肝胆期最佳扫描时间是20 min,此时肝细胞对Gd-EOB-DTPA的吸收与排泄达到平衡[9]。
有学者发现肝胆期的信号强度不仅反映肝细胞摄取Gd-EOB-DTPA的程度,而且还包括Gd-EOB-DTPA在细胞外间隙的分布的量;达到平衡时,Gd-EOB-DTPA在细胞外间隙分布的量与细胞外间隙的容积有关。有学者证实正常肝脏及脾脏细胞外间隙的体积相似[10],因而可以应用注射Gd-EOB-DTPA后20 min时脾脏的信号强度(S20)来矫正Gd-EOB-DTPA在细胞外间隙分布的影响[11]。本研究定义L20/S20为肝细胞增强指数,肝脏的体积(VL)被认为是预测术后肝功衰竭以及病死率的重要指标[11]。
图2HUI与ICG15呈负相关。
图3HUI与Child-Pugh评分呈负相关。
图4HUI与MELD评分呈负相关。
最初Gd-EOB-DTPA的药物动力学模型来源于大鼠实验[12,13],证实肝细胞通过阴离子转运多肽(OATP1)摄取Gd-EOB-DTPA,随后通过多重耐药性相关蛋白(MRP2)将对比剂排泄到毛细胆管。肝细胞也通过OATP1摄取胆红素,肝细胞通过同样的转运机制(有机阴离子)摄取Gd-EOB-DTPA与ICG[11],由此可以推测Gd-EOB-DTPA/Gd-BOPTA增强MRI可以用于检测肝储备功能。本研究中HUI与ICG15、Child-Pugh 评分及MELD评分呈负相关,表明HUI可以作为评估肝脏储备功能的指标。本研究首次同时应用ICG15、Child-Pugh 评分及MELD评分作为金标准。
2.肝硬化损害肝功能的机制及其对HUI、ICG清除试验、Child-Pugh 评分及MELD评分的影响
疾病、药物以及化学物质等会损伤肝脏储备功能,可能的原因是上述因素会引起过度的炎症反应并最终导致肝纤维化及肝硬化。肝硬化时,细胞外基质的增加和血管空间的减少会导致肝细胞的血流灌注减少,影响肝细胞的代谢及再生,从而损害肝脏储备功能。有学者认为患者发生肝硬化时,肝细胞的生长因子及其他转录因子低水平表达,导致DNA合成减少,从而再生的肝体积减少[14]。肝硬化还可以增加缺血再灌注损伤的风险[15]。肝脏肿瘤本身很少引起肝储备功能的损害,除非在肿瘤数目众多或肝血管和/或胆管被阻塞时才会发生[16]。
本研究12例原发性小肝癌患者中,肿瘤均位于肝右叶,所有患者均有肝硬化病史。12例肝癌患者与12例肝功能正常志愿者肝左叶的L20/S20值差异有统计学意义,表明肝硬化会损害患者的肝储备功能。12例小肝癌患者间肝脏的L20/S20差异有统计学意义,可能的解释是不同程度的肝硬化对肝脏储备功能的损害是不同的,但是肝储备功能的差异与肝硬化程度间的关系本文没有涉及,值得进一步研究。
本研究中1例结肠癌肝转移患者,其转移瘤位于肝右叶,没有出现肝脏储备功能不均一的现象。可能的解释是患者肝右叶转移瘤体积较小,受累的肝细胞数目较少。结肠癌肝转移患者在肝脏切除术后部分会发生肝功能衰竭,目前公认最重要的原因是化疗引起的肝毒性[16]。
发生肝硬化时,肝细胞摄取Gd-EOB-DTPA及ICG的量减少,可能的原因是肝细胞减少和肝纤维组织增多[17]。肝硬化患者ICG-15升高的原因可能是当肝血流量减少时,ICG由循环系统运输至肝脏的量随之减少;肝细胞从血窦中摄取ICG的量减少。在肝硬化背景下,肝脏血流量减少,并出现肝内门静脉分流和肝血窦毛细管化。与其他器官的毛细血管不同,肝血窦的独特之处在于代谢物质(包括蛋白质)可以在肝血窦与肝细胞间自由扩散。经静脉注射后,ICG完全与白蛋白及b-脂蛋白结合。肝血窦毛细管化导致蛋白质扩散受到限制[18],肝细胞摄取ICG的量随之减少。因此,肝硬化时肝细胞摄取ICG的量不仅反映肝脏的储备功能,而且与肝脏血流有关[19]。Gd-EOB-DTP在肝脏的代谢途径与ICG相似[11],由此可以推断,肝硬化时Gd-EOB-DTPA也可以反映肝血窦毛细血管化和肝内门静脉分流的程度,并在一定程度反映肝血流情况。
Child-Pugh评分并不直接反映肝硬化的病理过程,而是反映肝脏的储备功能。Child-Pugh评分指标包括凝血酶原时间、总胆红素及血清白蛋白水平、肝性脑病分期、腹水程度。凝血酶原时间和国际标准化比值是实时反映肝储备功能的指标。血清白蛋白和胆红素水平是分别反映肝脏合成功能和分泌功能的指标。MELD评分纳入了血肌酐水平、血总胆红素水平及凝血酶原时间[20,21]。MELD评分也不直接反应肝硬化的病理过程,它的优势在于可对终末期肝病的患者进行肝储备功能的评估,当MELD评分小于10时,意味着患者病情比较稳定,外科手术可进行;当患者的MELD评分介于10~15之间时,外科手术应慎用;当患者的MELD评分高于15时,外科手术应禁用。
本研究中有2例胆管细胞癌患者出现肝叶间储备功能不均一,提示HUI可以对肝叶段功能进行分别评估。由此推测,外科医生可以根据不同叶段的HUI值,选择恰当的手术切除范围,从而预防肝功能衰竭。
4.高胆红素血症损害肝功能的机制及其对HUI、ICG清除试验、Child-Pugh 评分及MELD评分的影响
胆管细胞癌患者会出现高胆红素血症,高胆红素血症损害肝脏储备功能的可能原因包括:①在肝脏胆汁淤积的情况下进行肝切除会抑制增殖基因及转录因子的表达,这些因子与肝细胞增殖有关[22];②扩张的胆管压迫肝门区血管,导致肝门静脉血流减少,肝动脉血流会代偿性增加,这时进行肝切除会进一步加剧肝门静脉血流的减少,从而抑制肝脏的再生。因此与非胆汁淤积患者相比,胆汁淤积的患者肝切除术后会增加发生并发症的风险。
HUI与ICG-15、Child-Pugh及MELD评分的之间的相关性可能会受到高胆红素血症的影响。胆红素水平是Child-Pugh评分及MELD评分中的一项。高胆红素可能导致Child-Pugh评分及MELD评分偏高。Gd-EOB-DTPA、ICG及胆红素在肝脏代谢途径大致相同,并竞争同一载体[11],发生高胆红素血症时肝细胞摄取Gd-EOB-DTPA及ICG的量会减少,在这种情况下HUI、ICG清除试验及Child-Pugh评分的结果需谨慎解读。
健康志愿者的胆总管开始强化出现于对比剂注射后10 min,20 min后胆总管内对比剂的量已足够进行胆道评价。在胆道阻塞或肝功能降低患者中Gd-EOB-DTPA静脉注射20~30 min后胆管树不显影或显影程度减低。由此可见,Gd-EOB-DTPA增强MR胆管成像可以提供胆汁流体动力学的可靠信息,但是Gd-EOB-DTPA增强MRI用于评估由于胆道恶性梗阻引起的局域性肝功能损伤的程度尚未建立,需要进一步研究[23]。
本研究采用的IQQA-3D三维影像解读分析系统可以实时、快速、智能分割肝脏/肝段及测量容积、信号强度,也可以测量脾脏的上述参数。IQQA-3D 三维影像解读分析系统可以对不同叶段的肝脏HUI进行分别描述,同时可以实时准确评估整肝及不同叶段肝脏的体积,因此可以更加准确地评估肝脏储备功能。
综上所述,以ICG清除试验、Child-Pugh评分及MELD评分为金标准,Gd-EOB-DTPA增强MRI可以用于评估肝脏的储备功能,同时计算肝脏体积。因此,Gd-EOB-DTPA增强MRI是一种具有潜力的定量评估肝脏储备功能的方法。
[1]Poon RT,Fan ST,Lo CM,et al.Improving survival results after resection of hepatocellular carcinoma: a prospective study of 377 patients over 10 years[J].Ann Surg,2001,234(1):63-70.
[2]Imamura H,Seyama Y,Kokudo N,et al.Single and multiple resections of multiple hepatic metastases of colorectal origin[J].Surgery,2004,135(5):508-517.
[3]Choi SB,Kim KS,Choi JY,et al.The prognosis and survival outcome of intrahepatic cholangiocarcinoma following surgical resection:association of lymph node metastasis and lymph node dissection with survival[J].Ann Surg Oncol,2009,16(11):3048-3056.
[4]Shoup M,Gonen M,D'Angelica M,et al.Volumetric analysis predicts hepatic dysfunction in patients undergoing major liver resection[J].J Gastrointest Surg,2003,7(3):325-330.
[5]Jarnagin WR,Gonen M,Fong Y,et al.Improvement in perioperative outcome after hepatic resection: analysis of 1,803 consecutive cases over the past decade[J].Ann Surg,2002,236(4):397-406.
[6]van den Broek MA,Olde Damink SW.Liver failure after partial hepatic resection:definition,pathophysiology,risk factors and treatment[J].Liver Int,2008,28(6):767-780.
[7]Imamura H,Seyama Y,Kokudo N,et al.One thousand fifty-six hepatectomies without mortality in 8 years[J].Arch Surg,2003,138(11):1198-1206.
[8]Rohrer M,Bauer H,Mintorovitch J,et al.Comparison of magnetic properties of MRI contrast media solutions at different magnetic field strengths[J].Invest Radiol,2005,40(11):715-724.
[9]Reimer P,Schneider G,Schima W.Hepatobiliary contrast agents for contrast-enhanced MRI of the liver:properties,clinical development and applications[J].Eur Radiol,2004,14(4):559-578.
[10]Kötz B,West C,Saleem A,et al.Blood flow and Vd (water):both biomarkers required for interpreting the effects of vascular targeting agents on tumor and normal tissue[J].Mol Cancer Ther,2009,8(2):303-309.
[11]Yamada A,Hara T,Li F,et al.Quantitative evaluation of liver function with use of gadoxetate disodium-enhanced MR imaging[J].Radiology,2011,260(3):727-733.
[12]Ringe KI,Husarik DB,Sirlin CB,et al.Gadoxetate disodium-enhanced MRI of the liver.I.Protocol optimization and lesion appearance in the noncirrhotic liver[J].AJR,2010,195(1):13-28.
[13]Lorusso V,Pascolo L,Fernetti C,et al.In vitro and in vivo hepatic transport of the magnetic resonance imaging contrast agent B22956/1:role of MRP proteins[J].Biochem Biophys Res Commun,2002,293(1):100-105.
[14]Tiberio GA,Tiberio L,Benetti A,et al.IL-6 promotes compensatory liver regeneration in cirrhotic rat after partial hepatectomy[J].Cytokine,2008,42(3):372-378.
[15]Corpechot C,Barbu V,Wendum D,et al.Hepatocyte growth factor and c-Met inhibition by hepatic cell hypoxia:a potential mechanism for liver regeneration failure in experimental cirrhosis[J].Am J Pathol,2002,160(2):613-620.
[16]Fan ST.Liver functional reserve estimation:state of the art and relevance for local treatments:the Eastern perspective[J].J Hepatobiliary Pancreat Sci,2010,17(4):380-384.
[17]Malhi H,Gores GJ.Cellular and molecular mechanisms of liver injury.Gastroenterology,2008,134(6):1641-1654.
[18]van Beers BE,Materne R,Annet L,et al.Capillarization of the sinusoids in liver fi brosis:noninvasive assessment with contrastenhanced MRI in the rabbit[J].Magn Reson Med,2003,49(4):692-699.
[19]Nanashima A,Yamaguchi H,Shibasaki S,et al.Relationship between indocyanine green test and technetium-99m galactosyl serum albumin scintigraphy in patients scheduled for hepatectomy:clinical evaluation and patient outcome[J].Hepatol Res,2004,28(4):184-190.
[20]Paes-Barbosa FC,Ferreira FG,Szutan LA.Hepatectomy preoperative planning[J].Rev Col Bras Cir,2010,37(5):370-375.
[21]Verloh N,Haimerl M,Zeman F,et al.Assessing liver function by liver Enhancemen t duringthe hepatobiliary phase with Gd-EOB-DTPA-enhanced MRI at 3 Tesla[J].Eur Radiol,2014,24(5):1013-1019.
[22]Nakano K,Chijiiwa K,Tanaka M.Lower activity of CCAAT/enhancer binding protein and expression of cyclin E,but not cyclin D1,activating protein-1 and p21(WAF1),after partial hepatectomy in obstructive jaundice[J].Biochem Biophys Res Commun,2001,280(3):640-645.
[23]lee NK,Kim S,Lee JW,et al.Biliary MR imaging with Gd-EOB-DTPA and its clinical applications[J].Radiographics,2009,29(6):1707-1724.
Evaluation of hepatic functional reserve on Gd-EOB-DTPA-enhanced MRI
LI Li,TANG He-han,LIU Yang-yang,et al.
Department of Radiology,Sichuan Province Traditional Chinese Medicine Hospital,610072,P.R.China
Objective: Based on the gold standard of indocyanine green (ICG) clearance at 15min,Child-Pugh score and MELD score,to quantitatively evaluate the hepatic functional reserve on Gd-EOB-DTPA-enhanced MRI.Methods:Fifteen patients with hepatic tumors and 12 normal volunteers underwent ICG clearance test,Child-Pugh score,MELD score and Gd-EOB-DTPA-enhanced MR examination for preoperative checkup.HUI,ICG15,Child-Pugh score and MELD score were evaluated with Spearman rank correlation analysis.Results:A significant negative correlation was observed between HUI and ICG15 (r=-0.718,P=0.003),between HUI and Child-Pugh score (r=-0.663,P=0.007),and between HUI and MELD score (r=-0.711,P=0.003).There was statistical significant difference of HUI among the different sites (left lobe,right lobe and caudat lobe) of the small liver cancer in 12 cases (P<0.05).Conclusion:Gd-EOB-DTPA-enhanced MRI can quantitatively evaluate the hepatic functional reserve in different lobes or segments respectively.
Hepatic reserve function; Liver neoplasms; Gd-EOB-DTPA; Magnetic resonance imaging
610072成都,成都中医药大学附属医院放射科(李莉);610041成都,四川大学华西医院放射科(唐鹤菡、刘洋洋、林丽丽、陈国勇、蔡磊、袁放、宋彬)
李莉(1979-),女,山西省太原市人,博士,讲师,主要从事腹部影像诊断工作。
宋彬,E-mail: cjr.songbin@vip.163.com
国家自然科学基金面上项目资助项目(81171338;81471658)
R735.7; R445.2
A
1000-0313(2016)01-0019-07
10.13609/j.cnki.1000-0313.2016.01.006
2015-09-23
2015-10-24)