杜氏盐藻生长及PSⅡ对不同磷源的响应
2016-10-14杨宋琪史邵华王丽娟徐卫民罗光宏
杨宋琪, 史邵华, 王丽娟, 徐卫民, 罗光宏
杜氏盐藻生长及PSⅡ对不同磷源的响应
杨宋琪1, 2, 3, 史邵华4, 王丽娟1, 2, 3, 徐卫民5, 罗光宏1, 2, 3
(1. 甘肃省微藻工程技术研究中心, 甘肃张掖 734000; 2. 甘肃省河西走廊特色资源利用重点实验室, 甘肃张掖 734000; 3. 河西学院, 甘肃张掖 734000; 4. 西南大学生命科学学院, 重庆 400715; 5. 天津开发区天光高科技开发有限公司, 天津300457)
在实验室控制条件下, 研究了无机磷磷酸二氢钠(NaH2PO4)及3种有机磷源三磷酸腺苷二钠盐(adenosine disodium triphosphate, ATP)、β-甘油磷酸二钠(sodium β-glycerophosphate, G-P)和D-葡萄糖-6-磷酸(D-Glucose 6-phosphate, D-G-6-P)对杜氏盐藻()生长及PSII系统的影响。结果表明, 杜氏盐藻在ATP和NaH2PO4的磷环境中生长迅速, 最大比生长速率(max)分别为(0.736±0.0158)/d和(0.667±0.0553)/d; 而β-甘油磷酸二钠和D-葡萄糖-6-磷酸培养条件下盐藻生长则具有滞后效应,max分别为(0.232±0.0114)/d和(0.31±0.0077)/d。ATP和NaH2PO4作为磷源时, 盐藻最大电子传递效率(ETRmax)和最大饱和光强(k)显著高于β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理组(<0.05), 而NPQ则呈相反。JIP-test参数可知, 单位反应中心吸收的光能(ABS/RC)、=0时单位反应中心捕获的用于还原QA的能量(TR0/RC)和最大光化学效率(P0)在各组间差异不显著(>0.05), 但β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理组单位反应中心耗散掉的能量(DI0/RC)显著增加(<0.05),0和E0显著降低(<0.05)。表明β-甘油磷酸二钠和D-葡萄糖-6-磷酸作为磷源时盐藻光合系统反应活性中心(RC)部分关闭, 反应活性中心的数量(RC/CS0)减少, PSⅡ受体侧电子传递受到影响, 能量耗散效率提高。综上可知, 杜氏盐藻均能利用无机磷和有机磷作为磷源供其生长, 但ATP作为磷源使得盐藻在最短时间进入对数期, 生物量显著提高(<0.05)。
杜氏盐藻(); 磷; 叶绿素荧光; PSⅡ; 生长
磷是湖泊富营养化的关键因子, 也是藻类生长的第一限制因子[1]。磷营养盐缺乏, 降低了藻细胞的光合速率和呼吸速率、抑制藻的生长, 甚至导致细胞死亡等[2]。研究表明, 藻类能直接利用水体中无机磷(DIP)提供其生长、繁殖[3]。然而, 水体中无机磷含量很低[4], 成为藻类在水体中生存竞争的首要营养元素[5]。因此, 许多藻类进化出能利用其他形态的磷源来维持自身生长的能力[6-7]。目前已知中肋骨条藻、东海原甲藻、微小亚历山大藻、铜绿微囊藻、小球藻、拟柱胞藻等均可利用ATP、葡糖-6-磷酸、甘油磷酸、核苷酸、磷酸酯等有机磷作为磷源进行正常的生命过程, 生长状况甚至优于无机磷酸盐[8-14]。
盐生杜氏藻()是一种不具细胞壁的嗜盐单细胞绿藻, 因其在适宜条件下能够合成具有良好经济价值的β-类胡萝卜素而倍受关注[15]。有研究指出, 磷对杜氏藻生长和光合系统的响应均有重要影响, Geider等[2]发现磷限制会使得巴夫杜氏藻最大光化学效率降低; 尹翠玲等[16]发现杜氏盐藻PSⅡ最大光能转化效率、叶绿素a浓度和细胞密度均随着磷浓度的增加而增加, 并在290.4 µmol/L浓度时达到最大。然而, 杜氏盐藻能否利用其他形态的磷未见报道。因此, 本研究通过分析杜氏盐藻()对不同磷源的吸收利用, 探究其生长和光合作用方面对不同磷源的响应情况, 进而揭示杜氏盐藻对不同磷源的利用情况, 为盐藻培养基的优化和营养盐的筛选提供理论支持。
1 材料与方法
1.1 藻种培养
实验所用藻种杜氏盐藻()由天津开发区天光高科技开发有限公司提供。供试藻种置DunaliellaMedium中培养, 培养条件: pH 7.5, 温度(25±1)℃, 光照强度80 µmol/(m2·s), 光暗比12 h︰12h。
1.2 实验处理
以Dunaliella Medium磷为基准(磷为0.1 mmol/L), 分别以四种不同形态的磷NaH2PO4、ATP、β-甘油磷酸二钠和D-葡萄糖-6-磷酸为初始磷源进行培养至对数期时, 将离心、洗涤后的藻体接入无磷培养基中, 饥饿培养3d后, 再将饥饿的藻细胞分别接入含有不同磷源的300 mL Dunaliella培养基中, 初始藻密度为1.4×105个/mL, 每48 h进行取样测定相关参数。每个处理设置3个平行, 每天定时摇动3次。
1.3 叶绿素a含量及比生长速率的测定
每个处理各取5 mL的藻液进行离心, 7000 r/min,离心10 min, 去除上清液, 接着将藻细胞用90%的丙酮在4℃条件下黑暗提取24 h后将提取液定容至10 mL, 于紫外分光光度计(日本岛津, UV-2550紫外分光光度计)测其663 nm和645 nm波长处吸光值[17]。
叶绿素a含量(mg/L)=(8.02663+20.21645)
比生长速率计算:
max=max(1,2,3, …,µ, )
式中,表示杜氏盐藻在某一时间段内的比生长速率,max表示最大比生长速率,2表示2时间的藻类现存量,1表示1时间的藻类现存量。
1.4 快速光响应曲线的测定
待藻种进入对数期后, 利用PHYTO-PAM荧光仪(PhytoPAM Phytoplankton Analyzer, 德国Walz公司)测定盐藻快速光响应曲线, 测定参数包括最大PSⅡ表观电子传递速率(ETRmax), 饱和光强(k), 光化学淬灭(qP)和非光化学淬灭(NPQ)。测定前将藻液暗适应20 min, 然后分别在1、32、64、128、192、320、448、576、960、1472和1856 µmol/(m2·s)光强下测定其光响应曲线。相对电子传递速率通过下列方程计算获得[18]:
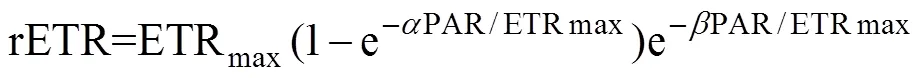
式中,为光响应曲线的起始斜率,为光曲线下降时的斜率(光抑制参数), ETRmax为最大PSⅡ表观电子传递速率, PAR为光照强度。
1.5 JIP-test参数的测定
荧光参数测定采用植物效率分析仪(Handy PEA, 英国Hansatech), 待藻培养进入对数期时, 各处理取样2.3 mL, 并暗适应30 min后测定快速叶绿素荧光诱导动力学参数, 测定光强为3000µmol/(m2·s), 最大激发波长650 nm。所获得的参数包括RCCS0,P0,0,E0, ABS/RC, DI0/RC, TR0/RC, ET0/RC等, 各参数意义见表1[19]。
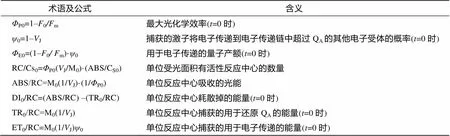
表1 JIP测定所用的叶绿素荧光动力学参数
1.6 数据统计
实验数据用SPSS 13.0进行单因素方差分析(One Way ANOVA), 并用LSD法进行多重比较, 使用Origin 8.5软件作图。
2 结果
2.1 不同磷源条件下盐藻的生长特性
4种磷源培养下, 杜氏盐藻叶绿素a含量均随时间的推移而显著增加(<0.05, 图1)。结果发现, 无机磷(NaH2PO4)和有机磷(ATP)很容易被盐藻吸收利用, 增长率在第1~3天达到最大,max分别为(0.667±0.055)/d和(0.736±0.015)/ d。在培养的第12天进入稳定期, 叶绿素a质量浓度最大值分别为5.91 mg/L和6.69 mg/L。而盐藻对β-甘油磷酸二钠和D-葡萄糖-6-磷酸吸收利用相对滞后, 最大比增长率出现在第3~4天,max分别为(0.232±0.011)/d和(0.31±0.007)/d, 并且在第16天左右进入稳定期, 叶绿素a质量浓度分别为5.90 mg/L和4.85 mg/L。
2.2 快速光响应曲线
杜氏盐藻在4种磷源条件下光响应曲线结果表明(图2, 表1), 4个处理的ETRmax和Ik在各组之间均呈现出显著差异(<0.05), 大小关系: ATP>NaH2PO4> β-甘油磷酸二钠>D-葡萄糖-6-磷酸; D-葡萄糖-6-磷酸和β-甘油磷酸二钠处理组非光化学淬灭值(NPQ)分别为0.209±0.012, 和0.187±0.014, 显著高于ATP(0.169± 0.026)和NaH2PO4(0.165±0.028)处理组(<0.05); 光化学淬灭系数qP值在β-甘油磷酸二钠处理组最低(0.637±0.009), 显著低于其他3个处理(<0.05); 而v/m值在各组之间差异不显著(>0.05)。
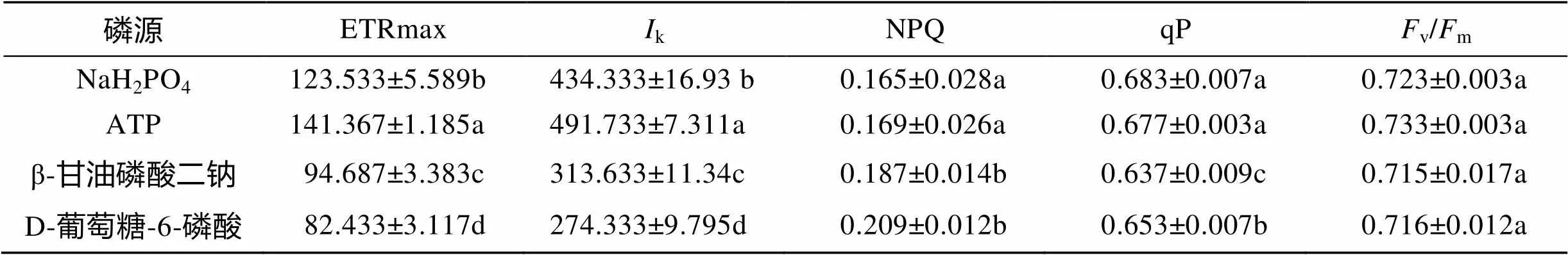
表2 不同磷源条件下杜氏盐藻光响应曲线参数值
a, b, c, d: 各处理组之间字母标注相同, 差异不显著(>0.05); 字母标注不相同, 差异显著(<0.05)
2.3 叶绿素荧光参数的变化
不同磷源处理下, 盐藻叶绿素荧光参数反应活性中心所捕获的光能(ABS/RC)、反应活性中心捕获的激发能用于还原QA的能量(TR0/RC)、反应活性中心捕获的光能用于电子传递的能量(ET0/RC)和反应活性中心耗散掉的能量(DI0/RC)的变化情况如图3所示。结果表明, 四个处理中盐藻ABS/RC和TR0/RC差异不显著(>0.05), 但β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理组DI0/RC相比于其他两组显著增加(<0.05), D-葡萄糖-6-磷酸处理ET0/RC显著低于其他三组(<0.05)。最大光化学效率(P0)在各组之间差异不显著(>0.05), 而=0时捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率(0)、用于电子传递的量子产额(E0)和单位受光面积有活性反应中心的数量(RC/CS0)NaH2PO4和ATP处理组均显著高于β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理组(<0.05)。
3 讨论
水生态系统中, 对藻类生长具有显著促进作用的无机磷(DIP)含量很低, 而有机磷占据磷源较大一部分。因此, 藻类在无机磷限制的环境下通过各自的代谢途径对有机磷加以利用以满足自身需要[8]。本研究结果表明, 杜氏盐藻均能利用NaH2PO4、ATP、β-甘油磷酸二钠和D-葡萄糖-6-磷酸维持其生长, 在NaH2PO4和ATP中盐藻生长更好, 且ATP作磷源时盐藻进入对数期需要更短的时间(1~2 d), 最大比增长率也高于其他3组。赵艳芳等[12]对中肋骨条藻和东海原甲藻的研究发现这两种藻能利用无机磷和有机磷化合物生长繁殖, 且在有机磷化合物中生长更好, 本实验结果出现类似的效应, 表明在无机磷限制而有机磷充足的条件下盐藻能够良好的生长, 且生长状况或会优于无机磷源。
光合植物叶绿素荧光动力学可以快速、简便、无损伤的检测受外界环境影响下的植物光合生理状况, 能够准确测定植物光系统对光能的吸收、传递、耗散和分配等[20], 通过叶绿素荧光的变化能够反映不同环境影响下植物光合机构与功能的变化[21]。本研究结果发现, 4种磷处理条件下杜氏盐藻v/m均为0.7~0.74, 各组之间差异不显著(>0.05), 说明杜氏盐藻均未受到磷营养盐胁迫[22-23], 盐藻能利用4种磷源供其生长。qP与NPQ是PSⅡ天线色素吸收光能的两条淬灭路径, 二者呈竞争关系, qP指PSⅡ天线色素吸收的光能用于光化学电子传递的份额, 亦即PSⅡ反应中心的开放程度, qP越大, 表明PSⅡ的电子传递活性越大; 而NPQ则是指PSⅡ天线色素吸收的光不能用于光化学电子传递的份额, 一般以热的形式耗散掉, 是藻类对自身光合机构的一种保护机制[22]。相比于ATP和NaH2PO4处理组, β-甘油磷酸二钠和D-葡萄糖-6-磷酸作磷源时杜氏盐藻qP显著降低而NPQ显著升高(<0.05), 说明此时盐藻PSⅡ反应中心的开放程度较低, 电子由PSⅡ的氧化侧向PSⅡ反应中心的传递受阻, 热耗散增加, 能量利用效率较低。最大PSⅡ表观电子传递速率(ETRmax)和饱和光强(k)结果可知ATP作磷源时盐藻光强饱和值高, 较高的电子传递速率将大量的光能及时传递出去。
JIP-test是一种定量化分析叶绿素荧光诱导的方法[24], 能够准确的反应PSⅡ反应中心及电子供体侧和受体侧的生理状态[25-26]。四种磷源处理盐藻ABS/RC和TR0/RC差异不显著, 说明盐藻反应中心所吸收的光能没有因为磷源的不同而呈现出显著差异。相比于NaH2PO4和ATP处理, β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理组DI0/RC显著增加, 但ET0/RC呈降低趋势, 表明β-甘油磷酸二钠和D-葡萄糖-6-磷酸作磷源时有活性反应中心负担加重, 迫使其耗能效率提高, 其PSⅡ反应活性中心捕获的光能更多的用于QA的还原, 使得用于电子传递的能量减少, 最终导致光合能力的降低。P0表征PSⅡ反应中心供体侧的电子传递性能, 也反映了暗适应后PSⅡ最大光化学效率[27]。四个处理组之间P0差异不显著(>0.05), 该结果与v/m结果相吻合, 意味着其光合效率不会因为磷源形态而被抑制。0E0等参数反映了PSⅡ受体侧QA、QB和PQ库等的变化情况。有机磷β-甘油磷酸二钠和D-葡萄糖-6-磷酸处理使得杜氏盐藻0和E0下降, 可能由于盐藻对这两种有机磷相对较低的利用率导致其PSⅡ受体侧电子传递受到影响, 表现为QA传递电子的能力下降, 有活性反应中心的开放程度下降。
[1] Chu S P. The influence of the mineral composition of medium on the growth of planktonic algae (part I): methods and culture media[J]. Journal of Ecology, 1942, 30: 284-340.
[2] Geider R J, Macintyre H L, Graziano L M, et al. Responses of the photosynthetic apparatus of(Chorophyta) to nitrogen and phosphorus limitation[J]. European Journal of Phycology, 1998, 33(4): 315-332.
[3] Cembella A D, Antia N J, Harrison P J. The utilization of inorganic and organic phosphorus compounds as nutrients by eukaryotic microalgae: A multidisciplinary perspectice[J]. Part 2. CRC. Crit Rev Microbiol, 1984, 65: 3205-3212.
[4] Rai L C , Gaur(Eds) J P . Algal Adaption to Environmental Stresses: Physiological, Biochemical and Molecular Mechanisms[M]. Berlin: Springer-Verlag Berlin Deidelberg, 2001.
[5] Correll D L. The role of phosphorus in the eutrophication of receiving waters: a review[J]. Journaal of Environment Quality. 1998, 27: 261-266.
[6] Berman T. Alkaline phosphatases and phosphorus availibity in Lake Kinneret[J]. Limnol Oceanogr, 1970, 15: 663-664.
[7] Huang B Q, Hong H S. Alkaline phosphatase activity and utilization of dissolved organic phosphorus by algae in subtropical coastal waters[J]. Marine Pollution Bulletin, 1999, 39: 205-211.
[8] Hong H S, Wang H L, Huang B Q. The availability of dissolved organic phosphorus to marine phytoplankton[J]. Chinese Journal of Oceanology and Limnology, 1995, 13(2): 169-176.
[9] 张清春, 于仁诚, 周名江, 等. 不同类型含磷营养物质对微小亚历山大藻() 生长和毒素产生的影响[J]. 海洋与湖沼, 2005, 36(5): 465- 474. Zhang Qingchun, Yu RenCheng, Zhou Mingjiang, et al. Effect of different phosphorus substrates on growth and toxin generation of[J]. Oceanologia et Limnologia Sinica, 2005, 36(5): 465-474.
[10] 邹迪, 肖琳, 杨柳燕, 等.不同形态磷源对铜绿微囊藻与附生假单胞菌磷代谢的影响[J].环境科学, 2005, 26(3): 118-121. Zhou Di, Xiao Lin, Yang Liuyan, et al. Effects of phosphorus sources of different forms on phosphorus metabolism ofandsp.[J]. Environmental Science, 2005, 26(3): 118-121.
[11] 钱善勤, 孔繁祥, 史小丽, 等. 不同形态磷酸盐对铜绿微囊藻和蛋白核小球藻生长的影响[J]. 湖泊科学, 2008, 20(6): 796-801. Qian Shanqin, Kong Fanxiang, Shi Xiaoli, et al. Effects of three types of phosphate on the growth ofand[J]. Journal of Lake Science, 2008, 20(6): 796-801.
[12] 赵艳芳, 俞志明, 宋秀贤, 等. 不同磷源形态对中肋骨条藻和东海原甲藻生长及磷酸酶活性的影响[J]. 环境科学, 2009, 30(3): 693-699. Zhao Yanfang, Yu Zhiming, Song Xiuxian, et al. Effects of different phosphorus substrates on the growth and phosphatase activity ofand[J]. Environmental Science, 2009, 30(3): 693-699.
[13] Zhaohui Wang, Yu Liang, Wei Kang. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa. Harmful Algae, 2011, 10, 113-118.
[14] Fang bai, Rui Liu, YanJun Yang, et al. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium,[J]. Harmful Algae, 2014, 39: 112-120.
[15] Aharon Oren. A hundred years of Dunaliella research: 1905-2005[J]. Saline Systems, 2005, 04: 1-14.
[16] 尹翠玲, 梁英, 张秋丰. 磷浓度对盐生杜氏藻和纤细角毛藻叶绿素荧光特性及生长的影响[J]. 水产科学, 2007, 26(3): 154-159. Yin Cuiling, Liang Ying, Zhang Qiufeng. Effects of different P concentrati ons on the grow th and chlorophyll fluorescence ofand[J]. Fisheries Science, 2007, 26(3): 154- 159.
[17] Goldman J C , Azov Y , Riley C B . The effect of pH in intensive microalgal cultures[J]. Journal of Experimental Marine Biology and Ecology, 1982, 57: 1-10.
[18] Platt T, Gallegos C L, Harrison W G. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J]. Journal Marine Research, 1980, 38, 687-701.
[19] Strasser R J, Tsimill-Michael M, Srivastava A. Analysis of the chlorophyll a fluorescence transient [M]. Netherlands: KAP Press. 2004, 1-47.
[20] 李晓, 冯伟, 曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报, 2006, 26(10): 2186-2196. Li Xiao, Feng Wei, Zeng Xiaochun. Advances in chlorophyll fluorescence analysis and its uses[J]. Acta Botanica Boreal-Occidentalia Sinica, 2006, 26(10): 2186-2196.
[21] Strasser R J, Strasser B J. Measuring fast fluorescence transients to address environmental questions: the JIP test[M]. Netherlands: Kluwer Academic. 1996, 977- 980.
[22] 梁英, 冯丽霞, 尹翠玲, 等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J]. 海洋科学, 2007, 31(1): 71-76. Liang Ying, Feng Lixia, Yin Cuiling, et al. Current status and prospect of chlorophyll fluorescence technique in the study of responses of microalgae to environmental stress[J]. Marine Sciences, 2007, 31(1): 71-76.
[23] 王昭玉, 王江涛. 叶绿素荧光检测技术在浮游植物营养盐限制研究中的应用[J]. 海洋科学, 2008, 12(32): 97-101. Wang Zhaoyu, Wang Jiangtao. The application of chlorophyll fluorescence detection techniques in the study of phytoplankton nutrient limitation[J]. Marine Sciences, 2008, 12(32): 97-101.
[24] 韩博平, 韩志国, 付翔. 藻类光合作用机理与模型[M]. 北京: 科学出版社, 2003. Han Boping, Han Zhiguo, Fu Xiang. Algal photosynthesis Mechanisms and models[M]. Beijing: Science Press, 2003.
[25] Strasser R J, Srivastava A, Govindjee. Polyphasic chlorophyll alpha fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology, 1995, 61: 32-42.
[26] Appenroth K J, Stǒckel J, Srivastava A, et al. Multiple effects of chromate on the photosynthetic apparatus of Spirodela polyrhiza as probed by OJIP chlorophyll a fluorescence[J]. Environmental Pollution, 2001, 115: 49-64.
[27] Bueno B, Fillat M F, Strasser R J, et al. Effect of lindance on the photosynthetic apparatus of the cyanobacterium: fluorescence induction studies and immunolocalization of ferredoxin NADP+ reductase[J]. Environmental Science Pollution Research, 2004, 11: 98-106.
[28] Schansker G, Tóth S Z, Strasser R J. Methylviologen and dibromothymoquinone treatments of pea leaves reveal the role of photosystem Ⅰ in the Chl. a fluorescence rise OJIP[J]. Biochimica et Biophysica Acta, 2005, 1706: 250-261.
Response of growth and PhotosystemⅡofon different phosphorus sources
YANG Song-qi1, 2, 3, SHI Shao-hua4, WANG Li-juan1, 2, 3, XU Wei-min5, LUO Guang-hong1, 2, 3
(1. Gansu Engineering Technology Research Center for Microalgae, Zhangye 734000, China; 2. Key Laboratory of Hexi Corridor Resources Utiligation of Gansu, Zhangye 734000, China; 3. Hexi University, Zhangye 734000, China; 4. School of Life Science, Southwest University, Chongqing 400715, China; 5. Tianjing Development Zone Tian Guang High Technology Development Company Limited, Tianjing 300457, China)
The effects on the growth and PS Ⅱ ofunder inorganic and organic phosphorus sources, including NaH2PO4,ATP, sodium β-glycerophosphate (G-P), and D-Glucose 6-phosphate (D-G-6-P), were investigated. The results showed thatcould grow rapidly under ATP and NaH2PO4; the maximum growth rate (max) was 0.736±0.0158 and 0.667±0.0553 per day, respectively. However, a hysteresis phenomenon was discovered under G-P and D-G-6-P, and themaxwere 0.232±0.0114 and 0.31±0.0077 per day respectively, which was markedly lower than in the ATP and NaH2PO4controls (<0.05). The value of ETRmaxandkunder ATP and NaH2PO4were significantly higher than those in the G-P and D-G-6-P controls (<0.05), while the value of NPQ was the reverse. JIP test parameters showed that ABS/RC, TR0/RC, andP0did not differ significantly among groups (>0.05); however, DI0/RC was increased, whereas0andE0were decreased significantly under G-P and D-G-6-P conditions (<0.05). These results demonstrated that RC could close partially, RC/Cso decreased, electron transport on the acceptor side of photosystemⅡwas blocked, and the efficiency of dissipation of energy increased when the phosphorus sources were G-P and D-G-6-P. In conclusion,could utilize both dissolved inorganic phosphate (DIP) and dissolved organic phosphorus (DOP), and ATP had a greater effect on growth than other organic phosphorus sources, which was reflected in the growth in the logarithmic phase at the shortest time and the significant increase in biomass in the presence of ATP (<0.05).
; phosphorus; chlorophyll fluorescence; photosystemⅡ (PSⅡ); Growth
(本文编辑: 梁德海)
Feb. 8, 2016
[The ninth Batch of Science and Technology Planning Projects, No. 1009FTGG017; Gansu Provincial Science and Technology Planning-Social Development Project, No.1604FKC090]
TS201.3
A
1000-3096(2016)10-0001-07
10.11759/hykx20151204001
2015-12-04;
2016-06-02
甘肃省第九批科技计划项目(1009FTGG017); 甘肃省科技支撑计划—社会发展类项目(1604FKC090)
杨宋琪(1988-), 男, 甘肃陇南人, 硕士, 助教, 主要从事藻类生理生态学方面研究, E-mail: sqyang@hxu.edu.cn; 罗光宏, 通信作者, 男, 甘肃张掖人, 硕士, 教授, 主要从事微藻资源开发与利用研究, E-mail: 13993693452@163.com
