Cu2+印迹磁性壳聚糖微球的表征及吸附性能
2016-10-14马立成车小奎冯海亮
马立成, 郑 其, 车小奎, 冯海亮, 严 波
Cu2+印迹磁性壳聚糖微球的表征及吸附性能
马立成, 郑 其, 车小奎, 冯海亮, 严 波
(北京有色金属研究总院 稀有金属冶金材料研究所,北京 100088)
以磁性Fe3O4为磁核,Cu2+为模板离子,壳聚糖为功能单体,制备了Cu2+印迹磁性壳聚糖微球(MIPs)。采用透射电镜、红外光谱分析、振动样品磁强计和X射线衍射仪对MIPs进行表征。结果表明,MIPs具有三维网状的多孔结构,并且Fe3O4被壳聚糖包埋且分布均匀。同时通过振动样品磁强计测得其饱和磁化强度为10.8 emu×g-1,具有一定的磁性能。采用静态吸附法研究了MIPs对Cu2+的吸附。结果表明,pH值为5;吸附3 h达到吸附平衡;MIPs对Cu2+的吸附符合准二级动力学方程。并对MIPs的选择识别能力进行了评价,结果表明:MIPs对Zn2+、Co2+、Ni2+的相对选择性系数分别为2.07、2.59、3.44,对Cu2+具有较高的选择识别性能。并且,MIPs再生-重复使用10次吸附容量没有明显的降低。
;吸附;选择性
1 前 言
铜及其化合物的主要污染来源是铜锌矿的开采和冶炼、金属加工等产生的废水[1,2]。铜作为生命体必须的有益元素,毒性较小,但是人体过量的摄入铜会引起腹痛呕吐,长期积累过量的铜会造成肝硬化[3,4]。因此,从废水中分离和富集铜离子引起了广泛的关注。目前处理含铜离子废水的方法有化学沉淀、电解、离子交换、膜分离等,但存在成本高、工艺复杂、尤其对低浓度废水的处理效果不佳[5~9]。吸附法作为一种有效的分离技术,具有分离效率高、操作简单、分离产物易于回收等优点[10~13],在含铜废水处理领域具有广泛的应用前景。因此,制备具有吸附容量大,稳定性高的吸附剂对含铜废水的处理具有重要的意义。
壳聚糖(化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖)是天然多糖中唯一的碱性多糖。其分子链C2和C6上含有大量游离的氨基和羟基,能与许多重金属离子形成稳定的螯合物[14,15]。由于壳聚糖在酸性溶液中不稳定,常采用交联、改性等方法以提高壳聚糖的化学稳定性和机械强度[16~22]。虽然交联等方法提高了壳聚糖的化学稳定性和机械强度,但是交联反应中消耗了分子链上的羟基和氨基使其对金属离子的吸附容量降低。为了克服交联过程中消耗氨基和羟基使其对金属离子的吸附容量降低的缺陷,采用金属离子印迹技术制备Cu2+印迹壳聚糖以提高其对Cu2+的吸附容量和选择性[23~25]。
磁性吸附材料具有传质速率快、固-液接触好,便于磁性分离等特点[26]。因此本研究以Fe3O4为磁核,Cu2+为模板离子,壳聚糖为功能单体,制备了Cu2+印迹磁性壳聚糖。并采用透射电子显微镜(TEM),振动样品磁强计(VSM),傅里叶变换红外光谱仪(FTIR)和X射线衍射仪(XRD)对其进行了表征。采用静态吸附法研究了Cu2+印迹磁性壳聚糖微球对Cu2+的吸附,同时研究了其在Cu2+/Zn2+,Cu2+/Ni2+和Cu2+/Co2+组成的二元混合溶液中的选择识别性能。
2 实验部分
2.1 试剂及仪器
壳聚糖(国药集团化学试剂有限公司,脱乙酰度:80%~95%,黏度:50~800 mPa×s,分子量>62×104,简称CTS),甲醛,环氧氯丙烷,戊二醛,硫酸铜,硫酸,氢氧化钠均为分析纯,磁性Fe3O4为实验室自制(Fe3O492.5%,粒径为10~30mm)。
透射电子显微镜(日本Hitachi公司,H600),全自动4站比表面积和孔度分析仪(美国康塔仪器公司,250MG),振动样品磁强计(美国LakeShore公司,LakeShore7307),傅里叶变换红外光谱仪(美国Nicolet公司,Nexus 670),电感耦合等离子体光谱仪(美国Jarrel-ASH公司,ICAP-9000),X射线衍射仪(荷兰PANalytical公司,X’Pert PRO MPD),恒温振荡器(太仓市实验设备厂,THZ-C),pH计(上海精密科学仪器有限公司,PHS-C)。
2.2 Cu2+印迹磁性壳聚糖微球的制备
将一定量的壳聚糖溶解在体积比为2.0%的乙酸溶液中,配制成壳聚糖溶液,加入适量Fe3O4,搅拌均匀,将磁性壳聚糖溶液滴加到2 mol×L-1的NaOH溶液中,制得磁性壳聚糖微球。将微球分散在去离子水中,加入一定量的甲醛溶液,在50℃下于恒温振荡器中作用3 h后,除去未反应的甲醛,调整pH值为10,加入适量的环氧氯丙烷微交联3 h,再用1 mol×L-1的硫酸去除甲醛,制得微交联磁性壳聚糖微球,并将微交联的微球存放于去离子水中。
将微交联的微球加入到含有印迹离子Cu2+的溶液中,印迹6 h,所加Cu2+与壳聚糖氨基的摩尔比为2:1,印迹后将微球在60℃下与戊二醛交联3 h,交联结束后,分别用乙醇和去离子水洗涤至中性,再用1 mol×L-1的硫酸洗脱印迹Cu2+离子,直至检测不到Cu2+,再用1 mol×L-1的NaOH浸泡1 h,洗涤至中性,真空干燥得到Cu2+印迹磁性壳聚糖微球(MIPs)。
非印迹磁性壳聚糖微球(NMIPs)的制备过程中不加印迹离子,制备方法与印迹磁性壳聚糖的制备方法相似。
2.3 MIPs的表征
将MIPs经树脂包埋后,用切片机将其切成超薄切片并固定在有支持膜的载网上,然后采用H600型透射电子显微镜观察其形貌和孔结构。
采用全自动4站比表面积和孔度分析仪测定其比表面积和孔度。
准确称取一定量干燥的MIPs,在25℃下采用LakeShore7307型振动样品磁强计测定MIPs的磁滞回线,得出其饱和磁化强度和剩余磁化强度。
分别将MIPs、壳聚糖和Fe3O4研碎成粉末,采用KBr压片法用Nexus 670型傅里叶变换红外光谱仪进行分析。
分别将干燥的Fe3O4、壳聚糖粉末和MIPs的用X' Pert PRO MPD型X射线衍射仪进行测试,管电压30 KV,管电流20 mA,扫描速度为6º×min-1,波长=1.54,扫描范围10~70º。
2.4 MIPs的吸附性能
2.4.1 pH值对MIPs吸附Cu2+的影响
取5份浓度为300 mg×g-1的Cu2+溶液中25 mL,依次调整pH值为2、3、4、5、6,分别加入0.05 g的MIPs,在25℃恒温震荡器中振荡适当时间,达到吸附平衡后,磁性分离MIPs,取上清液用电感耦合等离子体光谱仪测定溶液中Cu2+的平衡浓度,按下式计算平衡吸附容量e:

其中:0和e分别表示初始浓度和平衡浓度,mg×L-1;表示溶液的体积,L;表示MIPs的用量,g;e表示吸附容量,mg×g-1。
2.4.2 吸附动力学
准确称取0.05 g的MIPs,加入50 mL浓度为300 mg×L-1的Cu2+溶液,调整溶液的pH值为5,在25℃恒温振荡器中振荡,每隔一定时间取样测定溶液中Cu2+的平衡浓度,计算平衡吸附容量。
2.4.3 吸附等温线
准确称取0.05 g 的MIPs多份,加入50 mL不同浓度的Cu2+溶液,调整溶液的pH值为5,在25℃下于恒温振荡器中振荡一定时间,达到吸附平衡后磁性分离MIPs,取适量的滤液测定溶液中Cu2+的平衡浓度,计算平衡吸附容量。
2.4.4 选择吸附性能
为了研究MIPs的选择性吸附性能,本研究分别配制总浓度为200 mg×L-1的Cu2+/Zn2+,Cu2+/Ni2+,Cu2+/Co2+二元体系的混合溶液,准确称取0.05 g MIPs和NMIPs分别加入到25 mL上述溶液中,在25℃下振荡吸附达到平衡后,取上清液测定溶液中Cu2+、Zn2+、Co2+、Ni2+浓度。采用分配系数d,选择吸附系数和相对选择系数对选择性能进行评价。
分配系数(d)指一定温度下,处于平衡状态时,组分在固定相中的浓度和在流动相中的浓度之比,分配系数反映了溶质在两相中的迁移能力及分离效能,是描述物质在两相中行为的重要物理化学特征参数。d表达式为:d=(0-e)/e。其中0为初始浓度,mg×L-1;e吸附后金属离子在溶液中的浓度,mg×L-1;为溶液体积,mL;为吸附材料质量,g。
选择吸附系数是评价MIPs选择性的重要指标,在竞争离子存在条件下MIPs对Cu2+的选择性系数为:=d(Cu2+)/d(M2+)。其中d(Cu2+)为Cu2+的分配系数;d(M2+)为干扰离子的分配系数。
相对选择系数是对MIPs印迹材料选择性的评价,反映印迹效果的指标,越大,表明印迹效果越好。表达式为:=imprinted/non-imprinted。其中imprinted为MIPs的选择吸附系数;non-imprinted为NMIPs的选择吸附系数。
2.4.5 重复使用
将0.05 g干燥的MIPs置于300 mg×L-1含Cu2+的溶液中吸附3 h后,测定溶液中金属离子浓度,计算吸附容量e。再用1.0 mol×L-1的H2SO4解吸2 h,直到检测不到Cu2+为止,去离子水洗涤后用1 mol×L-1的NaOH浸泡1 h,可得到再生的MIPs。按上述方法将再生的MIPs重复解吸-吸附10次,测试MIPs的重复使用性能。
3 结果与讨论
3.1 MIPs的形态结构
图1是制备的MIPs的粒径分布,由图可知,所制得的MIPs粒径相当均匀,平均粒径为0.8 mm。并用全自动4站比表面积和孔度分析仪测定了MIPs的比表面积为13.3 m2×g-1,平均孔径为4.737 nm,孔容为5.47×10-3mL×g-1。
图2是MIPs的透射电镜照片,从图中可以看出MIPs具有空间网状的多孔结构,这是由于MIPs的制备中经过印迹和交联反应,形成了具有专一识别模板离子(Cu2+)的空穴结构,增加了MIPs的孔结构,将有利于吸附过程的进行。同时也可以看到Fe3O4均匀分布在微球内部,没有出现明显的分相现象和团聚,这有利于维持MIPs的力学性能。
3.2 磁性能分析
图3是MIPs 的磁滞回线。从图中可以看出,MIPs的饱和磁化强度为10.8×g-1,剩磁为0.8 emu×g-1,MIPs的矫顽力为0,表现出较好的超顺磁性特点,表明MIPs在外加磁场的作用下具有一定的磁性,当外加磁场消失后,其磁性能重新分布,有利于磁性分离。
3.3 FT-IR分析
图4所示分别为Fe3O4(a)、CTS (b)、和 MIPs (c)傅里叶变换红外光谱图,与壳聚糖红外光谱b线对比可知:MIPs的3423.06 cm-1处吸收峰的位置基本没有发生变化,但吸收峰尖锐,这是由于Fe3O4、交联剂和环氧氯丙烷与壳聚糖分子链上的部分氨基和羟基发生反应引起的。1600.43 cm-1为-NH2伸缩振动峰,说明MIPs结构中具有大量的-NH2。1030.16 cm-1处一级醇羟基吸收峰明显减弱,并向低频方向移动,说明环氧氯丙烷与壳聚糖分子上的羟基发生了反应,消耗了羟基所致。
3.4 XRD分析
图5是Fe3O4(a)、MIPs (b)和CTS(c),的X射线衍射图,可以看出,Fe3O4在2= 18.3º,30.1º,35.43º,43.0º,53.5º,56.9º,62.5º处有明显的特征衍射峰,与Fe3O4标准X衍射图一致,说明Fe3O4是尖晶石结构。c线是壳聚糖衍射图,在2= 20.1º和29.34º处有两个主要衍射峰,说明壳聚糖是非晶结构。与MIPs的衍射图相比较,可以看出MIPs在2= 20.1º处的衍射峰消失,在2= 29.34º处的衍射峰减弱,这是由于印迹和交联反应过程使壳聚糖分子链上的氨基和羟基间氢键被破坏,使MIPs中的壳聚糖发生了变化。但是在MIPs中,Fe3O4的特征峰的位置没有发生变化,其强度明显减弱,说明在MIPs的制备过程对Fe3O4的结构没有影响,保持尖晶结构。
3.5 pH值对MIPs的吸附性能影响
pH值是溶液中金属离子存在形态的重要影响因素之一,同时也是影响吸附材料对金属离子吸附的重要因素。图6是不同pH值对MIPs的吸附影响。从图中可以看出,在pH值在1~5,MIPs对Cu2+的吸附容量随着溶液pH值的增大逐渐增大,当pH>5时,吸附容量又随着pH值的增大而减小。这是因为在较低pH值下,溶液中H+浓度较高,H+与MIPs分子链上的部分-NH2质子化形成-NH3+,即H+与Cu2+在MIPs分子链上发生竞争吸附;同时,-NH2与H+结合形成的-NH3+增大了空间位阻,阻碍了带正电的Cu2+与MIPs分子链上的-NH2结合[27],从而导致吸附容量降低。当pH>5时,随着溶液中H+浓度降低,OH-浓度增大,溶液中的Cu2+易形成Cu(OH)2沉淀,影响MIPs对Cu2+的吸附,导致吸附容量开始下降。因此,确定MIPs对Cu2+的吸附最佳pH值为5左右。
3.6 MIPs对Cu2+的吸附动力学
图7是MIPs对Cu2+的吸附容量随时间的变化曲线,从图中可以看出,在吸附初始阶段,MIPs对Cu2+的吸附容量随着时间的增加而迅速增加,随着时间的延长,吸附容量逐渐趋于平缓,在180 min时,吸附容量基本不再增加,达到吸附平衡。由此可知MIPs对Cu2+的吸附过程可分为三个阶段:在吸附初始阶段,Cu2+主要在MIPs表面的吸附,吸附容易进行,因而吸附速率较快;吸附中期,Cu2+穿过边界层进入空隙向内部迁移扩散,吸附过程中随着MIPs表面活性吸附位点的减少,溶液中Cu2+浓度减小,Cu2+扩散到MIPs内部被阻碍,因此吸附速率减缓;到吸附后期,随着MIPs的活性基团基本全部与Cu2+结合,溶液中Cu2+浓度也越来越小,吸附容量不再增加,吸附趋于平衡[28]。
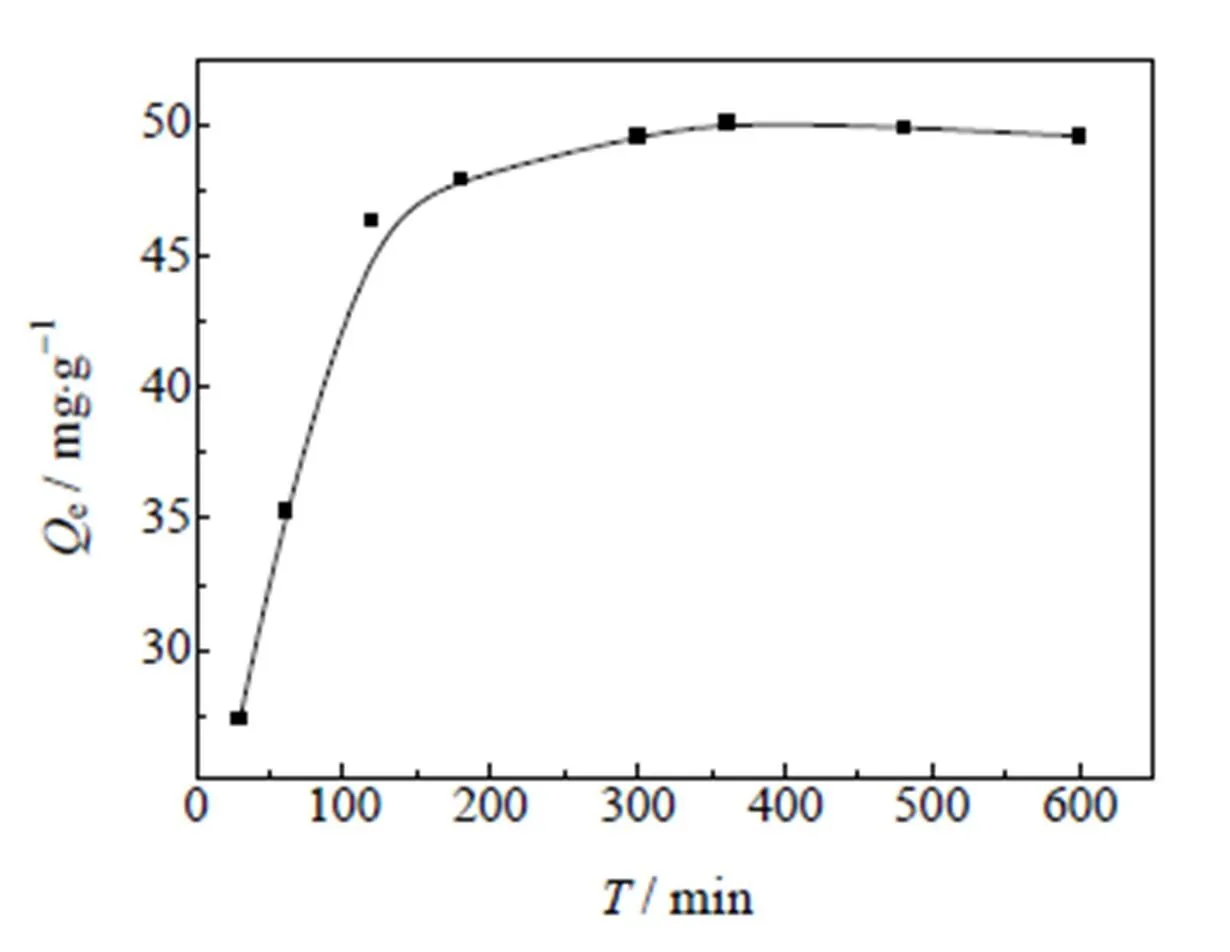
图7 吸附动力学曲线
采用Lagergren准一级吸附动力学方程和准二级吸附动力学方程[29]对动力学曲线进行分析,其中准一级动力学吸附方程为:ln(e-t)=lne-1;准二级动力学方程为:/t=1/2e+/e。
其中:e是平衡吸附容量,mg×g-1;t是时刻吸附容量,mg×g-1;1是准一级吸附速率平衡常数,g×(mg×min)-1;2是准二级吸附速率平衡常数,g×(mg×min)-1。
分别以ln(et)对和/t对作图,进行线性回归分析,根据直线截距和斜率可求得吸附速率和动力学常数1和2,结果见表1。由表1线性相关系数可知,准二级吸附动力学方程线性相关系数R2接近1,并且通过计算准二级动力学方程对Cu2+的吸附容量为52.0×g-1,与实验结果接近。说明MIPs对Cu2+的吸附过程符合准二级动力学方程。由于吸附过程首先以扩散的方式由外表面经MIPs的表面孔穴进入其内表面,随着吸附的进行,Cu2+与MIPs的内外表面的功能基团形成共价键或离子键,发生化学吸附,控制整个过程的吸附速率[30],因此准二级动力学方程能更好的满足整个吸附过程。

表1 吸附动力学参数
3.7 MIPs对Cu2+的吸附等温线
图8为在25℃下,Cu2+初始浓度为0~900 mg×L-1时,测定了MIPs对Cu2+的吸附等温线,从图中可以看出,MIPs的吸附容量随Cu2+浓度的升高而增大,最大吸附容量为78.1 mg×g-1。
分别采用Langmuir方程和Freundlich方程分别对图8的数据进行线性回归分析,结果见表2。其中Langmuir方程:e/e=e/m+1/1m;Freundlich方程:lne=lnF+lne/。

表2 MIPs对Cu2+的吸附等温线参数
其中:e为平衡浓度,mg×L-1;e为平衡吸附容量,mg×g-1;m为饱和吸附容量,mg×g-1;L为Langmuir吸附平衡常数,L×mg-1;F为Freundlich吸附平衡常数,L1/n×mgn-1/n×g-1;为常数。
由表2可见:MIPs吸附Cu2+的实验数据用Langmuir方程拟合效果好于Freundlich方程拟合效果,且相关系数大于0.99,说明MIPs对Cu2+的吸附可以用Langmuir方程描述。
3.8 选择吸附性能
MIPs印迹交联后增加了其对目标离子的特异选择性,本研究采用与Cu2+具有相同电荷数和离子半径的Zn2+、Co2+、Ni2+为竞争离子,对MIPs的选择性识别性能进行评价,得到e,分配系数d,选择吸附系数和相对选择系数,结果见表3。

表3 MIPs对Cu2+/Zn2+,Cu2+/Ni2+,Cu2+/Co2+二元体系的选择性参数
根据表3数据可知,在相同的实验条件下,具有相近的离子半径、离子大小和相同的电荷数的Cu2+、Zn2+、Co2+、Ni2+配制的Cu2+/Zn2+,Cu2+/Ni2+,Cu2+/Co2+二元混合溶液的吸附表明,MIPs对Cu2+的吸附容量和选择吸附系数均高于NMIPs,表明MIPs对Cu2+有较高的选择吸附性,一方面是由于经过Cu2+印迹后,在MIPs表面形成能特异识别Cu2+的空穴结构,对Cu2+的具有专一识别性能;另一方面,经过交联后,导致MIPs结晶结构发生一定程度的削弱,使其分子链上氨基及羟基间的氢键作用减弱,导致其吸附位点活性相对增大,更容易结合Cu2+。根据选择吸附系数可以得出MIPs对溶液中四种金属离子的吸附能力大小为:Cu2+>Zn2+> Ni2+> Co2+。相对选择吸附系数均大于2,说明印迹对Cu2+的选择吸附起到了较好的效果,这是由于印迹交联后,在MIPs表明形成了能够专一识别Cu2+的空穴结构,不仅增大了MIPs的比表面积,而且增强了其对Cu2+的选择识别性能。而NMIPs表面没有专一识别Cu2+的空穴结构,在二元体系中吸附,共存金属离子会分享NMIPs上的活性吸附位点,发生竞争吸附,因此在NMIPs上Cu2+吸附容量降低,共存离子吸附容量增加,选择性系数吸附系数较MIPs的低。
3.9 重复使用
MIPs再生-吸附数次与吸附容量的变化如图9所示。从图可以看出,经过再生-重复使用10次后,对Cu2+的吸附容量基本没有明显的降低。说明MIPs可以重复使用多次后,仍然具有较高的吸附容量和稳定性。
4 结 论
(1)以磁性Fe3O4为磁核,Cu2+为模板离子,壳聚糖为功能单体,制备了Cu2+印迹磁性壳聚糖微球。MIPs具有三维网状的多孔结构,并且Fe3O4被壳聚糖包埋且分布均匀,其饱和磁化强度为10.8 emu×g-1,具有一定的磁性能。
(2) 通过静态吸附法研究其吸附性能,结果表明,MIPs对Cu2+的吸附最佳pH值为5,约3 h达到吸附平衡,吸附过程符合准二级动力学,并且对Cu2+的吸附符合Langmuir方程。
(3) 选择吸附实验表明:MIPs对Cu2+具有较高的选择吸附性能,MIPs对Cu2+/Zn2+,Cu2+/Ni2+,Cu2+/Co2+的相对选择系数分别为2.07,2.59,3.44。并且MIPs再生-重复使用10次,其吸附容量没有明显的降低。因此MIPs可以从含铜离子废水中有效的分离出Cu2+,期望应用于含重金属离子废水处理中。
[1] Cebrian E, Agell G, Marti R,. Response of the Mediterranean sponge Chondrosia reniformis Nardo to copper pollution [J]. Environ Pollut, 2006, 141(3): 452-458.
[2] Xiang H, Yu X Y. Toxic effect of copper pollution on water and hydrophyte [J]. Hunan Agricultural Sciences, 2009, (11): 54-56.
[3] Xiong X, Li X Y, Lin W,. Copper content in animal manures and potential risk of soil copper pollution with animal manure use in agriculture [J]. Resources, Conservation and Recycling, 2010, 54(11): 985-990.
[4] Muchuweti M, Birkett J W, Chinyanga E,. Heavy metal content of vegetables irrigated with mixtures of wastewater and sewage sludge in Zimbabwe: implications for human health [J]. Agriculture, Ecosystems & Environment, 2006, 112(1): 41-48.
[5] ZHANG Chuan-lei (张传雷), SUN Nan-nan (孙南南), XIE Shi-tao (谢实涛),. Review on wastewater treatment of heavy metals and reutilization technique (重金属废水处理技术和资源化概述) [J]. Modern Chemical Industry (现代化工), 2014(4): 38-41.
[6] SHAO Li-fen (邵利芬), YANG Yu-jie (杨玉杰), YAO Shu-guang (姚曙光),. Reseach progress of copper-containing electroplating wastewater treatment (含铜电镀废水处理技术研究进展) [J]. Industrial Water & Wastewater (工业用水与废水), 2007. 38(3): 13-15.
[7] Kurniawan T A, Chan G, Lo W H,. Physico–chemical treatment techniques for wastewater laden with heavy metals [J]. Chem Eng J, 2006, 118(1): 83-98.
[8] Harper T R, Kingham N W. Removal of arsenic from wastewater using chemical precipitation methods [J]. Water Environment Research, 1992, 64(3): 200-203.
[9] CHENG Si-xi (成四喜), HUANG Zheng-zheng (黄铮铮), LEI Xiao-yu (雷筱娱),. Research progresses in treatment of copper-containing wastewater by ion exchange resin process (离子交换树脂法处理含铜废水的研究进展) [J]. Environmental Protection of Chemical Industry (化工环保), 2014, 34(3): 230-234.
[10] Cay S, Uyanık A, Özaşık A. Single and binary component adsorption of copper (II) and cadmium (II) from aqueous solutions using tea-industry waste [J]. Separation and Purification Technology, 2004, 38(3): 273-280.
[11] Mohan D, Pittman Jr C U. Arsenic removal from water/wastewater using adsorbents -A critical review [J]. J Hazard Mater, 2007, 142(1): 1-53.
[12] Veglio F, Beolchini F. Removal of metals by biosorption: a review [J]. Hydrometallurgy, 1997, 44(3): 301-316.
[13] AjayKumar A V, Darwish N A, Hilal N.[J]. World Appl Sci J, 2009, 5(): 32-40.
[14] Ravi Kumar M N V. A review of chitin and chitosan applications [J]. React Funct Polym, 2000, 46(1): 1-27.
[15] Rinaudo M. Chitin and chitosan: properties and applications [J]. Prog Polym Sci, 2006, 31(7): 603-632.
[16] SUN Chang-mei (孙昌梅), QU Rong-jun (曲荣君), WANG Chun-hua (王春华),. Progress in adsorbents for metal ions based on chitosan and its derivatives (基于壳聚糖及其衍生物的金属离子吸附剂的研究进展) [J]. Ion Exchange and Adsorption (离子交换与吸附), 2004, 20(2): 184-192.
[17] WANG Yu-ting (汪玉庭), TANG Yu-rong (唐玉蓉). Study on properties of crosslinked chitosan polymers for adsorbing metal ions (交联壳聚糖对重金属离子的吸附性能研究) [J]. Environmental Pollution & Control (环境污染与防治), 1998, 20(1): 1-3.
[18] GUO Min-jie (郭敏杰), LIU Zhen (刘振), LI Mei (李梅). Research progresses on adsorbing heavy metal ions with chitosan (壳聚糖吸附重金属离子的研究进展) [J]. Environmental Protection of Chemical Industry (化工环保), 2004,24(4): 262-265.
[19] Vasconcelos H L, Camargo T P, Gonçalves N S,. Chitosan crosslinked with a metal complexing agent: Synthesis, characterization and copper(II) ions adsorption [J]. React Funct Polym, 2008, 68(2): 572-579.
[20] Laus R, Costa T G, Szpoganicz B,. Adsorption and desorption of Cu(II), Cd(II) and Pb(II) ions using chitosan crosslinked with epichlorohydrin-triphosphate as the adsorbent [J]. J Hazard Mater, 2010, 183(1): 233-241.
[21] Yang Z, Zhuang L, Tan G. Preparation and adsorption behavior for metal of chitosan crosslinked by dihydroxy azacrown ether [J]. J Appl Polym Sci, 2002, 85(3): 530-535.
[22] Laus R, De Favere V T. Competitive adsorption of Cu(II) and Cd(II) ions by chitosan crosslinked with epichlorohydrin–triphosphate [J]. Bioresource Technol, 2011, 102(19): 8769-8776.
[23] Yoshida M, Uezu K, Goto M,. Metal ion imprinted microsphere prepared by surface molecular imprinting technique using water-in-oil-in-water emulsions [J]. Journal of Applied Polymer Science, 1999, 73(7): 1223-1230.
[24] Tan T W, He X J, Du W X. Adsorption behaviour of metal ions on imprinted chitosan resin [J]. J Chem Technol Biot, 2001, 76(2): 191-195.
[25] Chen C Y, Yang C Y, Chen A H. Biosorption of Cu(II), Zn(II), Ni(II) and Pb(II) ions by cross-linked metal-imprinted chitosans with epichlorohydrin [J]. Journal of Environmental Management, 2011, 92(3): 796-802.
[26] Dave P N, Chopda L V. Application of iron oxide nanomaterials for the removal of heavy metals [J]. Journal of Nano technology, 2014, 2014:1-14.
[27] DANG Ming-yan (党明岩), ZHANG Ting-an (张廷安), WANG Ping (王娉),, Adsorption behavior on Platinum by chloromethylthiirane crosslinked chitosan resin (环硫氯丙烷交联壳聚糖树脂对铂的吸附性能) [J]. Nonferrous Metals(Extractive Metallurgy) (有色金属(冶炼部分)), 2008(1): 30-33.
[28] Andaç M, Özyapi E, Senel S,. Ion-selective imprinted beads for aluminum removal from aqueous solutions [J]. Ind Eng Chem Res, 2006, 45(5): 1780-1786.
[29] LIU Yao-chi (刘耀驰), ZHANG Xiao-wen (张晓文), LIU Hui-jun (刘慧君),. Synthesis of uranyl sulphate imprinted ion exchange resin and its recognition characteristics (硫酸铀酰印迹离子交换树脂的合成及识别特性研究) [J]. J Chem Eng Chinese Univ (高校化学工程学报), 2006, 20(4): 510-514.
[30] HONG Ying (洪英), ZHONG Ze-hui (钟泽辉), GUO Bin (郭宾). Kinetic of adsorption of Zn2+on imprinted chitosan polymer (壳聚糖印迹聚合物对Zn2+的吸附动力学) [J]. Chemical Industry and Engineering Progress (化工进展), 2011, 30(6): 1296-1301.
Characterization and Properties ofCu Ion-Imprinted Magnetic Chitosan Beadsand their Cu2+Adsorption Performance
MA Li-cheng, ZHENG Qi, CHE Xiao-kui, FENG Hai-liang, YAN Bo
(Rare Metals and Metallurgy Materials Research Institute, General Research Institute for Nonferrous Metals, Beijing 100088, China)
Cu2+ion imprinted magnetic chitosan beads (MIPs) were synthesized using Fe3O4as the magnetic core, Cu2+as the template ion, and chitosan as the functional monomer. The structure and properties of the MIPs were studied by TEM, XRD, VSM, FTIR and XRD, and the results show that the MIPs has a 3-dimension network structure with Fe3O4uniformly distributed inside. The magnetic properties were measured by vibrating sample magnetometer and the saturation magnetization was 10.8 emu×g-1. Cu2+adsorption was investigated by a static adsorption method. The results show that the optimum adsorption pH value is ~ 5, and the adsorption equilibrium is established within 3 h. The kinetic study shows that the adsorption process follows the pseudo-second-order kinetic equations. The selection recognition ability of the MIPs were evaluated by relative selectivity coefficient () in an aqueous solution. The results show that the MIPs has a high selectivity toward Cu2+, and the relative selectivity coefficient () of MIPs for Cu2+/Zn2+, Cu2+/Ni2+and Cu2+/Co2+are 2.07, 2.59 and 3.44, respectively. Furthermore, the MIPs can be regenerated and reused for 10 times without a significantly decrease of adsorption capacity.
metal ion-imprinted; chitosan; magnetic; characterization; adsorption; selectivity
1003-9015(2016)01-0174-08 网络出版地址:http://www.cnki.net/kcms/detail/33.1141.TQ.20151222.1044.006.html
X131.2
A
10.3969/j.issn.1003-9015.2015.00.034
2014-09-01;
2014-11-23。网络出版时间:2015-12-22 10:44:47
国家高技术研究发展计划(863)(2013AA065703)。
马立成(1987-),男,宁夏固原人,北京有色金属研究总院硕士生。通讯联系人:郑其,E-mail:qiz65@sina.com
