遮荫对油用牡丹植株生长和光合特性的影响
2016-10-14蔡艳飞李世峰王继华熊灿坤李树发
蔡艳飞,李世峰,王继华,熊灿坤,宋 杰,李树发*
(1 国家观赏园艺工程技术研究中心,昆明 650205;2 云南省农业科学院花卉研究所,昆明 650205;3 云南省花卉育种重点实验室,昆明 650205;4 云南省花卉工程中心,昆明 650205,5 云南格桑花卉有限责任公司,云南香格里拉 650000)
遮荫对油用牡丹植株生长和光合特性的影响
蔡艳飞1,2,3,4,李世峰1,2,3,4,王继华1,2,3,4,熊灿坤5,宋 杰1,2,3,4,李树发1,2,3,4*
(1 国家观赏园艺工程技术研究中心,昆明 650205;2 云南省农业科学院花卉研究所,昆明 650205;3 云南省花卉育种重点实验室,昆明 650205;4 云南省花卉工程中心,昆明 650205,5 云南格桑花卉有限责任公司,云南香格里拉 650000)
设置100%全光照(L0)、50%全光照(L1)、25%全光照(L2)和15%全光照(L3)4种光环境,分析不同遮荫环境对油用牡丹的生长、光合作用及叶绿素荧光参数的影响。结果表明:(1)油用牡丹的花朵数量、比叶重、气孔密度在L2和L3处理下显著低于L0处理,但L1较L0无显著变化;随着遮荫水平增加,油用牡丹种子数量、气孔器面积百分比逐渐下降,且在4个不同处理间差异显著。(2)油用牡丹叶片最大净光合速率(Pmax)、光补偿点(LCP)和光饱和点(LSP)在遮荫条件下均有不同程度降低,L2和L3处理的Pmax和LSP显著低于L0,但L1较L0无显著变化。(3)L3处理的光系统Ⅱ(PSⅡ)的最大量子效率(Fv/Fm)为0.76,显著低于其余3个光照处理;随光化光诱导时间的增加,开放的PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)呈逐渐下降并趋于稳定的趋势,而PSⅡ的实际量子产量效率(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)呈逐渐增加并趋于稳定的趋势,稳定后的Fv′/Fm′、ΦPSⅡ值表现为L0>L1>L2>L3,NPQ大小顺序为L3>L2>L1>L0,但不同处理间的qP无显著差异。研究发现:过度遮荫(15%~25%自然光强)严重抑制了油用牡丹的净光合速率,而且与产量直接相关的花朵数量和种子数量也显著下降,最终造成严重减产;在云南昆明地区50%~100%之间的自然光可能是油用牡丹较为合适的生长光强。
油用牡丹;遮荫;生长;光合特性;叶绿素荧光
油用牡丹为毛茛科(Ranunculaceae)芍药属(Paeonia)多年生植物,其籽油富含α-亚麻酸,现已成为集观赏价值、油用价值和药用价值为一身的特有油料植物资源[1-2]。近年来,油用牡丹栽培面积不断扩大,油用牡丹产业在地方经济中的作用日益凸现。

因此,本研究通过人工遮荫设置不同光照强度,对主要栽培油用牡丹品种‘凤丹’(P.ostii)的生长、光合作用及叶绿素荧光参数进行比较研究,分析油用牡丹对光能的需求和适应性,探明其生长发育最有利的光照强度,为油用牡丹的优化栽培提供理论和实践指导。
1 材料和方法
1.1 材料与处理
2014年10月份,将3年生油用牡丹品种‘凤丹’按照株行距30 cm×50 cm种植在云南省农业科学院花卉研究所大春河基地(alt:2 019 m,E 102°34′57″,N 24°34′53″)试验大棚内,种植基质为沙壤土。2015年2月1日开始,在植株发芽前利用人工遮荫的方法开始遮光处理,设置4种光环境梯度:L0(全光照)、L1(1层遮荫网,相当于50%全光照)、L2(2层遮荫网,相当于25%全光照)、L3(3层遮荫网,相当于15%全光照),每个光梯度处理100株,3个重复。试验期间所有油用牡丹均进行相同的水分和施肥管理,遮荫80 d后进行生长、光合及叶绿素荧光参数的测定。
1.2 测定指标及方法
1.2.1 生长环境光强和生长指标 在晴天,从9:00~18:00,每隔1 h用DRM-FQ双辐射计(美国)分别测定4种不同光环境(L0、L1、L2和L3)下光照强度随时间的变化情况。每个处理重复3次。在油用牡丹的盛花期(4月中下旬),用卷尺测量30株油用牡丹的株高,并统计花朵数量。待果实成熟后,随机选取15个果实,称量果实鲜重,统计种子数量和种子鲜重。每个处理重复3次。
1.2.2 比叶重和叶绿素含量 采集植株从顶端往下数第3~5片叶片,采收后立刻带回实验室。采用叶面积仪LI-3000A(LI-Cor Inc., Nebraska, USA)测定叶片面积,然后将叶片放入烘箱中80 ℃烘烤48 h,使叶片达恒重,称取叶片干重。根据叶面积和干重,计算比叶重(LMA, g·m-2)。叶绿素含量参照Inskeep等[11]的方法进行测定。每个处理4个重复。
1.2.3 叶片表皮特征 取叶片中间部分(避开叶脉),直接用镊子撕取表皮,将表皮制成临时装片,在生物显微镜(Nikon Eclipse E800, Yokohama, Japan)下观察并用Nikon-DXM1200数码显微摄影系统拍照。用图形分析软件(Image-Pro Plus 6.0)测量气孔密度(SD)、气孔器长度(l)、气孔器宽度(w)。SD=视野内气孔个数/视野面积。单个气孔器的面积(As)=π×l×w/4,π=3.14,气孔器面积百分率(At)=As×SD×100[12]。每个处理取30个视野的平均值。
1.2.4 光响应曲线 采用便携式光合作用测定系统LI-6400 XT(Li-Cor Inc. Nebraska, USA)测定不同光环境下油用牡丹叶片净光合速率的光响应曲线。以LI-6400-02 LED提供红蓝光源获得不同的光强梯度(2 000、1 600、1 200、1 000、800、600、400、300、200、150、100、50、25和0 μmol·m-2·s-1)。测定时,CO2浓度控制为400 μmol·mol-1,叶室温度设为20℃,相对湿度50%~60%。在每一光强下平衡150 s后自动记录净光合速率(Pn)等光合参数。每植株测定1片叶片,每处理各4次重复。
用光合助手软件(Photosyn Assistant, V1. 1, Dundee Scientific, UK)拟合光响应曲线[13],该软件应用的模型方程是非直角双曲线方程[14]。根据此方程计算最大净光合速率(Pmax)、光饱和点(LSP)、光补偿点(LCP)、光合量子效率(AQE)等光合参数。
1.2.5 叶绿素荧光参数 采用英国Technologica公司的叶绿素荧光快速成像系统Chlorophyll Fluorescence Imager(CFI)测定叶绿素荧光参数。待测叶片经暗适应30~60 min后置于样品台,调节测量光(0.5 μmol·m-2·s-1)测定初始荧光Fo,然后打开饱和脉冲光(6000 μmol·m-2·s-1,0.8 s)测定最大荧光Fm。当饱和脉冲光结束后,打开光化光(400 μmol·m-2·s-1),每20 s打开一次饱和脉冲光测定光下最大荧光Fm′、光化光下的稳态荧光Fs。据此,由仪器内部软件计算给出相关的叶绿素荧光参数,包括光下最小荧光F0′、光系统Ⅱ(PSⅡ)的最大量子效率(Fv/Fm)、开放的PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)、PSⅡ的实际量子产量效率(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)。连续测定340 s,监测各叶绿素荧光参数随时间变化的曲线变化。每植株测定1片叶片,每处理各4次重复。
1.3 数据处理
所有数据采用统计软件SPSS 16.0 for Windows软件包(SPSS Inc., Chicago, USA)进行分析,处理间比较采用方差分析和LSD检验。统计图采用SigmaPlot 11.0(Systat Software, Inc.)绘制。
2 结果与分析
2.1 试验区光合有效辐射日变化
试验区光合有效辐射(PAR)日变化如图1所示。其中,4月份昆明地区晴天PAR在9:00~16:00均具有较高值,中午自然光强(L0)最高可达1 851 μmol·m-2·s-1,而在50%(L1)、25%(L2)和15%(L3)自然光强下,一天之中最大光强分别为902、476和297 μmol·m-2·s-1。
2.2 遮荫对油用牡丹植株生长和叶表皮特征的影响
2.2.1 生长特征 表1显示,与全光照处理(L0)相比,遮荫处理(L1、L2和L3)使油用牡丹株高显著升高15.2%~20.5%(P<0.05),但L1、L2、L3处理间的株高没有显著差异;同时,油用牡丹花朵数量、果实鲜重、种子数量、种子鲜重均随遮荫程度的增加显现出逐渐下降趋势,且花朵数量和种子鲜重在L2和L3处理下显著低于全光照(L0)处理,而果实鲜重和种子数量则在L1、L2和L3处理下均比L0显著降低,且遮光处理间也有显著差异。另外,随着遮荫程度的增加,油用牡丹的比叶重(LMA)呈逐渐下降趋势,其在L1处理下与L0处理无显著差异(P>0.05),但在L2和L3处理下比L0处理显著降低。

L0.100%全光照;L1.50%全光照;L2.25%全光照;L3.15%全光照。下同图1 试验区光合有效辐射日变化L0.100% of full light;L1 .50% of full light;L2.25% of full light;L3. 15% of full light. The same as belowFig.1 Diurnal course of photosynthetically active radiation at the experimental area
从表1还可以看出,油用牡丹单位鲜重叶绿素a和叶绿素b含量均随着遮荫水平的增加呈先增加后降低的趋势,并均在L2处理下达到最大值,且各遮荫处理比全光照处理均有不同程度增加,但叶绿素a含量在不同处理间没有显著差异,叶绿素b含量仅L2处理与L0处理间具有显著差异。可见,遮荫显著抑制了油用牡丹的正常生长,且遮荫程度越重抑制越明显。
2.2.2 叶片表皮特征 经过对油用牡丹叶片上、下表皮进行观察,发现其上表皮均无气孔分布,下表皮气孔呈椭圆形(图2)。其中,4个光照处理油用牡丹
叶片的气孔密度变化范围在74.41~87.99个/mm2之间,并以全光照处理(L0)最大,且3个遮荫处理的气孔密度均显著低于L0处理,而遮荫处理间无显著差异;气孔器长度、气孔器宽度和单个气孔器面积(As)则是在L1处理下具有最大值,且其气孔器长度和单个气孔器面积与L0差异达到显著水平;随着遮荫水平的增加,油用牡丹叶片总的气孔面积百分比(At)呈逐渐降低趋势,且各遮荫处理均与全光照处理存在显著性差异,如L3处理的At仅为L0处理的80%(表2)。说明油用牡丹能够通过调整叶片的气孔分布和气孔大小来适应不同程度的遮荫环境。
2.3 遮荫对油用牡丹植株光合特性的影响
2.3.1 光合-光响应曲线及特征参数 由图3可知,当光合有效辐射(PAR)≤200 μmol·m-2·s-1时,4个光照处理油用牡丹植株的净光合速率(Pn)均随着PAR的增加迅速增加;当PAR>200 μmol·m-2·s-1后,各处理Pn随光照强度增加而变化幅度逐渐减缓;当PAR≥600 μmol·m-2·s-1后,各处理Pn均趋于稳定,且随着遮荫水平的增加,Pn值有逐渐降低的趋势(图3)。

表1 不同遮荫条件下‘凤丹’牡丹的生长指标和叶绿素含量比较
注:同一列不同字母表示不同光照处理之间差异显著(P<0.05);下同
Note: Different letters in the same column indicate significant differences among different shading treatments at 0.05 level. The same as below

图2 不同遮荫条件下‘凤丹’牡丹叶片气孔分布Fig.2 The distribution of stomata of of P. ostii under different shading treatments
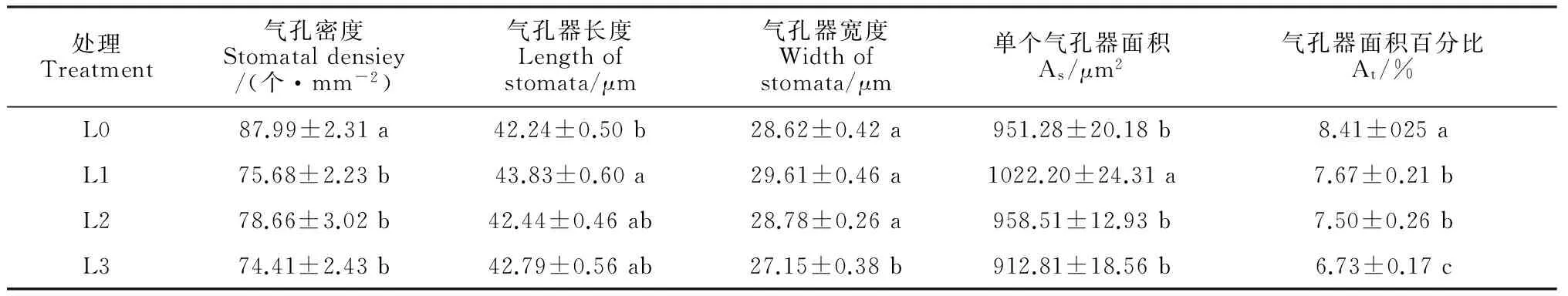
处理Treatment气孔密度Stomataldensiey/(个·mm-2)气孔器长度Lengthofstomata/μm气孔器宽度Widthofstomata/μm单个气孔器面积As/μm2气孔器面积百分比At/%L087.99±2.31a42.24±0.50b28.62±0.42a951.28±20.18b8.41±025aL175.68±2.23b43.83±0.60a29.61±0.46a1022.20±24.31a7.67±0.21bL278.66±3.02b42.44±0.46ab28.78±0.26a958.51±12.93b7.50±0.26bL374.41±2.43b42.79±0.56ab27.15±0.38b912.81±18.56b6.73±0.17c

表3 不同遮荫条件下‘凤丹’牡丹叶片光合特征参数

图3 不同遮荫条件下油用牡丹的光合-光响应曲线Fig.3 Photosynthesis-light response curves of P. ostii under different shading treatments

图4 不同遮荫条件下凤丹牡丹光系统Ⅱ最大量子效率(Fv/Fm)Fig.4 The maximum quantum efciency of photo system Ⅱ (Fv/Fm) of P. ostii under different shading treatments
另外,从光响应曲线模型拟合得到的光合特征参数(表3)来看,遮荫对油用牡丹的最大净光合速率(Pmax)、光补偿点(LCP)、光饱和点(LSP)和表观量子效率(AQE)均产生显著影响。而且,随着遮荫水平提高,油用牡丹叶片的Pmax、LCP、LSP均呈逐渐降低趋势,而AQE则呈逐渐升高趋势。其中,L1、L2和L3处理植株的Pmax分别比L0处理降低了3.71%、7.51%和15.93%,LCP则分别降低了47.06%、41.18%和52.94%,LSP则分别降低了5.55%、15.80%和35.34%,L3处理的降幅达到显著水平;同时,植株AQE则在L3处理中具有最高值,且显著高于L0、L1和L2处理,比L0处理显著升高44.23%。以上结果说明遮荫条件下,油用牡丹能够通过降低LCP、LSP,增加AQE来提高对弱光的利用效率以适应弱光环境,但遮荫环境对油用牡丹的光合作用仍然产生了一定的抑制作用,且遮荫程度越高,抑制作用越强。
2.3.2 叶绿素荧光参数 如图4所示,不同程度遮荫均使油用牡丹叶片光系统Ⅱ(PSⅡ)的最大量子效率(Fv/Fm)有所降低,但L1和L2处理的Fv/Fm值与对照L0没有显著差异,而L3处理植株的Fv/Fm值(0.76)显著低于L0、L1和L2处理,其比L0降低了4.54%(P<0.05)。
同时,如图5所示,遮荫还显著影响了油用牡丹叶片PSⅡ的实际量子效率(ΦPSⅡ)、PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)。首先,各光照处理植株的ΦPSⅡ均随光化光诱导时间逐渐增加,并有先快后慢趋势,且处理间存在差异。其中,当光化光诱导时间小于80 s时,随着光化光诱导时间的增加,4个光照处理植株的ΦPSⅡ快速增加;当光化光诱导时间大于80 s后,L3处理植株的ΦPSⅡ开始增加缓慢并趋于稳定,其ΦPSⅡ显著低于同期L0、L1和L2处理植株;当光化光诱导时间大于200 s后,L2植株的ΦPSⅡ增加幅度也逐渐变缓,其植株叶片的ΦPSⅡ低于同期L0和L1植株;当光化光诱导时间大于300 s后,L0和L1植株的ΦPSⅡ也趋于稳定,且此时L0处理具有最高的ΦPSⅡ(图5,A)。
其次,各光照处理叶片Fv′/Fm′随着光化光诱导时间的增加呈逐渐下降并最终趋于稳定的趋势,但处理间存在差异(图5,B)。其中,各处理Fv′/Fm′趋于稳定所需的光化光诱导时间表现为L3
再次,随着光化光诱导时间的增加,各光照处理叶片qP、NPQ均呈逐渐增加并趋于稳定的趋势,但值稳定后4个处理间的qP差异较小,而其NPQ则有较大差异;在相同的光化光诱导时间下,各光照处理qP明显以L1处理较低,其余处理间相近,而各处理NPQ则表现为L3≈L2>L1>L0(图5,C、D)。
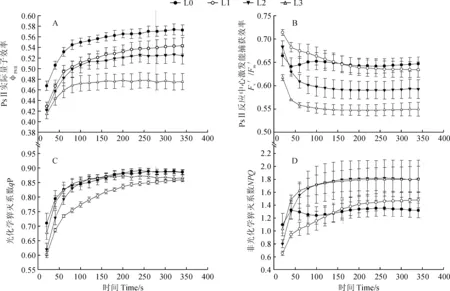
图5 不同遮荫条件下‘凤丹’牡丹叶片叶绿素荧光参数随时间的变化Fig. 5 The changes of chlorophyll fluorescence of P. ostii with time under different shading treatments
以上结果说明,遮荫条件下油用牡丹叶片的潜在量子效率有所降低,同步降低的还有PSⅡ反应中心的实际量子效率和光能捕获效率,而过剩的光能则主要以热耗散的方式被耗散。
3 结论与讨论
3.1 遮荫对油用牡丹生长的影响
植物在遮荫环境下形态的调整对于植株能否适应遮荫环境起到了至关重要的作用。为了最大程度地获取光照,植物往往会将同化的碳更多地分配于植株的垂直生长,从而出现株高增加的现象[15]。本研究中,遮荫对油用牡丹的株高产生了显著影响,遮荫处理L1、L2和L3植株的株高显著高于光照最强的L0处理;同时,L2和L3处理的花朵数量和种子鲜重显著低于L0处理,但L1处理与L0处理无显著差异,而果实鲜重和种子数量则随着遮荫水平的增加而降低,且4个不同遮荫处理间具有显著差异。说明与全光照生长的植株相比,遮荫后油用牡丹植株将更多的营养物质能量分配给株高的生长,而相应地分配到花朵、果实和种子的营养物质能量则相对减少。
叶片是植物进化过程中对环境变化敏感且可塑性较大的器官,在不同的选择压力下可形成各种适应类型,其结构特征最能体现环境因子对植物的影响或植物对环境的适应[16]。比叶重是表征植物生长过程中碳收获的叶性状指标,比叶重的调整是植物对遮荫环境做出的典型形态学反应[17]。本研究中,油用牡丹的比叶重(LMA)在遮荫条件下受到显著影响,并随着遮荫水平的增加呈逐渐下降趋势,光照较强的L0和L1处理的LMA无显著差异(P>0.05),但它们却与光照较弱的L2和L3处理间具有显著差异。油用牡丹LMA在弱光环境下降低,意味着相同生物量形成的叶面积较大,叶片较薄,从而增强了叶片的捕光能力。说明油用牡丹在遮荫条件下能够通过增加单位质量的叶面积来提高其光能捕获能力,弥补遮荫环境带来的光照不足,满足光合作用所需,保证一定的光合积累,从而有利于油用牡丹在弱光环境中的生长,这与前人的研究结论一致[18]。
叶片气孔是植物水分蒸腾的主要部位,气孔的大小和密度与植物的光合作用及水分利用效率密切相关。较大的气孔开度可使CO2更容易进入光合器官,水分更容易蒸发,能有效提高CO2进入光合器官和水分蒸发的速率,从而使植物具有较强的光合能力。一般来说,生长在高光强下的植物通常比低光强下的植物具有较高的气孔密度,弱光环境下叶片气孔密度减小、气孔开张度显著降低[19-20]。本研究也得到相类似的结果,随着遮荫水平的增加,油用牡丹叶片气孔密度和气孔器面积百分比呈逐渐下降趋势,光照最强的L0处理植株具有最高的气孔密度和气孔器面积百分比,并与其余3个遮荫处理间具有显著差异。气孔密度和气孔导度共同控制着植物的水分、气体交换,L0处理植株较高的气孔密度和气孔器面积百分比暗示其与外界水分、气体交换频率较高,植株的生理代谢活动较强,这可能是L0处理植株具有较高光饱和光合速率的原因之一,同时也表明油用牡丹能通过调整叶片气孔的分布来适应不同的遮荫环境。
3.2 遮荫对油用牡丹光合特性的影响
光饱和点和光补偿点是衡量植物需光特性的重要生理指标,分别代表植物对光强耐受性的上限和下限,其范围可以反映植物对光能的利用能力[21]。在自然光下(L0处理),油用牡丹的光饱和点在660 μmol·m-2·s-1左右,光补偿点在13.6 μmol·m-2·s-1左右。本研究中,L0处理中午的光合有效辐射最强在1900 μmol·m-2·s-1左右,其光强在较长时间内大大高于L0处理植株的光饱和点,与其余3个遮荫处理相比,L0处理植株具有最高的净光合速率;同时,试验水平内的强光产生的过剩光能并没有对其光合器官产生严重损伤,其光合作用并没有表现出明显的光抑制。结果暗示油用牡丹植株对强光具有较强的耐受性和适应性,应属阳生植物。
随着遮荫水平的增加,油用牡丹通过降低光饱和点和光补偿点、增加表观量子效率来适应弱光环境。在弱光环境下,较低的光饱和点、光补偿点和较高的表观量子效率意味着植物在光照有限的条件下能够以最大能力利用低光量子通量,进行最大可能的光合作用,从而利于在较弱光强下进行有机物的积累,满足遮荫环境下植株的正常生长,是植物对遮荫环境的适应性表现[22]。光照不仅是植物进行光合作用的原动力,光照强度还会影响温度和湿度等与植物光合作用密切相关的环境因子,如高光强往往引起温度上升和湿度下降,而适度的遮荫可以在一定程度上缓解水分亏缺和避免强光伤害,从而有利于光合作用的进行。前人的研究也表明,适当遮荫的林缘生境和林窗生境是油用牡丹最适宜的生长环境[2,9]。本研究中,L1处理的光强较为接近油用牡丹的光饱和点,其净光合速率和光饱和点与L0处理无显著差异,而遮荫程度较高的L2和L3处理的光强最高分别能达到480和300 μmol·m-2·s-1左右,远没有达到油用牡丹的光饱和点,不能满足光饱和需求,其净光合速率也较L0处理显著下降,光照严重不足可能是抑制L2和L3处理植株光合作用的主要因子。
叶绿素荧光可以反映光能吸收、激发能传递和光化学反应等的差异,在研究植物光合机制及植物光合作用对外界环境胁迫的响应中发挥了重要作用[23]。首先,Fv/Fm值表示PSⅡ最大光化学效率,反映PSⅡ的原初光能转化效率,常被用来作为环境胁迫程度的指标和探针。非胁迫条件下Fv/Fm值通常在0.80~0.85之间,胁迫条件下该参数明显下降[24-26]。本研究中,油用牡丹Fv/Fm值在L0、L1和L2处理间没有显著差异,其值为0.80左右,处于Fv/Fm值的正常范围内。过度遮荫处理(L3)油用牡丹植株的Fv/Fm值为0.76,显著低于L0、L1和L2处理,说明遮荫后油用牡丹叶片PSⅡ的潜在量子效率有所降低。其次,Fv′/Fm′和ΦPSⅡ分别表示开放的PSⅡ反应中心的激发能捕获效率和PSⅡ的实际量子效率。随着光化光诱导时间的增加,油用牡丹叶片Fv′/Fm′逐渐降低,ΦPSⅡ则逐渐增加,并在诱导一段时间后趋于稳定。Fv′/Fm′、ΦPSⅡ稳定后其大小表现为L0>L1>L2>L3,说明遮荫降低了油用牡丹叶片PSⅡ反应中心的光能捕获效率和实际量子效率,这可能是遮荫植株光合能力降低的又一主要原因。第三,光化学猝灭系数(qP)是对PSⅡ原初电子受体QA氧化状态的一种量度,反映PSⅡ天线色素吸收的光能用于光化学电子传递的份额,在一定程度代表PSⅡ反应中心开放程度[27]。而非光化学猝灭系数(NPQ)反映PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,它对光合机构起一定的保护作用,是抵御光破坏的主要途径之一[28]。本研究中,随着光化学诱导时间的增加,油用牡丹叶片qP逐渐增加,但qP稳定后不同处理间没有显著差异,说明遮荫对油用牡丹叶片PSⅡ的电子传递活性影响不大;同时,随着光化光诱导时间的增加,NPQ逐渐增加并趋于稳定,且随着遮荫水平的增加,NPQ逐渐增加,又说明在400 μmol·m-2·s-1的光强下,遮荫植株的过剩光能较大,其以热耗散方式耗散光能的作用增大。
综上所述,油用牡丹是阳生植物,它在遮荫条件下能够通过增加株高、减少花朵和种子数量、降低比叶重和气孔密度等形态结构方面的调整来适应遮荫环境,同时还可以通过降低光补偿点和光饱和点等光合生理方面的调整来尽可能多地捕获光能及提高对弱光的利用率。然而,过度遮荫(15%自然光强)会严重抑制油用牡丹的净光合速率,Fv/Fm、ΦPSⅡ和Fv′/Fm′显著下降,NPQ显著上升,且与产量直接相关的花朵数量和种子数量显著下降,最终造成严重减产。据此建议:在油用牡丹的生产栽培过程中,可以采取适当的遮荫措施以创造其最适宜的生长光环境,但遮荫网密度不能过大,应根据各地的光照条件和天气状况进行调整。综合考虑,在云南昆明地区50%~100%之间的自然光可能是油用牡丹较为合适的生长光强。
[1] 张 涛,高天姝,白瑞英,等.油用牡丹利用与研究进展[J].重庆师范大学学报(自然科学版),2015,32(2):143-149.
ZHANG T, GAO T S, BAI R Y,etal. Utilization and research progress of oil tree peony[J].JournalofChongqingNormalUniversity, (Natural Science), 2015,32(2): 143-149.
[2] 张衷华,唐中华,杨逢建,等.两种主要油用牡丹光合特性及其微环境影响因子分析[J].植物研究,2014,34(6):770-775.
ZHANG Z H, TANG Z H, YANG F J,etal. Photosynthetic characteristics and its micro-environmental limiting factors of two main oil peony[J].BulletinofBotanicalResearch, 2014,34(6): 770-775.
[3] ALERIC K M, KIRKMAN L K. Growth and photosynthetic responses of the federally endangered shrub,Linderamelissifolia, to varied light environments[J].AmericanJournalofBotany, 2005,92(4): 682-689.
[4] SOFO A, DICHIO B, MONTA G. Shade effect on photosynthesis and photoinhibition in olive during drought and rewatering[J].AgriculturalWaterManagement, 2009,96(8): 1 201-1 206.
[5] PANDEY S K, SINGH H, SINGH J S. Species and site effects on leaf traits of woody vegetation in a dry tropical environment[J].CurrentScience, 2009,96(8): 1 109-1 114.
[6] 王 雁.北京市主要园林植物耐荫性及其应用的研究[D].北京:北京林业大学,1996.
ZHU Y, SONG H, ZHAO S W. Effect of shading treatment on photosynthetic characteristics and flower quality ofPaeoniasuffruticosa[J].ActaBotanicaBoreali-OccidentaliaSinica,2012,32(4): 731-738.
[8] 郑国生,何秀丽.夏季遮荫改善大田牡丹叶片光合功能的研究[J].林业科学,2006,42(4):27-32.
ZHENG G S, HE X L. Studies on the photosynthetic improvement in the leaves of field tree peony through shading treatment in summer[J].ScientiaSilvaeSinicae, 2006,42(4): 27-32.
[9] 周曙光,孔祥生,张妙霞,等.遮光对牡丹光合及其他生理生化特性的影响[J].林业科学,2010,46(2):56-60.
ZHOU S G, KONG X S, ZHANG M X,etal. Effects of shading on photosynthesis and other physiological and biochemical characteristics in tree peony[J].ScientiaSilvaeSinicae, 2010,46(2): 56-60.
[10] 左利娟,成仿云,张佐双.光照强度对牡丹生长发育的影响[J].东北林业大学学报,2009,37(1):27-29.
ZUO L J, CHENG F Y, ZHANG Z S. Effects of light intensity on growth and florescence of tree peonies[J].JournalofNortheastForestryUniversity, 2009,37(1): 27-29.
[11] INSKEEP W P, BLOOM P R. Extinction coefficients of chlorophyll a and b in N, N-dimethylformamide and 80% acetone[J].PlantPhysiology, 1985,77: 483-485.
[12] JAMES S A, BELL D T. Leaf morphological and anatomical characteristics of heteroblasticEucalyptusglobulusssp.globulus(Myrtaceae)[J].AustralianJournalofBotany, 2001,49(2): 259-269.
[13] ROTHSTEIN D E, ZAK D R. Photosynthetic adaptation and acclimation to exploit seasonal periods of direct irradiance in three temperate, deciduous-forest herbs[J].FunctionalEcology, 2001,15(6): 722-731.
[14] PRIOUL J L, CHARTIER P. Partitioning of transfer and carboxylation components of intercellular resistance to photosynthetic CO2fixation: a critical analysis of the methods used[J].AnnalsofBotany, 1977,41(4): 789-800.
[15] 薛思雷,王庆成,孙欣欣,等.遮荫对水曲柳和蒙古栎光合生长和生物量分配的影响[J].植物研究,2012,32(3):354-359.
XUE S L, WANG Q C, SUN X X,etal. Effects of shading on the photosynthetic characteristics, growth, and biomass allocation inFraxinusmandshuricaandQuercusmongolica[J].BulletinofBotanicalResearch, 2012,32(3): 354-359.
[16] AASAMAA K, SOBER A, RAHI M. Leaf anatomical characteristics associated with shoot hydraulic conductance, stomatal conductance and stomatal sensitivity to changes of leaf water status in temperate deciduous trees[J].AustralianJournalofPlantPhysiology, 2001,28(8): 765-774.
[17] 张 林,罗天祥.植物叶寿命及其相关叶性状的生态学研究进展[J].植物生态学报,2004,28(6):844-852.
ZHANG L, LUO T X. Advances in ecological studies on leaf lifespan and associated leaf traits[J].ActaPhytoecologicaSinica, 2004,28(6): 844-852.
[18] 刘泽彬,程瑞梅,肖文发,等.遮荫对中华蚊母树苗期生长及光合特性的影响[J].林业科学,2015,51(2):129-136.
LIU Z B, CHENG R M, XIAO W F,etal. Effects of shading on growth and photosynthetic characteristics ofDistyliumchinenseseedlings[J].ScientiaSilvaeSinicae, 2015,51(2): 129-136.
[19] 贺安娜,林文强,姚 奕.遮荫对虎耳草光合生理特性的影响[J].植物研究,2012,32(6): 657-661.
HE A N, LIN W Q, YAO Y. Effect of shading on the photosynthetic characteristics ofSaxifragestoloniferaCurt[J].BulletinofBotanicalResearch, 2012,32(6): 657-661.
[20] 眭晓蕾,毛胜利,王立浩,等.辣椒幼苗叶片解剖特征及光合特性对弱光的响应[J].园艺学报,2009,36(2):195-208.
SUI S L, MAO S L, WANG L H,etal. Response of anatomical structure and photosynthetic characteristics to low light in leaves of capsicum seedlings[J].ActaHorticulturaeSinica, 2009,36(2): 195-208.
[21] 尚海琳,李方民,林 玥,等.桃儿七光合生理特性的地理差异研究[J].西北植物学报,2008,28(7):1 440-1 447.
SHANG H L, LI F M, LIN Y,etal. Photosynthetic characteristics ofSinopodophllumhexandrumfrom different distribution areas in China[J].ActaBotanicaBoreali-OccidentaliaSinica, 2008,28(7): 1 440-1 447.
[22] 解小娟,杨晓红,陈晓阳.遮荫对转BADH基因的美丽胡枝子叶片形态和光合特性的影响[J].林业科学,2013,49(3):33-42.
XIE X J, YANG X H, CHEN X Y. Effects of shading on leaf shape and photosynthetic characteristics of the transgenicLespeezaformosawith expressingBADHgene[J].ScientiaSilvaeSinicae, 2013,49(3): 33-42.
[23] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence: A practical guide[J].JournalofExperimentalBotany, 2000,51(345): 659-668.
[24] LICHTENTHALER H K, BABANI F, LANGSDORF G. Chlorophyll fluorescence imaging of photosynthetic activity in sun and shade leaves of trees[J].PhotosynthesisResearch, 2007,93(1-3): 235-244.
[25] 寇伟锋,刘兆普,陈铭达,等.不同浓度海水对油葵幼苗光合作用和叶绿素荧光特性的影响[J].西北植物学报,2006,26(1):73-77.
KOU W F, LIU Z P, CHEN M D,etal. Effect of sea water at different concentrations on the photosynthesis and chlorophyll-fluorescence properties of oil sunflower seedlings[J].BotanicaBoreali-OccidentaliaSinica, 2006,26(1): 73-77.
[26] 许大全.光合作用效率大全[M].上海:科学技术出版社,2002:33.
[27] MAO L Z, LU H F, WANG Q,etal. Comparative photosynthesis characteristics ofCalycanthuschinensisandChimonanthuspraecox[J].Photosynthetica, 2007,45(4): 601-605.
[28] MULLER P, LI X P, NIYOGI K K. Non-photochemical quenching. A response to excess light energy[J].PlantPhysiology, 2001,125(4): 1 158-1 166.
(编辑:裴阿卫)
Effects of Shading on Growth and Photosynthetic Characteristics of Oil Peony
CAI Yanfei1,2, 3,4, LI Shifeng1,2, 3,4, WANG Jihua1,2, 3,4,XIONG Cankun5, SONG Jie1,2, 3,4, LI Shufa1,2, 3,4*
(1 National Engineering Research Center for Ornamental Horticulture, Kunming 650205, China; 2 Flower Research Institute, Yunnan Academy of Agricultural Sciences, Kunming 650205, China; 3 Key Lab of Yunnan Flower Breeding, Kunming 650205, China; 4 Yunnan Flower Research and Development Center, Kunming 650205, China; 5 Yunnan Ge-sang Flower Co., Ltd., Shangri-La, Yunnan 650000)
The growth,photosynthesis and chlorophyll fluorescence parameters of oil peony were measured under 100% of full light (L0), 50% of full light (L1), 25% of full light (L2) and 15% of full light (L3), respectively. The results showed that: (1) the number of flowers, leaf dry mass per unit area (LMA) and stomatal density of L0 treatment were significantly higher than that of L2 and L3, but there was no significant difference with L1 treatment; With the increase of shading levels, the number of seed, stomatal area percentage decreased gradually and there was significant difference among treatments; (2) the photosynthetic rate (Pmax), light compensation point (LCP) and light saturation point (LSP) decreased with the increase of shading;Pmaxand LSP of L0 treatment were significantly higher than that of L2 and L3, but there was no significant difference with L1 treatment; (3) the maximum quantum efficiency of photosynthetic system Ⅱ (Fv/Fm) of L3 treatment was 0.76, which was significantly lower than that of other treatments; With the increase of induction time by actinic light, the induction time by actinic light (Fv′/Fm′) decreased gradually and tended to be stable; the PSⅡ quantum yield efficiency (ΦPSⅡ), photochemical quenching (qP) and non photochemical quenching (NPQ) increased gradually and tended to be stable. The order ofFv′/Fm′ andΦPSⅡ after stable was L0>L1>L2>L3, while NPQ was L3>L2>L1>L0, and there was no significant difference in qP among treatments. It is indicated that over shading (15%-25% of full light) severely inhibited the net photosynthetic rate of oil peony, and the number of flowers and seeds which directly related to the yield was also significantly decreased, resulting in a serious reduction in production. Therefore, 50%-100% of full light may be more suitable for the growth of oil peony in Kunming area, Yunnan.
oil peony; shade; growth; photosynthetic characteristics; chlorophyll fluorescence
1000-4025(2016)08-1623-09
10.7606/j.issn.1000-4025.2016.08.1623
2016-05-13;修改稿收到日期:2016-07-13
国家科技支撑计划项目‘高山特色花卉高效生产技术集成’(2015BAD10B03);“科技部创新人才推进计划”中青年科技创新领军人才配套项目(2014HE002)
蔡艳飞(1982-),女,副研究员,主要从事植物生理生态适应性研究。E-mail:caiyanfei1013@126.com
*通信作者:李树发,硕士,研究员,主要从事植物栽培及遗传育种相关研究。E-mail:lsf206498@126.com
Q945.79
A
