陆地棉GhCDPK1基因响应干旱胁迫的功能初探
2016-10-14田晓涵张梦丹庞学兵祝建波朱新霞
田晓涵,张梦丹,庞学兵,祝建波,朱新霞
(石河子大学 生命科学学院 农业生物技术重点实验室, 新疆石河子 832000)
陆地棉GhCDPK1基因响应干旱胁迫的功能初探
田晓涵,张梦丹,庞学兵,祝建波,朱新霞*
(石河子大学 生命科学学院 农业生物技术重点实验室, 新疆石河子 832000)
钙依赖性蛋白激酶(CDPKs)是一类重要的钙信号感受蛋白和响应蛋白,在植物干旱、低温、盐碱等非生物胁迫应答中起着重要的调控作用。为探讨陆地棉GhCDPK1基因在干旱胁迫下所起的作用,该研究利用实时荧光定量PCR技术分析了PEG模拟干旱胁迫下该基因的表达量,发现GhCDPK1基因受干旱胁迫诱导。通过构建植物表达载体pCAMBIA2300-GhCDPK1,采用农杆菌介导的叶盘法转化模式植物烟草,发现干旱胁迫下转基因植株保水能力明显高于野生型植株,叶绿素、脯氨酸、可溶性蛋白含量及POD、SOD活性也高于野生型植株,而丙二醛含量低于野生型植株。研究结果表明,GhCDPK1基因作为正向调控因子响应干旱胁迫诱导,过表达GhCDPK1基因可以使植株积累更多的渗透调节物质、增强抗氧化系统酶的活性和维持细胞膜的稳定性来提高植物抵御外界干旱胁迫的能力。
陆地棉;GhCDPK1;干旱胁迫;表达分析;转基因
干旱、极端温度和土地盐渍化等非生物逆境严重地影响植物生长发育和农作物产量,造成全世界作物产量损失30% ~ 50%,其中干旱对作物产量的影响最大[1],干旱可以导致植物细胞脱水、膜系统和酶系统遭到破坏、严重时引起细胞代谢紊乱、功能丧失,甚至造成植株死亡。棉花是新疆主要的经济作物,由于新疆典型的干旱、半干旱气候特征,加之土壤盐碱化、倒春寒、秋季霜冻等不利环境因素很大程度上影响棉花的产量和品质,给棉花生产造成巨大损失。因此,研究棉花的抗逆基因及其耐逆分子机制,对提高棉花抗逆性十分必要。
钙依赖性蛋白激酶(calcium-dependent protein kinases, CDPKs)是植物细胞钙信号转导的主要感受器和效应器[2-3],能够通过与形式多样的底物相互作用,参与植物对干旱、盐和低温胁迫的响应。前人研究发现过表达AtCDPK1可以提高植株对低温、高盐、ABA胁迫的耐受能力,但对高温胁迫敏感[4];AtCPK10、AtCPK8、AtCPK4和AtCPK11的T-DNA插入突变体比野生型对干旱胁迫敏感,过表达AtCPK10、AtCPK8、AtCPK4和AtCPK11可以显著提高植株的抗旱能力[5-7];AtCPK23的T-DNA插入突变体比野生型对干旱和盐胁迫具有更强的耐受能力,过表达AtCPK23的植株对干旱和盐胁迫很敏感[8];干旱和盐胁迫能够诱导AtCPK6的表达,过表达AtCPK6能够提高植物的抗旱和耐盐能力,但AtCPK6的T-DNA插入突变体在干旱和盐胁迫处理下和野生型没有显著差异[9],这说明拟南芥CDPKs在植物耐受非生物胁迫过程中,既可能是正向调节因子,也可能是负向调节因子,CDPK成员间还存在功能冗余现象。研究还发现在水稻中过表达OsCPK9可以提高植株的抗旱能力[10],过表达OsCPK4可以增强水稻抵抗盐胁迫和干旱胁迫的能力[11],在拟南芥中异源过表达葡萄ACPK1基因能提高转基因植株抗旱保水能力[12]。
到目前为止,陆地棉中仅有少量有关CDPK/CPK基因功能的报道,其中GhCPK1基因参与调控棉花纤维的发育[13-14];GhCDPK5能够应答盐胁迫的诱导,在盐胁迫信号传导路径中发挥作用[15];用探针在相关基因芯片上检测发现干旱和碱胁迫下,GhCDPK2、GhCDPK3、GhCDPK11、GhCDPK14、GhCDPK16及GhCDPK28基因表达量增加[16], 但陆地棉其它CDPKs基因在非生物胁迫中的功能还未见报道。在前期通过RT-PCR技术成功克隆得到陆地棉GhCDPK1基因的基础上,本研究利用实时荧光定量PCR技术分析GhCDPK1基因在干旱胁迫下的表达水平,通过构建植物过表达载体,在模式植物烟草中异位表达来探讨该基因在干旱胁迫下所起的作用,分析转基因植株在干旱及复水处理下渗透调节物质、抗氧化酶活性和细胞膜稳定性变化,为进一步研究陆地棉GhCDPK1基因的功能、探索其参与棉花抗旱机制奠定基础。
1 材料和方法
1.1 实验材料
陆地棉‘新陆早33’(GossypiumhirsutumL.cv. Xinluzao 33)种子由新疆石河子农业科学研究院棉花研究所提供;野生型(wild type, WT)烟草(NicotianatabacumL.)‘NC89’由新疆石河子大学农业生物技术重点实验室保存。
1.2 方 法
1.2.1 棉花GhCDPK1基因干旱胁迫下的表达 采用盆栽法培养棉花幼苗,待幼苗长至3片真叶时,取长势一致的植株,用含20% PEG6000(W/V)的MS液体培养基浸根,分别取处理0、1、3、6、12和24 h棉花叶片,液氮速冻,-70 ℃保存备用。参照RNA提取试剂盒(艾德莱生物公司)说明书分别提取对照CK和胁迫处理样品的RNA,采用cDNA合成试剂盒(北京全式金公司)合成cDNA,以GhCDPK1 -q为引物(北京六合华大基因合成,表1),根据SYBR Green Ⅰ Master Mix (Roche公司)进行基因扩增,以UBQ7为内参基因,分析GhCDPK1基因在不同时间干旱胁迫下的表达情况。反应程序为:94 ℃预变性5 min;94 ℃变性15 s,56 ℃退火30 s,72 ℃延伸30 s,40个循环。每个样品重复3次,采用2-ΔΔCt法对数据进行分析。
1.2.2 植物表达载体的构建 根据植物表达载体pCAMBIA2300(本实验室保存)和GhCDPK1基因的酶切位点设计引物(表1),用带酶切位点引物进行PCR扩增,反应程序为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 30 s,30个循环,72 ℃延伸7 min,4 ℃保存。用1%琼脂糖凝胶电泳检测扩增产物,获得的目的片段回收纯化(Tiangen生物公司)后,与pMD19-T载体(大连Takara公司)进行连接,转化E.coilDH5α感受态细胞,筛选经过PCR及质粒酶切鉴定的阳性克隆,送上海生工生物工程有限公司进行测序。
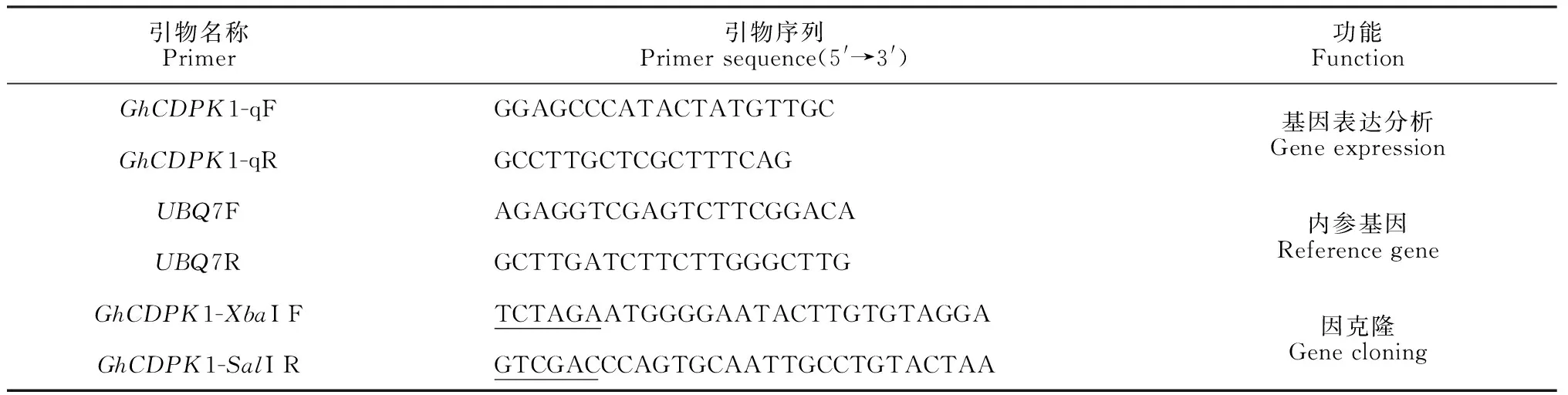
表1 本实验所用引物
利用质粒提取试剂盒(Tiangen生物公司)提取序列无误的pMD19-GhCDPK1质粒与植物表达载体pCAMBIA2300的质粒,用XbaI和SalI(Promega公司)分别进行双酶切,回收纯化(Tiangen生物公司)酶切产物后,用T4DNA连接酶(Promega公司)16℃过夜连接,转化E.coilDH5α感受态细胞,通过菌液PCR对阳性重组子初步筛选,同时提取质粒,进行双酶切鉴定,获得的阳性克隆命名为pCAMBIA2300-GhCDPK1。
1.2.3 烟草转化及分子鉴定 将pCAMBIA2300-GhCDPK1重组质粒通过电击法转入农杆菌GV3101(本实验室保存)感受态细胞,叶盘法转化烟草‘NC89’,暗培养2 d后,转入含有卡那霉素的分化筛选培养基,约15 d继代1次,待叶片边缘长出愈伤、叶片开始卷曲并分化出大量丛生芽后,移入生根培养基中最终获得抗性再生植株。待根系发达后移栽入营养土中,幼苗长至7~8片叶片时,用改良的CTAB法小量提取烟草基因组DNA,进行PCR检测,提取PCR检测结果为阳性的烟草植株以及受体烟草的总RNA,采用RT-PCR检测目的基因的转录水平。
1.2.4 转GhCDPK1基因烟草的干旱胁迫 选取长势相近、生长约2个月的野生型和T0代转基因烟草株系,实验前均充分浇水,待托盘无水分进出时开始计时,进行自然干旱处理。连续12 d不浇水,第13 d复水,试验共进行15 d。观察并记录不同时期烟草表型,取第0、6、9、12天及复水1、3 d烟草叶片,根据张志良等[17]方法进行叶绿素、脯氨酸、可溶性蛋白、丙二醛含量及过氧化物酶和超氧化物歧化酶活性的测定。试验设3个重复,每个指标重复测定3次。
2 结果与分析
2.1 GhCDPK1基因在干旱胁迫下的表达分析
qRT-PCR结果表明,GhCDPK1基因受干旱胁迫诱导表达。20% PEG6000胁迫处理1 h,GhCDPK1基因表达迅速上调,并且达到最大值,为对照的2.10倍;随着处理时间的延长,表达量降为初始水平;12 h后表达逐渐增强,此时表达量为初始的1.68倍;24 h后表达量下降(图1)。推测GhCDPK1基因可能主要在逆境胁迫初期和后期起作用。
2.2 植物表达载体的鉴定
用带酶切位点引物进行PCR扩增,获得了目的基因片段(图2)。利用XbalⅠ和SalⅠ酶切pMD19-GhCDPK1质粒和植物表达载体pCAMBIA2300质粒,酶切产物回收纯化后,连接转入DH5α感受态细胞,重组阳性质粒经双酶切鉴定,获得1 764 bp目的基因片段(图3),确定目的基因GhCDPK1已整合到pCAMBIA 2300载体上。
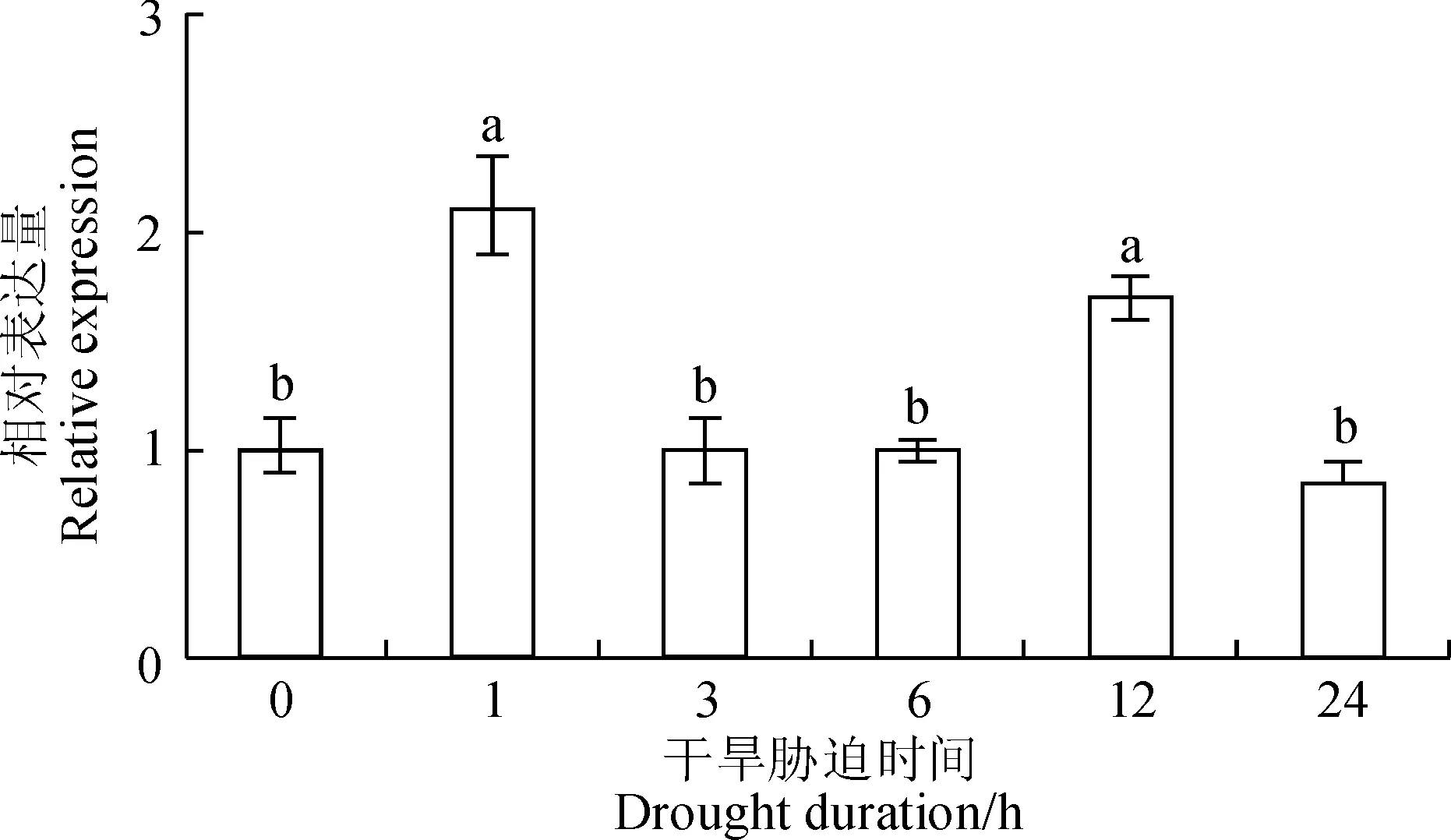
不同小写字母表示处理间在0.05水平显著性差异图1 胁迫下GhCDPK1基因的表达分析Different letters indicate significant difference among treatments at 0.05 levelFig. 1 Analysis of GhCDPK1 gene expression under drought stress
2.3 转基因烟草的获得及鉴定
将重组质粒pCAMBIA2300-GhCDPK1叶盘法转化烟草,筛选获得抗性再生植株。移栽生长2月后提取植株基因组DNA,进行PCR检测(图4),阳性结果植株提取叶片RNA进行RT-PCR鉴定(图5),筛选出的转基因烟草植株用于后续生理指标的测定。

M. 250 bp DNA Ladder marker; 1. PCR产物图2 PCR产物电泳图M. 250 bp DNA Ladder marker; 1. PCR productsFig. 2 The products of PCR amplification

M. Trans 5K DNA marker;1、2. 酶切产物; 3. 质粒对照图3 重组质粒的双酶切鉴定M. Trans 5K DNA marker; 1,2. Double enzyme digestion products; 3. Plasmid controlFig. 3 Double enzyme digestion of recombinant plasmid
2.4 转基因烟草抗旱性分析
2.4.1 干旱胁迫下转基因烟草表型变化 如图6所示,正常生长状态下,转基因株系植株叶片较野生型略大(图6,A);断水前期并无明显差异,但胁迫9 d后,野生型烟草基部叶片出现轻度萎蔫,逐渐变黄,而转基因株系叶片正常伸展,受影响较小;干旱胁迫12 d,野生型烟草整株萎蔫,此时转基因株系基部叶片开始下垂萎蔫并变黄,但萎蔫程度轻(图6,B);复水1 d后,野生型烟草顶部嫩芽出现缓解,转基因株系均能得到一定恢复,顶部幼嫩叶片开始完全伸展(图6,C)。由此可见,转GhCDPK1基因烟草在干旱胁迫实验中表现出更强的抗旱性。
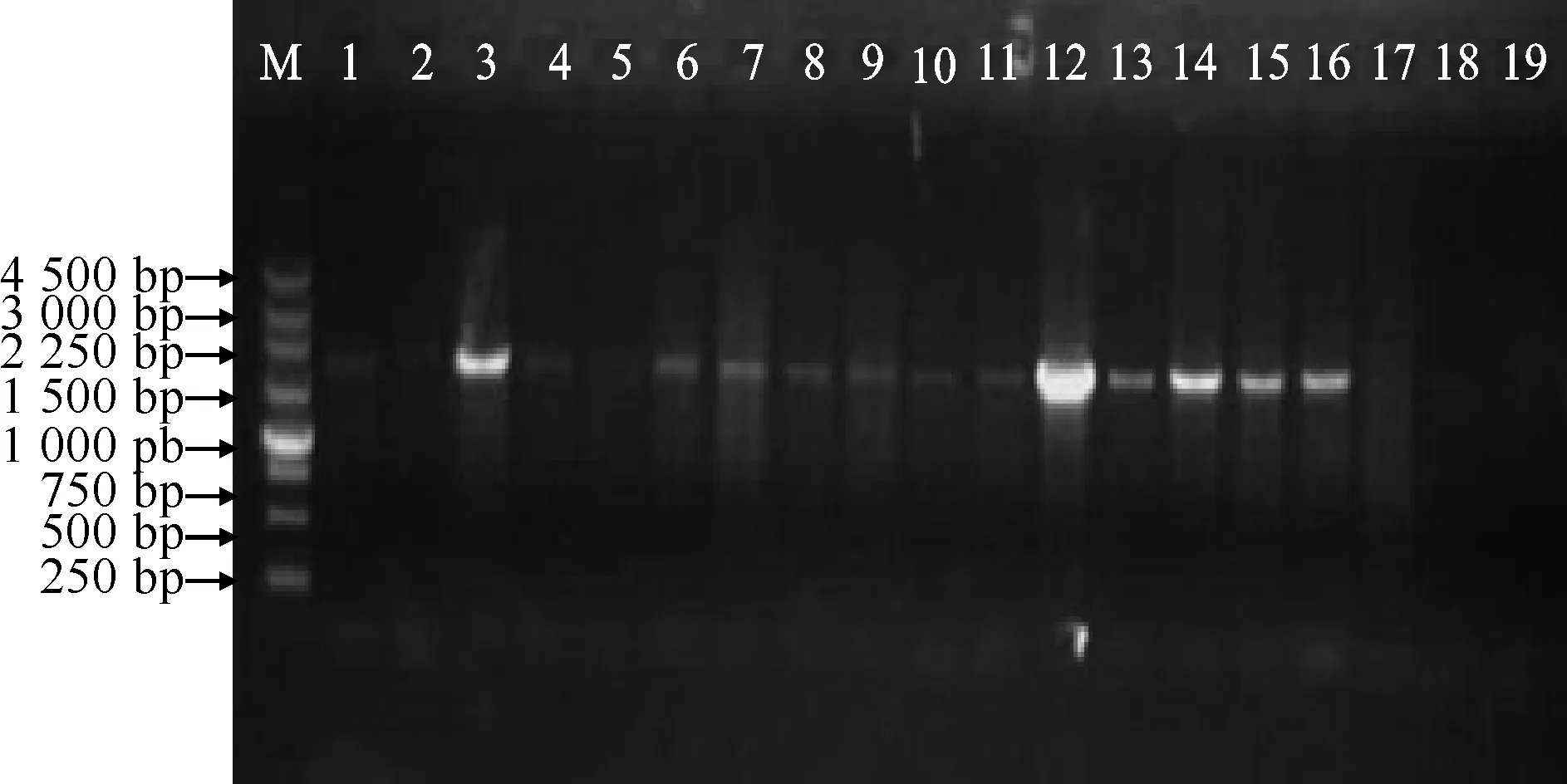
M. 250 bp DNA Ladder marker;1~16. 转基因植株; 17~19. 野生型植株图4 转基因烟草PCR检测M. 250 bp DNA Ladder marker;1-16. Transgenic plants;17-19. Wild type tobaccoFig. 4 PCR identification of transgenic plants
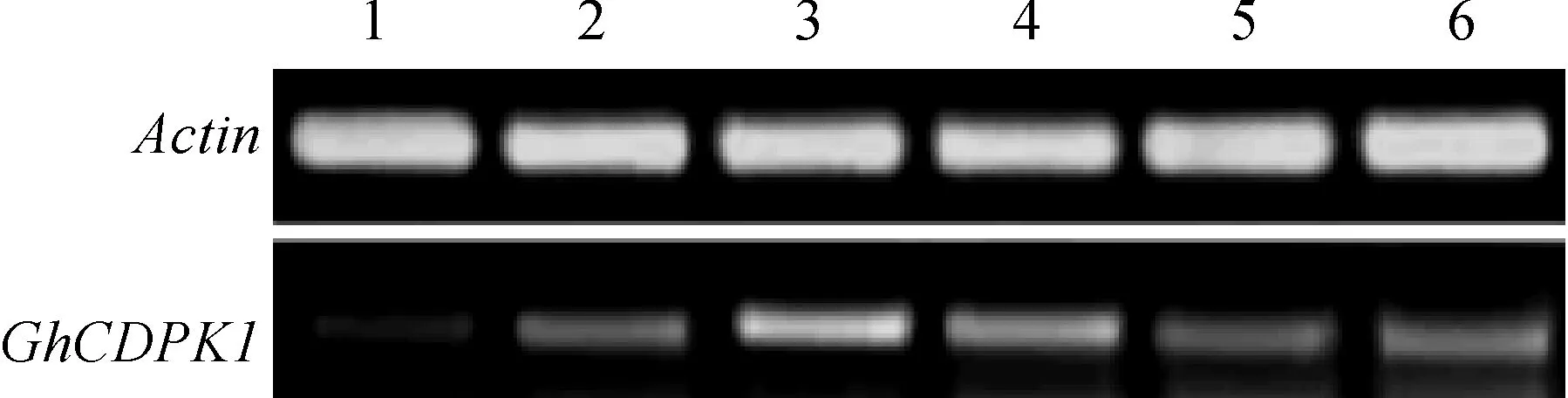
1~6. 转基因植株图5 转基因烟草RT-PCR检测1-6. Transgenic plantsFig. 5 RT-PCR identification of transgenic plants

A. 正常生长状态烟草;B. 断水12 d; C. 复水1 d;Line1、Line 2. 2个不同株系转基因烟草图6 野生型和转基因烟草干旱胁迫下的形态特征A. Normal states of WT and transgenic tobacco; B. Withheld watering for 12 d; C. Recovered for 1 d; Line 1 and Line 2. Two different lines of transgenic tobaccoFig. 6 The phenotypes of WT, line 1 and line 2 under drought stress
2.4.2 干旱胁迫下转基因烟草生理指标变化 干旱胁迫过程中,植物的叶绿素含量降低,光合作用减弱,最终导致植物的生长发育迟缓或停滞。从图7, A可以看出,胁迫前期,野生型和转基因型烟草的叶绿素含量差异不明显。在断水6 d前,盆中土壤未干透,并未对植株造成干旱胁迫,所以植株叶绿素含量持续上升;随着胁迫时间的延长,野生型和转基因型烟草的叶绿素含量均开始下降,但转基因株系的含量始终显著高于野生型;胁迫第12 d,两者叶绿素含量均达到最低值;复水后,野生型和转基因烟草叶绿素含量均开始上升。
干旱、盐碱、低温等逆境胁迫下,脯氨酸大量积累,其含量与植物的抗逆性呈正相关。由图7,B可以看出,正常生长条件下,转基因株系脯氨酸含量较野生型烟草高;干旱胁迫过程中,野生型和转基因株系脯氨酸含量均逐渐增加,且转基因型脯氨酸含量显著高于野生型;复水后,二者脯氨酸含量均呈现下降趋势。
从图7,C来看,干旱胁迫下,转基因和野生型烟草的可溶性蛋白含量均增加,且转基因的含量高于野生型。胁迫前9 d,转基因和野生型烟草的可溶性蛋白含量差异不大;12 d时,转基因株系可溶性蛋白含量是0 d的1.87倍,野生型为初始的1.66倍;复水1 d后,转基因可溶性蛋白含量是野生型的1.27倍,达到极显著水平。

A.叶绿素含量; B.脯氨酸含量; C.可溶性蛋白含量;D.丙二醛含量; E.POD活性; F.SOD活性*和**分别表示相关性达显著(P<0.05)和极显著(P<0.01)水平图7 干旱胁迫对野生型(WT)和转GhCDPK1基因烟草部分生理指标的影响A.Chlorophyll concentration;B.Proline content;C.Soluble protein content;D.MDA content; E.POD activity;F.SOD activity;* and ** indicate significant correlation at 0.05 and 0.01 level,respectivelyFig. 7 Physiological analyses of WT and GhCDPK1 tobacco measured under drought stress
植物受到干旱胁迫后,体内产生的活性氧将细胞膜过氧化产生丙二醛(MDA),所以MDA指标直接反映细胞膜的损伤程度。正常生长的野生型和转基因烟草MDA含量差别不大;随着干旱时间的增加,野生型和转基因株系烟草叶片MDA含量逐渐增加,但是野生型含量明显高于转基因型;复水后,转基因株系MDA含量也低于野生型。这说明转基因烟草株系较转基因型细胞膜受损程度较小,自我修复能力较强(图7,D)。
从图7, E来看,野生型烟草POD活性起初极显著高于转基因型,但在胁迫过程中,上升程度较为平缓;转基因株系POD活性在胁迫过程中持续上升,胁迫6 d时与野生型含量相当,随后显著高于野生型株系。图7 ,F SOD活性显示,正常状态下,野生型和转基因型烟草SOD活性并无明显差异;胁迫6 d时,转基因和野生型烟草SOD活性相当;胁迫12 d时,转基因烟草SOD活性为野生型的1.18倍,达到极显著水平;随着胁迫时间增加,野生型和转基因烟草SOD活性呈现不同的变化趋势,胁迫9 d后,野生型烟草SOD活性开始下降,但转基因型SOD活性骤升,为野生型的2倍;复水后,二者SOD活性均下降。
3 讨 论
植物对逆境胁迫应答反应是一个涉及多基因、多信号传导途径及多基因表达产物的复杂过程,这一过程涉及到植物对逆境胁迫信号的感知、逆境胁迫信号的传递、相应受体对逆境胁迫信号的识别与转导以及相关抗逆基因的表达等[17]。逆境胁迫信号会导致细胞质内Ca2+浓度发生变化,CDPK因具有独立的激酶结构域和类似于钙调素的钙离子结合域,可以直接感知和结合Ca2+,把Ca2+信号转换成磷酸化信号,并在细胞内放大和传递[18],进一步调控下游抗逆基因的转录表达,启动相应的生理生化代谢、离子和水分跨膜运输等,以减轻或避免胁迫对植物造成伤害。
CDPKs在植物中数量众多、功能多样化。过表达AtCPK6可提高拟南芥的脯氨酸含量以及一些抗逆相关基因的表达,参与盐及干旱胁迫诱导过程[9],过表达AtCPK10的拟南芥叶片叶绿素含量以及植株的抗旱能力均得到提高[5];过表达OsCDPK7基因可以通过调控下游胁迫响应基因salT、rabl6A等来参与干旱、冷害及盐害胁迫响应,增强转基因植株对干旱、冷害及盐害的耐性[19];过表达水稻OsCPK12和OsCPK21可提高过氧化氢酶、ROS以及NADPH氧化酶的积累,参与调控盐、ABA及稻瘟病的抗逆响应[20,21]。
实时定量PCR结果显示,GhCDPK1基因受干旱胁迫诱导表达。推测在干旱胁迫过程中,胞质钙离子浓度发生变化,GhCDPK1能迅速感知干旱胁迫和钙信号,诱导和启动干旱信号转导途径的传递。对转GhCDPK1基因烟草在干旱胁迫下的形态特征及生理指标进行观察和测定,发现转基因植株长势均优于野生型,叶绿素、脯氨酸、可溶性蛋白含量及POD、SOD活性高于野生型植株,而丙二醛含量低于野生型植株,这些研究结果与前人对AtCPK6、AtCPK6、OsCPK12和OsCPK21研究结果相似,说明过表达GhCDPK1基因可以使转基因植株积累可溶性蛋白、脯氨酸等渗透调剂物质来降低细胞的渗透势,同时POD和SOD活性增强,清除干旱胁迫产生的活性氧,维持生物膜的稳定性从而降低干旱胁迫对质膜的伤害,使转基因植株的保水能力显著增强。由于CDPKs基因家族拥有较多成员,不同CDPK基因成员对干旱胁迫的表达模式可能不同,为了在陆地棉中挖掘耐旱相关关键CDPK基因,需要克隆更多的CDPK基因来研究它们的功能,而有关GhCDPK1如何调控干旱胁迫的下游相关基因表达,也有待进一步研究。
本研究在陆地棉中克隆得到一个受干旱胁迫诱导表达的钙依赖蛋白激酶基因GhCDPK1,过表达GhCDPK1基因可以使植株积累更多的渗透调节物质、增强抗氧化系统酶的活性和细胞膜的稳定性,显著提高植物对干旱逆境条件的适应性。
[1] LOBELL D B, SCHLENKER W, COSTA-ROBERTS J. Climate trends and global crop production since 1980[J].Science, 2011, 333(6 042): 616-620.
[2] BOUDSOCQ M, SHEEN J. CDPKs in immune and stress signaling[J].TrendsinPlantScience, 2013, 18(1): 30-40.
[3] BOUDSOCQ M, WILLMANN M R, MCCORMACK M,etal. Differential innate immune signalling via Ca2+sensor protein kinases[J].Nature, 2010, 464(7287): 418-422.
[4] 卢慧星. 拟南芥AtCDPK1参与非生物胁迫响应和ABA信号途径的证据[D].呼和浩特: 内蒙古农业大学, 2009.
[5] ZOU J J, WEI F J, WANG C,etal.Arabidopsiscalcium-dependent protein kinaseCPK10 functions in abscisic acid and Ca2+-mediated stomatal regulation in response to drought stress[J].PlantPhysiol., 2010, 154(3): 1 232-1 243.
[6] ZOU J J, LI X D, RATNASEKERA D,etal.ArabidopsisCALCIUM-DEPENDENT PROTEIN KINASE8 and CATALASE3 function in abscisic acid-mediated signaling and H2O2homeostasis in stomatal guard cells under drought stress[J].PlantCell, 2015, 27(5): 1 445-1 460.
[7] ZHU S Y, YU X C, WANG X J,etal. Two calcium-dependent protein kinases,CPK4 andCPK11, regulate abscisic acid signal transduction inArabidopsis[J].PlantCell, 2007, 19: 3 019-3 036.
[8] MA S Y, WU W H.AtCPK23 functions inArabidopsisresponses to drought and salt stresses[J].PlantMol.Biol., 2007, 65(4): 511-518.
[9] XU J, TIAN Y S, PENG R H,etal.AtCPK6, a functionally redundant and positive regulator involved in salt/drought stress tolerance inArabidopsis[J].Planta, 2010, 231(6): 1 251-1 260.
[10] WEI S, HU W, DENG X,etal. A rice calcium-dependent protein kinaseOsCPK9 positively regulates drought stress tolerance and spikelet fertility[J].BMCPlantBiol., 2014, 14(1): 1-13.
[11] CAMPO S, BALDRICH P, MESSEGUER J,etal. Overexpression of a calcium-dependent protein kinase confers salt and drought tolerance in rice by preventing membrane lipid peroxidation[J].PlantPhysiol., 2014, 165(2): 688-704.
[12] YU X C, ZHU S Y, GAO G F,etal. Expression of a grape calcium-dependent protein kinaseACPKlinArabidopsisthalianapromotes plant growth and confers abscisic acid-hypersen-sitivity in germination, postgermination growth, and stomatal movement[J].PlantMol.Biol., 2007, 64(5): 531-538.
[13] HUANG Q S, WANG H Y, GAO P,etal. Cloning and characterization of a calcium dependent protein kinase gene associated with cotton fiber development[J].PlantCellRep., 2008, 27(12): 1 869-1 875.
[14] WANG H, MEI W, QIN Y,etal. 1-Aminocyclopropane carboxylic acid synthase is phosphorylated by calcium-dependent protein kinase 1 during cotton fiber elongation[J].ActaBiochim.Biophys.Sin. (Shanghai),2011,43(8): 654-661.
[15] 甄军波, 张 曦, 王玉美,等. 棉花盐胁迫应答基因GhCPK5的克隆及序列分析[J]. 中国农业大学学报, 2011, 16(3):8-14.
ZHEN J B, ZHANG X, WANG Y M,etal.. Isolation and sequence analysis of salt responsive geneGhCPK5 fromGossypiumhisutumL[J].JournalofChinaAgriculturalUniversity, 2011, 16(3): 8-14.
[16] 张志良, 瞿伟菁. 植物生理学实验指导[M] .北京: 高等教育出版社, 2003: 70-73.
[17] 裴丽丽, 郭玉华, 徐兆师,等. 植物逆境胁迫相关蛋白激酶的研究进展[J]. 西北植物学报, 2012, 32(5):1 052-1 061.
PEI L L, GUO Y H, XU Z S,etal.. Research progress on Stres related protein kinases in plants[J].ActaBot.Boreal. -occident.Sin., 2012, 32(5): 1 052-1 061..
[18] TAKAHASHI Y, ITO T. Structure and Function of CDPK: A Sensor Responder of Calcium Signaling and Communication in Plants[M]. 2011, 129-146.
[19] SAIJO Y, HATA S, KYOZUKA J,etal. Over-expression of a single Ca2+-dependent protein kinase confers both cold and alt/drought tolerance on rice plants[J].PlantJ., 2000, 23(3):319-327.
[20] ASANO T, HAYASHI N, KOBAYASHI M,etal. A rice calcium-dependent protein kinaseOsCPK12 oppositely modulates salt-stress tolerance and blast disease resistance[J].PlantJ., 2012, 69(1):26-36.
[21] ASANO T, HAYASHI N, KOBAYASHIi M,etal. Functional characterisation ofOsCPK21, a calcium-dependent protein kinase that confers salt tolerance in rice[J].PlantMol.Biol., 2011,75(2):179-191.
(编辑:宋亚珍)
Preliminary Exploration for Function of CottonGhCDPK1 Gene under Drought Stress
TIAN Xiaohan, ZHANG Mengdan, PANG Xuebing, ZHU Jianbo, ZHU Xinxia*
(College of Life Science, Shihezi University, Shihezi, Xinjiang 832000, China)
CDPKs(calcium-dependent protein kinases) are important calcium signal receptors and response proteins, which play important roles in response to various abiotic stresses in plants, such as drought, low temperature and salinity. To study the effect of cottonGhCDPK1 gene to drought stress, this study used quantitative real-time PCR to analyze the gene expression under PEG stress. The results showed thatGhCDPK1 gene was up-regulated by drought stress. Moreover, plant expression vector was constructed andGhCDPK1 gene was introduced into tobacco byAgrobacturium-mediated leaf disk transformation method to identify the gene function. The results showed that after drought stress, the water retention capacity of transgenic plants was significantly higher than that of wild type plants; the contents of chlorophyll, proline, soluble protein and the activities of POD and SOD in transgenic tobacco plants were higher than that of wild type, whereas the content of MDA was lower than that of wild type plants. These results indicate thatGhCDPK1 gene, as a positive regulator, was induced by drought stress, and over-expression ofGhCDPK1 gene can enhance the ability of plants to resist drought stress by accumulating more osmotic adjustment substances, enhancing the activity of the antioxidant system and maintaining the stability of the cell membrane.
cotton;GhCDPK1; drought stress; expression analysis; transgenosis
1000-4025(2016)08-1515-07
10.7606/j.issn.1000-4025.2016.08.1515
2016-05-17;修改稿收到日期:2016-07-26
国家大学生创新计划(201510759017);新疆生产建设兵团新疆特色植物基因资源研究与利用创新团队(2014CC005); 石河子大学育种专项(gxjs2014-yz04)
田晓涵(1990- ),女,硕士研究生,主要从事环境生物技术研究。E-mail: 723745781@qq.com
*通信作者:朱新霞,副研究员,主要从事植物生物技术和棉花分子育种研究。E-mail: zhuxxshz@126.com
Q785; Q789
A
