马尾松毛虫质型多角体病毒非结构蛋白p44在Bac-to-Bac系统中的表达和亚细胞定位
2016-10-13彭晗王洪秀王金昌关丽梅靳亮万翠香
彭晗王洪秀王金昌关丽梅靳亮万翠香
(1. 南昌大学生命科学与食品工程学院,南昌 330077;2. 江西省农业科学院农业应用微生物研究所,南昌 330200;3. 江西省科学院微生物研究所,南昌 330029)
马尾松毛虫质型多角体病毒非结构蛋白p44在Bac-to-Bac系统中的表达和亚细胞定位
彭晗1王洪秀2王金昌3关丽梅3靳亮3万翠香1
(1. 南昌大学生命科学与食品工程学院,南昌 330077;2. 江西省农业科学院农业应用微生物研究所,南昌 330200;3. 江西省科学院微生物研究所,南昌 330029)
为探寻马尾松毛虫质型多角体病毒(DpCPV 1)p44蛋白的功能,构建了DpCPV 1基因组S8片段的原核表达体系,表达纯化蛋白后免疫家兔制备了多克隆抗体。利用Bac-to-Bac杆状病毒表达系统,构建了3种重组的杆状病毒质粒(Bacmid-p44、Bacmid-p44-eGFP和Bacmid-eGFP)。转染昆虫细胞Sf9进行表达,通过Western blot检测和蛋白的亚细胞定位观察。Western blot检测结果显示,Bacmid-S8在昆虫细胞Sf9中表达实际蛋白的大小为35 kD,比在原核系统中表达的蛋白(44 kD)略小;利用激光共聚焦显微镜观察p44-eGFP的融合蛋白的亚细胞定位发现,融合p44的绿色荧光蛋白(eGFP)主要聚集在细胞质中,而未融合的eGFP则分布于整个细胞,说明 DpCPV 1的p44蛋白定位于细胞质中。
马尾松毛虫质型多角体病毒;多克隆抗体;真核表达;细胞定位
昆虫质型多角体病毒(cypovirus,CPV)属于呼肠孤病毒科,质型多角体病毒属。根据病毒基因组dsRNA片段在聚丙烯酰胺或琼脂糖凝胶中电泳图谱的差异,目前CPV已被分为20个电泳型[1,2]。马尾松毛虫质型多角体病毒(dendrolimus punctatus cytoplasmic polyhedrosis Virus 1,DpCPV 1)属于1型,该病毒基因组S8片段编码一个由390个氨基酸组成、分子量为43.78 kD的非结构蛋白(p44),是我国的特有种类,于1973年首次分离得到[3]。
随着结构生物学与信息处理等新技术的运用与发展,包括X射线晶体衍射、低温电镜与三维重构技术,质型多角体病毒结构学研究方面已取得突破性进展[4]。Yu等[5]利用低温电子显微镜技术在分辨率上研究了衣壳蛋白的三维结构,在与基因组直接作用的区域中观察到螺旋与β发卡结构之间的构象改变,同时发现了特有的加帽结构和释放通道。Cheng等[6]通过低温电子显微镜研究发现,CPV的五聚体塔状蛋白的酶区域是拓扑结构高度保守并且有5个连接着鸟苷酰基转移酶和甲基转移酶区域的独特的通道;通过氨基酸序列推理,LPP是由S7片段编码P50蛋白修饰后得到的。Yang等[7]研究发现:当CPV病毒粒子进行转录时,衣壳蛋白VP1A、VP1B和塔状蛋白VP3构象发生变化,衣壳空间扩大和塔状蛋白周围通道的加宽,使得基因组RNA从紧凑的病毒粒子衣壳更加灵活的转录和输出。
相对CPV结构蛋白的深入研究,CPV非结构蛋白的研究相对缓慢。文力[8]、张万菊[9]等对DpCPV 1基因组中的第9片段(S9)的编码序列进行了cDNA克隆和序列测定,并对NS5蛋白的表达和功能进行了初步分析。汪洋等[10]研究发现由DpCPV基因组第9片段编码的非结构蛋白NS5蛋白在感染昆虫细胞时,定位在昆虫细胞的细胞膜上。段兵[11]和胡建芳等[12]对马尾松毛虫CPV基因组第8片段进行序列分析和原核表达。凝胶迁移阻抑分析(EMSA)显示,由CPV基因组第8片段编码的p44蛋白具有序列非特异性的ssRNA结合活性,不与dsRNA、ssDNA、dsDNA结合;进一步研究发现p44氨基酸序列116-197 aa之间的区域(富含谷氨酸区域)为单一的RNA结合区域[13]。
目前,质型多角体病毒S8片段编码的非结构蛋白p44蛋白的真核表达和昆虫细胞上定位研究还未见报道。本研究利用Bac-to-Bac杆状病毒表达系统,构建重组Bacmid-S8-eGFP和Bacmid-S8,将DpCPV 1 S8片段和绿色荧光蛋白基因(eGFP)以C端融合的方式在昆虫Sf9细胞中进行融合表达及细胞定位,旨在为下一步非结构蛋白p44在CPV复制过程中的功能研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 细胞系、菌种及质粒 草地贪夜蛾(Spodoptera frugiperda)细胞系Sf9由中国科学院武汉病毒所昆虫病毒基因工程学科组提供,于27℃培养,生长培养基为Grace's昆虫细胞培养基(10%胎牛血清)。大肠杆菌(Escherichia coli)DH5α、BL21和DH10B菌株均为本实验室保存;载体pMD18-T vector系统、T4 DNA Ligase及其buffer购自宝生物工程(大连)有限公司,载体pET-28a、pFastBacDual、pFastBacDual-eGFP(GFP片段插入在PstⅠ和HindⅢ酶切为点之间)和DpCPV 1基因序列S8片段为本实验室保存。
1.1.2 主要试剂 DM2000 DNA Marker 购自康为世纪生物科技有限公司;DNA MarkerⅢ购自东盛生物科技有限公司产;预染蛋白Marker购自南京生兴生物技术公司;异丙基-β-D硫代半乳糖苷(IPTG)购自武汉贝特生物公司;Ni-NTA His.BindTMResins购自Novagen公司;其余药品均为国产分析纯以上。转染试剂lipofectin 购自Invitrogen公司(美国);荧光染料 Hoechst 33258 购自 Biosharp公司(美国);PVDF膜购自Millipore公司(美国);PCR纯化试剂盒购自Promega公司(上海);质粒提取试剂盒购自Promega公司(上海)。
1.1.3 引物合成 根据DpCPV 1基因组S8片段的核苷酸序列,设计引物;除通用引物M13F 和M13R(Cat. No. N530-02,Invitrogen公司,美国)外,其余引物均由上海生工生物工程技术服务有限公司合成。引物列表,见表1。
1.2 方法
1.2.1 以实验室保存的DpCPV病毒基因组S8为模板,以pTS8F、pTS8R为引物,利用两步法进行RT-PCR扩增[14]。PCR扩增的片段通过相应的酶切位点酶切,连接到原核表达载体pET-28a(pET28a-S8)。将阳性重组质粒转化大肠杆菌感受态细胞BL21,1 mmol/L的IPTG于37℃诱导表达4 h。收集菌体,经超声破碎后离心,获得包涵体蛋白。用8 mol/L的尿素溶液溶解包涵体蛋白,然后通过Ni-NTA树脂柱进行蛋白纯化。将收集的洗脱流出液装入透析袋,对含适量甘油的0.01 mol/L PBS pH8.0透析48 h,每4-8 h更换一次PBS溶液。然后,将上述透析袋包埋在聚乙二醇粉末中,对蛋白溶液进行浓缩。并为下一步制备抗体做准备。

表1 PCR扩增产物所需引物列表
1.2.2 抗体制备 纯化的目的蛋白常规方法(淋巴加皮下注射)免疫家兔,制备抗血清。实验兔、鼠饲养,抗原注射及最终采血均委托武汉爱博泰克生物科技有限公司进行。
1.2.3 重组Bacmid病毒的构建及PCR检测 以pFS8-1F、pFS8-1R和pFS8-2F、pFS8-2R为引物,以pET28a-S8载体为模板进行PCR扩增。将上述胶回收的S8片段分别连接到pFastBacDual和pFastBacDual-eGFP载体上。依照质粒提取试剂盒说明书中介绍的方法,分别提取质粒。酶切鉴定阳性克隆子,分别命名为pFastBac-S8和pFastBac-S8-eGFP。
将pFastBac-S8、pFastBac-S8-GFP和pFastBac-Dual空载体(用作对照)分别转座到含有AcBacmid和helper质粒的DH10B感受态细胞,涂布于LA培养基平板[含50 μg/mL卡那霉素(kanamycin,Kana),7 μg/mL庆大霉素(gentamicin,Gm),10 μg/mL四环素(tetracycline,Tetra),100 μg/mL 5溴-4-氯-3-吲哚-β-D-乳糖苷(5-bromo-4-chloro-3-indolyl- β-D-galactoside,X-gal)和40 μg/mL异丙-β-D-硫代吡喃半乳糖苷(thiogalactopyranoside,IPTG)],于37℃培养24-48 h。检查平板上的蓝白斑,白斑即重组Bacmid的菌落。挑取白色单菌落,接种于5 mL LB培养基,37℃振荡培养14 h。取出3 mL于10 000×g 离心10 min,抽提重组Bacmid质粒。抽提Bacmid质粒的具体方法参考Bac-to-Bac®Baculovirus Expression Systems手册的3.5节。
以上述提取的重组Bacmid为模板,以通用引物M13F和M13R以及目的片段上两端的引物(表1)进行PCR检测。鉴定正确的重组Bacmid分别命名为Bacmid-p44、Bacmid-p44-eGFP和Bacmid-Dual,于4℃冰箱中保存。
1.2.4 重组病毒转染昆虫细胞 Sf9在35 mm的培养皿中接种5×105的Sf9 细胞,27℃培养过夜。在生物安全柜中弃去上层培养基,加入2 mL无血清的培养基室温放置1 h。取5 μg重组Bacmid质粒以及6 μL脂质体(Invitrogen,美国),分别用无血清培养基稀释至100 μL,将两者混合。静置15-40 min 后,向脂质体和DNA的混合液中加入800 μL培养基,混匀,移入35 mm培养皿中,培养6 h。移去转染液,添加2 mL含10%血清的培养基,混匀,培养72 h后倒置荧光显微镜下观察是否有荧光信号。离心回收上清,即为P1病毒贮液,4℃避光保存。
按照2×106个细胞/孔的量将Sf9细胞转入35 mm的培养皿中,贴壁生长至少1 h。每孔加入适量的上述P1病毒贮液,27℃湿盒孵育72 h。500×g离心5 min取上清,即为P2病毒贮液。重复上述方法扩增P3病毒贮液,用于重组Bacmid的高效表达。
1.2.5 Western blot 检测 取P3病毒贮液感染Sf9细胞,72 h后将细胞吹起,500×g离心5 min,取适量细胞沉淀,加50 μL的SDS-PAGE上样buffer,进行SDS-PAGE电泳后转膜,以p44蛋白多克隆抗体为一抗,辣根过氧化酶标记的羊抗兔的血清(武汉博士德生物工程有限公司)为二抗,用Western blot法检测p44蛋白的表达。
1.2.6 p44的亚细胞定位 用P2病毒贮液感染贴壁生长24 h的Sf9细胞(覆盖玻底培养皿50%),27℃培养24 h,移除细胞培养基,用PBS(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH7.4)将细胞洗1遍,加入4%多聚甲醛(北京赛驰生物科技有限公司)(过滤除菌)室温静置固定15 min,再用PBS(pH7.4)将细胞洗1遍;加入透化液[0.25% TritonX-100(上海索莱宝生物科技有限公司)],室温静置10 min;用PBS(pH7.4)洗涤细胞,加荧光染料hoechst 33258染核5-10 min,然后用PBS洗3遍,再加入1 mL PBS。激光共聚焦显微镜(TCS SP2,Leica,德国)观察绿色荧光分布情况。
1.2.7 序列统计分析与系统发育树构建 将DpCPV 1基因组S8片段,放入NCBI上进行Blast序列比对(http://www.ncbi.nlm.nih.gov/BLAST/)。根据已经公开的CPV的S8片段进行比对,利用Mega4.0分析软件进行聚类分析,并采用软件 ClustalW和PHYLIP3.67的邻近法构建系统发育树,其核酸和氨基酸序列比对的bootstrapping数值分别为0.01和0.2。
2 结果
2.1 DpCPV 1基因组S8片段和其编码非结构蛋白p44的系统发育分析
通过系统发育树分析,DpCPV 1 基因组S8片段与舞毒蛾质型多角体病毒(LdCPV 1)基因组S8片段具有最高的序列同源性(99%),与另外两株DPCPV(AY211092.1和AF389469.1)序列同源性均为98%;分别与3株家蚕质型多角体病毒(BmCPV 1)Strain H、Strain I和Strain suzhou 对应片段的同源性为84%、83%和81%(图1)。

图1 DpCPV1基因组S8片段的核酸系统发育树
DpCPV 1 S8片段编码非结构蛋白p44的系统发育树分析显示:p44蛋白与LdCPV 1、BmCPV 1 strain H和冬尺蠖蛾质型多角体病毒(ObCPV 18)的相应非结构蛋白氨基酸序列同源性分别为99%、85%和 35%。另外,我们检测到了p44蛋白与3株鞘脂菌属(Sphingobium)细菌的氨基脱氧分枝酸裂解酶(aminodeoxychorismate lyase)有27%的氨基酸序列同源性(图2)。
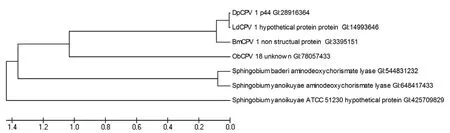
图2 DpCPV 1非结构蛋白p44的系统发育树
2.2 DpCPV S8片段的分子克隆和抗体制备
以pTS8F和pTS8R为正反向引物,以DpCPV 1基因组S8片段为模板进行RT-PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,扩增片段大小约为1 170 bp(图3-A)。将S8连接至pET28a载体上,构建表达质粒。用BamHⅠ和Hind III双酶切验证正确后(图3-B),命名为pET28a-S8。经测序,将鉴定正确的克隆质粒pET28a-S8转化大肠杆菌BL21,加IPTG诱导后离心收集菌体,进行SDSPAGE分析。结果(图4)显示,检测到插入的S8片段的载体有相应蛋白的表达,蛋白大小约为51 kD。因插入的S8片段后面携带了一个His纯化标签(大小约7 kD),所以实际插入S8片段表达的蛋白大小为44 kD,与p44蛋白大小相符。
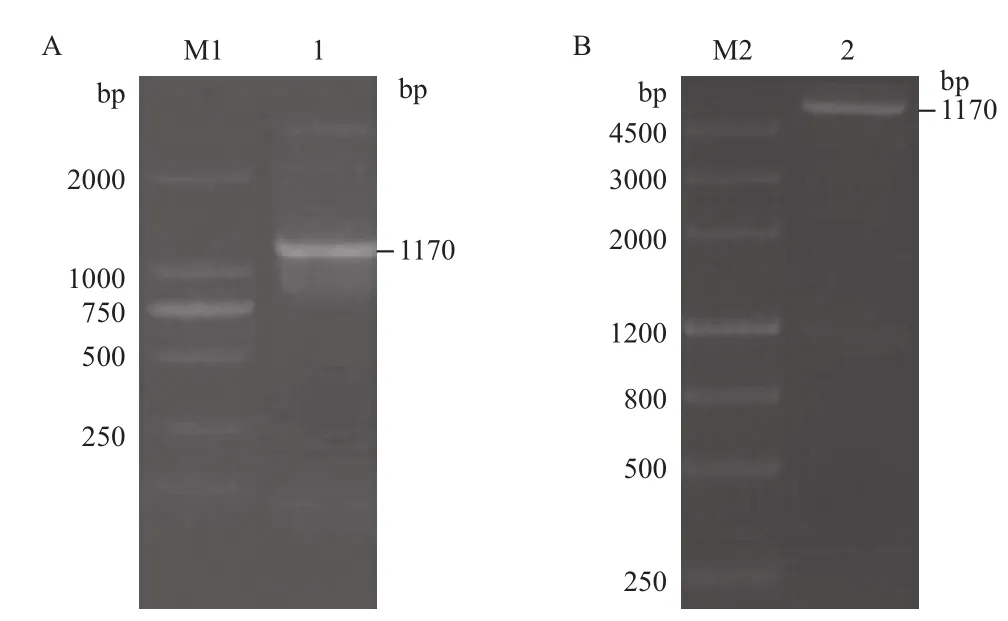
图3 S8原核表达载体的构建
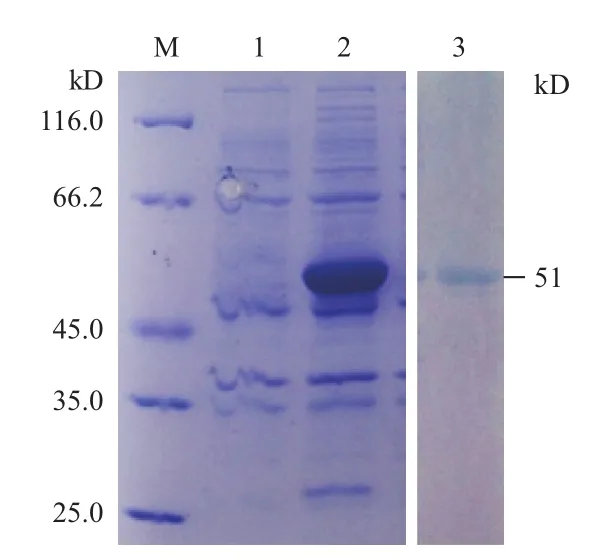
图4 SDS-PAGE检测p44诱导表达结果
通过His纯化标签经Ni-NTA纯化树脂纯化包涵体的目的蛋白后,所得纯化蛋白免疫家兔,制备p44蛋白的多克隆抗体 anti-p44。
2.3 重组病毒载体构建
将S8片段克隆至pFastBac-eGFP和pFastBac-Dual质粒上,构建载体。用XhoⅠ和KpnⅠ双酶切验证后,分别命名为pFast-S8和pFast-S8-eGFP(图5)。分别将pFast-S8、pFast-S8-eGFP和pFastBacDual(空载对照)转座到DH10B感受态细胞,经培养后提取并鉴定正确的Bacmid DNA(图6)。
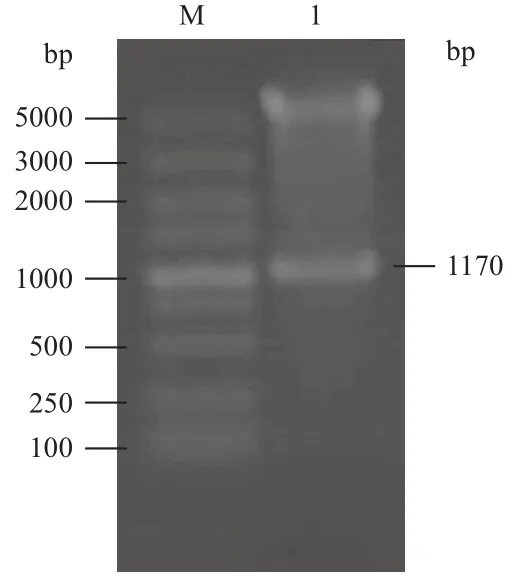
图5 酶切验证pFast-S8
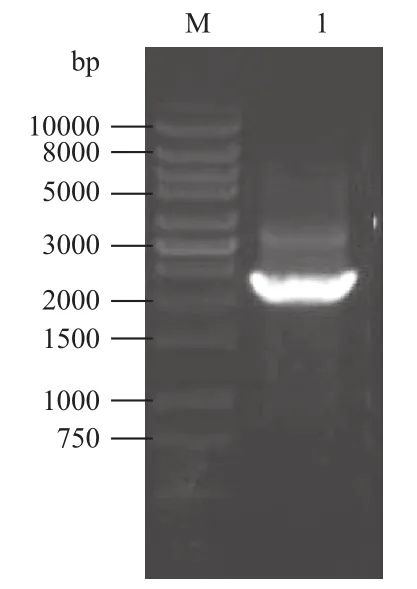
图6 Bac-S8的PCR验证
2.4 p44的真核表达的Western blot 检测
用构建的重组Bacmid-S8病毒转染Sf9 细胞,经SDS-PAGE检测蛋白的表达情况(图7-A)。然后以anti-p44为一抗,HRP标记的羊抗兔血清抗体为二抗,经Western blot检测DpCPV 1 S8编码蛋白p44在昆虫细胞Sf9内表达情况。结果(图7-B)显示,Bacmid-S8感染的Sf9细胞(第1泳道)在35 kD处有明显条带,而空白的Sf9细胞(第3泳道)和经Bacmid-S7感染的Sf9细胞(第2泳道)作为阴性对照,未检测出条带。第1泳道检测到的条带是p44蛋白的真核表达蛋白,大小为35 kD,但是比原核表达的p44蛋白小了9 kD。
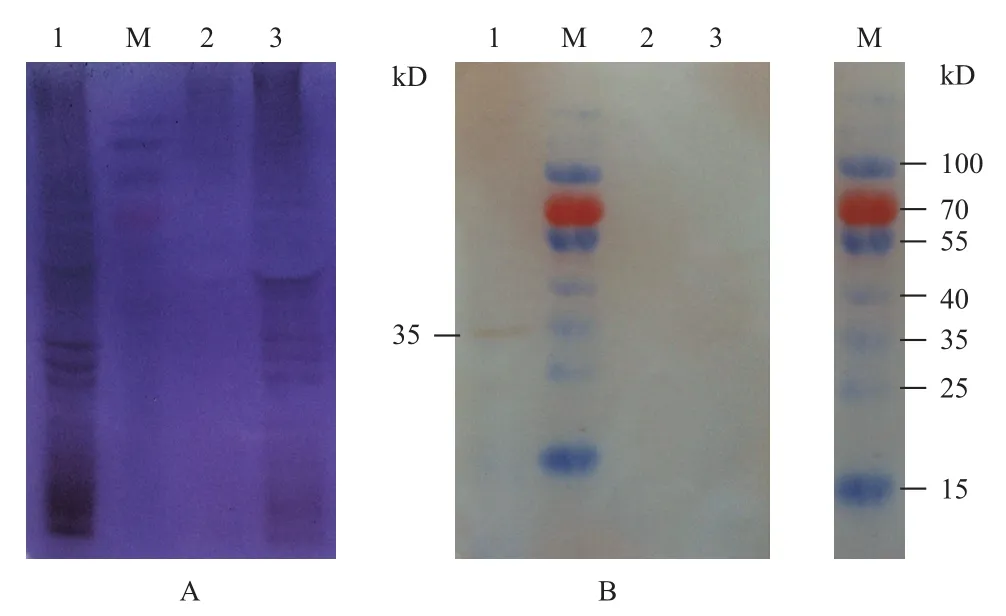
图7 p44蛋白的真核表达SDS-PAGE(A)及Western blot(B)检测
2.5 非结构蛋白p44蛋白的亚细胞定位
用P3代病毒感染昆虫细胞Sf9后24 h,用激光共聚焦显微镜观察蛋白的亚细胞定位情况。结果表明,昆虫细胞Sf9被杆状病毒感染后,细胞核明显增大,经荧光染料 Hoechst 33258染洗后,紫色部位为细胞核。融合了p44的eGFP的蛋白则主要聚集在细胞质中(图8-A),而未融合p44的EGFP均匀地分布于整个细胞中(图8-B),说明S8片段编码的非结构蛋白p44主要定位于细胞质中。
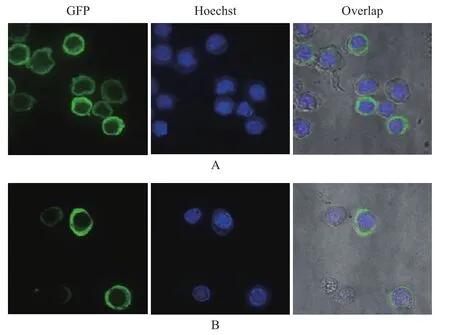
图8 融合了EGFP的p44在昆虫细胞中的定位
3 讨论
本研究通过克隆 DpCPV 1基因组S8片段到原核表达载体BL21内,原核表达p44蛋白。经SDSPAGE电泳检测到诱导表达的蛋白大小约51 kD,这是因为在构建表达S8片段的后面添加了一个His纯化标签,纯化标签的蛋白大小约7 kD,因此DpCPV 1基因组S8片段原核表达蛋白的大小约44 kD,与p44的蛋白大小相符。将DpCPV 1 S8片段原核表达蛋白免疫家兔,制备了p44的多克隆抗体。Western blot结果显示DpCPV 1 S8片段编码的非结构蛋白p44实际大小为44 kD,与推测的蛋白分子量大小结果一致。
采用Bac-to-Bac杆状病毒表达系统,将DpCPV 1基因组 S8片段单独插入以及S8片段与绿色荧光蛋白基因(egfp)以C端融合的方式插入苜蓿银纹夜蛾核多角体病毒(Autographa californica multiple nucleocapsid NPV,AcMNPV)基因组中,获得重组的杆状病毒质粒(Bac-S8和Bac-S8-eGFP),转染昆虫细胞Sf9后进行Western blot检测和蛋白的亚细胞定位的观察。Western blot检测结果显示,Bac-S8在昆虫细胞Sf9中获得高效表达,但表达的p44蛋白的大小为35 kD,比原核表达的p44蛋白(44 kD)略小。推测DpCPV 1 S8片段表达的蛋白p44在昆虫细胞内发生了切割修饰,这种蛋白切割现象此前也在DpCPV 1的其它片段表达的蛋白中发现过。如Jin等[15]将DpCPV 1感染甜菜夜蛾幼虫,取中肠样品经Western blot检测发现,DpCPV 1 S7片段编码的蛋白p50在感染的第3天表达的蛋白大小为50 kD,在感染的第5天发现该蛋白发生切割修饰,修饰后的蛋白大小为31 kD,上述数据证实了DpCPV S7片段在真核细胞内表达的蛋白发生了切割。因此,我们推测p44蛋白在真核细胞内发生了降解或者被昆虫细胞的某些酶切割或修饰。
用激光共聚焦显微镜观察Bac-S8-eGFP的融合蛋白的亚细胞定位发现,融合p44的绿色荧光蛋白(eGFP)主要聚集在细胞质中,没有融合eGFP的分布于整个细胞,说明 DpCPV 1的非结构蛋白p44定位于细胞质中。类似的情况也发生在DpCPV 1 S7片段编码的结构蛋白p50,Jin等[15]研究发现p50-eGFP同样定位于细胞的细胞质中。而DpCPV 1的S9片段编码的非结构蛋白NS5,免疫荧光实验发现NS5蛋白定位于细胞的细胞质膜上并且跨膜结构域位于蛋白质N端的57-71 aa[16]。相关蛋白的定位研究发现,为研究病毒的生命周期具有重要作用。
4 结论
本研究利用Bac-to-Bac系统首次对DpCPV 1 S8片段进行了真核表达和昆虫细胞的亚细胞定位,发现S8片段能够定位到细胞的细胞质。
[1]Shapriro A, Green T, Rao S, et al. Mrophological and molecular characterization of a cypvirus from the mosquito Uranotaenia sapphirina(Diptera:Culicidae)[J]. J Virol, 2005, 79(15):9430-9438.
[2]King AMQ, Adams MJ, Lefkowitz EJ, Carstens EB. Virus taxonomy:classification and nomenclature of viruses. Ninth report of the International Committee on Taxonomy of Viruses[M]. Elsevier Academic Press, 2012:537-536.
[3] 广东省林业科学研究所. 马尾松毛虫多角体病毒研究初报[J].林业科技通讯, 1974, 10:13.
[4]贺倩, 刘小侠, 张青文. 昆虫质型多角体病毒的研究进展[J].昆虫知识, 2010, 47(5):834-840.
[5]Yu XK, Jin L, Zhou ZH. 3.88 Å structure of cytoplasmic polyhedrosis virus by cryoelectron microscopy[J]. Nature, 2008, 453:415-419.
[6]Cheng L, Sun JC, Zhang K, et al. Atomic model of a cypovirus built from cryo-EM structure provides insight into the mechanism of mRNA capping[J]. PNAS, 2011, 108:1373-1378.
[7]Yang CW, Gang J, Liu HR, et al. Cryo-EM structure of a transcribing cypovirus[J]. PNAS, 2012, 109(16):6118-6123.
[8]文力, 张珈敏. 马尾松毛虫质型多角体病毒NS5蛋白基因的cDNA克隆及序列分析[J]. 中国病毒学, 2003(1):49-53.
[9]张万菊, 赵淑玲, 张小霞, 等. 马尾松毛虫质多角体病毒NS5蛋白的表达和功能初步分析[J]. 中国病毒学(英文版),2006(4):401-404.
[10]汪洋, 张珈敏, 李杨, 等. 马尾松毛虫CPV基因组第7片段的cDNA克隆及序列分析[J]. 武汉大学学报:理学版, 2004(2):216-222.
[11]段兵, 赵淑玲, 张海元, 等. 文山松毛虫质型多角体病毒S8片段cDNA克隆与原核表达[J]. 中国病毒学, 2004(6):627-631.
[12]胡建芳, 张珈敏, 杨娟, 等. 单引物法扩增马尾松毛虫CPV基因组第8片段及其序列分析[J]. 中国病毒学, 2003, 18(1):39-43.
[13]Zhao SL, Liang CY, Zhang WJ, et al. Characterization of the RNA-binding domain in the Dendrolimus punctatus cytoplasmic polyhedrosis virus nonstructural protein p44[J]. Virus Research,2005, 114(1):80-88.
[14]Paul RL, Susan JC, Owen EC, et al. Cloning of noncultivatable human rotavirus by single primer amplification[J]. Journal of Virology, 1992, 66(3):1817-1822.
[15]Jin L, Dai CW, Qin TC, et al. Molecular characterization of protein p50 of Dendrolimus punctatus cytoplasmic polyhedrosis virus[J]. Journal of Basic Microbiology, 2013, 53(1):37-44.
[16] Chen WG, Zhang, JM, Dong CJ, et al. Identification of transmembrane domain of a membrane associated protein NS5 of Dendrolimus punctatus cytoplasmic polyhedrosis virus[J]. J Biochem Mol Biol, 2006, 39:412-417.
(责任编辑 马鑫)
Expression of Dendrolimus puntatus Cytoplasmic Polyhedrosis Virus(DpCPV1)Non-structural Protein p44 in Bac-to-Bac System and Localization in Infected Cells
PENG Han1WANG Hong-xiu2WANG Jin-chang3GUAN Li-mei3JIN Liang3WAN Cui-xiang1
(1. School of Life Sciences and Food Engineering,Nanchang University,Nanchang 330077;2. Institute of Agricultural Applied Microbiology,Jiangxi Agricultural Academy of Sciences,Nanchang 330200;3. Institute of Microbiology,Jiangxi Academy of Sciences,Nanchang 330029)
In order to study the function of the Dendrolimus puntatus cytoplasmic polyhedrosis virus(DpCPV1)protein p44,PCR primers were designed according to the sequence of genome segment S8,the prokaryotic expression vector for genome segment 8 of DpCPV1 was constructed,and the polyclonal antibodies were prepared by immunizing rabbits with the purified expressed protein. Three recombinant plasmids(Bacmid-p44,Bacmid-p44-eGFP and Bacmid-eGFP)were constructed using Bac-to-Bac Baculovirus expression system.,and they were transfected into insect cell Sf9 for the expression. The detection and subcellular localization of the protein were determined by Western blot. The results from Western blot showed that the actual expressed protein of Bacmid-S8 in Sf9 was 35 kD,smaller than the one(44 kD)expressed in the prokaryotic expression vector. The subcellular localization of fusion protein of p44-eGFP was determined by laser scanning confocal microscope,and the fused green fluorescent protein(eGFP)of p44 concentrated in the cytoplasm of the cells,while infused eGFP distributed throughout the whole cell,indicating that p44 protein of DpCPV1 was localized mainly in the cytoplasm of the cell. This work was the first study of having the eukaryotic expression of DpCPV1 S8 and subcellular location of it in insect cells,
Dendrolimus puntatus cytoplasmic polyhedrosis virus;polyclonal antibody;eukaryotic expression;cellular localization
10.13560/j.cnki.biotech.bull.1985.2016.03.020
2015-05-19
国家自然科学基金项目(31260031),江西省科技重大专项基金项目(2014ACF60002),中科院开放基金项目(2014AEM003)
彭晗,女,硕士,研究方向:昆虫病毒学;E-mail:penghan0830@163.com;王洪秀为本文并列第一作者
靳亮,男,博士,研究方向:昆虫病毒学;E-mail:Jinliang079@163.com万翠香,女,博士,副教授,研究方向:应用微生物学;E-mail:cuixiangwan@ncu.edu.cn
