葡萄类钙调磷酸酶B亚基互作蛋白激酶VvCIPK10的特性与表达
2016-10-13余义和李秀珍郭大龙张会灵杨英军李学强张国海
余义和,李秀珍,郭大龙,张会灵,杨英军,李学强,张国海
葡萄类钙调磷酸酶B亚基互作蛋白激酶VvCIPK10的特性与表达
余义和,李秀珍,郭大龙,张会灵,杨英军,李学强,张国海
(河南科技大学林学院,河南洛阳 471003)
【目的】在葡萄中克隆丝苏氨酸蛋白激酶,分析其激酶特性和在逆境胁迫下的表达模式,为进一步研究该基因参与逆境胁迫的分子功能,探讨葡萄抗逆分子机制提供理论依据。【方法】利用电子克隆技术获得序列,设计特异引物进行RT-PCR反应,对克隆到的序列进行开放阅读框和保守结构域分析;构建原核表达载体,转化表达菌株后用IPTG进行诱导表达,收集菌体后裂解细胞,制备蛋白上样液,SDS-PAGE电泳对表达产物进行分析,同时对融合蛋白进行可溶性分析;IPTG大量诱导表达融合蛋白,收集菌体后进行超声破碎细胞,用麦芽糖结合蛋白纯化柱纯化MBP-VvCIPK10融合蛋白,SDS-PAGE电泳进行分析;纯化后的融合蛋白与体外自磷酸化缓冲液进行自磷酸化反应,反应后SDS-PAGE电泳,压磷屏检测体外自磷酸化反应;构建重组瞬时表达载体pBI221-GFP/VvCIPK10;分离拟南芥原生质体,通过PEG介导的瞬时转化方法将重组表达载体pBI221-GFP/ VvCIPK10转化至原生质体;通过基因枪介导的转化方法将重组表达载体pBI221-GFP/VvCIPK10转化至洋葱表皮细胞,培养16 h后用激光共聚焦显微镜进行荧光信号检测;选择生长相对一致且健壮的葡萄植株,于干旱、低温和盐胁迫处理后不同时间取样,同时在田间取葡萄不同组织样品,实时荧光定量PCR检测在葡萄不同组织中的表达以及在不同逆境胁迫下的表达模式。【结果】PCR克隆获得葡萄全长为1 357 bp,5′端非编码区为30 bp,3′端非编码区为156 bp,开放阅读框为1 171 bp,编码436个氨基酸,理论等电点为8.59,分子量为48.7 kDa。保守结构域预测分析显示该蛋白5′端具有一个激酶结构域,3′末端具有一个PPI结构域和一个NAF结构域。BLSATP分析表明葡萄VvCIPK10与桃树CIPK(XP_007205151)一致性最高(74%)。重组表达载体pMAL-C5X/VvCIPK10在大肠杆菌中经诱导表达获得与理论分子量(43 kDa+48.7 kDa)相一致的融合蛋白。MBP-VvCIPK10融合蛋白经柱纯化后获得单一的蛋白条带,VvCIPK10的自磷酸化活性依赖于Mn2+,不依赖于Mg2+和Ca2+,EDTA可以抑制VvCIPK10的自磷酸化活性。亚细胞定位结果显示,VvCIPK10定位在细胞核、细胞膜和细胞质。在葡萄各个组织中均有表达,主要在葡萄根和叶片中大量表达,葡萄茎、花序、果实和卷须中的表达量较低。在干旱、低温和盐胁迫处理后,呈现受诱导表达模式。的表达在低温胁迫后6 h达到峰值,干旱和盐胁迫后2 h即达到峰值。【结论】葡萄能够响应干旱、低温和盐胁迫,推测在葡萄抗非生物逆境胁迫中具有重要作用。
葡萄;类钙调磷酸酶B亚基;丝苏氨酸蛋白激酶;;表达分析
0 引言
【研究意义】葡萄作为重要果树在世界范围内广泛栽培。葡萄栽培过程中常遇到各种各样的非生物逆境胁迫,导致葡萄生长发育受阻和果实品质降低,严重影响葡萄生产和经济效益[1]。在葡萄中挖掘逆境胁迫相关基因并分析关键基因功能,对于培育抗逆能力强的葡萄新种质具有重要的理论意义和应用价值。【前人研究进展】类钙调磷酸酶B亚基蛋白(Calcineurin B-like protein, CBL)是植物钙信号转导途径中的重要钙感受器之一,在钙信号介导的植物逆境胁迫响应过程中发挥重要作用[2-5]。CBL互作蛋白激酶(CBL- interacting protein kinase,CIPK)编码丝/苏氨酸蛋白激酶,与CBL相互作用形成蛋白激酶复合物来响应逆境胁迫,通过感受细胞内Ca2+浓度变化来调节下游逆境相关基因的表达,实现对逆境胁迫的转录调控[6-8]。研究人员利用正向遗传学在拟南芥中筛选到一系列的盐敏感突变体(salt overly sensitive,SOS),SOS2编码丝/苏氨酸蛋白激酶即AtCIPK24,SOS3编码CBL蛋白即AtCBL4,二者通过相互作用协同应对高盐逆境胁迫[9-10]。TaCIPK29是在小麦中克隆的一个丝/苏氨酸蛋白激酶,在转录水平可以响应干旱、NaCl和低温处理,在烟草中过量表达增强了转基因植株的耐盐性[11]。油菜转录本在NaCl、渗透胁迫以及ABA处理后急剧增加,启动子活性受NaCl、甘露醇以及ABA的诱导,转的拟南芥植株增强了对NaCl的耐受能力[12]。苹果受盐、低温和干旱胁迫诱导表达,在拟南芥中过量表达可以增强转基因植株的抗盐、干旱和低温的能力[13]。鹰嘴豆转录本受盐、低温和干旱等逆境胁迫的诱导表达,在拟南芥突变体中过量表达可以恢复NaCl敏感表型[14]。这些研究表明CIPK不仅参与了植物对盐、低温以及干旱等逆境胁迫反应,还说明不同物种中的基因功能保守。【本研究切入点】是葡萄中K+通道Shaker家族的一个成员,与拟南芥高度同源[15]。VvCIPK23可以通过调控来实现K+在干旱条件下进入果实组织中,进而调节果实酸度[15]。能否直接参与葡萄逆境胁迫响应还不清楚。【拟解决的关键问题】本研究拟在葡萄中克隆并进行序列分析,对其是否具有激酶特性进行鉴定,并探讨该基因在不同逆境胁迫条件下的表达模式,为进一步鉴定葡萄在逆境胁迫下的生物学功能及其抗逆分子机制提供理论依据。
1 材料与方法
试验于2015年在河南科技大学进行。
1.1 植物材料与试验处理
于2015年在河南科技大学试验基地取样。植物材料为4—6年生篱架栽培‘京秀’葡萄,果实于转色期取样,根系(第一侧根)、茎(第3—4片新展开叶之间的茎段)、叶(第3—4片新展开叶)、卷须(新生第1卷须)和花序在盛花前期采样。取样后液氮速冻,及时提取总RNA,反转录为cDNA后-80℃条件下保存备用。
‘京秀’葡萄组培苗继代培养20 d,选择生长健壮一致的瓶苗用于逆境胁迫处理。组培苗正常生长条件:温度为(24±1)℃、相对湿度为75%、光周期为光照14 h/黑暗10 h。从培养基中拔出幼苗置于培养皿(不盖盖子),暴露于正常生长条件下进行干旱处理。将瓶苗置于4℃条件下进行低温处理。在培养瓶中加入20 mL 100 mmol·L-1的NaCl溶液进行盐胁迫处理。正常培养条件下的组培苗作为干旱和低温胁迫的对照。在培养瓶中加入20 mL蒸馏水作为盐胁迫的对照。试验组和对照组分别于处理后0、2、6、12和24 h取样。取样后液氮速冻,提取总RNA后反转录为cDNA,-80℃条件下保存备用。
1.2 总RNA提取与反转录
葡萄不同组织总RNA提取按照plus植物总RNA提取试剂盒(天根生化科技有限公司,北京)说明书进行。反转录按照PrimeScriptII 1st Strand cDNA Synthesis Kit(TaKaRa,大连)说明书进行。
1.3的克隆与序列分析
以葡萄的部分cDNA序列为种子序列(GenBank登录号:NM_001281285),在NCBI网站的EST数据库中进行BLAST检索,下载同源性在95%以上的EST序列,利用SeqMan软件进行拼接,获得葡萄的电子序列。依据此电子序列,用Primer Premier 5.0软件设计特异引物P1:5′-GGAGAG AGGGGTGTTCGATCTCTG-3′和P2:5′-GCGCTAAC CAGAACATTTAATCGC-3′。用PrimeSTAR® Max DNA Polymerase进行PCR反应,具体反应体系和反应程序参考使用说明书。PCR产物经1.2%的琼脂糖凝胶电泳,回收目标片段,连接至pMD19-T载体,转化TOP10感受态细胞,经抗生素和蓝白斑筛选,挑取阳性克隆送公司测序验证。利用NCBI网站的ORF Finder在线软件分析的开放阅读框。用NCBI网站的BLASTn和BLASTp在线软件进行同源性分析。用ExPASy网站的PROSITE和NCBI网站的CD search进行保守结构域预测分析。用ExPASy网站的Compute pI/Mw程序分析氨基酸序列的分子量和理论等电点。
1.4 原核表达载体和瞬时表达载体构建
根据葡萄开放阅读框设计引物,构建原核表达载体用引物P3:5′-GGGATGCCAG AGATCGAACGCGGCTC-3′(下划线为I酶切位点)和P4:5′-GGGTTAATCGATCAATTTG AACCCCG-3′(下划线为R I酶切位点),构建瞬时表达载体用引物P5:5′-AGCAATGCCAG AGATCGAACGCGGCTC-3′(下划线为I酶切位点)和P6:5′-ATGCTTTAATCGATCAATTT GAACCCCG-3′(下划线为I酶切位点)。以pMD19-T/VvCIPK10质粒为模板,用PrimeSTAR® Max DNA Polymerase进行PCR反应。用I和R I双酶切PCR产物和pMAL-C5X原核表达载体,用I和I双酶切PCR产物和pBI221-GFP瞬时表达载体,分别回收目标片段后进行连接反应,转化TOP10感受态细胞,经抗性筛选后挑取阳性克隆,提取质粒用双酶切进行鉴定,含有目标片段的重组载体经测序验证。
1.5 原核表达与蛋白纯化
重组载体pMAL-C5X/VvCIPK10转化BL21感受态细胞,经氨苄青霉素(100 mg·L-1)筛选,挑取单克隆进行PCR检测。阳性克隆接种至LB液体培养基中(含100 mg·L-1氨苄青霉素),37℃振荡培养过夜。次日以1﹕50的比例接种至新鲜LB液体培养基中,37℃振荡培养至OD600值为0.6左右,加入终浓度为0.1 mmol·L-1的IPTG诱导培养4 h,以不加IPTG诱导的pMAL-C5X/VvCIPK10和pMAL-C5X空载体作为对照。5 000 r/min离心2 min收集菌体,加入等体积的2倍上样缓冲液悬浮细胞,沸水浴5 min,样品冷却后5 000 r/min离心1 min,取适量样品进行SDS-PAGE(浓缩胶浓度为5%,分离胶浓度为12%)电泳分析。PBS(pH 7.4)缓冲液重悬诱导表达的菌体,在冰浴条件下超声波(100 V电压,5 S间隔)处理至菌液粘稠透亮,制备上样液后经SDS-PAGE电泳,进行蛋白可溶性分析。
融合蛋白纯化按照pMALTM融合蛋白纯化系统(NEB)说明书进行。菌液经IPTG诱导后,用50 ml离心管收集菌体,10 ml Column Buffer重悬沉淀,于-20℃冷冻过夜。冰浴中解冻后用超声破碎机处理,4℃条件下12 000 r/min离心20 min,上清液中加入5倍体积的Column Buffer即为粗提液。将直链淀粉树脂倒入柱子中,用5倍柱体积的Column Buffer洗柱子,然后加入粗提液,12倍柱体积的Column Buffer洗柱子,流速为10 ml·min-1,最后用Column Buffer+10 mmol·L-1麦芽糖洗脱融合蛋白,收集流出液,检测不同收集管中的蛋白浓度。根据浓度需要混合不同收集管的融合蛋白。
1.6 蛋白激酶活性分析
取纯化过的融合蛋白4 μg,加入0.4 μL 1 mol·L-1Tris-HCl(pH 8.0),金属离子10 mmol,ddH2O补齐至9.5 μL。加入0.5 μL 5 μCi γ-32P-ATP后充分混匀,30℃温浴30 min。加入等体积的2倍上样缓冲液终止反应,沸水浴5 min,样品冷却后SDS-PAGE电泳。电泳后转移至PVDF膜,保鲜膜包好后进行压磷屏。
1.7 亚细胞定位
大量抽提重组质粒pBI221-GFP/VvCIPK10,纯化后备用。参照Yoo等的方法制备拟南芥原生质体[16],采用PEG介导的方法将重组质粒转化原生质体。取洋葱5—6层鳞茎,剥取内表皮置于培养皿中,黑暗培养24 h。金粉包裹重组质粒,用基因枪介导的方法转化洋葱表皮细胞。转化后的材料置于25℃条件下光照培养16 h,用激光共聚焦显微镜(ZEISS LSM-510 META,Germany)进行观察。转化空载体pBI121-GFP作为对照。
1.8 实时荧光定量PCR
根据序列设计引物P7:5′-CCGTCGGT ATTTCCAGCAG-3′和引物P8:5′-CTTTCGCCCCAT CGTAGC-3′。(GenBank登录号:AY680701)基因作为内参基因,设计引物P9:5′-GATTCTGGT GATGGTGTGAGT-3′和引物P10:5′-GACAATTTC CCGTTCAGCAGT-3′。提取葡萄不同组织和逆境处理后不同时间叶片的总RNA,反转录cDNA后稀释50倍,在Bio-Rad IQ5 Real-Time PCR Detection System(Bio-Rad Laboratories, Hercules, CA)进行实时荧光定量PCR。PCR反应体系和反应程序按照SYBR®Premix Ex TaqTMII说明书进行。采用2-ΔΔCt法对结果进行相对定量分析[17],每个样品重复3次。
1.9 数据处理与分析
采用Excel进行数据处理和作图,用DPS 7.05软件进行显著性检验。
2 结果
2.1 葡萄类钙调磷酸酶B互作蛋白激酶的克隆与序列分析
根据电子克隆获得的基因序列设计引物,以‘京秀’葡萄叶片cDNA为模板进行PCR扩增,结果得到与预期片段大小一致的产物。测序结果表明5′端非编码区为30 bp,3′端非编码区为156 bp,开放阅读框为1 171 bp,编码436个氨基酸,理论等电点为8.59,分子量为48.7 kDa(GenBank登录号为KT001237)。保守结构域预测分析显示该蛋白5′端具有一个激酶结构域,3′末端具有一个PPI结构域,中间具有一个NAF结构域。经BLSATP分析显示,所获得的葡萄VvCIPK10蛋白与桃树(XP_007205151)、苹果(XP_008344764)、草莓(XP_004302572)和拟南芥(NP_180595)在氨基酸水平上一致性分别达到74%、72%、70%和65%。
2.2 VvCIPK10的原核表达
以葡萄叶片cDNA为模板,用特异引物扩增的开放阅读框,通过T/A克隆连接到pMD19-T载体上,获得重组质粒pMD19-T/VvCIPK10,测序验证开放阅读框序列。用R I和d III双酶切重组载体pMD19-T/VvCIPK10和原核表达载体pMAL-C5X,分别回收开放阅读框目标片段和pMAL-C5X载体骨架片段,连接后形成重组载体pMAL-C5X/VvCIPK10。用R I和d III双酶切重组载体pMAL-C5X/VvCIPK10,结果获得与开放阅读框序列大小一致的目标片段(图1),说明原核表达载体构建完成,可用于下一步原核表达试验。

M:DNA分子量标准;1:重组质粒pMAL-C5X/VvCIPK10;2:EcoR I和Hind III双酶切重组质粒pMAL-C5X/VvCIPK10
将重组载体pMAL-C5X/VvCIPK10转化至大肠杆菌BL21,经菌液PCR检测,挑取阳性克隆摇菌培养,用0.1 mmol·L-1的IPTG诱导表达后进行SDS-PAGE分析。含有pMAL-C5X空载体的菌株经诱导后,在43 kDa的位置产生一条目标带,说明麦芽糖结合蛋白正确表达。含有重组载体pMAL-C5X/VvCIPK10的菌株经诱导后,在90 kDa左右的位置产生一条目标带,菌体经超声破碎后上清液在相同位置也有目标条带(图2-A),说明正确表达并以可溶性蛋白形式表达。将含有可溶性蛋白的上清液用亲和淀粉树脂柱纯化,SDS-PAGE结果显示在90 kDa左右的位置产生单一目标带(图2-B),说明纯化得到成分单一的MBP-VvCIPK融合蛋白。
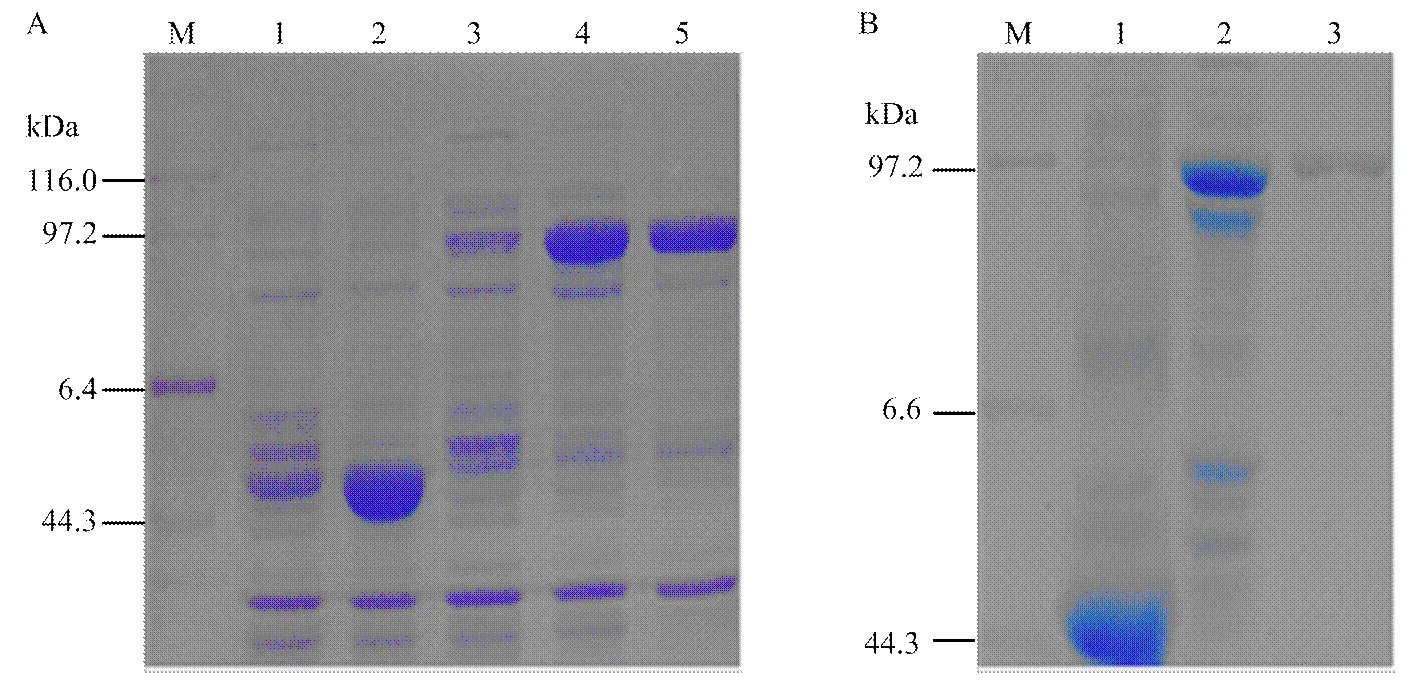
A:葡萄VvCIPK10在大肠杆菌中的诱导表达。M:蛋白质分子量标准;1:未经IPTG诱导的对照;2:IPTG诱导的对照;3:未经IPTG诱导的重组菌;4:IPTG诱导重组菌的总蛋白;5:IPTG诱导重组菌的可溶性蛋白。B:MBP-VvCIPK10融合蛋白的纯化泳道1:IPTG诱导的对照;泳道2:IPTG诱导重组菌的可溶性蛋白;泳道3:纯化后的MBP-VvCIPK10融合蛋白
2.3 VvCIPK10的激酶特性分析
VvCIPK10具有激酶结构域,为分析该蛋白是否具有激酶特性,用纯化获得的MBP-VvCIPK10融合蛋白进行体外自磷酸化酶活性分析。结果表明VvCIPK10的自磷酸化酶活性依赖于Mn2+,但不依赖于Mg2+和Ca2+,添加金属离子螯合剂可以抑制VvCIPK10的自磷酸化酶活性(图3)。

图3 VvCIPK10的自磷酸化酶活性分析
2.4 VvCIPK10的亚细胞定位
转化空载体pBI221-GFP的原生质体和洋葱表皮细胞的细胞核、细胞质和细胞膜上存在荧光信号,转化重组载体pBI221-GFP/VvCIPK10的原生质体和洋葱表皮细胞的细胞核、细胞质和细胞膜上存在荧光信号。这说明VvCIPK10定位在细胞核、细胞质和细胞膜(图4)。
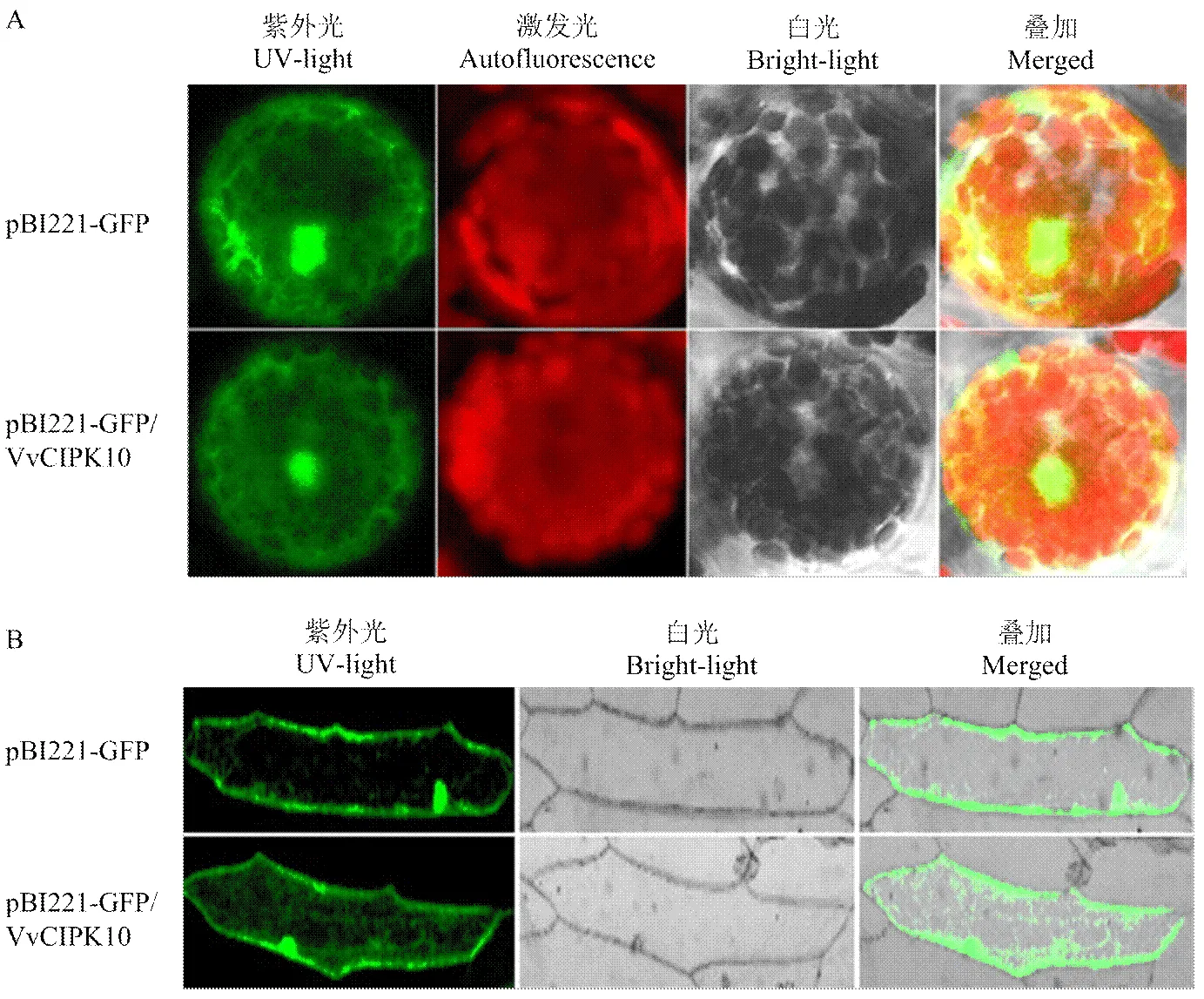
A:葡萄VvCIPK10在拟南芥原生质体中的亚细胞定位;B:葡萄VvCIPK10在洋葱表皮细胞中的亚细胞定位
2.5的表达分析
在葡萄各个组织中均有表达,但表达量在不同组织之间存在差异。在葡萄茎、花序、果实和卷须中的表达量较低。在葡萄根和叶中大量表达,与茎、花序、果实和卷须中的表达量相比存在显著差异(<0.05)。为探讨对不同逆境处理的响应模式,用低温、干旱和盐胁迫处理葡萄幼苗后,检测叶片中的表达变化。的表达在低温处理后2 h开始增加,6 h达到最大值,然后表达量降低,到24 h表达量又恢复到一个较高的水平。的表达量在干旱胁迫后2 h快速增加,达到一个峰值,然后在不同时间点都维持较高的表达水平。盐胁迫后的表达量迅速增加,在2 h就达到峰值,6 h下降至较低的表达水平,在12—24 h呈现持续增加的模式(图5)。
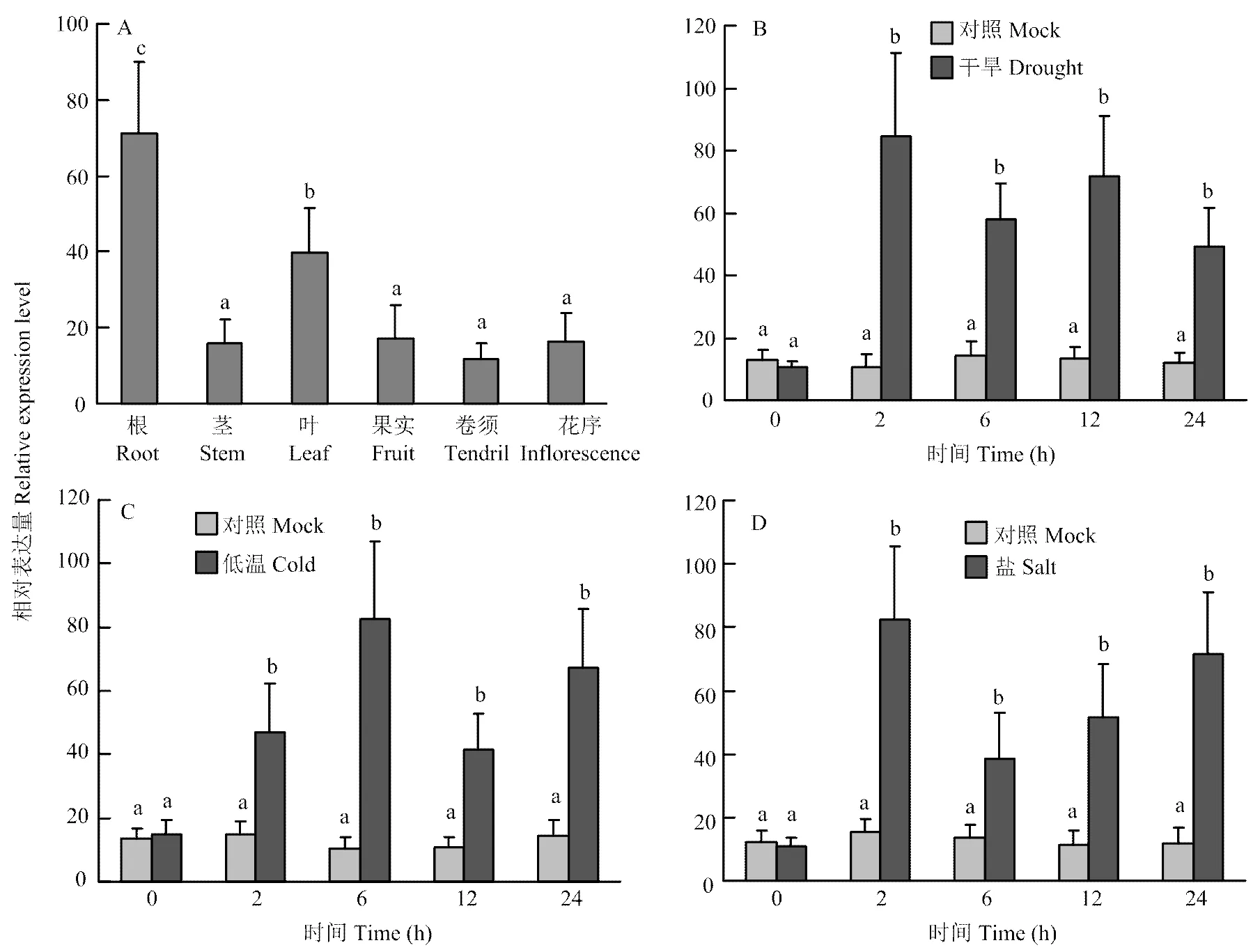
A:VvCIPK10在葡萄不同组织中的表达分析;B—D:葡萄VvCIPK10对干旱、低温和盐胁迫的响应。不同小写字母表示差异显著(P<0.05)
3 讨论
植物CBI-CIPK网络信号系统在逆境胁迫响应过程中具有重要作用[17-18]。CBL蛋白是植物所特有的小分子Ca2+感受器。CIPK是能够与CBL相互作用的丝/苏氨酸蛋白激酶,属于第3类的SnRK3(SNF1-related protein kinase 3)[19-20]。在拟南芥中,AtCBL4/SOS3与AtCIPK24/SOS2相互作用,并与NHX7/SOS1共同组成SOS信号系统参与拟南芥对盐胁迫的调控[9-10]。已有的研究结果表明的表达模式主要分两种:一是同一物种内不同的对不同的环境刺激呈现不同的响应模式[21-22];二是不同物种中的同源对不同刺激的响应模式[23-25]。拟南芥可以增强转基因植株对干旱和盐胁迫的抗逆性,但不能明显改善转基因植株的抗低温能力[26-27]。苹果与高度同源,可以对干旱、低温和盐胁迫做出快速响应,同时在苹果中过量表达可以明显提高转基因植株对干旱、低温和盐胁迫的耐受性[13,28]。油菜是的另一个同源基因,该基因可以对干旱、盐和ABA处理作出快速响应,同时,启动子活性可以受干旱、盐和ABA处理的诱导[12]。在拟南芥中过量表达可以提高转基因植株抗盐能力,但没有提高转基因植株抗干旱的能力[12]。
VvCIPK10具有丝/苏氨酸蛋白激酶结构的典型特征,N端具有保守的激酶结构域,是激活底物的关键功能域,C端具有一个NAF基序(也称为FISL基序)和一个蛋白磷酸酶互作(protein phosphatase interaction,PPI)基序。CBL与CIPK的NAF基序结合可以解除其对CIPK活性的抑制,从而激发CIPK的自磷酸化和磷酸化活性,使CIPK-CBL复合体具有活性功能,进而使复合体处于激活状态[29-30]。PPI结合位点能够与蛋白磷酸酶2C(PP2C)ABI的N端相互作用,如CIPK24和CIPK8能够与ABI2相互作用,CIPK20与ABI1相互作用[4]。为分析VvCIPK10的激酶特性,笔者在大肠杆菌中表达了MBP-VvCIPK10融合蛋白,纯化后进行了自磷酸化分析,结果显示VvCIPK10的自磷酸化依赖于Mn2+,但不依赖于Ca2+和Mg2+,同时EDTA可以抑制VvCIPK10依赖于Mn2+的自磷酸化活性。亚细胞定位结果显示VvCIPK10主要定位在细胞核、细胞膜和细胞质中,这与CIPK在细胞中的定位特性是一致的。体外激酶活性和亚细胞定位试验表明VvCIPK10是一个典型的丝/苏氨酸蛋白激酶。
在电子克隆的过程中发现,与高度同源的6条EST序列均是受非生物胁迫诱导的。用干旱、低温和盐胁迫逆境处理葡萄幼苗后,的表达都呈现诱导表达模式。不同逆境处理的表达模式略有不同,其中干旱胁迫对的表达影响最为明显,说明有可能主要参与抗旱反应。小麦的表达受盐、低温和干旱胁迫的诱导,其中受盐胁迫表达变化更明显,在烟草中过量表达导致转基因植株抗盐胁迫能力提高[11]。通过转基因试验分析的耐胁迫能力以及如何响应逆境有待进一步研究。
4 结论
葡萄VvCIPK10的自磷酸化酶活性依赖于Mn2+,但不依赖于于Mg2+和Ca2+。VvCIPK10定位在细胞核、细胞膜和细胞质。在葡萄各个组织中均有表达,主要在葡萄根和叶片中大量表达。在干旱、低温和盐胁迫处理后,葡萄呈现受诱导表达模式。研究结果为进一步研究参与逆境胁迫的分子功能,以及为探讨葡萄抗逆分子机制提供了参考。
References
[1] 贺普超. 葡萄学. 北京: 中国农业出版社, 1999: 28-38.
HE P C.. Beijing: China Agriculture Press, 1999: 28-38. (in Chinese)
[2] 汤湖斌, 闵康康, 徐玲玲, 胡海涛, 杨玲, 王长春. CBL-CIPKs信号系统的研究进展. 中国细胞生物学学报, 2015, 37(1): 100-105.
TANG H B, MIN K K, XU L L, HU H T, YANG L, WANG C C. Research progress in CBL-CIPKs signaling system., 2015, 37(1): 100-105. (in Chinese)
[3] 沈金秋, 郑仲仲, 潘伟槐, 潘建伟. 植物CBL-CIPK信号系统的功能及其作用机理. 植物生理学报, 2014, 50(4): 641-650.
SHEN J Q, ZHENG Z Z, PAN W H, PAN J W. Functions and action mechanisms of CBL-CIPK signaling system in plants., 2014, 50(4): 641-650. (in Chinese)
[4] LUAN S. The CBL-CIPK network in plant calcium signaling., 2009, 14(1): 37-42.
[5] WEINL S, KUDLA J. The CBL-CIPK Ca2+-decoding signaling network: function and perspectives., 2009, 184(3): 517-528.
[6] LUAN S, LAN W, LEE S C. Potassium nutrition, sodium toxicity, and calcium signaling: connections through the CBL-CIPK network., 2009, 12(3): 339-346.
[7] BATISIC O, WAADT R, STEINHORST L, HELD K, KUDLA J. CBL-mediated targeting of CIPKs facilitates the decoding of calcium signals emanating from distinct cellular stores., 2010, 61(2): 211-222.
[8] YU Q, AN L, LI W. The CBL-CIPK network mediates different signaling pathways in plants., 2014, 33(2): 203-214.
[9] LIU J, ISHITANI M, HALFTER U, KIM C S, ZHU J K. TheSOS2 gene encodes a protein kinase that is required for salt tolerance., 2000, 97(7): 3730-3734.
[10] Halfter U, Ishitani M, Zhu J K. TheSOS2 protein kinase physically interacts with and is activated by the calcium- binding protein SOS3., 2000, 97(7), 3735-3740.
[11] DENG X M, HU W, WEI S Y, ZHOU S Y, ZHANG F, HAN J P, CHEN L H, LI Y, FENG J L, FANG B, LUO Q C, LI S S, LIU Y Y, YANG G X, HE G Y. TaCIPK29, a CBL-Interacting protein kinase gene from wheat, confers salt stress tolerance in transgenic tobacco., 2013, 8(7): e69881.
[12] HEN L, REN F, ZHOU L, WANG Q Q, ZHONG H, LI X B. Thecalcineurin B-Like 1/CBL-interacting protein kinase 6 (CBL1/CIPK6) component is involved in the plant response to abiotic stress and ABA signaling., 2012, 63(17): 6211-6222.
[13] WANG R K, LI L L, CAO Z H, ZHAO Q, LI M, ZHANG L Y, HAO Y J. Molecular cloning and functional characterization of a novel apple MdCIPK6L gene reveals its involvement in multiple abiotic stress tolerance in transgenic plants., 2012, 79(1/2): 123-135.
[14] TRIPATHI V, PARASURAMAN B, LAXMI A, CHATTOPADHYAY D. CIPK6, a CBL-interacting protein kinase is required for development and salt tolerance in plants., 2009, 58(5): 778-790.
[15] CUELLAR T, PASCAUD F, VERDEIL J L, TORREGROSA L, ADAM-BLONDON A F, THIBAUD J B, ADAM-BLONDON A, THIBAUD J, SENTENAC H, GAILLARD I. A grapevine Shaker inward K+channel activated by the calcineurin B-like calcium sensor 1-protein kinase CIPK23 network is expressed in grape berries under drought stress conditions., 2010, 61(1): 58-69.
[16] YOO S D, CHO Y H, SHEEN J. Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis., 2007, 2(7): 1565-1572.
[17] LIVAD K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod., 2001, 25(4): 402-408.
[18] THODAY-KENNEDY E L, JACOBS A K, ROY J. The role of the CBL-IPK calcium signalling network in regulating ion transport in response to abiotic stress., 2015, 76(1): 3-12.
[19] SYANYAL S K, PANDEY A, PANDEY G K. The CBL-IPK signaling module in plants: a mechanistic perspective., 2015, 155(2): 89-108.
[20] CROZET P, MARGALHA L, CONFRARIA A, RODRIGUES A, MARTINHO C, ADAMO M, BAENA-GONZALEZ E. Mechanisms of regulation of SNF1/AMPK/SnRK1 protein kinases., 2014, 5: 190.
[21] KRZYWINSKA E, BUCHOLC M, KULIK A, CIESIELSKI A, LICHOCKA M, DEBSKI J, DOBROWOLSKA G. Phosphatase ABI1 and okadaic acid-sensitive phosphoprotein phosphatases inhibit salt stress-activated SnRK2. 4 kinase., 2016, 16(1): 136.
[22] ZHANG H, YIN W, XIA X. Calcineurin B-Like family in: comparative genome analysis and expression pattern under cold, drought and salt stress treatment., 2008, 56(2): 129-140.
[23] KOLUKISAOGLU U, WEINL S, BLAZEVIC D, BATISTIC O, KUDLA J. Calcium sensors and their interacting protein kinases: genomics of theand rice CBL-CIPK signaling networks., 2004, 134(1): 43-58.
[24] KURUSU T, HAMADA J, NOKAJIMA H, KITAGAWA Y, KIYODUKA M, TAKAHASHI A, HANAMATA S, OHNO R, HAYASHI T, OKADA K, KOGA J. Regulation of microbe-associated molecular pattern-induced hypersensitive cell death, phytoalexin production, and defense gene expression by calcineurin B-like protein-interacting protein kinases, OsCIPK14/15, in rice cultured cells., 2010, 53(2): 678-692.
[25] D'ANGELO C, WEINL S, BATISTIC O, PANDEY G , CHEONG Y , SSHULTKE S, ALBRECHT V, EHLERT B, SCHULZ B, HARTER K, LUAN S. Alternative complex formation of the Ca2+- egulated protein kinase CIPK1 controls abscisic acid-dependent and independent stress responses in., 2006, 8(6): 857-872.
[26] CHEN L, WANG Q Q, ZHOU L, REN F, LI D D, LI X B. Arabidopsis CBL-interacting protein kinase (CIPK6) is involved in plant response to salt/osmotic stress and ABA., 2013, 40(8): 4759-4767.
[27] TRIPATHI V, PARASURAMAN B, LAXMI A, CHATTOPADHYAY D. CIPK6, a CBL‐interacting protein kinase is required for development and salt tolerance in plants., 2009, 58(5): 778-790.
[28] HU D G, MA Q J, SUN C H, SUN M H, YOU C X, HAO Y J. Overexpression of MdSOS2L1, a CIPK protein kinase, increases the antioxidant metabolites to enhance salt tolerance in apple and tomato., 2016, 156(2): 201-214.
[29] TANG R J, ZHAO F G, GARCIA V J, KLEIST T J, YANG L, ZHANG H X, LUAN S. Tonoplast CBL-IPK calcium signaling network regulates magnesium homeostasis in., 2015, 112(10): 3134-3139.
[30] HASHIMOTO K, ECKERT C, ANSCHUTZ U, SCHOLZ M, HELD K, WAADT R, REYER A, HIPPLER M, BECKER D, KUDLA J. Phosphorylation of calcineurin B-like (CBL) calcium sensor proteins by their CBL-interacting protein kinases (CIPKs) is required for full activity of CBL-CIPK complexes toward their target proteins., 2012, 287(11): 7956-7968.
(责任编辑 赵伶俐)
Characteristics and Expression of Calmodulin Like B Subunit Interaction Protein VvCIPK10 in Grapevine
YU Yi-he, LI Xiu-zhen, GUO Da-long, ZHANG Hui-ling, YANG Ying-jun, LI Xue-qiang, ZHANG Guo-hai
(College of Forestry, Henan University of Science and Technology, Luoyang 471003, Henan)
【Objective】The objective of this study is to clone serine/threonine protein kinaseinvolved in abiotic stress, and investigate the molecular mechanism of grapevine stress resistance. 【Method】The sequences ofwere obtained by electronic cloning technology, and the specific primers were designed to perform RT-PCR reaction. Open reading frame and conserved structure domain ofwere analyzed. The prokaryotic expression vector was constructed and transformed into the expression cells, and the recombinant bacteria were induced by IPTG. The expression products were collected and the protein sample was prepared. The protein samples were analyzed by SDS-PAGE electrophoresis, and the soluble characteristics of the fusion protein were analyzed. The fusion protein was induced by IPTG. The cells were collected and broken by using ultrasonic. The MBP-VvCIPK10 fusion protein was purified by maltose binding protein purification column and analyzed by SDS-PAGE. The purified fusion protein was incubated withself-phosphorylation buffer solution. After SDS-PAGE electrophoresis, the phosphor screen was performed and the phosphorylation reaction was detected. The recombinant transient expression vector pBI221-GFP/VvCIPK10 was constructed. The recombinant expression vector pBI221-GFP/VvCIPK10 was transformed into protoplasts by PEG mediated transient transformation. The recombinant expression vector pBI221-GFP/VvCIPK10 was transformed into onion epidermal cells by gene gun mediated transformation, and the fluorescence signal was detected by laser scanning confocal microscope after 16 h of culture. The relatively consistent and robust grape plants were selected, samples were taken at different times after drought, low temperature and salt stress treatments, at the same time, different tissue samples of grapes were taken in the field, with a kit to extract total RNA. After reverse transcription, expression ofwas detected by real-time quantitative PCR. 【Result】The full-length of1 357 bp, 5′ end of non-coding region is 30 bp, 3′ end of non-coding region is 156 bp, the open reading frame is 1 171 bp.open reading frame encoded 436 amino acids, the theoretical isoelectric point is 8.59, molecular weight is 48.7 kDa. Conserved domain prediction analysis showed that the protein has a kinase domain in 5′ terminal, a PPI domain and a NAF domain in 3′ terminal. BLSATP analysis showed VvCIPK10 consistency with peach CIPK (XP_007205151) is highest (74%). Recombinant expression vector pMAL-C5X/VvCIPK10 transformation in, expressed the molecular weight of fusion protein is consistent with the predicted molecular weight (43 kDa+48.7 kDa). MBP-VvCIPK10 fusion protein was purified by column. VvCIPK10 autophosphorylation activity was dependent on Mn2+but not dependent on Mg2+and Ca2+, and EDTA could inhibit the autophosphorylation activity of the VvCIPK10. Subcellular localization showed VvCIPK10 in the nucleus, cell membrane and cytoplasm. VvCIPK10 expressed in various tissues of grapevine. VvCIPK10 transcripts mainly accumulated in grapevine roots and leaves, but showed low expression levels in grapevine stem, inflorescence, fruit and tendril. After drought, low temperature and salt stress treatments,showed the induced expression model. The expression ofreached peak value at 6 h after low temperature stress, and reached the peak at 2 h after drought and salt stresses. 【Conclusion】It was concluded that grapevine VvCIPK10 as a serine threonine protein kinase is able to respond to drought, low temperature and salt stress, suggesting thatplays an important role in resistance to abiotic stress.
grapevine; calmodulin like B subunit; serine threonine protein kinase;; expression analysis
2016-04-15;接受日期:2016-09-12
国家自然科学基金(U1504321,31372026)、河南省教育厅科学技术研究重点项目(14A210018)、河南省教育厅科技攻关项目(17020005)、河南省科技创新人才计划(164100510006)、河南省高校科技创新人才支持计划(13HASTIT004)、河南科技大学创新团队项目(2015TTD003)
余义和,Tel:0379-64282345;E-mail:yuyihe2008@163.com。通信作者张国海,Tel:0379-64283362;E-mail:guohaizhang@126.com
