全脑放疗联合靶向药物与单独全脑放疗治疗非小细胞肺癌脑转移疗效及安全性的Meta分析
2016-10-13金福军曾川张献全
金福军 曾川 张献全
·论著·
全脑放疗联合靶向药物与单独全脑放疗治疗非小细胞肺癌脑转移疗效及安全性的Meta分析
金福军曾川张献全
目的采用Meta分析比较全脑放疗(WBRT)联合靶向药物与单用WBRT在非小细胞肺癌(NSCLC)脑转移瘤患者治疗中的疗效和安全性。方法计算机检索Pubmed、Embase、中国知网、万方数据库中有关WBRT联合靶向药物治疗NSCLC脑转移的文献,检索时间均从建库至2016年5月。通过纽卡斯尔-渥太华量表(NOS)对文献进行质量评价,采用优势比(OR)及其95%可信区间合并效应量,采用RevMan5.2软件进行数据分析。结果最终纳入15篇研究文献,共计1 084例患者。结果显示:联合治疗组疾病控制率(OR: 3.09,95% CI 2.11~4.54,P<0.00001)、1年生存率(OR: 2.55,95%CI1.84~3.54,P<0.00001)均高于单纯放疗组,差异具有明显统计学意义;安全性方面,联合治疗组皮疹发生率高于单纯放疗组(OR: 9.10,95%CI2.89~28.66,P=0.0002),但均属于Ⅰ~Ⅱ度不良反应,经对症处理后可缓解,其余不良反应如腹泻、恶心呕吐、乏力、骨髓抑制、呼吸困难两组比较均无统计学意义(P>0.05)。结论WBRT联合靶向药物治疗NSCLC脑转移瘤明显优于单纯WBRT放疗,不良反应亦无明显增加。
非小细胞肺癌;脑转移;放疗;靶向治疗;Meta分析
据全球癌症数据统计,肺癌的发病率与病死率均呈上升趋势,位居全球癌症病死率的首位,其病理类型包括小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC) ,其中NSCLC占80%以上[1-2]。脑转移是NSCLC最常见并发症,其发生率高达30%[3],也是晚期肺癌患者死亡的常见原因,而表皮生长因子受体(epidermal growth factor receptor, EGFR) 突变的肺腺癌患者更容易发生脑转移[4]。目前针对NSCLC脑转移的处理主要以全脑放疗(whole brain riadiotherapy,WBRT)为主,但其疗效仍不理想。近年来,表皮生长因子受体抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)在晚期NSCLC中的应用逐渐增多,尤其是对于NSCLC脑转移的患者。一些研究显示EGFR-TKI联合放疗显示出较好的疗效,但另一些研究显示其疗效及安全性较差,结论尚存在争议[5-7]。本研究旨在通过Meta分析的方法比较WBRT 联合靶向药物与单用WBRT治疗NSCLC伴多发脑转移患者的疗效与安全性。
资料与方法
一、纳入标准与排除标准
纳入标准:①研究对象均为病理组织学和影像学明确诊断的晚期NSCLC患者;②CT或核磁共振成像(magnetic resonance imaging, MRI)等影像学证实有脑转移瘤的存在;③研究对象体能状况(ECOG)评分≤3分;④文章提供的数据清晰明确,能够直接获取或计算出优势比(odds ratio,OR)及其95%可信区间(confidence interval,CI);⑤文献语种为英文或中文文献。排除标准:①与本研究主题无关的文献;②病例报告、个案报道、会议摘要、文献综述、动物性实验;③通过各种方法均无法获取全文或提供数据不足的文献;④除中英文以外的其他语种文献。
二、文献检索策略
计算机检索PubMed、Embase、中国知网(CNKI)和万方数据库中有关放疗联合EGFR-TKI治疗晚期NSCLC脑转移患者相关的文章。各数据库均采用主题词与自由词联合检索,检索时间均从建库至2016年5月。英文检索词包括“lung cancer”、“whole brain radiotherapy”、“EGFR-TKI”;中文检索词包括“肺癌”、“全脑放疗”、“靶向治疗”。 此外,同时手工检索美国临床肿瘤学会(ASCO)中的会议论文或摘要以及文献中出现过的通过上述文献检索没有发现的其他文章。
三、文献资料提取
由2名研究者按照标准的数据提取形式独立阅读文献并提取资料,当意见分歧时,增加1名研究人员,经讨论协商达成一致性意见。每项研究提取的信息包括:①一般资料:第一作者姓名、文献发表日期及作者所在国家;②文献特征:实验组、对照组病例数、中位年龄、干预措施、结局指标。当无法从文献获取某些关键信息时,通过邮件与通讯作者联系,若仍无法获取相应数据,则记录为“not report”。
四、文献质量评价
文献的质量评价标准主要参照队列研究的标准评价方法即纽卡斯尔-渥太华量表(Newcastle-Ottawa scale, NOS),该量表评价内容包括患者的选择(selection),研究的可比性(comparability)和结局(outcome),分数分布从0到9[8-9]。在该研究中,将得分为5分或更高的研究认定为较高质量文献并纳入。文献质量评价由两名研究者独立评价, 若评价结果不一致者,经讨论协商决定。
五、统计学分析
本研究的主要终点指标为疾病控制率(disease control rate, DCR)和1年生存率。采用1.1版实体瘤治疗疗效评价标准(response evaluation criteria in solid tumors, RECIST)评价治疗效果。主要包括“完全缓解(complete response, CR)”、“部分缓解(partial response, PR)”、“疾病稳定(stable disease, SD)”及“疾病进展(progress disease, PD)”。定义DCR=CR+PR+SD,OR及其95%CI用来计算合并效应量。
各研究间的异质性采用χ2检验进行分析,取检验界值α=0.1。首先采用固定效应模型合并各组OR值。若固定效应模型下异质性检验结果提示P≤0.1或I2≥50%,提示各研究间存在明显的统计学异质性,则换用随机效应模型,同时进行敏感性分析寻找异质性来源。采用Cochrane协作网提供的RevMan 5.2 软件进行数据分析。
结 果
一、文献筛选结果
普通投票方法可以分为均等投票和赋权投票两类,赋权投票是给投票专家赋予不同权重,均等投票则是以相同权重进行投票。根据应用背景需求,按投票原则又可以分为一票否决,一致表决,大数原则和阀值表决等[35]。对于回归问题,可以通过平均值,加权求和,中位数,最大数等方式进行整合[37]。
初检共获得266篇文献,通过方法学部分所制定的检索词及数据库逐层筛选,最终纳入文献15篇[5-7,10-21],其中中文文献8篇,英文文献7篇。均为回顾性研究,共包括1 084例晚期NSCLC患者,见图1。

图1文献检索流程图
二、纳入研究的基本特征
所纳入的15篇文献均为近5年内的研究。实验组采用全脑放疗联合吉非替尼或埃罗替尼,对照组采用单纯全脑放疗,有3篇研究未报告患者中位年龄。12篇研究报告了DCR数据,3篇研究仅报告了1年生存率相关数据,另有3篇文献仅报告了DCR数据,见表1。
三、方法学质量评价
方法学质量评分结果,见表1。所纳入的15篇文献质量评分有6篇为8分,4篇为7分,5篇为6分,表明所纳入研究的质量较好。
四、统计分析结果
1. DCR: NSCLC脑转移患者WBRT+TKI与单纯放疗之间DCR的比较汇总分析结果如图2所示。共12篇文献报道了相应数据,异质性检验提示(χ2=4.86,P=0.94,I2=0%),说明纳入研究间无明显异质性,故采用固定效应模型进行分析。结果显示:全脑放疗+EGFR-TKI治疗组(n=418)的DCR明显高于对单纯全脑放疗组(n=494),差异具有统计学意义(OR: 3.09,95%CI2.11~4.54,P<0.00001)。
2. 1年期生存率: 1年期生存率的比较汇总分析如图3所示。 共11篇文献 (n=744) 报道了相应数据,异质性检验结果提示(χ2=8.58,P=0.57,I2=0%),说明各纳入研究间无明显异质性,故采用固定效应模型进行分析。结果显示:全脑放疗EGFR-TKI治疗组(n=363)的1年生存率明显高于对单纯全脑放疗组(n=381),差异具有统计学意义(OR: 2.55,95%CI1.84~3.54,P<0.00001)。

表1 纳入研究的基本特征
注:NR:无报道,OS: 总存活率,RR:反应率

图2非小细胞脑转移患者放疗+ EGFR-TKI与单纯放疗之间DCR的比较
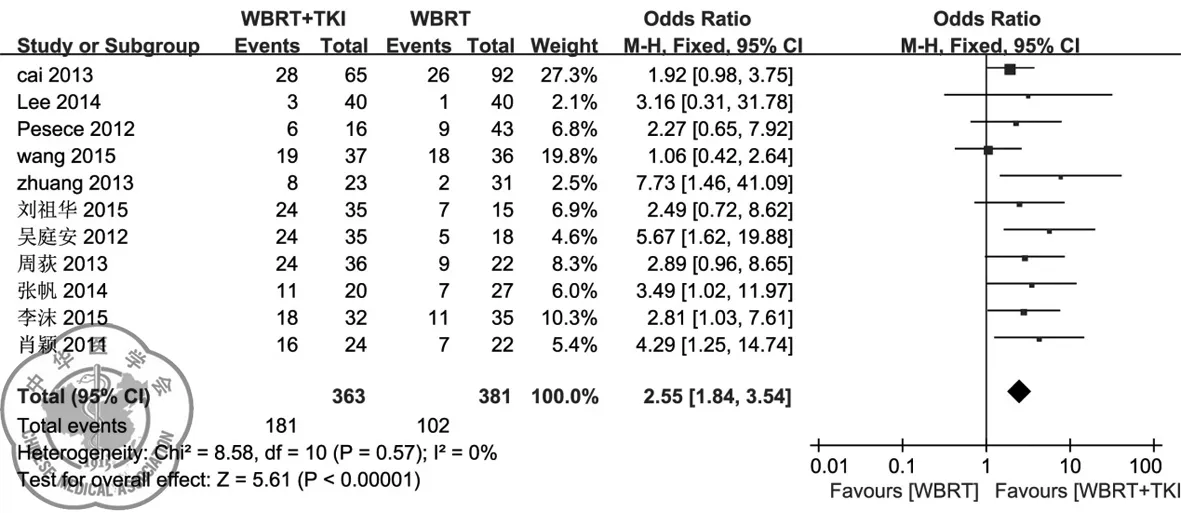
图3 非小细胞肺癌脑转移患者放疗+EGFR-TKI与单纯放疗之间1年生存率的比较
3. 不良反应: 如图4所示,共12篇文献报道了不良反应发生的情况,结果提示:对于NSCLC脑转移患者,与单纯放疗相比,放疗+EGFR-TKI联合治疗可增加皮疹的发生率(P=0.0002)。而两组在恶心呕吐、腹泻、乏力、骨髓抑制、呼吸困难方面差异均无统计学意义(P>0.05)。
4. 发表性偏倚:以两组患者DCR指标绘制倒漏斗图。如图5所示,倒漏斗图基本对称, 说明纳入研究间不存在明显的发表性偏倚。
讨 论
本研究结果显示,WBRT联合EGFR-TKI治疗NSCLC脑转移患者的DCR(OR: 3.09,95%CI2.11~4.54,P<0.00001)及1年期生存率(OR: 2.55,95%CI1.84~3.54,P<0.00001)明显高于单纯WBRT。在不良反应方面,联合治疗组可增加皮疹的发生率(P=0.0002), 其余不良反应发生率两组间无明显差异。可见WBRT联合EGFR-TKI治疗NSCLC脑转移是一种相对安全有效的方法,能明显延长患者1年期生存率,改善生活质量。
EGFR-TKI 是小分子的药物,有较好的脂水分配系数使其具有高渗透性,更易吸收至血脑屏障。研究证实,脑转移后正常血脑屏障遭到破坏以及全脑放射治疗时血脑屏障血管水肿使血管内皮细胞间距拉大,使血脑屏障通透性增加,从而使脑内EGFR-TIK 浓度增加[22]。Broniseer 等[23]报道厄洛替尼及其代谢产物在服药第8、34 天时其血浆浓度分别为 30 365、2 527 ng·h-1·ml-1,脑脊液浓度分别为2 129、240 ng·h-1·ml-1,血脑屏障穿透性分别约为 7%、9%。现已有多项研究表明 EGFR-TIK 具有放射治疗增敏作用,其主要机制是可能通过促进肿瘤细胞凋亡,引起肿瘤细胞周期再分布和抑制放射性损伤修复等多种途径发挥放射增敏作用[24-25]。

图4非小细胞脑转移患者放疗+EGFR-TKI与单纯放疗之间不良反应情况的比较

图5发表性偏倚检测漏斗图
当出现脑转移后,患者的正常血脑屏障受到破坏,此时加用靶向治疗,相比较化疗而言,药物更加容易透过人体的血脑屏障,且联合使用放疗,能够强化血脑屏障的通透性,更有助于药物进入与吸收[26]。早期小样本研究已表明 EGFR-TKI 联合放疗是 NSCLC 患者颅内转移的有效治疗手段[27-30],Ma等[30]报道的一项Ⅱ期临床研究中,共21例亚裔 NSCLC脑转移患者接受了WBRT (40 Gy/20 f/4 w) 联合吉非替尼(250 mg/d)治疗,并以吉非替尼 250 mg/d 维持直到患者肿瘤进展或因不良反应作用不能耐受而中止治疗,结果显示中位生存期13.0个月,中位无进展生存期10.0个月,1年期累积生存率为58.7%。本研究结论得出WBRT联合EGFR-TKI治疗组患者的1年期生存率为49.9%,显著高于单纯WBRT治疗患者的26.8%,所得结论与上述相关文献报道结果相符。
由于本研究所纳入的原始文献未按照EGFR基因突变状态进行分组检测,所以无法对基础突变做相关Meta分析。既往有研究报道,靶向治疗对EGFR突变的脑转移患者疗效显著,对颅内病灶的有效率达70%~89%,可明显改善患者的预后,总生存时间可提高至12.9~19.8个月,PFS可提高至6.6~23.3个月,EGFR突变状态在脑转移患者中是一个独立的预后因素,突变患者生存时间更长[31-32]。而Zhuang等[13]的研究结果提示,WBRT联合靶向药物治疗EGFR基因突变与野生型相比并不能显著提高患者的局部PFS及OS,这可能是因为用药时间选择不佳以及样本量较小所导致的结论差异。
本研究仍存在一定的局限性。首先,所得结论主要基于观察性研究结果,相对于随机对照实验有较高的潜在混杂因素;其次,研究数据基于已发表文献,虽然漏斗图显示所纳入的研究中无明显发表偏倚,但因为阳性结果相对于阴性结果更易于发表,发表偏倚仍然是一个问题;第三,所纳入的研究数据多数来源于亚洲人群,因缺乏相应数据行亚组分析,故是否适用于其他人群仍需进一步验证。
总之,本研究证实了WBRT联合EGFR-TKI治疗NSCLC脑转移患者是安全有效的。但目前多为回顾性研究,且在研究设计等方面存在许多缺陷和不足。今后尚需更多大规模前瞻性随机对照试验进一步证实其疗效与安全性。
1钱桂生. 为提高我国呼吸系统疾病的诊治水平而努力[J/CD]. 中华肺部疾病杂志:电子版, 2012, 5(1): 1-3.
2Siegel RL, Miller KD, Jemal A, et al. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5-29.
3Chen AM, Jahan TM, Jablons DM, et al. Risk of cerebral metastases and neurological death after pathological complete response to neoadjuvant therapy for locally advanced nonsmall-cell lung cancer: clinical implications for the subsequent management of the brain[J]. Cancer, 2007, 109(8): 1668-1675.
4Shin DY, Na II, Kim CH, et al. EGFR mutation and brain metas-tasis in pulmonary adenocarcinomas[J]. J Thorac Oncol, 2014, 9(2): 195-199.
5Cai Y, Wang JY, Liu H. Clinical observation of whole brain radiotherapy concomitant with targeted therapy for brain metastasis in non-small cell lung cancer pationts witth chemotherapy failure[J]. Asian Pac J Cancer Prev, 2013, 14(10): 5699-5703.
6Wang F, Ning F, Liu C, et al. Comparison of Gefitinib Versus VMP in the Combination with Radiotherapy for Multiple Brain Metastases from Non-small Cell Lung Cancer[J]. Cell Biochem Biophys, 2015, 71(2): 1261-1265.
7Fu H, Zhang XL, Xiao Y, et al. Evaluation of gefitinib plus radiotherapy
in non-small-cell lungg cancer patients with brain metastases[J]. Zhong hua Yi Xue Za Zhi, 2012, 92(8): 524-527.
8Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605.
9Wells G, Shea B, O′connell, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. 2003. Available at: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.
10Pesce GA, Klingbiel O, Ribi K, et al. Outcome,quality of life and coggnitive function of patients with brain metastases from non-small cell lung cancertreated with whole brain radiotherapy combined with gefitinib or temozolomide. A randomised phase Ⅱ trial of the Swiss Group for Clinical Cancer Research[J]. Eur J Cancer, 2012, 48(3): 377-384.
11Sperduto PW, Wang M, Robins HI, et al. A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non-small cell lung cancer and 1 to 3 brain metastases: Radiation therapy Oncology Group 0320[J]. Int J Radiat Oncol Biol Phys, 2013, 85(5): 1312-1318.
12Lee SM, Lewanski CR, Counsell N, et al. Randomizedtrial of erlotinib Plus Whole-Brain radiotherapy for NSCLC patients with multiple brain metastases[J]. J Natl Cancer Inst, 2014, 106(7): 1-7.
13Zhuang H,Yuan Z, Wang J, et al. Phase II study of whole brain radiotherapy with or without erlotinib in patients with multiple brain metastases from lung adenocarcinoma[J]. Drug Des Devel Ther, 2013, 7: 1179-1186.
14周荻, 徐欣, 谢华英, 等.全脑放疗联合靶向治疗与同步放、化疗治疗非小细胞肺癌脑转移疗效分析[J]. 上海交通大学学报:医学版, 2013, 33(4): 480-484.
15张帆.EGFR-TKIs联合全脑放疗与全脑放疗治疗肺腺癌脑转移疗效分析[J].中国医学工程, 2014, 22(12): 71-72.
16伊生勇, 秦迎春. 吉非替尼联合全脑放射治疗非小细胞肺癌脑转移的临床观察[J]. 河北联合大学学报:医学版, 2012, 14(6): 831-832.
17肖颖, 刘永亮, 王海波, 等. 后程三维适形放疗联合吉非替尼治疗老年非小细胞肺癌脑转移的疗效[J]. 中国老年医学杂志, 2011, 31(10): 1767-1768.
18吴庭安, 林大任, 王智辉, 等. 吉非替尼联合放疗治疗非小细胞肺癌脑转移疗效观察[J]. 中华全科医学, 2012, 10(6): 893-895.
19刘祖华. 全脑放疗联合靶向治疗与同步放、化疗治疗非小细胞肺癌脑转移疗效研究[J]. 中外医学研究, 2015, 13(10): 13-14.
20刘萍. 表皮生长因子受体酪氨酸酶抑制剂联合放疗治疗非小细胞肺癌脑转移临床观察[J]. 中华实用诊断与治疗杂志, 2013, 27(7): 693-694.
21李沫, 季秀杰, 周迪. 厄洛替尼联合全脑放疗治疗非小细胞肺癌脑转移的临床疗效[J].中国老年学杂志, 2015, 35(18): 5184-5186.
22O′Connor MM, Mayberg MR. Effects of radiation on cerebral vasculature:a review[J]. Neurosurgery, 2000, 46(1): 138-149, 150-151.
23Broniscer A, Panetta JC, O Shaughnessy M, et al. Plasma and cerebrospinal fluid pharmacokinetics of erlotinib and its active metabolite OSI_420[J]. Clin Cancer Res, 2007, 13(5): 1511-1515.
24Ceresoli GL, Cappuzzo F, Gregorc V, et al. Gefitinib in patients with brain metastases from non-small-cell lung cancer: a prospective trial [J]. Ann Oncol, 2004, 15(7): 1042-1047.
25Hotta K, Kiura K, Ueoka H, et al. Effect of gefitinib ('Iressa',ZD1839) on brain metastases in patients with advanced non-smallcell lung cancer[J]. Lung Cancer, 2004, 46(2): 255-261.
26邓滨. 三维适形放疗联合紫杉醇化疗对局部晚期非小细胞肺癌的疗效及不良反应 [J]. 中外医学研究, 2012, 10(31): 26.
27Ceresoli GL, Cappuzzo F, Gregorc V, et al. Gefitinib in patients with brain metastases from non-small-cell lung cancer: a prospective trial [J]. Ann Oncol, 2004, 15(7): 1042-1047.
28Hotta K, Kiura K, Ueoka H, et al. Effect of gefitinib ('Iressa',ZD1839) on brain metastases in patients with advanced non-smallcell lung cancer[J]. Lung Cancer, 2004, 46(2): 255-261.
29Wu C, Li YL, Wang ZM, et al. Gefitinib as palliative therapy for lung adenocarcinoma metastatic to the brain[J]. Lung Cancer, 2007, 57(3): 359-364.
30Ma S, Xu Y, Deng Q, et al. Treatment of brain metastasis from nonsmall cell lung cancer with whole brain radiotherapy and Gefitinibin a Chinese population[J]. Lung Cancer, 2009, 65(2): 198-203.
31Jamal-Hanjani M, Spicer J. Epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of epidermal growth factor receptor-mutant non-small cell lung cancer metastatic to the brain[J]. Clin cancer Res, 2012, 18(4): 938-944.
32孙红奎, 郑积华, 张为民. 非小细胞肺癌EGFR突变状况与脑转移研究进展[J]. 中华肿瘤防治杂志, 2014, 21(10): 795-799.
(本文编辑:黄红稷)
金福军,曾川,张献全. 全脑放疗联合靶向药物与单独全脑放疗治疗非小细胞肺癌脑转移疗效及安全性的Meta分析[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(4): 366-371.
Comparison of the efficacy and safety between whole brain radiotherapy combined with targeted drugs and whole brain radiotherapy for non small cell lung cancer with brain metastasis: a Meta analysis
JinFujun,ZengChuan,ZhangXianquan.
OncologyDepartment,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China
ZhangXianquan,Email:xqzhng@126.com
ObjectiveTo compare the efficacy and safety between whole brain radiotherapy(WBRT) combined with targeted therapy and WBRT alone in the treatment of non-small cell lung cancer(NSCLC) with brain metastasis by Meta analysis. MethodsA literature search was conducted among PubMed, Embase, Wanfang and the Chinese National Knowledge Infrastructure databases which related WBRT plus target therapy or WBRT alone in the treatment of NSCLC with brain metastases from inception to May, 2016. Studies quality was assessed by Newcastle-Ottawa Scale(NOS), odds ratios (OR) and 95% confidence intervals (CIs) as effect measures. The data analysis were performed using RevMan5.2. ResultsFifteen eligible studies including 1 084 cases were included. Results showed that compared with WBRT alone, WBRT combined with targeted therapy showed higher disease control rate(OR: 3.09, 95%CI2.11-4.54,P<0.00001)and 1-year overall survival (OR: 2.55, 95%CI1.84-3.54,P<0.00001), differences were statistical significance. In safety part,add targeted therapy were frequently had rash(OR: 9.10,95%CI2.89-28.66,P=0.0002), but all of them were 1-2 grade toxicity and could be tolerated. There were no significant differences in Diarrhea, nausea, vomiting, fatigue, bone marrow suppression and dyspnea(P>0.05). ConclusionWBRT plus target therapy is superior to WBRT alone and well tolerated in the treatment of NSCLC with brain metastases. In addition, more high quality randomized controlled trials are needed.
Non-small cell lung cancer;Brain metastasis;Radiation therapy;Targeted therapy;Meta analysis
10.3877/cma.j.issn.1674-6902.2016.04.003
国家自然科学基金资助项目(81271264)
400010 重庆医科大学附属第二医院肿瘤科
张献全,Email:xqzhng@126.com
R563,R734.2
A
2016-07-02)
