PDCD4、PDCD5及MCL-1蛋白在结直肠癌组织中的表达*
2016-10-12何胜悦
何胜悦, 何 常*
(贵州医科大学附院 病理科, 贵州 贵阳 550004)
·临床研究·
PDCD4、PDCD5及MCL-1蛋白在结直肠癌组织中的表达*
何胜悦**, 何常***
(贵州医科大学附院 病理科, 贵州 贵阳550004)
目的: 探讨程序性死亡因子4 (PDCD4)、5 (PDCD5)及髓样细胞白血病-1(MCL-1)在结直肠癌(CRC)中表达及意义。方法: 应用免疫组化检测PDCD4、PDCD5与MCL-1在CRC(50例)、结直肠腺瘤(20例)和结直肠黏膜慢性炎症(20例)中的表达,同时分析PDCD4、PDCD5及 MCL-1蛋白的表达与CRC患者淋巴结转移、生存期及TNM分期的关系,采用spearman′s方法分析结直肠组织中MCL-1、PDCD4及PDCD5蛋白表达的相关性。结果: PDCD4、 PDCD5 及MCL-1在CRC、结直肠腺瘤、结直肠黏膜慢性炎症中的阳性表达率分别比较,差异有统计学意义(P<0.05);CRC患者标本中,MCL-1与PDCD4(r=-0.401,P<0.05)、PDCD5(r=- 0.445,P<0.05)表达呈负相关,而PDCD4与PDCD5的表达呈正相关(r= 0.510,P<0.05);PDCD4及 MCL-1在CRC组织中的表达与TNM分期、淋巴结转移及5年生存期有关(P<0.05)。结论: CRC发生及发展与PDCD4、PDCD5及MCL-1的蛋白表达有关。
结直肠肿瘤; 程序性细胞死亡因子; 髓样细胞白血病-1; 免疫组织化学
[Abstract]Objective: To explore the expression and clinical significance of PDCD4, PDCD5 and MCL-1 in colorectal cancer (CRC). Methods: The immunohistochemistry was adopted to detect protein levels of PDCD4, PDCD5 and MCL-1 in 50 cases of colorectal cancer, 20 cases of colorectal adenoma and 20 cases of colorectal inflammation. At the same time, the correlation between the expression of PDCD4, PDCD5 and MCL-1 and lymph node metastasis, survival length and TNM staging in patients with colorectal carcinoma was analyzed, and Spearman's method was adopted to analyze the correlation between expression of PDCD4, PDCD5 and MCL-1. Results: There were statistically significant differences in PDCD4, PDCD5 and MCL-1 positive expression rate in the CRC, colorectal adenoma and colorectal inflammation(P<0.05). In CRC patient specimens, MCL-1expresion was negatively correlated with PDCD4 expression(r=-0.401,P<0.05) and PDCD5(r=-0.445,P<0.05) while PDCD4 expression was positively correlated with PDCD5 expression(r=0.510,P<0.05). PDCD4 and MCL-1 expressions in CRC tissues were associated with TNM staging, lymph node metastasis and 5 years survival(P<0.05). Conclusion: The occurrence and development of CRC is correlated with the expression of PDCD4, PDCD5 and MCL-1.
[Key words]colorectal cancer; programmed cell death factor; myeloid cell leukemia-1; immunohistochemistry
近年来,结直肠癌(colorectal cancer, CRC)的发病率与死亡率都呈明显的上升趋势,其机制尚不清楚[1]。有研究认为,CRC的发生、发展和转归与结直肠组织细胞增殖与凋亡的失衡密切相关[2]。程序性细胞死亡因子4 (programmed cell death4,PDCD4)、PDCD 5与髓样细胞白血病-1(myeloid cell leukemia-1,MCL-1)作为凋亡调控分子,影响着细胞周期及凋亡,PDCD表达产物通过抑制相关基因的转录和翻译抑制肿瘤生成,在多种人肿瘤组织细胞中表达缺失或低表达,MCL-1则参与了多种细胞系的凋亡、分化和细胞周期的调控[3-5]。本研究通过检测PDCD4、PDCD 5及MCL-1蛋白的表达,探讨这些细胞因子在CRC中表达的意义。
1 材料与方法
1.1材料与试剂
选取2003年1月~2006年12月行CRC手术,术前未进行化(放)疗的同一组织学类型(管状腺癌Ⅱ级)病例50例,23~81岁,平均52岁;男24例,女26例。选取其中20例远癌处结直肠黏膜慢性炎症组织作为黏膜慢性炎症标本,23岁~48岁, 平均39岁;男11例,女9例。结直肠腺瘤病例20例,25岁~53岁,平均39岁;男13例,女7例。所取CRC、结直肠腺瘤及黏膜慢性炎症标本均经10%中性福尔马林固定,石蜡包埋,切片厚4 μm。PDCD4 、PDCD5 兔抗人多克隆抗体购自北京博奥森,MCL-1 兔抗人多克隆抗体购自武汉博士德,DAB 显色试剂盒购自北京中杉金桥生物技术有限公司。显微镜使用 OLYMPUS BX53 型。
1.2方法
采用免疫组织化学染色法测定PDCD4 、PDCD5及MCL-1蛋白的表达。PBS 代替一抗作为阴性对照。PDCD4、PDCD5以细胞浆有棕黄色显色为阳性,MCL-1以细胞质和(或)细胞核中有棕黄色显色为阳性。所有切片经2名病理医师在不了解患者资料的情况下进行评估,每张切片至少观察5个高倍视野,分别将切片的阳性细胞百分率与阳性细胞的着色强度进行计分。阳性细胞<25%为1分,25%~49%为2分,50%~75%为3分,>75%为4分。染色强度无着色计1分,浅黄色计2分,棕黄色计3分,棕褐色计4分。用阳性细胞得分与着色得分相加,≤4分为低表达,>4分为高表达。
1.3观察指标
比较PDCD4、PDCD5及MCL-1在CRC组织、结直肠腺瘤组织及结直肠黏膜慢性炎症组织中的表达,采用Spearman法分析CRC患者PDCD4 、PDCD5及MCL-1蛋白表达的相关性;同时分析PDCD4 、PDCD5及MCL-1蛋白表达与CRC患者年龄、性别、淋巴转移、生存期及TNM分期的关系。
1.4统计学方法
数据采用软件 SPSS 19.0 处理,计数资料用率(%)表示,数据采用χ2检验;采用Spearman等级相关进行相关性分析; 检验水准取α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1PDCD4、PDCD5及MCL-1蛋白表达
PDCD4、 PDCD5 及MCL-1在3种结直肠组织中均有表达,两两比较,差异有统计学意义(P<0.05)。见表1和图1。
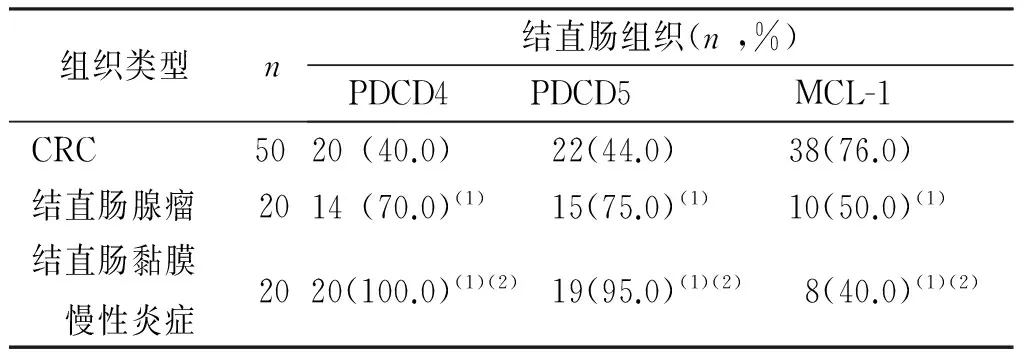
表1 PDCD4、 PDCD5 及MCL-1蛋白在3种结直肠组织中的表达
(1)与CRC比较,P<0.05;(2)与结直肠腺瘤比较,P<0.05
2.2MCL-1、PDCD4、PDCD5蛋白表达在CRC组织中的相关性分析
Spearman′s相关分析显示,在CRC组织中,MCL-1与PDCD4(r=-0.401,P<0.05)、PDCD5(r=- 0.445,P<0.05)表达呈负相关,PDCD4与PDCD5的表达呈正相关(r= 0.510,P<0.05)。
2.3PDCD4、PDCD5及 MCL-1蛋白表达与淋巴结转移、生存期及TNM分期的关系
PDCD4及 MCL-1在CRC组织中的表达与患者的年龄、性别无关(P>0.05),与TNM分期、淋巴转移及5年生存期有关(P<0.05);PDCD5与患者的年龄、性别、淋巴结转移、TNM分期及5年生存期均无关(P>0.05)。见表2。
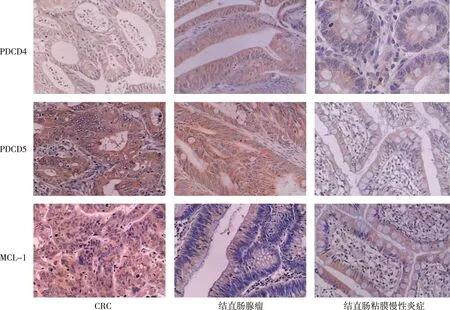
图1 PDCD4、PDCD5及MCL-1蛋白在3种结直肠组织中的表达(Envision,×200)Fig.1 The positive expression of PDCD4, PDCD5 and MCL-1 protein in 3 groups of colorectal tissues
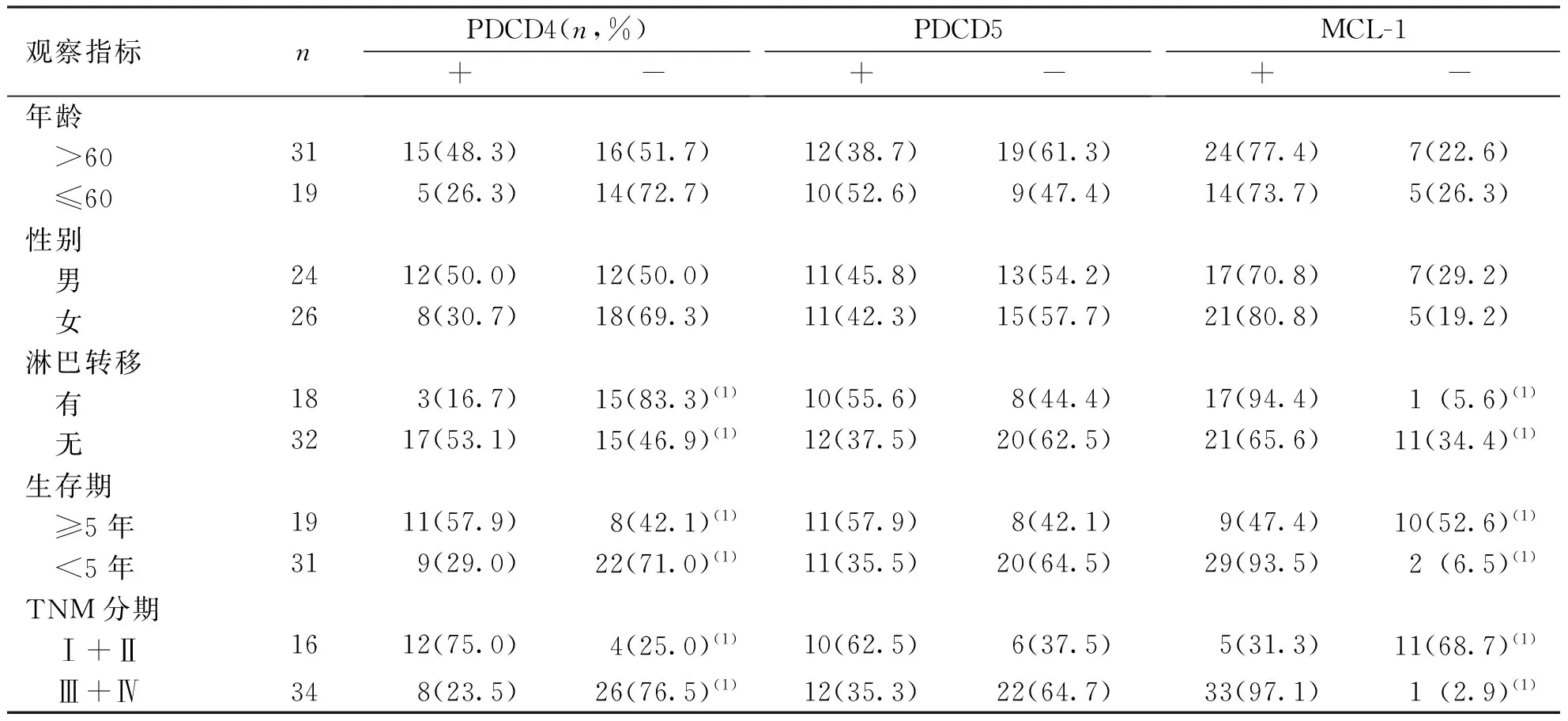
观察指标nPDCD4(n,%)+-PDCD5+-MCL-1+-年龄 >603115(48.3)16(51.7)12(38.7)19(61.3)24(77.4)7(22.6) ≤60195(26.3)14(72.7)10(52.6)9(47.4)14(73.7)5(26.3)性别 男2412(50.0)12(50.0)11(45.8)13(54.2)17(70.8)7(29.2) 女268(30.7)18(69.3)11(42.3)15(57.7)21(80.8)5(19.2)淋巴转移 有183(16.7)15(83.3)(1)10(55.6)8(44.4)17(94.4)1(5.6)(1) 无3217(53.1)15(46.9)(1)12(37.5)20(62.5)21(65.6)11(34.4)(1)生存期 ≥5年1911(57.9)8(42.1)(1)11(57.9)8(42.1)9(47.4)10(52.6)(1) <5年319(29.0)22(71.0)(1)11(35.5)20(64.5)29(93.5)2(6.5)(1)TNM分期 Ⅰ+Ⅱ1612(75.0)4(25.0)(1)10(62.5)6(37.5)5(31.3)11(68.7)(1) Ⅲ+Ⅳ348(23.5)26(76.5)(1)12(35.3)22(64.7)33(97.1)1(2.9)(1)
(1)与同一指标阳性比较,P<0.05
3 讨论
CRC早期临床症状并不明显,易被忽视,而在症状明显就诊时患者多已经进入晚期,目前治疗CRC,仍以手术切除为主,术后配合化疗、放疗等辅助综合治疗。治疗效果并不理想[1-2]。因此探讨如何早期发现并诊断CRC,为患者提供积极有效的治疗措施就显得甚为重要。PDCD4共编码185个氨基酸,位于人类染色体 10q24,PDCD4主要是通过促进肿瘤细胞的凋亡进而抑制了肿瘤的生长[2]。其编码蛋白具有多个磷酸化位点,可与蛋白激酶 C、脯氨酸激酶及酪氨酸激酶相结合,其促凋亡机制可能是通过抑制核糖体复合物的形成以及蛋白质的翻译进而诱发了细胞的凋亡[3]。Fassan M等[6]发现PDCD4在食道癌的发生中起重要作用。在众多恶性肿瘤中都发现该基因 mRNA及蛋白表达减少乃至缺失,亦与肿瘤病理的分期和预后有着密切的关系,并一定程度上影响了细胞的生长、凋亡与肿瘤抑制[7]。与本研究结果PDCD4在结直肠腺瘤与结直肠粘膜慢性炎症的阳性表达率要高于CRC的阳性表达率一致。在其与临床病理关系的分析中发现,PDCD4在CRC中的表达与TNM分期、淋巴结转移及5年生存期有关(P<0.05),提示PDCD4的表达对CRC的发病及预后存在这一定的关系。PDCD5可结合活化的caspase-3,延长活化的caspase-3 的体外半衰期,促进细胞凋亡;还可通过线粒体膜的通透性转运孔的开放以及细胞色素C等凋亡相关因子的释放,引起膜电位降低,促进凋亡的发生[4]。PDCD5还可以直接与p53作用,增加p53依赖的下游凋亡相关分子表达[8],进而诱导细胞凋亡。本研究结果显示PDCD5在结直肠粘膜炎症与结直肠腺瘤的阳性表达率高于CRC的阳性表达率,但PDCD5在CRC中的表达与患者的年龄、性别、淋巴结转移、TNM分期及生存期均无关(P>0.05)。从一方面表明,PDCD5可能在不同程度上影响了细胞从癌前病变至癌的进程, 并在癌症的早期有较为明显的表达,为CRC的早期诊断和治疗上提供了一种新的可能性。结合对软骨肉瘤、慢性粒细胞性白血病患者可采用重组PDCD5的联合疗法,说明PDCD5能增加肿瘤细胞的化学敏感性。也为CRC的治疗提供了新的依据[9-10]。MCL-1作为一个重要的抗凋亡基因,该基因定位于人类染色体的19q12-q13,包含了6个外显子和5个内含子,而且其外显子6可能是编码与促凋亡活动相关的结构域。在有关鼻 NK 细胞淋巴瘤的研究中,发现STAT3 高频激活与 MCL-1 的表达存在密切的关系,而且通过抑制 STAT3 的活性也可降低 MCL-1 的表达并诱导凋亡的发生[5]。本研究发现MCL-1在CRC中高表达,并且MCL-1的表达也与CRC的TNM分期、淋巴结转移及5年生存期有关(P<0.05),与MCL-1蛋白在多发性骨髓瘤组织中的表达升高一致[11]。
综上,CRC的发生及发展与PDCD4、PDCD5及MCL-1的表达有关,与此同时,本研究中对PDCD4、 PDCD5 与MCL-1表达的相关性分析显示3者在CRC发生发展中存在着一定的相互作用,提示联合检测分析PDCD4 、PDCD5与MCL-1的表达也为CRC的诊断与治疗提供了新的可能性。
[1]宋晓昕. Fascin、β-catenin、E-cadherin 在大肠管状腺瘤癌变过程中的表达及意义[J]. 河北医药, 2010(16): 2178-2180.
[2]Itani S, Kunisada T, Morimoto Y,et al.MicroRNA-21 correlates with tumorigenesis in malignant peripheral nerve sheath tumor (MPNST) via programmed cell death protein 4 (PDCD4) [J]. J Cancer Res Clin Oncol, 2012 (9):1501-1509.
[3]Wedeken L,Singh P,Klempnauer KH.Tumor suppressor protein Pdcd4 inhibits translation of p53 mRNA[J]. J Biol Chem, 2011 (50):42855-42862.
[4]Wang L,Wang C,Su B,et al. Recombinant human PDCD5 protein enhances chemosensitivity of breast cancer in vitro and in vivo[J].Biochem Cell Biol, 2013 (6):526-531.
[5]Tsutsui M, Yasuda H, Suto H, et al. Frequent STAT3 activation is associated with Mcl-1 expression in nasal NK-cell lymphoma[J]. Int J Lab Hematol, 2010(4):419-426.
[6]Fassan M,Pizzi M,Battaqlia G,et al.Programmed cell death 4(PDCD4) expression during muhistep Barrett’s carcinogenesis[J].J Clin Pathol, 2011 (3):274.
[7]Wang W, Zhao J, Wang H, et al.Progammed cell death 4(PDCD4 ) mediates the sensitivity of gastric cancer cells to TRAIL-induced apoptosis by down mgulmi on of FLIP expression[J].Exp Cel l Res, 2010 (15):2456-2464.
[8]Xu L, Hu J, Zhao Y, et al. PDCD5 interacts with p53 and functions as a positive regulator in the p53 pathway[J]. Apoptosis, 2012 (11):1235-1245.
[9]Chen C, Zhou H, Xu L, et al. Recombinant human PDCD5 sensitizes chondrosarcomas to cisplatin chemotherapy in vitro and in vivo[J].Apoptosis, 2010 (7): 805-813.
[10]Shi L, Song Q, Zhang Y, et al. Potent antitumor activities of recombinant human PDCD5 protein in combination with chemotherapy drugs in K562 cells[J]. Biochem Biophys Res Commun, 2010 (2): 224-230.
[11]王孟昌,张斌.髓样细胞白血病-1基因在多发性骨髓瘤发病中的分子机制[J].西安交通大学学报:医学版, 2011(4):429-432.
(2016-03-15收稿,2016-05-26修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Expression of PDCD4, PDCD5 and MCL-1 in Colorectal Carcinoma
HE Shengyue, HE Chang
(DepartmentofPathology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
贵州省科技厅基金(E2010-4)**贵州医科大学病理科2013级硕士研究生
R735.3
A
1000-2707(2016)08-0927-04
10.19367/j.cnki.1000-2707.2016.08.015
***通信作者 Email:2077166911@qq.com
网络出版时间:2016-08-23网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160823.1343.066.html
