昆虫肠道共生菌中产γ-氨基丁酸菌株的筛选及鉴定
2016-09-29王艳新刘开新夏婷婷金海如
唐 帅, 王艳新, 刘开新, 夏婷婷, 金海如
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
昆虫肠道共生菌中产γ-氨基丁酸菌株的筛选及鉴定
唐帅,王艳新,刘开新,夏婷婷,金海如
(浙江师范大学 化学与生命科学学院,浙江 金华321004)
从白蚁、蜜蜂、蝗虫、蜻蜓等10种昆虫肠道中分离得到昆虫肠道共生菌51株,采用薄层色谱法初筛、高效液相色谱法复筛,获得了多株产γ-氨基丁酸(GABA)的菌株.对其中一株GABA产量较高的菌株FE-7进行了显微形态观察、生理生化与16S rDNA扩增序列系统发育分析,鉴定FE-7可能为芽孢杆菌属的一个新种,其发酵液中GABA含量初测为2.1 g/L以上.表明从昆虫肠道特境中筛选产γ-氨基丁酸菌株具有开发前景.
共生菌;昆虫肠道;γ-氨基丁酸;筛选;鉴定
γ-氨基丁酸(γ-aminobutyricacid,GABA)是一种非蛋白质氨基酸,广泛分布于动植物、藻类、细菌和真菌中[1-2],在动物大脑、脊髓中作为一种重要的抑制性神经传递物质,具有降血压、利尿、镇静、改善神经系统、增加神经营养、促进生长激素分泌、治疗癫痫和焦虑、活化肾功能和肝功能等[3-5]多种生理功能.
传统微生物发酵法是以谷氨酸或其钠盐及富含谷氨酸的物质等为原料,利用具有谷氨酸脱羧酶(GAD)活性的大肠杆菌、曲霉菌、乳酸菌和酵母菌等微生物发酵制得γ-氨基丁酸,具有成本低、含量高的优点[6-9].已知产γ-氨基丁酸的菌株主要来源为土壤、奶制品及发酵制品等,而在特境中生长和繁殖的微生物资源开发利用非常少.
昆虫肠道微生物指能生长繁殖于昆虫肠道环境的微生物菌群.许多昆虫的细胞组织和肠道特境中含有大量的共生菌[10-12].肠道共生菌含有多种酶系统,如:植物性或腐食性昆虫白蚁的生长繁殖就与其后肠道中存在的微生物代谢密切相关[13];细菌中,谷氨酸脱羧酶系统控制的GABA的合成和分泌是细菌抵抗极端酸性pH特境的主要机制[14-15].本研究从白蚁、蜜蜂、蝗虫、蜻蜓等昆虫肠道中培养、分离,并经薄层色谱法初筛和高效液相色谱法复筛,筛选出发酵法产GABA的菌株,并进一步对高产GABA的菌株进行了鉴定,表明从昆虫肠道特境中筛选产GABA的菌株具有挖掘前景,为开发产GABA的其他菌种提供了参考依据.
1 材 料
1.1菌株来源
本实验以从金华市郊外捕获的健康白蚁、蚱蜢、蜜蜂、蜻蜓等昆虫样品作为实验材料,分离纯化昆虫肠道内可培养菌作为筛选出发菌.
1.2培养基
1)MEA培养基:麦芽浸膏20 g,蔗糖20 g,蛋白胨1 g,琼脂粉20 g,溴甲酚绿0.1 g,蒸馏水1 000 mL,pH 5.5.
2)PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 mL,pH自然.
3)种子培养基:葡萄糖10 g,蛋白胨5 g,酵母膏1 g,玉米浆3 g,KH2PO41 g,蒸馏水1 000 mL,pH 5.5.
4)发酵培养基:葡萄糖10 g,胰蛋白胨20 g,乙酸钠1 g,酵母膏1 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,KH2PO41 g,L-谷氨酸5 g,谷氨酸钠5 g,磷酸吡哆醛0.05 g,蒸馏水1 000 mL,pH 5.5.
1.3主要仪器设备及药品
超净工作台、高压蒸汽灭菌锅、恒温培养箱、离心机、紫外可见分光光度计、分析天平、摇床、显微镜、移液枪、扫描仪、高效液相色谱仪(Agilent 1260).
γ-氨基丁酸(sigma公司)、甲醇(色谱纯)、L-谷氨酸、茚三酮、75%乙醇溶液、正丁醇、冰醋酸、邻苯二甲醛.
2 方 法
2.1昆虫肠道共生菌的分离
[16].从郊外捕获的健康白蚁、蚱蜢、蜜蜂、蜻蜓等昆虫样品作为实验材料,分装于灭菌玻璃瓶送至实验室饥饿处理24 h,昆虫样品用75%乙醇液消毒2 min,之后用无菌蒸馏水冲洗3次,再用无菌解剖钳子取出昆虫内脏肠道,捣匀后稀释为10-1,10-2,10-3系列梯度后,分别取稀释成不同浓度的汁液0.1 mL,无菌涂布于MEA培养基平板上,30 ℃培养1~2 d.挑取长出的菌落周围培养基变为黄色的单菌落,初步确定为产酸菌,菌体采用平板划线法在PDA平板上反复划线培养,获得纯菌株.将分离纯化后的单菌落接入PDA固体斜面培养基,编号后于4 ℃冰箱保存,作为后续复筛菌株.每2周转接1次.
2.2产GABA共生菌的初筛
将从昆虫肠道中分离获得的单菌落在PDA培养基上活化培养后,分别用接种针挑取一环至装有50 mL无菌种子培养基的250 mL三角瓶中,30 ℃,110 r/min摇床培养24 h,制得种子菌液.将种子菌液以4%接种量分别转接到装有50 mL无菌发酵培养基的250 mL三角瓶中,30 ℃,110 r/min摇床培养发酵72~96 h.取发酵液离心过滤处理后进行硅胶薄层色谱检测,定性测定发酵液中是否含GABA,初步筛选出产GABA的菌株.
2.3产GABA共生菌的复筛
将硅胶薄层色谱显色结果较明显的菌株,按上述初筛发酵条件进行发酵后取发酵液离心过滤,再用邻苯二甲醛柱前衍生处理,利用高效液相色谱检测发酵液中的GABA及其含量,确定目的菌株,并筛选出GABA产量较高的菌株.
2.4发酵液中GABA的检测
1)薄层色谱法[17]:发酵培养完成后,取一定量发酵液水浴煮沸10 min,离心过滤,12 000 r/min离心10 min,取上清液,薄层色谱硅胶板上点样,点样量为2 μL,以5 g/L标准γ-氨基丁酸作参比,置于加有4%茚三酮的展开剂(V(正丁醇)∶V(冰醋酸)∶V(水)=4∶1∶3)中层析6~8 h后,70 ℃显色15 min.
2)高效液相色谱法[18]:色谱柱为Amethyst C18柱,250 mm×4.6 mm,5 μm;流动相A为纯甲醇,流动相B为乙酸钠缓冲溶液(pH 5.8)-甲醇(V(乙酸钠)∶V(甲醇)=55∶45)混合溶剂.紫外检测波长为336 nm.
15 mmol/L乙酸钠缓冲溶液:准确称取1.583 0 g三水合乙酸钠,加水1 000 mL,用冰醋酸调pH值至5.8,混匀后用0.45 μm滤膜过滤,备用.
2.5分子生物学鉴定
以通用引物7F(CAGAGTTTGATCCTGGCT)和1540R(AGGAGGTGATCCAGCCGCA)扩增细菌的16S rDNA基因;以通用引物NS1(GTAGTCATATGCTTGTCTC)和NS6(GCATCA CAGACCTGTTATTGCCTC)扩增真菌16S rDNA.PCR产物纯化后寄送上海生工生物工程有限公司测序,测序结果进行BLAST搜索同源序列比对,选取相似序列,利用MEGA 5.1建树,鉴定菌株.
3 结果与分析
3.1产GABA共生菌的初筛
从捕获昆虫的肠道中分离培养出51株可培养菌株.部分产酸菌株的平板图见图1和图2.
培养发酵后,离心处理发酵液,利用薄层色谱硅胶板进行色谱检测,其中部分菌株发酵液中GABA色谱展开图见图3.由图3可以看出:最左边标准GABA样品的色谱斑点清晰明显,Rf=0.397;部分昆虫肠道共生菌发酵液的色谱GABA
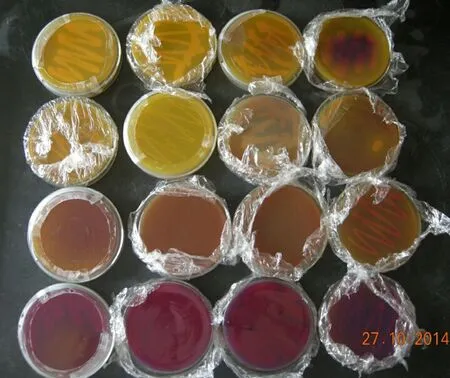
图1 部分产酸菌株初筛平板(含溴甲酚绿)图

图2 几株产GABA菌株平板(含溴甲酚绿)图
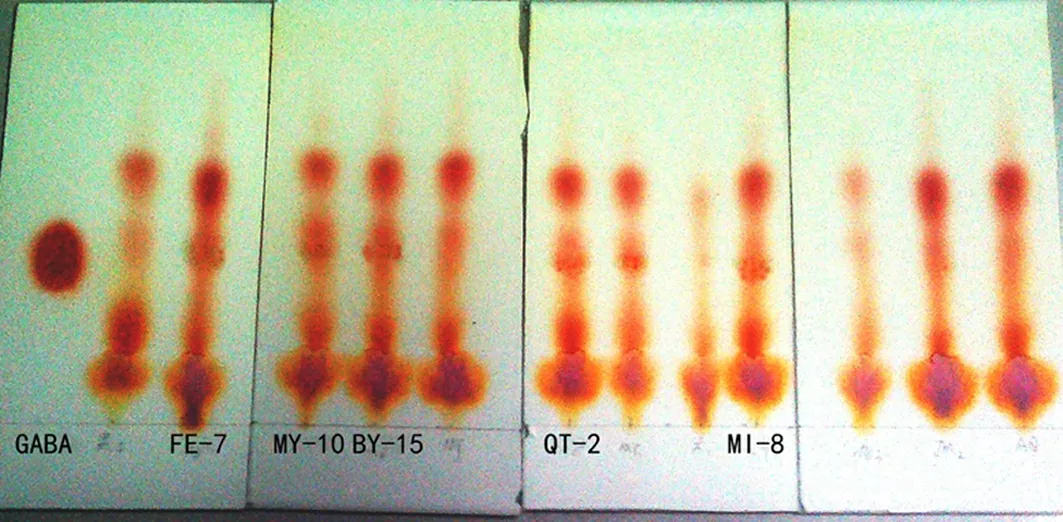
图3部分产GABA菌株发酵液薄层色谱结果
斑点位置与标准品基本相同,Rf值在0.39左右.初步判断筛选出的菌株为产GABA的菌株.
3.2产GABA共生菌的复筛
对薄层色谱初筛GABA色谱斑点较深的菌株进行发酵,对发酵液进行邻苯二甲醛柱前衍生处理后,高效液相色谱检测发酵液中的GABA及其含量[18].GABA标准品和发酵液中GABA的高效液相色谱结果见图4和图5.
由图5可以看出,昆虫肠道共生菌发酵液样品色谱图中的杂质峰能实现较好的分离,保留时间为9.264 min处的峰与图4中γ-氨基丁酸标准品峰的保留时间9.270 min几乎一致,表明目的菌株为产GABA的菌株.高效液相色谱法筛选出FE-7菌株的GABA产量较高,其优化发酵液中GABA含量初测为2.1 g/L以上(见表1).
3.3产GABA菌株FE-7的鉴定
对菌株FE-7进行了形态学观察,结果见图6和图7.该菌株在PDA培养基上30 ℃培养2 d后,菌落形态为平坦圆状,乳白色,革兰氏染色为阳性;其显微形态观察为球杆状,单个或成队,长度为4.1~6.3 μm;芽孢次端生,椭圆形.
3株肠道菌的部分生理生化糖类发酵实验结果见表2.

图4 γ-氨基丁酸标准品的色谱图

图5 昆虫肠道共生菌发酵液样品的色谱图

菌株编号FE-7MY-10BY-15QT-2MI-8GABA产量/(g·L-1)2.363a,A2.271b,B2.172c,C1.643d,D1.124e,E
注:数据为3次测定的平均值.经Duncan氏新复极差法检验,不同大小写字母分别表示在P≤0.01和P≤0.05水平上差异显著.

图6 FE-7菌株的菌落形态

图7 FE-7菌株的显微形态(×400)

发酵糖种类菌株MY-10FE-7BY-15发酵糖种类菌株MY-10FE-7BY-15葡萄糖+++棉籽糖+dd乳糖+++果糖+++D-半乳糖+++D-木糖+--蔗糖+++山梨醇++d麦芽糖+++鼠李糖---可溶性淀粉++-
注:+表示反应结果为阳性;-表示反应结果为阴性;d表示反应结果不能确定.
对FE-7菌株进行了分子生物学鉴定,其碱基序列长度为1 393 bp.FE-7菌株的系统发育树见图8.
通过16S rDNA扩增序列同源性及系统发育分析,FE-7菌株的遗传进化距离与芽孢杆菌属最近,但其遗传进化分支上无高同源性菌株,表明该菌可能为芽孢杆菌属的一个新种.将菌株FE-7命名为肠道芽孢杆菌(Bacillussp.).

图8FE-7菌株系统发育树
4 讨 论
地球上数量巨大的昆虫种类暗示了存在于它们肠道中的共生微生物的多样性,昆虫肠道微生物是寻求新的微生物种类和代谢产物的宝贵资源[19].昆虫肠道微生物的研究,不但有利于昆虫资源的开发利用,而且有利于从昆虫肠道这一特境中获得特殊功能的细菌资源[20].现阶段,对昆虫肠道共生菌的研究还处于初级阶段,且研究肠道微生物的昆虫种类较少,主要研究在植物病害防治和有害昆虫防治方面,而对昆虫肠道共生菌产活性氨基酸的研究未见报道.
本实验的目的是通过从特境——昆虫肠道中筛选共生菌,为微生物发酵产γ-氨基丁酸挖掘其他类型的菌种.本研究从多种昆虫肠道中培养、分离得到多株产GABA的肠道内生菌,鉴定出菌株FE-7可能为芽孢杆菌属的一个新种,表明从昆虫肠道特境中筛选产GABA菌株具有开发前景,同时也为挖掘其他新型菌种提供了参考依据.
参考文献:
[1]Ueno H.Enzymatic and structural aspects on glutamate decarboxylase[J].Journal of Molecular Catalysis B:Enzymatic,2000,10(1):67-79.
[2]Kazuhito H,Masayuki K,Keiko K,et al.Effect of aγ-aminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].British Journal of Nutrition,2004,92(3):411-417.
[3]Lin Zhi,Saito H,Omori M,et al.Effect of gabaron tea on the blood pressure and kidney function of rats loaded with saline [J].Nippon Kaseigaku Kaishi,2000,51(4):265-271.
[4]Leventhal A G,Wang Yongchang,Pu Mingling,et al.GABA and its agonists improved visual cortical function in senescent monkeys[J].Science,2003,300(5620):812-815.
[5]Carcia M C,Adler-Graschinsky E,Celuch S M.Role of CGRP and GABA in the hypotensive effect of intrathecally administered anandamide to anesthetized rats[J].European Journal of Pharmacology,2006,532(1/2):88-98.
[6]Plokhov A Y,Gusyatiner M M,Yampolskaya T A,et al.Preparation ofγ-aminobutyric acid usingE.colicell with high activity of glutamate decarboxylase[J].Applied Biochemistry and Biotechnology,2000,88(1):257-265.
[7]蒋冬花,后家衡,李杰,等.红腐乳中高产γ-氨基丁酸红曲霉菌株的筛选[J].浙江师范大学学报:自然科学版,2007,30(4):447-452.
[8]李秀凉,孙晓宇,韩晓云,等.产γ-氨基丁酸的乳酸菌株的诱变选育[J].食品科技,2012,37(9):16-19.
[9]Takahashi T,Furukawa A,Hara S,et al.Isolation and characterization of sake yeast mutants deficient inγ-aminobutyric acid utilization in sake brewing[J].Journal of Bioscience & Bioengineering,2004,97(6):412-418.
[10]Dillon R J,Dillon V M.The gut bacteria of insects:nonpathogenic interactions[J].Annual Review of Entomology,2004,49(1):71-92.
[11]Douglas A E.The molecular basis of bacterial-insect symbiosis[J].Journal of Molecular Biology,2014,426(23):3830-3837.
[12]Ferrari J,Vavre F.Bacterial symbionts in insects or the story of communities affecting communities[J].Philosophical Transactions of The Royal Society B:Biological Sciences,2011,366(1569):1389-1400.
[13]Andreas B.Symbiotic digestion of lignocellulose in termite guts[J].Nature Reviews Microbiology,2014,12(3):168-180.
[14]Castanie-Cornet M P,Penfound T A,Smith D,et al.Control of acid resistance inEscherichiacoli[J].Journal of Bacteriology,1999,181(11):3525-3535.
[15]Lin J,Smith M P,Chapin K C,et al.Mechanisms of acid resistance in enterohemorrhagicEscherichiacoli[J].Applied and Environmental Microbiology,1996,62(9):3094-3100.
[16]Mathew G M,Ju Y M,Lai C Y,et al.Microbial community analysis in the termite gut and fungus comb ofOdontotermesformosanus:the implication ofBacillusas mutualists[J].FEMS Microbiology Ecology,2012,79(2):504-517.
[17]李亚莉,秘鸣,魏珍珍,等.一株产GABA酵母菌的筛选及鉴定[J].食品科技,2013,38(6):17-21.
[18]贤乾隆,黄翠姬,杨振媚,等.高效液相色谱法测定乳酸菌发酵液中γ-氨基丁酸的含量[J].中国调味品,2013,38(3):50-54.
[19]Zhang Yinglao,Ge Huiming,Zhao Wei,et al.Unprecedented immunosuppressive polyketides fromDaldiniaeschscholzii,a mantis-associated fungus[J].Angew Chem Int Ed Engl,2008,47(31):5823-5826.
[20]Li Shuai,Shao Mingwei,Lu Yihui,et al.Phytotoxic and antibacterial metabolites from Fusarium proliferatum ZS07 isolated from the gut of long-horned grasshoppers[J].Journal of Agricultural and Food Chemistry,2014,62(36):8997-9001.
(责任编辑薛荣)
Screening and identify of symbiotic bacteria producingγ-aminobutyric acid from insect gut
TANG Shuai,WANG Yanxin,LIU Kaixin,XIA Tingting,JIN Hairu
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
51 intestinal symbiotic strains were isolated from 10 species of insect gut samples (termites, bees, locusts, dragonflies etc.). Severalγ-aminobutyric acid producing strains were obtained by screening comprised approach of TLC, HPLC. The high-yieldγ-aminobutyric acid producing strain FE-7 was identified as a possible new species of the genus bacillus based on microscopic morphology observation, physiological and biochemical characteristics and 16S rDNA sequence amplification phylogenetic analysis. The content of GABA was over 2.1 g/L in the raw fermented liquid. Thereby, screening of symbiotic bacteria producingγ-aminobutyric acid from special intestinal condition of insect would be useful and prospective development.
symbiotic bacteria; insect gut;γ-aminobutyric acid (GABA); screening; identify
10.16218/j.issn.1001-5051.2016.03.015
收文日期:2015-09-22;2015-11-09
国家自然科学基金资助项目(41371291);浙江省自然科学基金资助项目(LY12C01002)
唐帅(1990-),男,四川宜宾人,硕士研究生.研究方向:微生物学.
金海如.E-mail: hrjin@zinu.cn
Q939.99
A
1001-5051(2016)03-0320-05
