TUBB3、TYMS mRNA在进展期食管胃交界部腺癌组织中的表达及与新辅助化疗疗效的关系
2016-09-27李守淼刘志强万云杰李保中张志忠
李守淼,韩 朋,张 伟,刘志强,万云杰,李保中,张志忠
(1.安阳市肿瘤医院外科,河南 安阳 455000;2.安阳市肿瘤医院病理科,河南 安阳 455000)
TUBB3、TYMS mRNA在进展期食管胃交界部腺癌组织中的表达及与新辅助化疗疗效的关系
李守淼1,韩朋2,张伟1,刘志强1,万云杰1,李保中1,张志忠1
(1.安阳市肿瘤医院外科,河南 安阳 455000;2.安阳市肿瘤医院病理科,河南 安阳 455000)
目的探讨β-微管蛋白Ⅲ(TUBB3)和胸苷酸合成酶(TYMS)mRNA在进展期食管胃交界部腺癌(AEGJ)组织中的表达情况及在XP方案新辅助化疗疗效预测中的价值。方法54例进展期AEGJ患者均行XP方案化疗,并评价疗效。用分支DNA-液相芯片技术检测TUBB3、TYMS mRNA的表达情况,分析各基因表达与化疗疗效的关系。结果54例患者新辅助化疗有效率为48.15%。TUBB3、TYMS mRNA的低表达率分别18.52%%和25.93%;TUBB3、TYMS mRNA的表达与化疗敏感性有关。结论TUBB3、TYMS mRNA低表达是XP方案新辅助化疗敏感性的影响因素,两者的表达情况可为AEGJ个体化新辅助化疗方案的选择提供有益的参考。
食管胃交界部肿瘤;新辅助化疗;β-微管蛋白Ⅲ;胸苷酸合成酶
[Abstract]ObjectiveTo investigate the expressions of TUBB3,TYMS mRNA in the locally advanced adenocarcinoma of esophagogastric junction(AEGJ) and the relationship with efficacy of neoadjuvant chemotherapy.MethodsThe 54 patients with locally advanced AEGJ were given with XP neoadjuvant chemotherapy regimen,and the efficacy were evaluated.The expressions of TUBB3,TYMS mRNA were detected by multiplex branched-DNA liquid chip technology in all the patients before neoadjuvant chemotherapy.The relationship between various genes and chemotherapy efficacy was analyzed by univariate and logistic multivariate regression analyses.ResultsThe overall response rates was 48.15%.The low expression rate of TUBB3,TYMS mRNA in the locally advanced AEGJ was 18.52% and 25.93%.Low expressions of TUBB3,TYMS mRNA were seen as risk factors for drug-resistance.ConclusionLow expressions of TUBB3,TYMS mRNA are important factors for XP regimen insensitivity in the locally advanced AEGJ.They may provide an useful reference for designing individualized chemotherapeutic regimens for patients with locally advanced AEGJ.
[Key words]esophagogastric junction neoplasms; neoadjuvant chemotherapy; β-tubulin Ⅲ; thymidylate synthase
近年来食管胃交界部腺癌(adenocarcinoma of esophagogastric junction,AEGJ)的发病呈增长趋势[1-2]。现已证实新辅助化疗用于进展期胃癌能提高手术切除率、减少术后复发转移、延长生存期[3]。但对于Siewert Ⅱ型食管胃交界部腺癌新辅助化疗的疗效针对性研究较少。寻找可靠的化疗敏感性预测指标、早期筛选出对化疗应答不敏感的患者、减少不必要的术前化疗,已成为重要临床课题之一[4-5]。针对于此,我们回顾性研究了β-微管蛋白Ⅲ(β-tubulin Ⅲ,TUBB3)和胸苷酸合成酶(thymidylate synthetase,TYMS) mRNA在进展期AEGJ化疗前活检标本中的表达,评价两者表达情况在XP方案新辅助化疗疗效种的预测作用,为AEGJ的个体化治疗提供重要的依据。
1 资料与方法
1.1临床资料收集2012年6月至2015年9月在安阳市肿瘤医院行新辅助化疗并行基因检测的54例进展期Siewert Ⅱ型AEGJ患者,男39例,女15例;年龄34~70岁,中位年龄58岁;治疗前临床分期均为T3~4N1~3M0;术前病理类型:高-中分化腺癌4例,中分化腺癌11例,中-低分化腺癌14例,低分化腺癌21例,黏液腺癌2例,印戒细胞癌1例,黏液腺癌伴印戒细胞癌1例。分化良好型[6]21例,分化不良型33例。研究对象的选择标准:1)胃镜活检病理确诊为腺癌;2)排除远处转移;3)腹部增强CT显示局部肿块侵犯胃壁全层(T3或T4)或有区域淋巴结肿大;4)所有患者ECOG评分为0~2分,且无严重心、肺、肝、肾等脏器功能异常;5)无其他恶性肿瘤病史及放、化疗史;6)签署知情同意书,愿意接受术前化疗及手术者。
1.2治疗方案所有54例患者均行XP 3周方案新辅助化疗:紫杉醇注射液175 mg·m-2,静脉滴注2~3 h,第1天;卡培他滨胶囊1 000 mg·m-2,口服,2次/d,第1~14天。3周后重复,共2次。化疗同时予以地塞米松、西米替丁、格拉司琼、苯海拉明等辅助用药治疗。化疗结束后4周进行术前疗效评价,若无肿瘤进展则行标准根治术(D2),术后给予常规辅助化疗。根据2010年美国癌症联合会(american joint committee on cancer,AJCC)第7版TNM分期标准[7]进行术后病理分期,其中Ⅱ期18例、Ⅲ期34例(1例大体观肿瘤消失,镜下仅见散在癌细胞簇,另1例在病灶边缘及基底部仍见片状癌灶,难以分期)。
1.3检测方法
1.3.1临床检查在新辅助化疗前后分别进行胃镜(或超声胃镜)、64排增强CT检查进行对比疗效评价,手术患者术后行病理组织学检查、疗效评价。
1.3.2基因靶标检测将活检常规石蜡包埋肿瘤标本送广州益善生物技术有限公司医学检验中心对标本进行TUBB3、TYMS mRNA表达水平检测。采用分支DNA-液相芯片技术同时定量检测组织中TUBB3、TYMS mRNA表达水平。与传统方法不同,该方法不需要进行RNA的提取及PCR的扩增,而是通过捕获目标RNA、信号放大、Luminex检测获得检测结果,提高了准确性及可重复性。
具体步骤:取患者病理石蜡包埋组织样本进行裂解样本,使其释放样本中的RNA,试剂盒中的微粒球进一步捕获目标RNA,进而放大RNA信号,采用Luminex检测目标mRNA的表达结果。对Luminex 2001M多功能流式荧光点阵仪检测所得的原始数据进行校正和均一化处理,得到的netMFI值即为TUBB3,TYMS mRNA的相对表达量。
mRNA表达结果判定标准:通过分支DNA液相芯片技术对进展期AEGJ组织中TUBB3、TYMS mRNA表达水平进行检测,检测结果以高、中、低表示,相对表达量≥75%为高表达,25%~<75%为中表达(60%~<75%为中偏高,40%~<60%为中表达,25%~<40%为中偏低表达),<25%为低表达(其中<10%为超低表达)。将mRNA相对表达量<25%作为低表达,而≥25%合并为中高表达。将中高表达的患者作为耐药危险因素。各mRNA表达水平的高低反映化疗耐药的高低,是判断预后的重要指标。表达水平越低,化疗的药物敏感性则越高。数据库为数千例的中国胃癌人群数据库(数据库由广州益善医学检验所建立)。检测结果分析以广州益善个体化医疗系统化疗方案的形式发出。
1.4疗效判断以新辅助化疗前后胃镜(或超声胃镜)、64排增强CT及术后病理切片作为疗效判断的证据。新辅助化疗后原发病灶的疗效判定根据RECIST 1.0[4]标准评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),以CR+PR计算有效率。毒副反应采用NCI-CTC 3.0毒副反应分度标准判定[5]。

2 结果
2.1临床疗效近期疗效评价结果显示,CR 1例,PR 25例,SD 23例,PD 5例,新辅助化疗后均行R0切除。患者的性别、年龄、临床分期与化疗疗效无关(P>0.05)。见表1。

表1 54例患者的近期疗效与临床病理特征的关系 n
2.2治疗情况入组54例患者全部完成2周期XP方案新辅助化疗。毒副反应主要为恶心、呕吐、粒细胞减少、血小板减少、外周神经毒性,经对症治疗后缓解,未出现Ⅲ度及以上毒副反应。新辅助化疗后4周行标准根治术(D2)。术后并发症:2例患者出现吻合口出血,2例患者出现吻合口瘘,均经保守治疗后痊愈。

Logistic多因素回归分析结果显示TUBB3、TYMS mRNA低表达是影响新辅助化疗疗效的独立因子(P=0.031、0.012)。见表2。
Spearman相关分析显示:TYMS mRNA低表达与肿瘤的分化程度呈负相关(r=-0.335,P=0.015),而其他各因素之间均无明显相关性。
表2近期疗效影响因素Logistic多因素回归分析结果
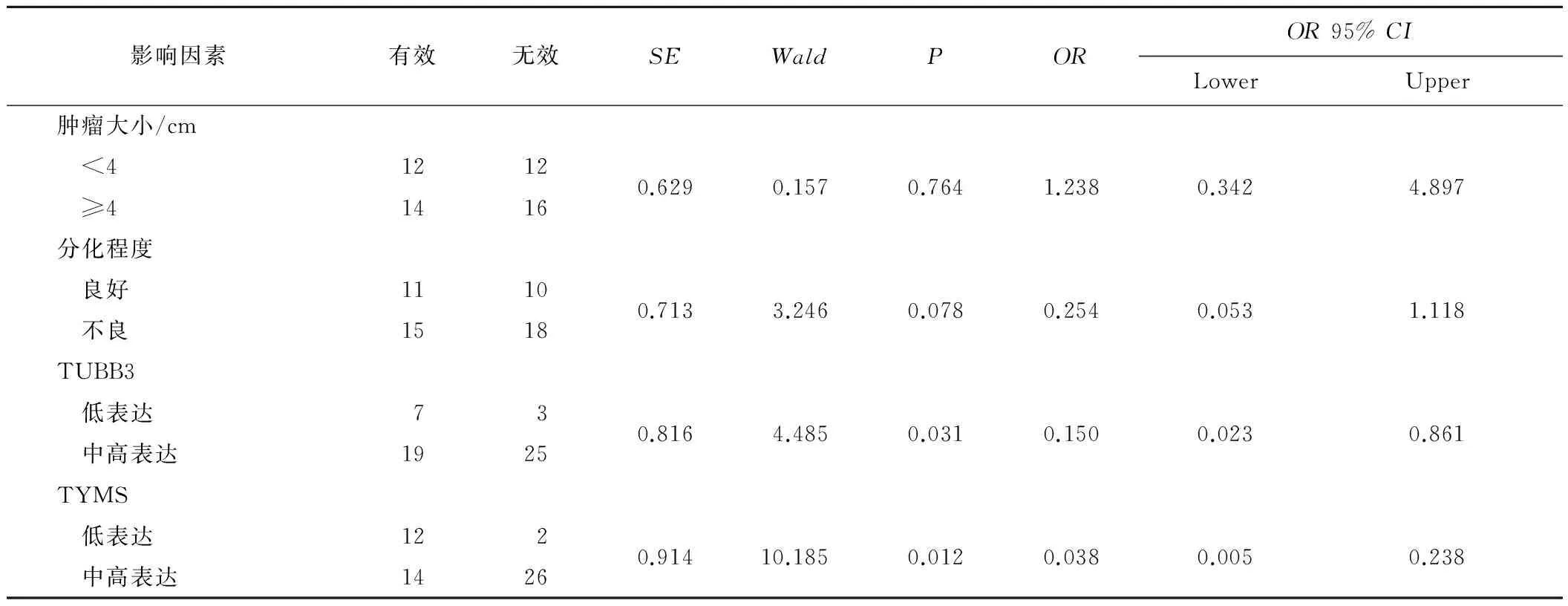
影响因素有效无效SEWaldPOROR95%CILowerUpper肿瘤大小/cm <412120.6290.1570.7641.2380.3424.897 ≥41416分化程度 良好11100.7133.2460.0780.2540.0531.118 不良1518TUBB3 低表达730.8164.4850.0310.1500.0230.861 中高表达1925TYMS 低表达1220.91410.1850.0120.0380.0050.238 中高表达1426
3 讨论
研究[8]表明AEGJ与中远段胃癌在发生发展过程中可能存在不同的分子机制。肿瘤细胞耐药是AEGJ新辅助化疗不获益的原因,也是降低综合治疗患者生存率的主要原因。有研究[9]报道发现新辅助化疗能显著改善局部进展期AEGJ的治疗效果。如何预测AEGJ新辅助化疗敏感性的问题有待解决。如果能找到较为准确的预测新辅助化疗敏感性标志物将有助于临床医生根据肿瘤的分子生物学特征选择更有效的治疗方案,避免不获益的化疗。
TUBB3与抗微管化疗药敏感性的关系最密切。在多种肿瘤细胞系的研究和临床研究中,都显示TUBB3低表达肿瘤患者接受紫杉醇类化疗的效果较好,中位生存期较长。反之,TUBB3高表达患者的抗微管类化疗药物疗效较差[10-12]。TYMS是嘧啶核苷酸合成的限速酶,也是氟类药物发挥化疗作用的主要靶点。TYMS mRNA表达水平越高,患者接受氟类药物化疗耐药性越高,反之化疗效果越好,生存期越长[13]。
液相芯片是一种全新概念的生物芯片,具有简单快速、敏感性好、特异性高、节省样本量、缩短分析时间、节约劳动力、检测费用低,以及多通路、高通量和实时数据分析等优点[14]。本研究使用广州益善公司提供的液相芯片分析平台检测54例进展期AEGJ组织中TUBB3、TYMS mRNA表达水平。
本研究中应用XP方案对进展期AEGJ进行新辅助化疗,有效率为48.15%,与既往的报道基本相似[15],达到了降期、提高R0切除率的目的。本组52例患者新辅助化疗毒副反应主要为恶心、呕吐、粒细胞减少、血小板减少、外周神经毒性,经相应治疗后缓解,毒副反应均在可控制范围内;术后并发症仅有2例吻合口出血、2例吻合口瘘,提示新辅助化疗是安全的,并未增加手术并发症及手术风险。单纯的印戒细胞癌或粘液腺癌新辅助化疗病情均无缓解[16]。但化疗效果与年龄、分化程度无关。
既往的研究[17]表明,TUBB3高表达常常预示着化疗无反应。本研究结果也表明,TUBB3 mRNA高表达也预示着化疗疗效不明显,除了同时TYMS mRNA 低表达或中偏低表达。TYMS基因的检测对于预测胃癌新辅助化疗的疗效作用目前尚无统一观点[18]。本研究结果表明,TYMS mRNA的表达与化疗敏感性有关,低表达患者对新辅助化疗敏感,这与部分研究结果相一致[19]。
Logistic多因素回归分析显示,TUBB3和TYMS mRNA低表达是独立的化疗敏感性影响因素,预示着较高疾病缓解率。这与胃癌中的研究结果一致[20]。Spearman相关分析显示:TYMS mRNA低表达与肿瘤的分化程度呈负相关(r=-0.335,P=0.015)。
总之,本研究应用分支DNA-液相芯片技术检测了2种基因mRNA在进展期AEGJ新辅助化疗前的表达情况,发现TUBB3和TYMS mRNA的表达情况与新辅助化疗XP方案的敏感性有关,其表达可作为预测XP方案化疗疗效的因子。然而,由于本研究样本量有限,且为回顾性研究,TUBB3和TYMS在进展期AEGJ新辅助化疗中的预测价值仍然需要大规模的前瞻性对照临床试验进一步证明。
[1]Wijnhoven BP,Louwman MW,Tilanus HW,et al.Increased incidence of adenocarcinomas at the gastro-esophageal junction in Dutch males since the 1990s[J].Eur J Gastroenterol Hepatol,2002,14(2):115-122.
[2]Sihvo EI,Salminen JT,Rämö OJ,et al.The epidemiology of esophageal adenocarcinoma:has the cancer of gastric cardia an influence on the rising incidence of esophageal adenocarcinoma[J].Scand J Gastroenterol,2000,35(10):1082-1086.
[3]季加孚,季鑫.胃癌新辅助化疗的现状与展望[J].中国肿瘤临床,2012,39(20):1458-1461.
[4]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors[J].J Natl Cancer Inst,2000,92(12):205-216.
[5]Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176-181.
[6]潘平,仝运科,宋昕,等.贲门癌组织中HER-2的表达与临床病理参数和生存的关系[J].肿瘤基础与临床,2015,28(6):461-463.
[7]Rice TW,Rusch VW,Ishwaran H,et al.Cancer of the esophagus and esophagogastric junction:data-driven staging for the seventh edition of the American Joint Committee on Cancer/International Union Against Cancer Cancer Staging Manuals[J].Cancer,2010,116(16):3763-3773.
[8]叶延伟,师英强,王春萌,等.贲门癌与胃窦部癌的临床病理指标及免疫组化指标差异性分析[J].中华医学杂志,2009,89(14):962-966.
[9]Davies AR,Gossage JA,Zylstra J,et al.Tumor stage after neoadjuvant chemotherapy determines survival after surgery for adenocarcinoma of the esophagus and esophagogastric junction[J].J Clin Oncol,2014,32(27):2983-2990.
[10]Kavallaris M.Microtubules and resistance to tubulin-binding agents[J].Nat Rev Cancer,2010,10(3):194-204.
[11]Sève P,Dumontet C.Is class Ⅲ beta-tubulin a predictive factor in patients receiving tubulin-binding agents[J].Lancet Oncol,2008,9(2):168-175.
[12]Mariani M,Shahabi S,Sieber S,et al.Class Ⅲ β-tubulin(TUBB3):more than a biomarker in solid tumors[J].Curr Mol Med,2011,11(9):726-731.
[13]Kamoshida S,Suzuki M,Shimomura R,et al.Immunostaining of thymidylate synthase and p53 for predicting chemoresistance to S-1/cisplatin in gastric cancer[J].Br J Cancer,2007,96(2):277-283.
[13]Bay JT,Garred P.Rapid bead-based immunoassay for measurement of mannose-binding lectin[J].Scand J Immunol,2009,69(6):570-575.
[14]Lorenzen S,Pauligk C,Homann N,et al.Feasibility of perioperative chemotherapy with infusional 5-FU,leucovorin,and oxaliplatin with (FLOT) or without(FLO) docetaxel in elderly patients with locally advanced esophagogastric cancer[J].Br J Cancer,2013,108(3):519-526.
[15]Chen L,Shi Y,Yuan J,et al.Evaluation of docetaxel- and oxaliplatin-based adjuvant chemotherapy in postgastrectomy gastric cancer patients reveals obvious survival benefits in docetaxel-treated mixed signet ring cell carcinoma patients[J].Med Oncol,2014 ,31(9):159-169.
[16]He W,Zhang D,Jiang J,et al.The relationships between the chemosensitivity of human gastric cancer to paclitaxel and the expressions of class Ⅲ β-tubulin,MAPT,and surviving[J].Med Oncol,2014,31(5):950-956.
[17]Kamoshida S,Suzuki M,Shimomura R,et al.Immunostaining of thymidylate synthase and p53 for predicting chemoresistance to S-1/cisplatin in gastric cancer[J].Br J Cancer,2007,96(2):277-283.
[18]Ott K,Vogelsang H,Marton N,et al.The thymidylate synthase tandem repeat promoter polymorphism:A predictor for tumor-related survival in neoadjuvant treated locally advanced gastric cancer[J].Int J Cancer,2006 ,119(12):2885-2894.
[19]Hirakawa M,Sato Y,Ohnuma H,et al.A phase Ⅱ study of neoadjuvant combination chemotherapy with docetaxel,cisplatin,and S-1 for locally advanced resectable gastric cancer:nucleotide excision repair(NER) as potential chemoresistance marker[J].Cancer Chemother Pharmacol,2013,71(3):789-797.
Expressions of TUBB3,TYMS mRNA in the Locally Advanced Adenocarcinoma of Esophagogastric Junction and the Relationship with Efficacy of Neoadjuvant Chemotherapy
Li Shoumiao1,Han Peng2,Zhang Wei1,Liu Zhiqiang1,Wan Yunjie1,Li Baozhong1,Zhang Zhizhong1
(1.DepartmentofSurgery,AnyangTumorHospital,Anyang455000,China;2.DepartmentofPathology,AnyangTumorHospital,Anyang455000,China)
河南省科技发展计划重点攻关项目(编号:112102310121)
李守淼(1973-),男,硕士,副主任医师,主要从事胃肠道肿瘤外科临床工作。E-mail:shoumiaoli@126.com
张志忠(1982-),男,硕士,主治医师,主要从事腹部肿瘤外科临床工作。E-mail:zhangzz003@163.com
10.3969/j.issn.1673-5412.2016.04.007
R735.2;R730.53
A
1673-5412(2016)04-0304-05
2016-02-12)
