4,6-二氨基-1,3-苯二磺酸水解工艺及其动力学研究*
2016-09-26王海民陈田木陈胜思罗金岳
王海民,陈田木,陈胜思,罗金岳,徐 徐
(1 江苏远征化工有限公司,江苏 灌云 222228; 2 南京林业大学 化学工程学院,江苏 南京 210037)
4,6-二氨基-1,3-苯二磺酸水解工艺及其动力学研究*
王海民1,陈田木1,陈胜思2,罗金岳2,徐徐2
(1 江苏远征化工有限公司,江苏灌云222228; 2 南京林业大学 化学工程学院,江苏南京210037)
以间苯二胺磺化反应得到的4,6-二氨基-1,3-苯二磺酸和2,4-二氨基苯磺酸的混合产物为原料,通过对4,6-二氨基-1,3-苯二磺酸进行水解得到产物2,4-二氨基苯磺酸;并采用FT-IR和1H NMR等手段对产物进行了表征。利用单因素实验确定了适宜的水解工艺条件:水解时间2.5 h,水解温度130 ℃,滴加水量w(水):w(间苯二胺)=0.75:1,在此条件下,2,4-二氨基苯磺酸得率为98.16%(间苯二胺为基准)。温度在393~408 K,4,6-二氨基-1,3-苯二磺酸水解反应符合1-1级可逆反应模型,且随着温度的升高正、逆反应的水解速率常数都增加;通过拟合不同温度下的正、逆反应的水解速率常数,得4,6-二氨基-1,3-苯二磺酸水解反应正反应活化能为48.83 kJ/mol,逆反应活化能为47.62 kJ/mol。
4,6-二氨基-1,3-苯二磺酸;水解反应;动力学
染料中间体指的是用于生产染料和颜料的各种芳香烃衍生物[1-2]。4,6-二氨基-1,3-苯二磺酸俗称间苯二胺双磺酸,是活性嫩黄86、活性嫩黄KM-7G等染料的中间体[3]。芳双磺酸既可以酸性水解生成单磺酸也可以碱性水解(碱熔)生成酚类物质[4-5],因此可通过酸性或碱性水解磺酸基团来得到目标产物。4,6-二氨基-1,3-苯二磺酸可以通过酸性水解得到染料中间体2,4-二氨基苯磺酸[6]。动力学是化学反应的重要内容之一,其基本任务就是了解反应的速率以及因素对反应速率的影响,从而给人们提供选择反应的条件、掌握控制反应进行的主动权等[7-8]。近年来,对双磺酸水解的相关报道甚少。本文主要研究了以间苯二胺经发烟硫酸磺化得到4,6-二氨基-1,3-苯二磺酸和2,4-二氨基苯磺酸的混合产物为原料,再通过对4,6-二氨基-1,3-苯二磺酸进行水解而得到目标产物2,4-二氨基苯磺酸,并对其水解动力学模型进行研究,为工业生产和模拟研究提供数据支持。
1 实 验
1.1试剂和仪器
间苯二胺、20%发烟硫酸、98%硫酸、碳酸钠(分析纯),除碳酸钠外所有试剂均为工业纯。
LC-10ATVP型高效液相色谱仪;Nicolet 380傅里叶变换红外光谱仪;Bruker Avance III-600M核磁共振波谱仪。
1.2实验方法
1.2.14,6-二氨基-1,3-苯二磺酸水解工艺
(1) 磺化原料的制备
向500 mL的四口圆底烧瓶中加入50 g的98%硫酸和130 g的20%发烟硫酸,搅拌;缓慢加入40 g间苯二胺固体粉末,加毕升温至75~80 ℃,保温30 min;保温结束后再加入130~150 g的20%发烟硫酸,升温至130~135 ℃,搅拌反应4 h。反应式如下:

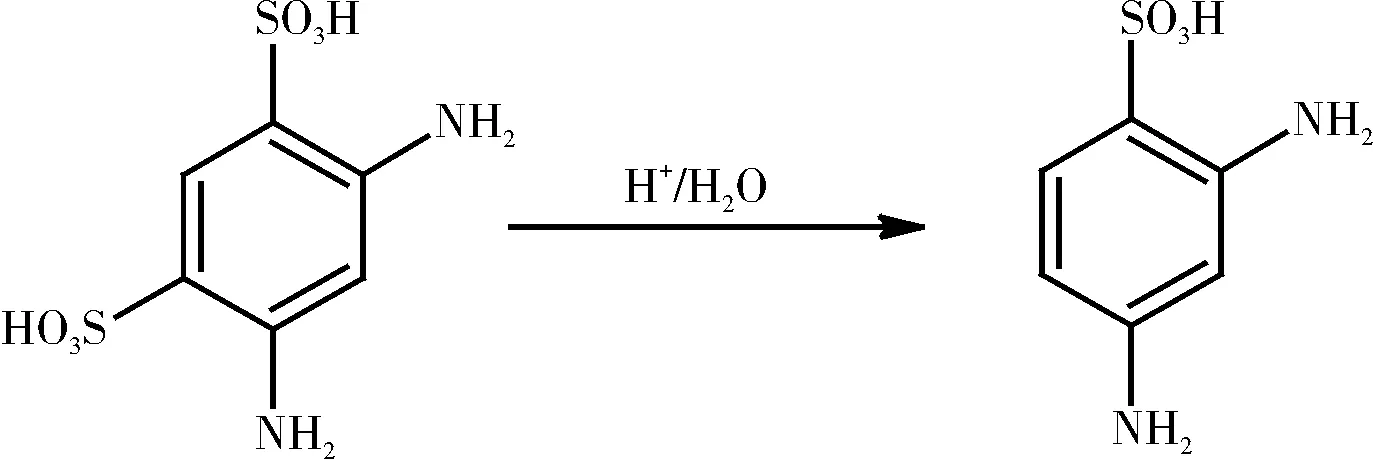
(2) 水解反应
接磺化反应后降温至一定温度,用恒压滴液漏斗缓慢滴加水,因反应放热需严格反应温度,滴加结束后,保温搅拌一定时间,制得2,4-二氨基苯磺酸。反应式如下:
1.2.24,6-二氨基-1,3-苯二磺酸水解反应动力学
称取一定量的4,6-二氨基-1,3-苯二磺酸于250 mL的烧瓶中,再向其中加入50 g的98%硫酸和11.25 g水,升温至一定温度,保温3 h,每隔0.5 h取样并用50 mL水稀释做HPLC分析。
1.3产物的分析鉴定
HPLC分析:检测条件为Kromasil 100-5C18色谱柱(5 μm,150 mm×4.6 mm,E34982),流动相采用25: 75的甲醇与水的混合液;流速为1.0 mL/min;进样体积5 μL;柱温40 ℃;检测波长254 nm。采用溴化钾(KBr)压片法制样,用Nicolet 380傅立叶变换红外光谱仪进行扫描分析。用重水(D2O)将目标产物溶解,然后用内标为四甲基硅烷(TMS),质子共振频率600 MHz的核磁共振分析仪进行检测。
1.4目标产物的得率计算

式中:i——目标产物氨基值含量(实验测定),%
m1——目标产物质量,g
m2——间苯二胺质量,g
M1——2,4-二氨基苯磺酸摩尔质量为188.20 g/mol
M2——间苯二胺的摩尔质量,108.14 g/mol
2 结果与讨论
2.1产物的分析鉴定结果
2.1.1产物的红外分析
从图1可知,3381.85 cm-1,3321.00 cm-1(伯胺内N-H伸缩振动峰),3063.82 cm-1(苯环中C-H伸缩振动峰),1580.40 cm-1(伯胺N-H面内弯曲振动峰),1485.43 cm-1,1450.53 cm-1(苯环C=C骨架伸缩振动峰),1066.19 cm-1和1021.35 cm-1(S=O伸缩振动峰),858.01 cm-1,813.17 cm-1(1,2,4-三取代苯环面外C-H弯曲振动峰)。

图1产物2,4-二氨基苯磺酸的红外谱图
2.1.2产物的核磁共振分析

图2 产物的1H NRM谱图
由图2可知,1H NRM δ(ppm)数据如下:δ 6.27~6.29(m,2H,苯环上3号和5号位置上的氢);δ 7.49(t,J=3.0 Hz,1H,6号苯环上的一个氢);δ 4.80是溶剂D2O化学位移,苯环NH2上的氢被质子化,不显示化学位移,由此可确定产物为2,4-二氨基苯磺酸。
2.24,6-二氨基-1,3-苯二磺酸水解工艺
2.2.1水解时间对反应的影响
选取水解反应温度为125 ℃,滴加水量w(水):w(间苯二胺)=1:1,考察不同的反应时间对2,4-二氨基苯磺酸得率的影响,结果如图3所示。
由图3可以看出,2,4-二氨基苯磺酸的得率随着时间的延长而增加。0~1.0 h,2,4-二氨基苯磺酸的得率显著增加;当时间增加到2.5 h后2,4-二氨基苯磺酸的得率趋于平衡,继续延长水解时间,得率也不会提高多少,这说明反应进行到2.5 h水解基本完全。综合考虑,选取水解时间为2.5 h较为适宜。

图3 水解时间对反应的影响
2.2.2水解温度对反应的影响
选取水解时间为2.5 h,滴加水量w(水):w(间苯二胺)=1:1,探讨不同的反应温度对2,4-二氨基苯磺酸得率的影响,结果如图4所示。
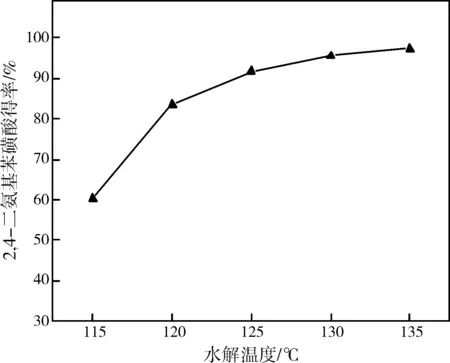
图4 水解温度对反应的影响
从图4可以清楚的看出,升高反应温度,2,4-二氨基苯磺酸的得率随之增加,这说明升高温度有利于2,4-二氨基苯磺酸的生成;但是,随着温度的升高,2,4-二氨基苯磺酸得率的增幅却在下降,由此可见反应温度过高会导致水解反应副产物的生成。控制水解反应温度在提高目标产物得率和减少副产物形成之间存在着矛盾,因此选择适宜的水解温度对反应尤为重要。综合以上分析,选取较为适宜的水解温度为130 ℃。
2.2.3滴加水量对反应的影响

图5 滴加水量对反应的影响
选取水解时间为2.5 h,水解温度为130 ℃,探讨滴加水量w(水):w(间苯二胺)依次为0.5:1,0.625:1,0.75:1,0.875:1,1:1对2, 4-二氨基苯磺酸得率的影响,结果如图5所示。
由图5可以看出,逐步增加滴加的水量,2,4-二氨基苯磺酸得率出现先升高后降低的趋势,滴加水量w(水):w(间苯二胺)=0.75:1时达到最大值。滴加的水量在w(水):w(间苯二胺)=0.75:1之前,2,4-二氨基苯磺酸得率缓慢升高,这说明一定范围内酸值降低有利于2,4-二氨基苯磺酸得率提高;继续增加滴加水量,2,4-二氨基苯磺酸得率快速下降,这说明酸值过低加速水解副产物的生成,从而降低了目标产物的得率。综合以上分析得知,滴加水量过高或过低都不利于2,4-二氨基苯磺酸的生成,故选取滴加水量为w(水):w(间苯二胺)=0.75:1较为适宜。
2.2.4稳定性实验
综合各单因素实验条件,4,6-二氨基-1,3-苯二磺酸水解工艺适宜条件为:水解时间为2.5 h,水解温度为130 ℃,滴加水量w(水):w(间苯二胺)=0.75:1,在此条件下,重复三次实验2,4-二氨基苯磺酸的得率分别为98.19%、98.17%、98.13%,三次平均值为98.16%,反应的稳定性较好。
2.3水解反应动力学研究
2.3.1水解反应动力学模型建立及公式推导
4,6-二氨基-1,3-苯二磺酸水解为单分子、可逆反应。其水解反应式如下:
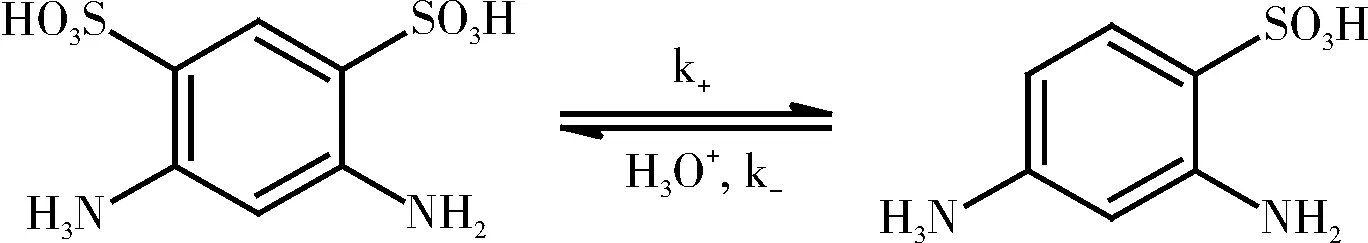
由于该反应为正、反方向都能进行的可逆反应。设该反应为1-1级可逆反应,即正反应和逆反应都为一级反应:
净的向右反应速率为正向和逆向反应速率的总结果,即:
(1)
根据式(1)无法解出k+和k-,故还需另外条件联立。又因为反应到达平衡时,v=dC/dt=0,所以:
K+(CA,0-CB)=k-CB
(2)
得:
(3)
将式(3)带入式(1)中,得:
(4)
将式(4)积分得:
(5)
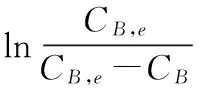
其中A为4,6-二氨基-1,3-苯二磺酸,B为2,4-二氨基苯磺酸,CA,0为A的初始浓度,CB为反应过程中B的浓度,CB,e为反应平衡时B的浓度,v为反应速率,k+,k-为正、逆反应速率常数,下标e表示平衡。
2.3.2动力学实验数据处理和讨论
为更深入的研究4,6-二氨基-1,3-苯二磺酸水解反应动力学,在水解工艺稳定性实验的基础下,模拟工业生产,初始酸值为80%且不改变初始酸值,4,6-二氨基-1,3-苯二磺酸初始浓度为CA,0=0.5 mol/L,测定了分别在393 K、398 K、403 K、408 K下实验结果作动力学研究如图6所示,以对实际工业化生产作参考。
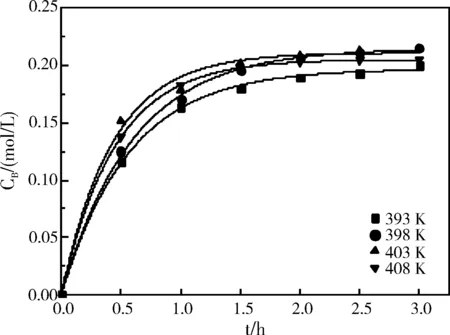
图6 不同温度下CB-t曲线

表1 不同温度下k值
Arrehnius方程关联到表1中的数据,1/T为横坐标,以lnk为纵坐标,并用Origin对其进行线性拟合,拟合结果如图7所示,再将拟合后的结果进行计算,得出正、逆反应的活化能及指前因子,如表2所示。
从图7可以看出,拟合后的两条直线均呈现较好的线性关系,这说明符合Arrehnius方程。由表2知,正、逆反应的活化能Ea+、Ea-分别为48.83 kJ/mol和47.62 kJ/mol,指前因子A+、A-分别为1.641×106h-1和1.582×106h-1。
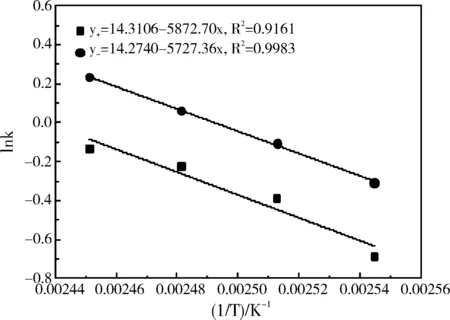
图7 Arrehnius关系线性回归
从图7可以看出,拟合后的两条直线均呈现较好的线性关系,这说明符合Arrehnius方程。由表2知,正、逆反应的活化能Ea+、Ea-分别为48.83 kJ/mol和47.62 kJ/mol,指前因子A+、A-分别为1.641×106h-1和1.582×106h-1。

表2 反应活化能及指前因子
3 结 论
(1) 以间苯二胺磺化反应得到的4,6-二氨基-1,3-苯二磺酸和2,4-二氨基苯磺酸的混合产物为原料,通过对4,6-二氨基-1,3-苯二磺酸进行水解制得2,4-二氨基苯磺酸,采用FT-IR、1H NMR等手段对实验产物进行了表征,确定产物为2,4-二氨基苯磺酸。
(2) 探讨了水解时间、水解温度和滴加水量等单因素对2,4-二氨基苯磺酸得率的影响,确定了适宜的工艺条件:水解时间2.5 h,水解温度130 ℃,滴加水量w(水):w(间苯二胺)=0.75:1,在此条件下,2,4-二氨基苯磺酸得率可达98.16%。
(3) 温度在393~408 K,通过Origin对实验数据的处理分析,发现4,6-二氨基-1,3-苯二磺酸水解反应符合1-1级可逆反应模型,且随着温度的升高正、逆反应的水解速率常数都增加;采用Arrehnius方程对不同温度下的正、逆反应的水解速率常数进行拟合,得到4,6-二氨基-1,3-苯二磺酸水解反应正反应活化能为48.83 kJ/mol,逆反应活化能为47.62 kJ/mol。
[1]赵雅琴,魏玉娟.染料化学基础[M].北京:中国纺织出版社,2006:29-31.
[2]董迎章.染料中间体行业的发展态势[J].精细化工原料及中间体,2011(4):38-41.
[3]宣光荣.常用染料与助剂的生产[M].西安:西北大学出版社,2002:97-109.
[4]周兴.α-萘酚-6, 8-二磺酸的水解[J].环境保护科学,1993,19(4): 55-58.
[5]张七男,李洪林,颜晓明,等.一种制备2-氨基-8-萘酚-6-磺酸的方法[P].中国:101182301A,2008-05-21.
[6]彭炫,王海民,叶丽丽,等.2,4-二氨基苯磺酸及其盐的生产方法[P].中国:102516137A,2012-06-27.
[7]Ville P, Mika H S, Anne K, et al. Rate-constraining changes in surface properties, porosity and hydrolysis kinetics of lignocellulose in the course of enzymatic saccharification[J]. Biotechnology Biofuels, 2016(9): 18-30.
[8]Ana M C, Bridgwater A V. Kinetic study of the pyrolysis of miscanthus and its acid hydrolysis residue by thermogravimetric analysis[J]. Fuel Processing Technology, 2015(138): 184-193.
Study on Hydrolysis Process of 4,6-diamino-1,3-benzenedisulfonic Acid and Its Kinetics*
WANG Hai-min1, CHEN Tian-mu1, CHEN Sheng-si2, LUO Jin-yue2, XU Xu2
(1 Jiangsu Yuanzheng Chemical Co., Ltd., Jiangsu Guanyun 222228;2CollegeofChemicalEngineering,NanjingForestryUniversity,JiangsuNanjing210037,China)
The mixed products of 4,6-diamino-1,3-benzenedisulfonic acid and 2,4-diaminobenzenesulfonic acid as raw material were prepared by m-phenylenediamine sulfonation. 2,4-Diaminobenzenesulfonic acid was obtained through 4,6-diamino-1,3-benzenedisulfonic acid hydrolysis, and the product was characterized by FT-IR and1H NMR. The favorable conditions of hydrolysis process obtained by single factor experiments were as follows: 2.5 h as the hydrolysis time, 130 ℃ as the hydrolysis temperature,w(water):w(m-phenylenediamine)=0.75:1 as the amount of dropping water. Under these conditions, the yield of 2,4-diaminobenzenesulfonic acid could reach 98.16% (m-phenylenediamine as datum). Temperature at 393~408 K, the hydrolysis reaction of 4,6-diamino-1,3-benzenedisulfonic acid corresponded with the model of 1-1 reversible reaction, otherwise the hydrolysis rate constants of positive and reverse reaction had increased as temperature rose. Hydrolysis rate constants of positive and reverse reaction at different temperatures were fitted knew that 4,6-diamino-1,3-benzenedisulfonic acid hydrolysis activation energy of positive reaction was 48.83 kJ/mol, and the hydrolysis activation energy of reverse reaction was 47.62 kJ/mol.
4,6-diamino-1,3-benzenedisulfonic acid;hydrolysis reaction; kinetics
国家自然科学基金项目(No:31470597);江苏省研究生企业工作站。
王海民(1974-),男,化工工程师、高级经济师,从事化工产品合成、开发和管理。
罗金岳(1964-),男,教授,主要研究方向为林产化学加工
TQ612
A
1001-9677(2016)016-0089-04
