金铁锁PtCYP450基因的克隆及原核表达△
2016-09-25李国栋韩丽君刘小莉杨耀文钱子刚
李国栋,韩丽君,刘小莉,杨耀文,钱子刚
(云南中医学院,云南 昆明 650500)
·基础研究·
金铁锁PtCYP450基因的克隆及原核表达△
李国栋,韩丽君,刘小莉,杨耀文,钱子刚*
(云南中医学院,云南 昆明 650500)
目的:从金铁锁PsammosilenetunicoidesW.C.Wu et C.Y.Wu中克隆细胞色素PtCYP450酶基因,进行序列分析和原核表达。方法:根据已获得的金铁锁转录组数据,设计PtCYP450基因全长扩增引物,利用RT-PCR方法获得金铁锁PtCYP450基因的全长cDNA序列,并进行TA克隆、测序及序列分析;构建金铁锁PtCYP450-03基因的原核表达载体pEASY-E1-CYP450,转入BL21(DE3) Chemically Competent Cell中,在ArtMediaTMProtein Expression培养基中进行蛋白表达。结果:获得全长1612 bp的金铁锁CYP450 cDNA,其开放阅读框(ORF)为1560 bp,编码519个氨基酸;序列分析及系统发育分析表明,PtCYP450基因属于CYP710家族成员。构建了pEASY-E1-CYP450重组质粒,获得稳定的原核表达体系,SDS-PAGE结果表明所表达的蛋白与预测的蛋白大小一致。结论:成功克隆了金铁锁PtCYP450基因,构建了稳定的pEASY-E1-CYP450原核表达体系,为进一步研究金铁锁中三萜皂苷合成代谢途径及其关键酶表达模式奠定基础。
金铁锁;PtCYP450;基因克隆;原核表达;序列分析
稀有濒危物种金铁锁PsammosilenetunicoidesW.C.Wu et C.Y.Wu为石竹科(Caryophyllaceae)单型属植物[1],以根入药,是“云南白药”的主要原料药之一,主治跌打损伤、风湿痛、痈疽疮疖、创伤出血等症[2],主要有效成分为金铁锁三萜总皂苷[3]。MVA途径是植物体内皂苷合成的主要途径,在此途径中有多种酶参与了次生代谢产物的合成及调控,如法尼基焦磷酸合成酶(FPS)、鲨烯环氧酶(SE)、鲨烯合成酶(SS)等都为三萜皂苷碳骨架形成相关的关键酶,它们的含量及表达对次生代谢产物的含量有重要影响[4-10]。三萜类骨架合成后,依赖细胞色素P450单加氧酶及糖基转移酶对萜类骨架进行结构修饰,最终获得各种各样的三萜皂苷产物。细胞色素P450单加氧酶系广泛分布于生物有机体内,参与了许多重要的生命过程,它在植物次生代谢产物的合成途径中起到氧化作用,并在调控植物生长和发育中起到重要作用[11-14]。本研究根据已获得的金铁锁转录组细胞色素P450单加氧酶基因序列,设计全长扩增引物,从金铁锁中成功提取了RNA,反转录为cDNA,并扩增出金铁锁P450基因全长cDNA序列,测序及序列分析后进行了克隆和原核表达,结果表明所构建的P450原核表达载体在大肠杆菌中成功表达目的蛋白。本研究为进一步研究金铁锁中三萜皂苷合成代谢途径中关键酶表达模式奠定了基础,为进一步确定和研究与金铁锁三萜皂苷合成代谢途径相关的P450提供参考,也为其他生物中P450的研究提供参考。
1 材料与试剂
金铁锁Psammosilenetunicoides植株采自云南省大理市鹤庆县马场,栽培于云南中医学院优良种苗繁育工程中心实验室。本实验材料为金铁锁根部。
质粒pEASY-T1 Vector、pEASY-E1Expression Vector、菌株DH5α、BL21(DE3)、ArtMediaTMProtein Expression(北京全式金生物技术有限公司);Takara Minibest Universal RNA Extraction Kit、PrimeScriptTMⅡ1st strand cDNA Synthesis Kit、Taq DNA聚合酶、DL2000 DNA Marker[宝生物工程(大连)有限公司];PCR产物回收试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小量制备试剂盒(上海捷瑞生物工程有限公司);一步法细菌活性蛋白提取试剂盒、引物合成和序列测序由上海生工生物工程技术服务有限公司完成;常用试剂及耗材(昆明鼎国生物技术有限公司)。
2 方法
2.1 金铁锁总RNA的提取及PtCYP450基因全长PCR扩增
按照Takara Minibest Universal RNA Extraction Kit试剂盒说明书提取金铁锁总RNA,-80 ℃保存备用;按照PrimeScriptTMⅡ 1st strand cDNA Synthesis Kit试剂盒说明书合成金铁锁第一链cDNA。根据金铁锁转录组中的一条PtCYP450序列,利用Primer5.0设计一对特异扩增引物。正向引物:5′-ATGAACACATCAGAAATCTGGG-3′;反向引物:5′-TCAGTCAAAGGAGAGAGGAAGAG-3′。采用25 μL反应体系,以第一链cDNA为模板进行扩增,PCR反应条件:94 ℃ 3 min;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 2 min,共32个循环;72 ℃ 10 min;4 ℃终止。PCR产物经1.0%琼脂糖凝胶电泳后切胶回收并纯化,测序得到DNA序列信息。测序结果经NCBI在线Blastx分析,DNAman软件寻找该基因的ORF。分子进化树构建用MEGA6.0软件完成,选择邻接法,应用自举检验1000次。
2.2 PtCYP450基因的克隆与表达载体构建
根据捷瑞PCR产物回收试剂盒说明书回收并纯化扩增的片段,将4 μL扩增出的目的片段PtCYP450插入1 μL pEASY-T1载体中进行连接,连接产物转化大肠杆菌DH5α。将转化菌涂布于含有50 μg·mL-1氨苄青霉素的LB平板上,37 ℃培养过夜,挑取白色菌落培养,进行菌落PCR验证后将阳性克隆送测序鉴定,提取阳性单克隆菌株质粒。将4 μL扩增出的PtCYP450目的片段插入1 μL pEASY-E1表达载体中进行连接,连接产物转化大肠杆菌DH5α。将转化菌涂布于含有50 μg·mL-1氨苄青霉素的LB平板上,37 ℃培养过夜,挑取单克隆进行PCR以鉴定阳性克隆,挑选正确表达方向的阳性克隆,200 r·min-1、37 ℃培养6 h,用试剂盒提取质粒,-20 ℃保存备用,获得表达载体pEASY-E1-P450。
2.3 PtCYP450基因的原核表达
用所获得的表达载体pEASY-E1-P450转化BL21(DE3)表达感受态细胞,将转化菌涂布于含有50 μg·mL-1氨苄青霉素的LB平板上,37 ℃培养过夜,挑取克隆,按照ArtMediaTMProtein Expression说明书加入适量体积的ArtMedia培养基内,250 r·min-1、37 ℃培养过夜,同时以相同条件的pEASY-E1空载体的转化菌作为对照。收集菌液并根据一步法细菌活性蛋白提取试剂盒说明书进行蛋白提取,分别收集上清液和沉淀蛋白,-80 ℃保存备用。取4 μL沉淀与12 μL上清液混匀,加入4 μL蛋白上样Buffer,100 ℃、5 min变性。将20 μL样品上样,进行SDS-PAGE(5%的浓缩胶和10%的分离胶)电泳测定。
3 结果与分析
3.1 金铁锁PtCYP450基因的扩增与克隆
提取金铁锁总RNA进行1.0%琼脂糖凝胶电泳检测,所获RNA条带清晰(见图1),紫外分光光度计分析显示A260/A280=1.96。表明所获得的金铁锁RNA纯度较好,可以用于扩增基因全长。将RNA反转为第一链cDNA,利用设计的引物进行扩增全长,PCR产物经过1.0%琼脂糖凝胶电泳检测,得到大小约为1600 bp的条带(见图1),与预期的目的片段一致。

注:M.DL2000;1、2.金铁锁RNA;3、4.PCR扩增产物。图1 金铁锁总RNA提取 及CYP450基因扩增
扩增产物测序后利用Sequencher 4.14软件进行序列拼接,得到1612 bp的序列,开放阅读框1560 bp,编码519个氨基酸,推测分子量约为60 kD。在NCBI上进行BLast比对,结合相关文献的查阅[15],筛选出包括金铁锁PtCYP450在内的17条属CYP710家族参与三萜皂苷生物合成的P450氨基酸序列。PtCYP450的核酸序列与其他植物的CYP450 710A1基因序列同源性为90%~70%,所编码的蛋白与其他植物(甜菜、葡萄、苜蓿等)CYP450 710A1基因编码的蛋白同源性高达98%~87%。使用MEGA6.0进行多序列的比对,采用邻接法(NJ)构建进化树,进行聚类分析,金铁锁PtCYP450与豆科的5个物种、十字花科的3个物种以及葡萄形成姐妹群,表明它们间亲缘关系较近(见图2)。结果表明克隆出的金铁锁PtCYP450基因属于CYP450 710亚家族。

图2 PtCYP450与其他物种CYP450 710家族氨基酸序列的进化树分析
3.2 金铁锁PtCYP450基因的表达载体构建与蛋白表达
用扩增出的目的片段CYP450与 pEASY-T1载体的连接产物转化大肠杆菌DH5α。将转化菌涂布于LB平板上培养,挑取白色菌落进行菌落PCR验证后将阳性克隆送测序鉴定,并提取质粒。根据pEASY-E1Expression Vector的构建图谱,利用CYP450目的片段与pEASY-E1构建原核表达载体pEASY-E1-CYP450,重组质粒经PCR与测序后确定目的片段连接上了pEASY-E1载体。将重组质粒转化到BL21(DE3)表达感受态细胞中,培养后用ArtMedia培养基诱导表达蛋白,蛋白经SDS-PAGE电泳测定,所表达的蛋白大小与预测蛋白大小一致(见图3),且pEASY-E1空载体转化菌对照组在预测位置并没有明显表达蛋白,因此认为金铁锁CYP450基因原核表达成功。

注:M.蛋白Maker;1.pEASY-E1空载体对照;2.pEASY-E1-P450。图3 SDS-PAGE电泳图
3.3 金铁锁PtCYP450编码蛋白特性分析
利用ExPASy Proteomics Server提供的在线工具ProtParam (http://web.expasy.org/protparam/)预测分析金铁锁CYP450基因编码的蛋白质的理化性质,预测结果如下:金铁锁CYP450基因编码编辑519个氨基酸,分子质量约为60 kD,理论等电点值(pI)为6.58,总共包括8400个原子,分子式为C2720H4183N713O759S25,在这个CYP450蛋白的20种氨基酸中,亮氨酸(Leu)所占比例最高,达到11.4%,而色氨酸(Trp)所占比例最低,均为1.5%;正电荷残基总数为59,负电荷残基总数为61。蛋白的不稳定指数为41.57,脂肪指数为86.99,总平均亲水性为-0.158。表明这是一个不稳定蛋白。
利用NPS@server在线软件分析预测金铁锁CYP450编码蛋白的二级结构,从预测结果可知,在CYP450蛋白二级结构组分中,α-螺旋(Hh)占46.24%,β-折叠(Ee)占6.17%,无规则卷曲占45.28%。利用SMART服务器分析金铁锁CYP450编码蛋白的功能结构域,从分析结果可知,金铁锁CYP450编码蛋白结构中,15~34位氨基酸间是一个跨膜螺旋区,第46~494位是细胞色素P450酶结构域,表明PtCYP450蛋白具有P450超家族结构域(见图4)。

图4 金铁锁CYP450编码蛋白的结构功能域示意图
利用SWISS-MODEL(http://swissmodel.expasy.org/)对金铁锁PtCYP450编码蛋白质进行三级结构预测分析,预测结果见图5。
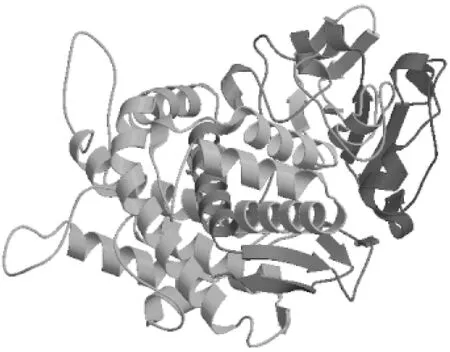
图5 金铁锁CYP450编码的蛋白质三级结构预测结果
4 讨论
在自然界中,很多具有重要价值的三萜皂苷产量较低,利用栽培措施大幅度提高产量或利用化学合成药用活性部分难度都很大。如果从分子水平上对其生物合成的关键基因进行研究调控,促进表达,能够提高目标产物的量,产生良好的社会及经济效益。目前,通过生物工程调控表达各种次生代谢产物关键酶的技术已日渐成熟,且取得了重大进展,是当前研究功能基因的热点,采用生物技术来缓解资源短缺等问题是中医药现代化的主要目的之一。
细胞色素P450单加氧酶系广泛分布于生物有机体内,是动植物生命过程重要的酶,在植物萜类生物合成过程中,CYP450家族成员起着十分重要的作用[15-17]。CYP450对三萜碳环骨架合成起着羟基化和氧化等一系列复杂的修饰作用,是三萜皂苷生物合成途径中的关键酶。近年来,由于二代高通量测序技术的飞速发展,基于RNA-Seq的转录组测序技术为研究药用植物功能基因提供了便利。本研究通过前期获得的金铁锁转录组数据,首次从中成功克隆出了金铁锁的CYP450基因,并进行了相关的生物信息学分析,以及构建了原核表达载体pEASY-E1-CYP450,将重组质粒转化到BL21(DE3)中,成功诱导表达出PtCYP450蛋白。根据氨基酸序列相似性及系统进化关系,可将CYP450分为不同的家族和亚家族。本文所克隆出的金铁锁PtCYP450的核酸序列与其他植物的CYP450 710A1基因序列同源性为90%~70%,结合系统发育分析的结果,初步确定其为CYP450 710亚家族。该研究为下一步确定参与金铁锁三萜皂苷合成代谢的CYP450s以及进行生物功能验证分析奠定基础,也将有助于深入研究金铁锁中三萜皂苷生物合成代谢途径。
[1] 吴征镒.云南植物志:第6卷[M].北京:科学出版社,1995:247-248.
[2] 许建阳,王发强,郑维发,等.金铁锁水煎浸膏对实验性类风湿关节痛镇痛作用的研究[J].武警医学,2003,14(10):589-591.
[3] 赵军,王伟,高嵘.金铁锁化学成分和药理研究进展[J].安徽农业科学,2009,37(24):11526-11529.
[4] 徐晓兰.灵芝三萜和金银花绿原酸生物合成途径关键酶基因的挖掘及分析[D].北京:北京协和医学院,2013.
[5] 吴颖.辽东楤木三萜皂苷合成相关基因克隆及功能研究[D].长春:吉林大学,2011.
[6] 杨欣,魏建和,刘娟,等.白木香法呢基焦磷合酶基因AsFPS1的克隆及表达分析[J].中国中药杂志,2013,38(19):3251-3255.
[7] 唐其.罗汉果转录组、表达谱的高通量测序及甜苷V生物合成关键酶的克隆[D].北京:北京协和医学院,2010.
[8] Jung-Yeon H,Jun-Gyo I,Yong-Soo K,et al.Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squaleneepoxidase gene in Panax ginseng[J].Phytochemistry,2010,71(1):36-46.
[9] Niu Y,Luo H,Sun C,et al.Expression profiling of the triterpenesaponin biosynthesis genes FPS,SS,SE,and DS in the medicinal plant Panaxnotoginseng[J].Gene,2014,533(1):295-303.
[10] 牛云云,朱孝轩,罗红梅,等.三萜皂苷合成生物学元件的初步开发:三七鲨烯环氧酶编码基因克隆及表达模式分析[J].药学学报,2013,48(2):211-218.
[11] Werck-Reichhart D,Feyereisen R.Cytochromes P450:a success story[J].Genome Biology,2000,1(6):1-9.
[12] Nelson D R.A world of cytochrome P450s[J].Phil Trans R Soc B,2013,368:20120430.DOI:10.1098/rstb.2012.0430.
[13] 贺丽虹,赵淑娟,胡之璧.植物细胞色素P450基因与功能研究进展[J].药物生物技术,2008,15(2):142-147.
[14] 阮仁余,孔建强,郑晓东,等.中国红豆杉细胞色素P450还原酶的基因克隆、表达与活性分析[J].遗传,2010,32(11):1187-1194.
[15] Tessa M,Jacob P,Qian S,et al.OSC2 and CYP716A14v2 Catalyze the Biosynthesis of Triterpenoids for the Cuticle of Aerial Organs of Artemisia annua.[J].Plant Cell,2015,27(1):286-301.
[16] Zhao Y J,Cheng Q Q,Su P,et al.Research progress relating to the role of cytochrome P450 in the biosynthesis of terpenoids in medicinal plants[J].Applied Microbiology & Biotechnology,2014,98(6):2371-2383.
[17] Xu Z C,Peters R J,Weirather J,et al.Full-length transcriptome sequences and splice variants obtained by a combination of sequencing platforms applied to different root tissues of Salvia miltiorrhiza and tanshinone biosynthesis[J].Plant Journal,2015,82(6):951-961.
CloningandProkaryoticExpressionofPtCYP450GeneinPsammosilenetunicoides
LIGuodong,HANLijun,LIUXiaoli,YANGYaowen,QIANZigang*
(YunnanUniversityofTraditionalChineseMedicine,Kunming650500,China)
Objective:To obtain the key enzyme genePtCYP450 involving in the triterpenesaponins biosynthesis,aPtCYP450 gene was cloned fromPsammosilenetunicoidesand prokaryotic expression were performed.Methods:According toone of thePtCYP450 gene sequences of transcriptome ofP.tunicoides,a pair of primers were designed,and the ORF (Open readingframe)of cDNA sequences was obtained by RT-PCR.Then TA cloning,sequencing,and sequence analysis were performed.Prokaryoticexpression vector pEASY-E1-CYP450was constructed and transformed intoE.coliRosetta (DE3) for the expression under theinduction of Isopropyl ArtMediaTMProtein Expression.Results:The ORF ofGrCYP450 has a length of 1560 bp coding for 519amino acids.Sequence analysis andphylogenic analysis showed thatPtCYP450 was the member of CYP710subfamily.The SDS-PAGE results showed that the expressed proteins were consistent with theanticipated size.Conclusion:ThePtCYP450 gene is successfully cloned,and the stable prokaryotic expression system is established.This study will provide a foundation for the further purification,structural and functional researches of CYP450 protein.
PsammosilenetunicoidesW.C.Wu et C.Y.Wu;PtCYP450;gene cloning;prokaryotic expression;sequence analysis
10.13313/j.issn.1673-4890.2016.6.015
2016-01-04)
国家自然科学基金(81260609,81560613);云南省自然科学基金[2014FD035,2015FB205(-015)];中央本级重大增减支项目 (2060302)
*
钱子刚,教授,研究方向:中药资源学;Tel:(0871) 65918214,E-mail:qianzig@aliyun.com
