7种不同来源灵芝热水提物体外抗氧化活性研究
2016-09-24杨水莲莫美华胡智豪
聂 健,杨水莲,莫美华,胡智豪
(华南农业大学食品学院,广东广州 510642)
7种不同来源灵芝热水提物体外抗氧化活性研究
聂 健,杨水莲,莫美华*,胡智豪
(华南农业大学食品学院,广东广州 510642)
[目的]比较不同地区灵芝热水提物的体外抗氧化活性。[方法]分别从总还原力、清除羟基自由基(·OH)、超氧阴离子自由基(O2-·)和DPPH自由基4个方面对7种灵芝子实体热水提物的体外抗氧化活性进行了初步研究。[结果]在相同浓度下,猫儿山野生灵芝热水提物的总还原力最强,吸光度高达2.48;·OH清除能力最高,清除率99.46%;清除DPPH自由基能力最强,清除率为96.62%;清除O2-·能力排第三。[结论]猫儿山野生灵芝热水提取物在总还原力、清除·OH、DPPH自由基3个方面的抗氧化能力表现出最强,说明猫儿山野生灵芝具有非常好的开发潜力。
灵芝;体外;抗氧化性;热水提取物;不同来源
灵芝Ganodermalucidum(Leyss.ex.Fr.)Karst 是一种珍贵药用真菌,属于真菌界、真核真菌亚界、真菌门、担子菌亚门、层菌纲、非褶菌目、灵芝菌科(Ganoderma taceae)、灵芝属(Ganoderma)的大型真菌[1]。世界上灵芝科的种类主要分布在亚洲、澳洲、非洲及美洲的热带和亚热带,少数分布于温带。地处北半球温带的欧洲仅有灵芝属的 4 种,而北美洲大约 5 种[2]。我国地跨热带至寒温带,灵芝科种类多而分布广。国内外大量的研究结果证明,灵芝具有较重要、广泛的药理作用且毒性极低,它具有抗细菌[3-4]、抗真菌[5]、抗病毒[6-7]、抗癌[8]等功效。灵芝的生物活性成分十分丰富,目前已从灵芝子实体、孢子和菌丝中分离到 300 多种化合物,可分为三萜类、多糖类、核苷类、呋喃类、生物碱类、蛋白质多肽类、脂肪酸、糖蛋白、甾醇类、有机锗、矿质元素等[9]。由于灵芝独特的药用价值,有关灵芝的栽培技术、有效成分的提取、分离、纯化以及其生物学活性和药理价值的研究已引起了国际上的广泛关注[10-16]。
目前,研究表明人类的许多慢性疾病和衰老现象均与人体内的自由基水平失衡有关[17-19]。清除自由基等抗氧化研究越来越受到重视,除了维生素类、氨基酸类抗氧化剂之外,从植物、菌类等生物来源的化合物中的天然抗氧化剂,由于其安全性高、无副作用而受到广泛关注。但这类天然化合物的提取过程复杂,多为纯品,成本较高,如提取出灵芝中的多糖或三萜,而对于这类生物粗提物的抗氧化作用研究较少[20]。笔者以不同地区的多种灵芝子实体(猫儿山野生灵芝、阳江海灵芝、长白山灵芝、方回春堂灵芝、泰山灵芝、黄山灵芝、日本灵芝)为材料,比较分析了它们的热水提物的体外抗氧化活性,为不同灵芝的开发利用提供理论依据,也为灵芝优良菌种选育奠定了基础。
1 材料与方法
1.1材料
1.1.1试材。阳江海灵芝,采于广东省阳江市闸坡,由华南农业大学食品学院应用微生物实验室驯化栽培;猫儿山野生灵芝,采自广西猫儿山国家自然资源保护区;长白山灵芝,采自吉林长白山;泰山灵芝,采自山东泰山;黄山灵芝,采自黄山云乐基地;方回春堂灵芝,采自福建莆田;日本灵芝,取自广西宏旺菌业发展有限公司。
1.1.2试剂药品。磷酸,分析纯,成都市联合化工试剂研究所;铁氰化钾,分析纯,天津市百世化工有限公司;三氯乙酸(TCA),分析纯,广州化学试剂厂;三氯化铁(FeCl3),分析纯,天津市科密欧化学试剂有限公司;番红花,分析纯,广州化学试剂厂;EDTANa2,分析纯,广州市威佳科技有限公司;磷酸二氢钠,分析纯,广州化学试剂厂;磷酸氢二钠,分析纯,广州化学试剂厂;过氧化氢(H2O2),分析纯,广州化学试剂厂;硫酸亚铁(FeSO4),分析纯,天津科密欧化学试剂有限公司;邻苯三酚,分析纯,天津市副晨化学试剂厂;Tris,分析纯,广州化学试剂厂;盐酸(HCl),分析纯,广州化学试剂厂;95%乙醇,分析纯,天津市富宇精细化工有限公司;DPPH(二苯基苦味酰基苯肼),分析纯,梯希爱(上海)化成工业发展有限公司。1.1.3仪器。METTLER AE 100 电子分析天平,中国上海精科天平厂;H-1微型涡旋混合器,上海精科实业有限公司;新一佳HH-2恒温水浴锅,江苏金上云市宏华仪器厂;UV-7500紫外可见分光光度计,中国上海精密科学仪器有限公司;KDC-140HK台式高速冷冻离心机,安徽中科中佳科学仪器有限公司;昆山舒美KQ-600双频超声波清洗器,昆山舒美超声仪器有限公司;Sartorius普及型pH计(PB-10),北京赛多利斯仪器系统有限公司;YB-500A型高速多功能粉碎机,上海力箭机械有限公司。
1.2方法
1.2.1不同来源灵芝热水提物总还原力测定。
1.2.1.1试剂配制。0.2 mol/L NaH2PO4溶液:称取NaH2PO4·2H2O 31.2 g(或NaH2PO4·H2O 27.6 g)加重蒸水1 000 mL即得。0.2 mol/L Na2HPO4溶液:称取Na2HPO4·12H2O 71.632 g(或Na2HPO4·7H2O 53.6 g 或Na2HPO4·2H2O 35.6 g)加重蒸水1 000 mL即得。0.2 mol/L pH 6.6的磷酸缓冲溶液:取62.5 mL 0.2 mol/L NaH2PO4加入37.5 mL 0.2 mol/L Na2HPO4,即得。1%铁氰化钾溶液:准确称取1 g铁氰化钾,加水溶解,定容至100 mL 棕色瓶中,保存备用。10%三氯乙酸(TCA)溶液:准确称取10 g TCA,加水完全溶解后,定容至100 mL棕色容量瓶中,保存备用。0.1% FeCl3:准确称取0.1 g FeCl3,加水完全溶解后,定容至100 mL,棕色容量瓶中,保存备用。
1.2.1.2总还原力测定。参照文献[21-22]的测定方法并略有修改。在2 mL 0.2 mol/L pH 6.6的磷酸缓冲溶液中加入2 mL样品、2 mL 1%铁氰化钾,混匀,混合物在50 ℃恒温条件下加热20 min,急速冷却到室温,加2 mL 10%三氯乙酸,充分混匀,4 ℃ 3 000 r/min离心10 min,取上层清液2 mL,加2 mL水,再加0.4 mL 0.1% FeCl3,混合均匀,静置10 min后在700 nm下测吸光度A700。每个处理3个重复。
1.2.2不同来源灵芝热水提物对羟基自由基(·OH)的清除作用。
1.2.2.1试剂配制。6 mmol/L FeSO4:精确称取0.166 8 g FeSO4·7H2O,溶于适量水中,最后定容至100 mL。6 mmol/L H2O2:30% H2O2溶液相当于10 mol/L,配制时将0.06 mL 30%H2O2溶液稀释至100 mL即可。6 mmol/L水杨酸:称取0.082 8 g水杨酸溶于适量水中,定容至100 mL,置棕色瓶中保存。
1.2.2.2清除率计算。参考Smirnoff等[23]测定方法并略有修改,在10 mL的试管中依次加入6 mmol/L FeSO4溶液1 mL、样品溶液1 mL、6 mmol/L H2O2溶液1 mL,摇匀,静置10 min,再加入6 mmol/L 水杨酸溶液1 mL,摇匀,静置30 min后,以双蒸水为参比,于510 nm处测其吸光值。清除率计算公式为:清除率(%)=[1-(Ai-Aj)/A0]×100%,式中,A0为用水代替样品溶液时测得的吸光度;Ai为不同样品液下测得的吸光度;Aj为水代替水杨酸时不同样品溶液测得的本底吸光度。
1.2.3不同来源灵芝热水提物对超氧阴离子自由基(O2-·)清除作用。
1.2.3.1试剂配制。0.1 mol/L HCl 溶液:取1 mL浓盐酸定容至100 mL即可。pH 8.0 0.05 mol/L Tris-HCl缓冲液:取Tris 0.61 g、EDTANa20.037 g用双蒸水溶解至98 mL左右,用HCl调节pH=7.9,最后定容至100 mL。10 mmol/L HCl溶液:取100 μL浓盐酸定容至100 mL即可。50 mmol/L邻苯三酚溶液:称取邻苯三酚0.063 g,用10 mmol/L HCl溶液溶解,定容至10 mL,避光,冷冻保存。
1.2.3.2清除率计算。参照Marklund等[24]测定方法并略有修改,取0.05 mol/L Tris-HCl(pH =8.2)缓冲液4.4 mL于试管中,置于25 ℃水浴中预热25 min,加入不同浓度测试液0.10 mL,2.5 mmol/L邻苯三酚0.5 mL,以蒸馏水为空白,混匀,于25 ℃恒温水浴中准确反应4 min,立即用10 mol/L HCl 2滴终止反应,并在299 nm处测其吸光度值。清除率计算公式为:清除率(%)=[1-(Ai-Aj)/Ac]×100%,式中,Ac为用水代替样品溶液时测得的吸光度;Ai为不同样品溶液下测得的吸光度;Aj为水代替邻苯三酚时不同样品溶液下测得的本底吸光度。
1.2.4不同来源灵芝热水提物对DPPH自由基清除作用。参照Brand-Williams等[25]测定方法并略有修改,准确称取20 mg DPPH用95%乙醇溶解并定容于250 mL 容量瓶中,得浓度为0.2 mmol/L的DPPH溶液,于棕色瓶中4 ℃保存。将样品溶液 2 mL与2 mL 2 ×10-4mol/L DPPH 溶液均匀混合,避光反应30 min 后在 517 nm 处测定其吸光度(Ai),同时用同法测定2 mL 2×10-4mol/L DPPH溶液与2 mL溶剂混合后的吸光度(Ac),以及 2 mL提取液与 2 mL 溶剂混合后的吸光度(Aj)。清除率计算公式为:清除率(%)=[1-(Ai-Aj)/Ac]×100%,式中,Ac为用水代替样品溶液时测得的吸光度;Ai为不同样品溶液下测得的吸光度;Aj为95%乙醇代替DPPH时不同来源样品溶液下测得的本底吸光度。
2 结果与分析
2.1不同来源灵芝热水提物总还原力的测定由图1可知,不同来源的灵芝在同一热水提取物浓度下(4 mg/mL),总还原力有显著性差异。其中猫儿山野生灵芝的总还原力远高于其他几种灵芝,吸光度达2.48,最低为阳江海灵芝,吸光度为0.3,总还原力由高到低依次为猫儿山野生灵芝、日本灵芝、方回春堂灵芝、长白山灵芝、黄山灵芝、泰山灵芝、阳江海灵芝。
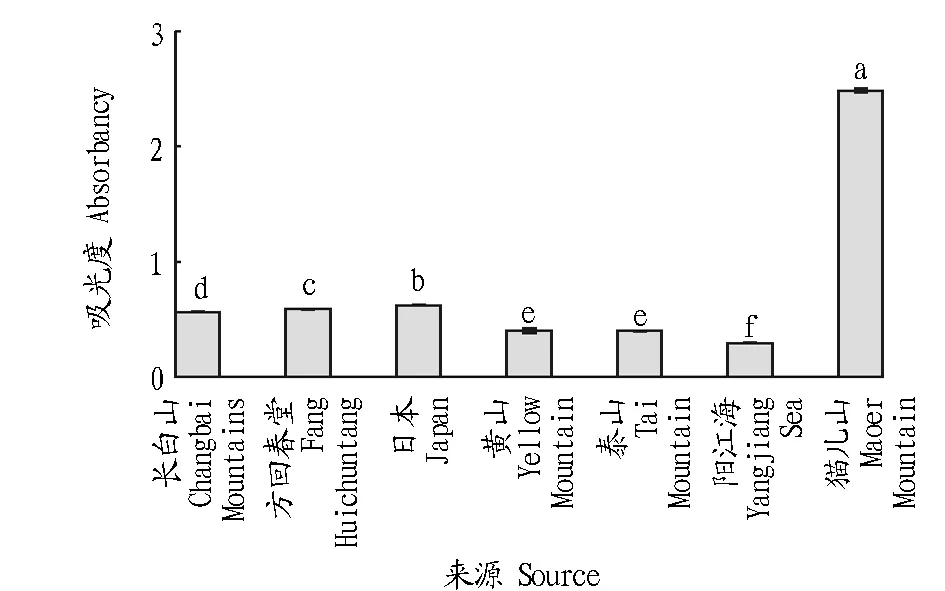
注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercases indicated significant differences (P<0.05)。图1 不同来源灵芝热水提物总还原力Fig.1 Reducing power of hot water extracts from different sources of G.lucidum
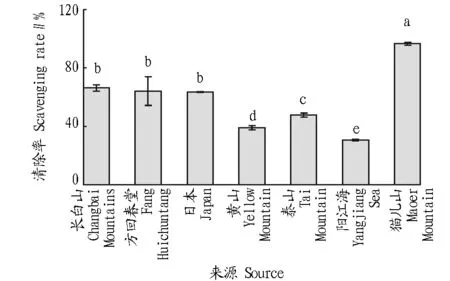
2.2不同来源灵芝热水提物清除羟基自由基(·OH)的测定从图2可以看出,不同来源的灵芝热水提取物在同一浓度下(10 mg/mL)清除·OH能力有显著性差异。其中猫儿山野生灵芝热水提取物对·OH清除能力最高,清除率为99.46%,阳江海灵芝清除率为96.3%,两者差异不显著(P>0.05),长白山灵芝热水提取物清除·OH能力最弱,清除率为17.94%。羟基自由基清除能力由高到低依次为猫儿山野生灵芝、阳江海灵芝、黄山灵芝、日本灵芝、泰山灵芝、方回春堂灵芝、长白山灵芝。

注:不同小写字母表示差异显著(P<0.05-)。Note:Different lowercases indicated significant differences (P<0.05)。图2 不同来源灵芝热水提物清除羟基自由基(·OH)效果Fig.2 Hydroxyl radical (·OH)scavenging of hot water extracts from different sources of G.lucidum

注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercases indicated significant differences (P<0.05)。图3 不同来源灵芝热水提物清除超氧阴离子自由基·)效果Fig.3 Superoxide radical ·)scavenging of hot water extracts from different sources of G.lucidum
2.4不同来源灵芝热水提物清除DPPH自由基的测定从图4可以看出,不同来源灵芝热水提取物在同一浓度下(2 mg/mL)清除DPPH自由基能力有显著性差异。其中猫儿山野生灵芝热水提取物清除DPPH自由基能力最高,清除率为96.62%;阳江海灵芝热水提取物清除DPPH自由基能力最弱,清除率为30.78%。DPPH自由基清除能力由高到低依次为猫儿山野生灵芝、长白山灵芝、方回春堂灵芝、日本灵芝、泰山灵芝、黄山灵芝、阳江海灵芝。
注:不同小写字母表示差异显著(P<0.05)。Note:Different lowercases indicated significant differences (P<0.05)。图4 不同来源灵芝热水提物清除DPPH自由基效果Fig.4 DPPH radlcal scavenging of hot water extracts from different sources of G.lucidum
3 结论与讨论

该试验通过清除DPPH、羟基自由基、超氧阴离子自由基活性及还原力能力4个体外抗氧化模型的测定,对不同来源
灵芝子实体热水提取物体外抗氧化性进行了比较研究,发现各种灵芝子实体热水提取物均有不同程度的体外抗氧化能力。但此次试验仅测定了同一浓度下不同来源灵芝的热水提取物体外抗氧化性,即通过预试验将热水提取物浓度调整到一个适宜比较的浓度进行横向比较,没有将水提物稀释成不同浓度梯度测定EC50,通常当EC50值低于10 g/L,表明真菌提取物具有很好的体外抗氧化活性[26]。从自由基清除率的比较可看出,灵芝热水提取物均具有较强的体外抗氧化活性,且不同的灵芝热水提取物抗氧化能力有显著差异,表明灵芝热水提取物对人体的氧化损伤有较好的保护作用。因为Lee等[26]研究表明热水提取物主要组成成分为粗多糖。说明猫儿山野生灵芝粗多糖具有较强的生理活性,粗多糖的分离纯化、结构鉴定以及抗氧化机理研究,还有待于进一步深入探讨。
[1] 赵继鼎,张小青.中国灵芝科真菌资源与分布[J].真菌学报,1992(1):55-62.
[2] 弓晓峰.黑灵芝元素形态、活性成分及其保健功能研究[D].南昌:南昌大学,2006:22-23.
[3] JONATHAN G S,AWOTONA F E.Studies on antimicrobial potentials of three Ganoderma species[J].Afr J Biomed Res,2010,13:133-139.
[4] QUERESHI S,PANDEY A K,SANDHU S S.Evaluation of antibacterial activity of differentGanodermalucidumextracts[J].People’s journal of scientific research,2010,3(1):9-14.
[5] WANG H,NG T B.Ganodermin,an antifungal protein from fruiting bodies of the medicinal mushroomGanodermalucidum[J].Peptides,2006,27(1):27-30.
[6] KIM B K,KIM H W,CHOI E C.Medicinal efficacies ofGanodermalucidum(XV) Anti-HIV activities ofGanodermalucidum[M]//Mushroom biology and mushroom products.Pennsylvania State University,1996:187-194.
[7] EO S K,KIM Y S,LEE C K,et al.Antiviral activities of various water and methanol soluble substances isolated fromGanodermalucidum[J].J Ethnopharmacol,1999,68(1/2/3):129-136.
[8] YUEN J,GOHEL M.Anticancer effects ofGanodermalucidum:A review of scientific evidence[J].Nutrition and cancer-an international journal,2005,53:11-17.
[9] IFF B,WACHTEL-GALOR S.Herbal medicine:Biomolecular and clinical aspects[M].2nd ed.Boca Raton(FL):CRC Press,2011:26.
[10] BANG T H,SHIMIZU K.Structure-activity relationship and inhibition pattern of reishi-derived(Ganodermalingzhi)triterpenoids against angiotensin-converting enzyme[J].Phytochemistry letters,2015,12:243-247.
[11] BANG T H,YAMAMOTO A,MATSUMOTO S,et al.Hypotensive effects of reishi(Ganodermalingzhi)’s auto-digested extract and its potent peptides for angiotensin-converting enzyme inhibition[J].Molecules,2014,19:13473-13485.
[13] FATMAWATI S,KONDO K,SHIMIZU K.Structure-activity relationships of lanostane-type triterpenoids fromGanodermalingzhias α-glucosidase inhibitors[J]. Bioorganic & medicinal chemistry letters,2013,23(21):5900-5903.
[14] NGUYEN V T,TUNG N T,CUONG T D,et al.Cytotoxic and anti-angiogenic effects of lanostane triterpenoids fromGanodermalucidum[J].Phytochemistry letters,2015,12:69-74.
[15] CHOI S,NGUYEN V T,TAE N,et al.Anti-inflammatory and heme oxygenase-1 inducing activities of lanostane triterpenes isolated from mushroomGanodermalucidumin RAW264.7 cells[J].Toxicology and applied pharmacology,2014,280(3):434-442.
[16] SATO N,ZHANG Q,MA C M,et al.Anti-human immunodeficiency virus-1 protease activity of new lanostane-type triterpenoids fromGanodermasinense[J].Chemical & pharmaceutical bulletin,2009,57(10):1076-1080.
[17] KOVACIC P,SOMANATHAN R.Cell signaling and receptors in toxicity of advanced glycation end products (AGEs):α-dicarbonyls,radicals,oxidative stress and antioxidants[J].J Recept Signal Transduct Res,2011,31(5):332-339.
[18] UNGVARI Z,KALEY G,DE CABO R,et al.A mechanisms of vascular aging:New perspectives[J].J Gerontol A Biol Sci Med Sci,2010,65:1028-1041.
[19] NAUMANN P,FORTUNATO F,ZENTGRAF H,et al.Autophagy and cell death signaling following dietary sulforaphane act independently of each other and require oxidative stress in pancreatic cancer[J].Int J Oncol,2011,39:101-109.
[20] 何瑞桃.灵芝的不同生产方式与药效品质关联性研究[D].雅安:四川农业大学,2009:17-18.
[21] YEN G,DUH P,TSAI H.Antioxidant and pro-oxidant properties of ascorbic acid and gallic acid[J].Food chemistry,2002,79(3):307-313.
[22] ZOU C,DU Y,LI Y,et al.Preparation of lacquer polysaccharide sulfates and their antioxidant activity in vitro[J].Carbohydrate polymers,2008,73(2):322-331.
[23] SMIRNOFF N,CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[24] MARKLUND S,MARKLUND G.Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J].Eur J Biochem,1974,47(3):469-474.
[25] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT-food science and technology,1995,28(1):25-30.
[26] LEE Y L,YEN M T,MAU J L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food chemistry,2007,104(1):1-9.
Antioxidant Activity of Hot Water Extracts from Seven Different Sources ofGanodemalucidum
NIE Jian, YANG Shui-lian, MO Mei-hua*et al
(College of Food Science, South China Agricultural University, Guangzhou, Guangdong 510642)
Ganodermalucidum; In vitro; Antioxidant activity; Hot water extracts; Different sources
聂健(1989- ),男,江西乐安人,硕士研究生,研究方向:灵芝活性成分。*通讯作者,副教授,博士,硕士生导师,从事食药用菌资源开发利用研究。
2016-04-15
S 567.3+1
A
0517-6611(2016)18-134-03
[12] BANG T H,SUHARA H,K,et al.Wild mushroom in Nepal:Some potential candidates as antioxidant and ACE inhibition sources[J].Evidence-based comprementary and alternative medicine,2014,2014:195305.
