寒地耐冷生防菌株筛选鉴定及特性研究
2016-09-24王玉霞刘宇帅孟利强晶曹胡基华陈静宇张淑梅
王玉霞,姜 威,刘宇帅,孟利强,李 晶曹 旭,胡基华,陈静宇,张淑梅*
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院高技术研究院,哈尔滨 150020)
寒地耐冷生防菌株筛选鉴定及特性研究
王玉霞1,2,姜威1,2,刘宇帅1,2,孟利强1,2,李晶1,2曹旭1,2,胡基华1,陈静宇1,张淑梅1,2*
(1.黑龙江省科学院微生物研究所,哈尔滨150010;2.黑龙江省科学院高技术研究院,哈尔滨150020)
试验分离鉴定黑龙江省鹤岗地区玉米根围冻土中生防菌株wswshg-10,并检测其低温生长特性、分泌活性物质能力、拮抗病原菌活性及催芽促生特性。综合形态和理化特性、16S rDNA和gyrB基因序列分析将其鉴定为甲基营养型芽孢杆菌Bacillus methylotrophicus。该菌株在4~15℃低温及20~30℃常温范围内可正常生长,是一株耐冷生防菌株,分泌几丁质酶、纤维素酶、蛋白酶、嗜铁素、吲哚乙酸、抗菌蛋白等多种活性物质,抑制烟草角斑病菌、玉米茎基腐病菌、黄瓜枯萎病菌、大豆菌核病菌、水稻恶苗和稻曲病菌、番茄灰霉病菌以及刺五加根腐病菌生长,抑制率74.3%~89.2%。菌液处理玉米种子能促进种子萌发及幼苗生长,根长和茎长显著增加。该菌株具有低温生长、抗菌促生特性,为低温菌剂研发提供菌株资源。
寒地;耐冷生防菌;鉴定;特性
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.008.html
王玉霞,姜威,刘宇帅,等.寒地耐冷生防菌株筛选鉴定及特性研究[J].东北农业大学学报,2016,47(8):31-38.
Wang Yuxia,Jiang Wei,Liu Yushuai,et al.Study on isolation and characterization of a psychrotrophic antagonistic bacterium from cold area[J].Journal of Northeast Agricultural University,2016,47(8):31-38.(in Chinese with English abstract)
低温菌在自然界中分布广泛,主要包括嗜冷菌(Psychrophilies)和耐冷菌(Psychrotrophic)。嗜冷菌主要分布于常冷环境,生长温度为0~20℃,耐冷菌从常冷到不稳定低温环境中均有分布,在0~ 5℃可生长,最高生长温度高于20℃[1]。低温菌以独特的生理功能适应环境,是一类重要菌株资源。目前,低温菌研究主要侧重于环境污染治理[2-4]、食品开发[5]、工业发酵[6]及农业废弃物降解等领域[7-9],生防领域研究较少,国内仅谢永丽和刘芳等从青海和西藏分离到低温适生生防芽孢杆菌[10-12]。黑龙江省微生物肥料和农药用量逐年增大。然而,黑龙江省低温时间长,春播时土壤温度偏低(约15℃),生防菌生存环境差,生防效果不佳。迄今为止,国内尚无低温菌微生物肥料和农药产品。
本研究基于黑龙江省特有寒地气候和低温微生物资源丰富等条件,筛选低温生防菌株,通过形态和生理生化特性以及16S rDNA和gyrB基因序列分析确定其种属地位,检测分泌活性代谢产物能力和低温生长特性,确定其对植物病原菌抑制效果及对玉米种子萌发影响,为低温生防菌株应用奠定基础。
1 材料与方法
1.1供试菌株
植物病原细菌烟草角斑病菌(Pseudomonas sy⁃ringae)和植物病原真菌大豆菌核病菌(Sclerotinia sclerotiorum)、水稻恶苗病菌(Fusarium monili⁃forme)、水稻稻曲病菌(Ustilaginoidea oryzae)、黄瓜枯萎病菌(Fusarium oxysporum)、玉米茎基腐病菌(Fusarium graminearum)、刺五加根腐病菌(Rhi⁃zoctonia solani)、番茄灰霉病菌(Botrytis cinerea)、大豆根腐病菌(Pythium spp.)均由黑龙江省生物工程重点实验室保存。
1.2耐冷生防菌筛选
从黑龙江省鹤岗地区玉米根部冻土中分离筛选耐冷生防菌。取10 g土样研磨后加入装有100 mL无菌水三角瓶中,10℃震荡3 h,倍比稀释至10-7,取10-6和10-7稀释液各100 μL分别涂布LB平板,10℃温箱培养直至菌落生长。挑取不同形态单菌落划线纯化后,以Fusarium oxysporum为指示菌采用平板对峙方法筛选生防菌株。
1.3菌株鉴定
1.3.1形态和生理生化特性鉴定
采用LB培养基10℃培养菌株3 d,通过革兰氏染色观察菌体和芽孢形态。参照伯杰细菌鉴定手册测定生理生化特性,包括葡萄糖发酵、MR、VP、氧化酶、接触酶、淀粉水解、明胶液化、尿素酶、柠檬酸盐利用、硝酸盐还原、石蕊牛奶、吲哚反应,7%NaCl生长,pH 5.7生长。
1.3.216S rDNA序列鉴定
以基因组DNA为模板,选用细菌通用引物27F:5'AGAGTTTGATCMTGGCTCAG 3'和1 492R: 5'GGYTACCTTGTTACGACTT 3'扩增16S rDNA基因。PCR反应条件:95℃预变性5 min;95℃变性30 s,50℃退火1 min,72℃延伸1.5 min,35个循环;72℃延伸10 min。PCR产物纯化后测序,所得序列在NCBI数据库中作BLAST比对,MEGA5.1软件进行系统发育分析。
1.3.3gyrB基因序列鉴定
选用引物UP1:5'GAAGTCATCATGACCGTTC TGCAYGCNGGNGGNAARTTYGA 3'和UP2r:5'AG CAGGGTACGGATGTGCGAGCCRTCNACRTNGCR⁃TCNGTCAT 3'从基因组DNA中扩增gyrB基因[10]。PCR扩增条件参照文献[13]。PCR产物纯化后测序,将序列在NCBI上作BLAST比对,MEGA5.1软件进行系统发育分析。
1.4菌株特性
1.4.1噬铁素检测
采用CAS平板法检测菌株是否分泌噬铁素[14]。取10 μL菌液接种于CAS平板上,10℃温箱培养3~7 d,观察有无酶解圈。
1.4.2几丁质酶检测
采用几丁质酶检测培养基检测菌株是否分泌几丁质酶。取10 μL菌液接种几丁质酶检测培养基(胶体几丁质1%,蛋白胨0.2%,酵母粉0.2%,硫酸镁0.02%,硫酸铁0.001%,磷酸氢二钾0.07%,磷酸二氢钾0.03%,琼脂粉2%),10℃培养3~7 d,观察有无酶解圈。
1.4.3纤维素酶检测
采用纤维素刚果红培养基检测菌株是否分泌纤维素酶,取10 μL菌液接种纤维素刚果红培养基(硫酸铵0.2%,磷酸二氢钾0.1%,氯化钠0.05%,纤维素粉2%,刚果红0.02%,琼脂粉2%),10℃培养3~7 d,观察有无酶解透明。
1.4.4蛋白酶检测
采用蛋白酶检测培养基检测菌株是否分泌蛋白酶。取10 μL菌液接种蛋白酶检测培养基平板上(脱脂奶粉1%,牛肉膏0.3%,蛋白胨1%,氯化钠0.5%),10℃培养3~7 d,观察有无酶解圈。
1.4.5吲哚乙酸检测
采用LB培养基10℃培养菌株3~7 d,取菌悬液50 μL滴入白色搪瓷盘中,加入50 μL Salkowski比色液(50 mL 35%HClO4+1 mL 0.5 mol·L-1Fe⁃Cl3),室温避光30 min后观察颜色变化,以不加比色液作对照,颜色变粉红表示分泌吲哚乙酸,不变色表示不分泌吲哚乙酸。
1.4.6抗菌蛋白检测
采用LB培养液10℃培养菌株3 d,4 000 r·min-1离心,收集上清液,采用硫酸铵分级沉淀方法获得抗菌蛋白,先加硫酸铵至30%饱和度,4℃过夜沉淀,10 000 r·min-1离心20 min,收集沉淀,得沉淀I。上清液依次加入硫酸铵至50%、70%和90%饱和度,4℃过夜沉淀,10 000 r·min-1离心20 min,收集沉淀Ⅱ、Ⅲ和Ⅳ,0.02 mol·L-1PBS pH 8.0缓冲液溶解,透析除盐,浓缩后以Fusarium oxysporum为指示菌对峙培养方法检测抑菌活性。
1.5菌株抑菌活性检测
1.5.1对烟草角斑病菌的抑菌活性
取病原细菌菌液100 μL涂布LB平板,平板中心放置无菌钢圈,钢圈中加入10 μL生防菌液,15℃培养3~7 d,观察有无抑菌圈。
1.5.2对植物病原真菌的抑菌活性
采用菌丝生长速率法检测生防菌对8种植物病原真菌抑菌活性。取100 μL生防菌液涂布PDA平板,平板中心接种活化后直径5 mm病原菌块,以不接种生防菌作对照,每个处理3次重复,15℃培养3~7 d,测定抑菌圈直径,按下列公式计算抑菌率。抑菌率(%)=(对照真菌直径-处理真菌直径)/对照真菌直径×100%。
1.6菌株适生温度检测
将活化后菌株按1%接种量接种到50 mL LB液体培养基中,分别置于4、10、15、20、25、30℃培养3 d,间隔12 h测定菌密度,每个处理3次重复。
1.7菌株对玉米种子催芽作用
采用LB液体培养基10℃培养菌株3 d,测定菌数后用无菌水稀释至107cfu·mL-1,选取100粒玉米种子放入50 mL稀释液中浸泡4 h,取出后将种子放在润湿滤纸上,将滤纸放在搪瓷盘中28℃培养2 d,记录萌发种子数,5 d后测量根长和芽长,LB培养液浸种作对照,每个处理3次重复。
2 结果与分析
2.1耐冷生防菌株筛选
基于不同菌落形态,分离到22株耐冷细菌,以Fusarium oxysporum为指示菌,筛选出1株显著抑制其生长的生防菌株wswhg-10(见图1)。

图1 低温耐冷生防菌株筛选Fig.1 Screening of psychrotrophicw asnwtsahgogn-i1st0ic bacteria against Fusarium oxysporum
2.2菌株鉴定
2.2.1形态及生理生化鉴定
菌株wswhg-10革兰氏阳性、中生芽孢、菌体杆状、单独或成对排列(见图2)。LB培养基上菌落乳白色、褶皱,近圆形。氧化酶、接触酶、MR、VP、柠檬酸盐利用、硝酸盐还原、明胶液化、淀粉水解、石蕊牛奶和吲哚反应均为阳性,葡萄糖发酵、尿素酶反应阴性,7%NaCl和pH 5.7生长(见表1)。与甲基营养型芽孢杆菌模式菌株CBMB205T特性基本一致[15]。

图2 菌株wswhg-10菌体与芽孢形态(1 500×)Fig.2 Morphology of strain wswhg-10

表1 菌株wswshg-10生理生化特性Table 1 Physiological and biochemical characteristics of strain wswhg-10
2.2.216S rDNA序列分析
应用细菌16S rDNA通用引物扩增得到1 400 bp DNA片段,测序后在NCBI数据库中作Blast比对,与芽孢杆菌属10株模式菌株同源性为99%,系统进化分析发现与B.methylotrophicus CBMB205T在同一分支(见图3),说明与B.methylotrophicus亲缘关系最近。
2.2.3gyrB基因序列分析
从基因组DNA中PCR扩增得到1 200 bp DNA片段,测序后在NCBI数据库中作Blast比对,与B. subtilis、B.methylotrophicus和B.amyloliquefaciens同源性较高为99%,系统进化分析发现与B.methylo⁃trophicus YJ11-1-4在同一分支(见图4),说明与B. methylotrophicus亲缘关系最近。
16S rDNA序列分析已广泛应用在属水平菌株鉴定,gyrB基因能将同属近似种菌株有效区分,两者结合可确保菌株鉴定有效性。经形态、生理生化和分子鉴定,菌株wswshg-10鉴定为甲基营养型芽孢杆菌B.methylotrophicus。

图3 基于16S rDNA基因序列构建的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA gene sequence

图4 基于gyrB基因序列构建的系统发育树Fig.4 Phylogenetic tree based on gyrB gene sequence
2.3菌株特性
利用特异检测培养基定性分析菌株wswhg-10分泌嗜铁素、几丁质酶、纤维素酶、蛋白酶和吲哚乙酸能力。菌株wswhg-10在含有胶体几丁质、蛋白和纤维素培养基上形成透明圈,说明该菌株生长过程中分泌几丁质酶、蛋白酶和纤维素酶(见图5B、C、D)。在CAS-平板上菌落周围变橙色,培养5 d的菌液加入Salkowski比色液后变成粉红色,说明菌株产生嗜铁素和吲哚乙酸(见图5A、E)。采用硫酸铵分级沉淀方法从无菌发酵液中收集4个沉淀,以Fusarium oxysporum为指示菌检测沉淀抑菌活性,结果见图5F,沉淀Ⅰ(30%硫酸铵沉淀)无抑菌活性,沉淀Ⅱ(30%~50%硫酸铵)、沉淀Ⅲ(50%~70%硫酸铵)和沉淀Ⅳ(70%~90%硫酸铵)均有抑菌活性,沉淀Ⅲ抑菌活性较大,说明该菌株可产生多种抗菌蛋白。
2.4抑菌活性
2.4.1对烟草角斑病菌抑菌活性
将生防菌wswhg-10与病原细菌共培养5 d,在生防菌周围有明显抑菌圈,抑菌圈直径3.8 cm(见图6),结果说明菌株wswshg-10对烟草角斑病菌具有较强抑制作用。

图5 菌株wswshg-10特性Fig.5 Characteristics of strain wswshg-10
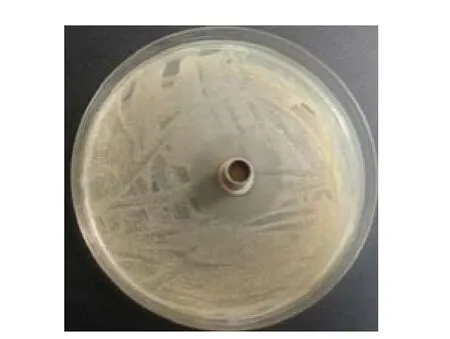
图6 菌株wswshg-10对烟草角斑病菌抑菌活性Fig.6 Inhibition activity of strain wswshg-10 to Pseudomonas syringae from tobacco
2.4.2对病原真菌抑菌活性
菌株wswshg-10对病原真菌抑菌效果见图7。菌株wswshg-10能抑制8种病原真菌生长,对S. sclerotiorum、F.moniliforme、U.oryzae、F.oxysporum、F.graminearum和B.cinerea抑菌率较高,分别为85.8%、86.9%、86.5%、89.2%、87.6%和84.7%,对R.solani和Pythium spp.抑菌率略低,分别为74.3%和80.2%。
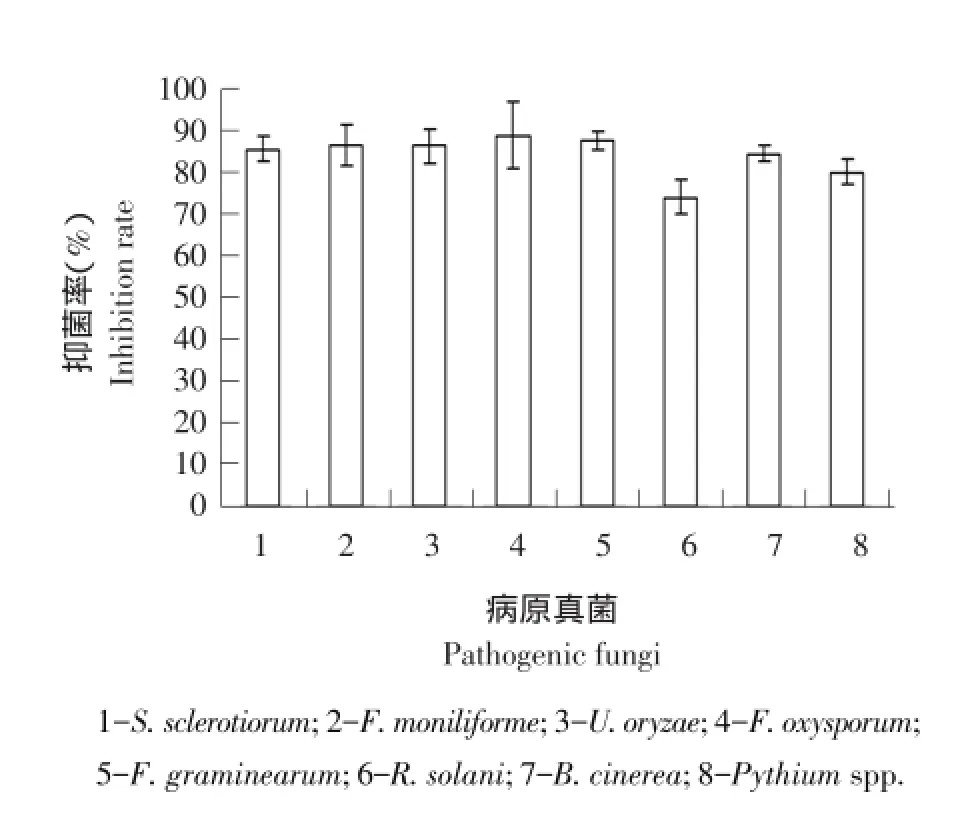
图7 菌株wswshg-10对病原真菌抑菌活性Fig.7 Inhibition activity of strain wswshg-10 to pathogenic fungi
2.5菌株适生温度
菌株wswshg-10在4、10、15、20、25和30℃均能生长,菌株生长速度与温度呈正相关(见图8)。4℃培养,菌株生长较慢,培养期间菌株持续生长,第3天菌体密度最高。随温度升高,菌株生长速度加快,10和15℃培养24 h,菌体密度为4℃的1.65和2.71倍,第3天菌体密度达最大值。20、25和30℃培养,菌体密度分别在48、36和24 h达最高值。该菌株在低温10和15℃好,最适生长温度为30℃,表明该菌株为耐冷细菌。
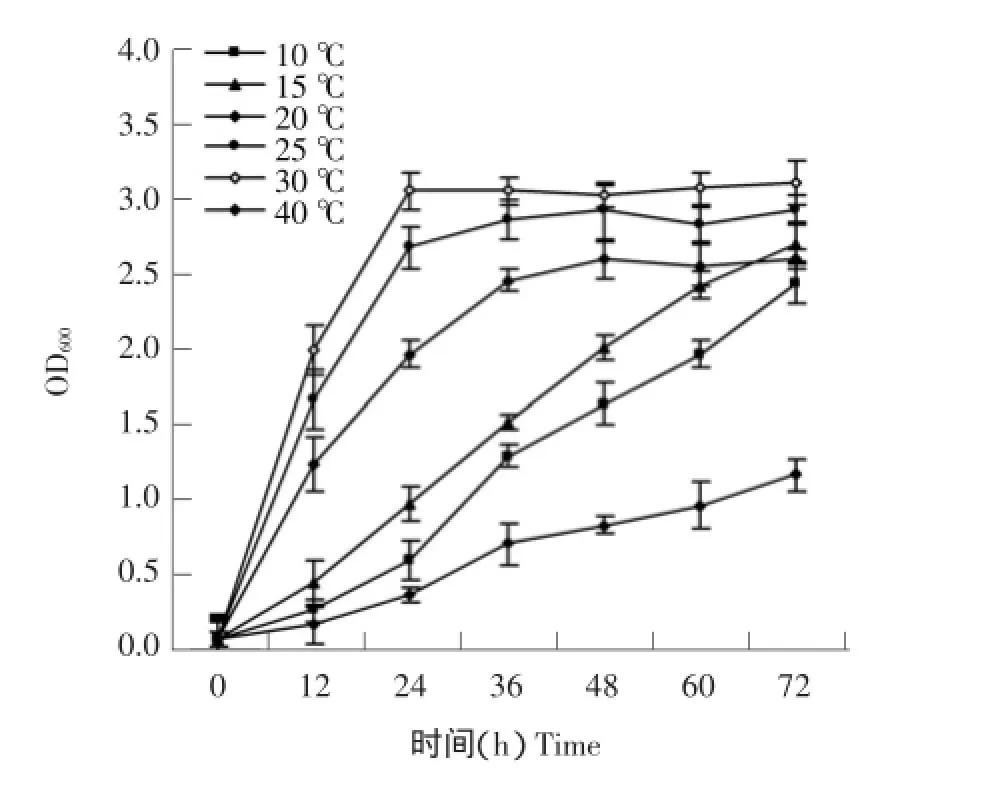
图8 温度对菌株生长影响Fig.8 Effect of temperature on the growth of strain wswshg-10
2.6菌株对玉米种子催芽作用
107cfu·mL-1菌液处理玉米种子,玉米种子提前1 d发芽且发芽整齐。与对照相比,芽长和根长显著增加(见表2)。结果表明该菌株可促进玉米种。

表2 菌株wswshg-10对玉米种子发芽影响Table 2 Effect of strain wswshg-10 on maize seed germination
3 讨论与结论
芽孢杆菌是土壤和植物微生态优势微生物种群,具有抗逆抗病和促生长功能。目前国内外已商品化的芽孢杆菌主要包括枯草芽孢杆菌、地衣芽孢杆菌、巨大芽孢杆菌和解淀粉芽孢杆菌[16]。甲基营养型芽孢杆菌(Bacillus methylotrophicus)为Madhaiyan等首次报道新种,分离自水稻根围土壤,具有促进植物生长功能[15]。在分类方面,Dunlap等认为甲基营养型芽孢杆菌与B.amyloliquefaciens subsp.plantarum亲缘关系最近,B.amyloliquefa⁃ciens subsp.plantarum的模式菌株FZB42T是甲基营养型芽孢杆菌变种[16]。
甲基营养型芽孢杆菌是一类新型生防资源菌,研究者已从土壤、植物体和海洋等不同生境中分离纯化出具有生防功能菌株,主要用于防治黄瓜炭疽病、立枯病和枯萎病,番茄灰霉病和青枯病以及香蕉枯萎病等[17-21]。2016年甲基营养型芽孢杆菌9912获得国家微生物农药登记,用于防治黄瓜灰霉病[22]。本研究从黑龙江寒地冻土中筛选出一株耐冷甲基营养型芽孢杆菌wswshg-10。该菌株抑菌谱广,对烟草角斑病菌、大豆菌核病菌、水稻恶苗病菌、水稻稻曲病菌、黄瓜枯萎病菌、玉米茎基腐病菌、刺五加根腐病菌、番茄灰霉病菌和大豆根腐病菌生长具有较强抑制作用,分泌蛋白酶、几丁质酶、纤维素酶、嗜铁素、吲哚乙酸、抗菌蛋白等多种活性物质。几丁质酶、嗜铁素和抗菌蛋白均为抗菌相关物质,但抑菌机制不同,嗜铁素通过与病原菌争夺铁离子,使病菌缺铁不能生长[23],几丁质酶通过溶解病菌细胞壁使菌体消融[24],抗菌蛋白通过水解病菌细胞壁、抑制菌丝和孢子萌发及诱导植物产生系统抗性阻止病菌侵入或抑制病菌生长[25],菌株wsw⁃shg-10能分泌抗菌物质,表明其抑菌机制复杂,多种机制协同作用可增强其抑菌活性。吲哚乙酸是植物生长激素,促进植物生长[26],本研究发现用wsw⁃shg-10菌液处理玉米种子可促进种子萌发,芽长和根长显著增加,可能是吲哚乙酸作用。纤维素酶具有降解纤维素能力,在农用废弃物降解方面具有应用潜力。蛋白酶在工业上应用广泛,本研究发现该菌株可产生低温纤维素酶和蛋白酶,纤维素酶活力不强,可能与低温限制有关,而蛋白酶活力较强,因此应深入研究菌株分泌蛋白酶特性。低温生长是菌株wswshg-10显著特性,尽管其最适生长温度为常温,但在低温10~15℃生长良好,菌株这一特性能耗,又可增强其在低温土壤中生长速度,提高生防效果和应用稳定性,该菌株在低温菌剂研发方面具有应用前景。
在生理生化特性方面,菌株wswshg-10与其模式菌株CBMB205T[15],菌株wsw⁃shg-10为阳性,菌株CBMB205T为阴性,与菌株N5、WF-3和LW-61在葡萄糖发酵、尿素酶和柠檬酸盐利用特性不同[17,19-20]。为准确确定菌株种属地位,本研究采用形态、生理生化、16S rDNA及gyrB基因序列分析综合鉴定。16S rDNA基因序列分析广泛应用于属水平鉴定,gyrB基因分子进化速率大于16S rDNA基因,更适合近缘种鉴定[27]。
[1]辛明秀,周培瑾.低温微生物研究进展[J].微生物学报,1998, 38(5):400-403.
[2] 韩晓云,姜安玺,何丽蓉.低温菌及其在环境工程中的应用[J].东北林业大学学报,2003,31(2):33-35.
[3]邱天,杨基先,崔迪,等.适冷微生物研究进展及应用现状[J].环境科学与技术,2012,35(61):124-127.
[4]李慧峰,黄津辉,周绪申,等.两株耐冷低温菌的分离鉴定及应用的初步研究[J].安徽农业科学,2013,41(3):1204-1206.
[5]曾胤新,陈波.低温微生物适冷特性及其在食品工业中的潜在用途[J].生物技术,2000,10(2):32-36.
[6]高云航,勾长龙,王雨琼,等.湖水中低温菌的筛选及其产酶特性[J].中国农学通报,2014,30(30):273-277.
[7]谢宇新,徐凤花,王彦伟,等.低温菌株的筛选及对堆肥温度的影响[J].农业环境科学学报,2011,30(7):1436-1442.
[8]单德鑫,王岩,张颖.低温菌群筛选及对温度的影响[J].东北农业大学学报,2015,46(6):40-46.
[9]赵伟,潘延欣,靳雯然,等.低温菌剂降解秸秆还田对东北黑土微生物活性的影响[J].湖北农业科学,2014,53(17):4020-4024.
[10]谢永丽,马莉贞,徐志伟,等.冻土荒漠区分离低温适生PGPR菌的鉴定及其抗菌促生特性[J].中国生物防治学报,2014,30 (1):94-100.
[11]谢永丽,高学文.可可西里低温适生拮抗芽孢杆菌的筛选鉴定及脂肽化合物分析[J].应用生态学报,2013,24(1):149-155.
[12]刘芳,薛鹏琦,乔俊卿,等.西藏低温适生芽孢杆菌的分离鉴定及其抗菌和促生作用[J].中国生物防治,2010,26(4):453-460.
[13]Yamamoto S,Harayama S.PCR amplification and direct sequenc⁃ing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J].Applied and Environmental Microbiology,1995,61(3): 1104-1109.
[14]Brian C,Louden D H,Aaron M L.Use of blue agar CAS assay for siderophore detection[J].Journal of Microbiology&Biology Edu⁃cation,2011,12(1):51-53.
[15]Madhaiyan M,Poonguzhali,Kwon S W,et al.Bacillus methylotro⁃phicus sp.nov.,a methanol utilizing,plant-growth-promoting bac⁃terium isolated from rice rhizosphere soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60:2490-2495.
[16]Dunlap C A,Kim S J,Kwon S W,et al.Phylogenomic analysis shows that Bacillus amyloliquefaciens subsp.plantarum is a later heterotypic synonym of Bacillus methylotrophicus[J].International Journal of Systematic and Evolutionary Microbiology,2015,65: 2104-2109.
[17]谢学文,董瑞利,石延霞,等.黄瓜炭疽病拮抗细菌的筛选及其抑制效果[J].中国生物防治学报,2016,32(2):215-220.
[18] 吕倩,胡江春,王楠,等.南海深海甲基营养型芽孢杆菌SHB114抗真菌脂肽活性产物的研究[J].中国生物防治学报,2014,30 (1):113-120.
[19]刘伟,宋双,沈小英,等.番茄灰霉病拮抗芽孢杆菌LW-61的筛选、鉴定及抑菌活性研究[J].西北农林科技大学学报:自然科学版,2013,41(11):73-79.
[20]王洪梅,吴云成,沈标.青枯病生防菌N5的特性及其生物学效应[J].土壤,2013,45(6):1082-1090.
[21]黄霄,陈波,周登博,等.菌株BM-24的分离鉴定及对香蕉枯萎病菌的抑菌活性[J].植物保护学报,2013,40(2):121-127.
[22]佚名.我国首登新型生物杀菌剂甲基营养型芽孢杆菌9912[J].河南化工,2016,33(2):32.
[23]Saha M,Sarkar S,Sarkar B,et al.Microbial siderophores and their potential applications:A review[J].Can J Microbiol,2015, 61(4):257-262.
[24]Saber W I,Ghoneem K M,Al-Askar A A,et al.Chitinase produc⁃tion by Bacillus subtilis ATCC 11774 and its effect on biocontrol of Rhizoctonia diseases of potato[J].Acta Biol Hung,2015,66(4): 436-448.
[25] 出晓铭,林毅雄,张珅,等.生防菌解淀粉芽孢杆菌抗菌蛋白的研究进展[J].包装与食品机械,2014,32(6):49-54.
[26]Wang L T,Lee F L,Tai C J,et al.Comparison of gyrB gene se⁃quences,16S rRNA gene sequences and DNA-DNA hybridiza⁃tion in the Bacillus subtilis group[J].International Journal of Sys⁃tematic and Evolutionary Microbiology,2007,57:1846-1850.
[27]La Duc M T,Satomi M,Agata N,et al.gyrBas a phylogenetic dis⁃criminator for members of the Bacillus anthracis-cereus-thuringi⁃ensis group[J].Journal of Microbiological Methods,2004,56:383-394.
Study on isolation and characterization of a psychrotrophic antagonis⁃tic bacterium from cold area/WANG Yuxia1,2,JIANG Wei1,2,LIU Yushuai1,2,MENG Liqiang1,2,
LI Jing1,2,CAO Xu1,2,HU Jihua1,CHEN Jingyu1,ZHANG Shumei1,2(1.Institute of Microbiology,Heilongjiang Academy of Sciences,Harbin 150010,China;2.Institute of Advanced Technology,Heilongjiang Academy of Sciences,Harbin 150020,China)
A psychrotrophic antagonistic bacterium wswshg-10 was isolated from maize rhizospheric frozen soil in Hegang area,Heilongjiang Province.Based on morphology and biochemistry characterization as well as 16S rDNA andgyrBgene sequence analysis,strain wswshg-10 was identified asBacillus methylotrophicus.The strain exhibited a capability of growth at low temperature ranged from 4 to 15℃and at normal temperature ranged from 20 to 30℃,secreting chitinase,cellulase,protease,siderophore, indoleacetic acid and antifungal proteins.It was able to inhibit pathogen growth such asPseudomonas syringae,Sclerotinia sclerotiorum,Fusarium moniliforme,Ustilaginoidea oryzae,Fusarium oxysporum, Fusarium graminearum,Rhizoctonia solani,Botrytis cinereaandPythiumspp.,the rate of inhibition was74.3%-89.2%.Soaking seed revealed that the strain could promote maize seed germination and seedling growth.Stain wswshg-10 had multifaceted beneficial characteristics.It may be an ideal plant growth promoting and biocontrol agent for its integrated use in agriculture.
cold area;psychrotrophic bioncontrol strain;identification;characterization
Q939.96
A
1005-9369(2016)08-0031-08
2016-05-13
国家自然科学基金项目(30301780);黑龙江省院所科技合作项目(YS16C15);黑龙江省科学院基金项目(KY15CZSM08)
王玉霞(1973-),女,高级工程师,硕士,研究方向为植物病害生物防治。E-mail:wangyuxia218@sohu.com
张淑梅,研究员,博士,研究方向为微生物农药研发。E-mail:shumeizhang@yahoo.com
