高雄激素PCOS动物模型中抗苗勒管激素Ⅱ型受体蛋白及其基因甲基化分析
2016-09-23郝栋栋殷倩钟兴明韦相才1苗竹林王永霞
郝栋栋,殷倩,钟兴明,韦相才1,*,苗竹林,王永霞
(1.暨南大学附属第一医院妇产科,广州 510632;2. 广东省计划生育科学技术研究所,广州 510000)
高雄激素PCOS动物模型中抗苗勒管激素Ⅱ型受体蛋白及其基因甲基化分析
郝栋栋1#,殷倩1#,钟兴明2,韦相才1,2*,苗竹林2,王永霞2
(1.暨南大学附属第一医院妇产科,广州510632;2. 广东省计划生育科学技术研究所,广州510000)
目的通过建立高雄激素诱导的多囊卵巢综合征(PCOS)大鼠模型,探讨抗苗勒管激素Ⅱ型受体(AMHR Ⅱ)在卵巢、子宫内膜中的表达及其基因启动子区域甲基化与PCOS发病及局部病理变化的关系。方法45只雌性SD大鼠随机分两组:PCOS组皮下注射脱氢表雄酮(DHEA)建立PCOS模型,对照组同期皮下注射等量生理盐水;测定血清激素水平,结合卵巢组织HE染色切片结构改变评估PCOS模型;免疫组化法检测卵巢、子宫内膜组织AMHR Ⅱ蛋白的表达与定位;通过甲基化特异性PCR(MSP)定性分析两组大鼠血液、卵巢组织AMHR Ⅱ基因启动子区域的甲基化状态。结果血清性激素水平及卵巢切片结果均提示成功建立PCOS动物模型;免疫组化检测显示AMHR Ⅱ蛋白定位表达于细胞膜,在卵巢间质及卵泡颗粒细胞中均存在阳性表达,且在模型组中的表达强于对照组(P<0.05);AMHR Ⅱ在子宫内膜中也存在表达,两组之间表达无统计学差异(P>0.05);MSP结果显示两组中血液及卵巢组织所有DNA样本均检出部分甲基化条带,两组之间无统计学差异(P>0.05)。结论AMHR Ⅱ可能参与了PCOS中AMH调控卵泡发育的过程,但与子宫内膜病变无明显相关性;AMHRⅡ基因在启动子区域存在着部分甲基化,但这种甲基化状态与PCOS发病及局部组织病理变化无明显相关。
抗苗勒管激素Ⅱ型受体;多囊卵巢综合征;DNA甲基化;动物模型
【Abstract】
Objective:To study localization,distribution and expression of anti-müllerian hormone type Ⅱ receptor (AMHR Ⅱ) in ovary and endometrium based on rat model of polycystic ovary syndrome (PCOS),and explore the correlation between AMHR Ⅱ gene methylation and the local histopathological changes.
Methods:Forty five female Sprague-Dawley rats were grouped randomly into model group (PCOS model) subcutaneously injected with dehydroepiandrosterone (DHEA) and control group with sodium chloride instead. The levels of related reproductive hormones in serum were measured. The ovarian tissue of rats in every group underwent paraffin embedding,microsection,HE staining,and then patho-histological changes were observed to assess the establishment of PCOS model. The localization,distribution and semi-quantitative analysis of AMHR Ⅱ protein were determined by immunohistochemistry (IHC). The qualitative analysis of AMHR Ⅱ gene methylation in blood and ovarian tissues was performed by methylation-specific PCR (MS-PCR).
Results:The reproductive hormone levels and morphology analysis of tissue HE stained indicated that PCOS animal model was successfully established. IHC analysis showed that AMHR Ⅱ mainly located and expressed in cell membrane,and ovarian stroma and of granulosa cells of follicle presented positively expression. The expression was significantly higher in the model group than the control group (P<0.05). AMHR Ⅱ were also expressed in endometrial glandular epithelial cells and stromal cells,and there were no significant differences between the two groups (P>0.05). MSP qualitative analysis showed partial methylation occurred in the promoter region of AMHR Ⅱ genes in the blood and ovarian tissues in both groups,but without significant differences (P>0.05).
Conclusions:AMHR Ⅱ may be involved in the follicular development process regulated by AMH,but it may not be related to endometrial lesions. AMHR Ⅱ gene partial methylation in the promoter region may not be correlated with the local histopathological changes.
(JReprodMed2016,25(9):832-837)
多囊卵巢综合征(PCOS)是以高雄激素、胰岛素抵抗为主要表现的内分泌、代谢紊乱综合征。PCOS至今发病机制不明,近年来有研究认为PCOS是一种卵源性疾病,卵巢局部调节因子的异常可能是导致PCOS一系列病理生理改变的重要因素[1]。抗苗勒管激素(AMH)是由卵巢颗粒细胞分泌的一种局部调节因子,在PCOS患者血清中明显高于正常同龄妇女,且研究认为其与卵泡生长发育密切相关。抗苗勒管激素Ⅱ型受体(AMHR Ⅱ)是AMH作用的中间受体,它的表达是否参与或者以何种方式参与AMH调控卵泡发育的过程,研究报道不一。DNA甲基化是基因表观遗传修饰的重要方式,AMHRⅡ基因在PCOS中是否通过表观遗传学改变从而影响其在组织中的表达,鲜有报道。本实验通过观察高雄激素PCOS大鼠模型卵巢、子宫内膜等局部组织中AMHR Ⅱ蛋白的表达与分布,探讨AMHR Ⅱ在PCOS局部组织病变发生发展中的作用;并对AMHRⅡ基因启动子区域甲基化状态进行定性分析,探讨AMHRⅡ基因在PCOS中是否存在表观遗传学改变以及此种改变是否参与了AMHR Ⅱ表达调控。
材料与方法
一、实验动物与试剂
清洁级SD雌性大鼠45只,均购自广东省医学动物实验中心,动物许可证编号SCXK(粤)2008-0002,20~23日龄,体重40~55 g。
ELISA试剂盒购自上海信帆生物技术有限公司;兔抗鼠AMHR Ⅱ单克隆抗体购自美国abcam公司;组织DNA提取试剂DNA重亚硫酸盐转化试剂盒及甲基化特异性PCR试剂盒购自北京天根生物技术有限公司。
二、实验方法
1. PCOS大鼠模型的建立:45只SD雌性大鼠随机分为PCOS组(n=25)与正常对照组(n=20)。前者皮下注射脱氢表雄酮(DHEA)6 mg/100 g/d,连续注射20 d,建立PCOS大鼠模型[2-3];后者同期予以等量生理盐水。两组大鼠均喂以标准大鼠颗粒饲料,环境温度20~23℃,湿度40%~60%,予清洁级饲养,每日光照10 h,自由饮水。
2. 标本的收集与病理检测:两组大鼠于6周龄始进行阴道脱落细胞涂片,于动情间期提前一天禁食,次日以3%戊巴比妥那(30 mg/kg,ip)麻醉,经腹主动脉一次性采血并分为抗凝与非抗凝两管;取出双侧卵巢与子宫,一侧卵巢迅速置于-80℃保存,用于后续提取组织DNA,子宫及另一侧卵巢则迅速置于10%中性甲醛中固定24 h,以卵巢最大横切面及子宫横切面为待测面分别行HE染色与免疫组织化学染色。
3. 血清激素检测:腹主动脉采取的非抗凝血在4 000 rpm离心10 min后分离上层血清-20℃保存。按照ELISA试剂盒说明书操作,测定血清睾酮(T)、雌二醇(E2)、孕酮(P)、黄体生成素(LH)、卵泡刺激素(FSH)以及抗苗勒管激素(AMH)水平。
4. 免疫组织化学检测AMHR Ⅱ蛋白的表达:采用链霉菌抗生物素-过氧化物酶免疫组化法(SP 法) 检测石蜡切片中AMHR Ⅱ。Ⅰ抗为兔抗鼠AMHR Ⅱ单克隆抗体1∶100 稀释,Ⅱ抗为辣根过氧化物酶标记羊抗兔抗体,用二氨基联苯胺(DAB) 显色。染色过程参照试剂盒说明操作,以PBS 代替Ⅰ抗作为阴性对照。卵巢、子宫内膜组织中AMHR Ⅱ蛋白半定量分析采用德国Lecia正立体式显微镜医学图像分析系统,阳性信号是指在细胞膜和胞浆内呈现棕黄色的颗粒,每张切片随机选取5个高倍镜视野分别测定卵巢间质和卵泡、子宫内膜间质和腺体的AMHR Ⅱ蛋白表达水平。
5. 大鼠基因组DNA的提取:采用经典的酚氯仿法提取血液基因组DNA;大鼠卵巢组织于-80℃取出并按DNA提取试剂盒说明书操作提取组织DNA。1%琼脂糖凝胶电泳及紫外分析仪检测DNA的纯度及浓度,于-20℃保存备用。
6. 大鼠基因组DNA中AMHRⅡ基因甲基化的检测:采用甲基化特异性PCR定性分析AMHRⅡ基因启动子区域的甲基化状态。①在数据库中查找AMHRⅡ基因相关序列,选择位于AMHRⅡ基因转录起始位点上游的一段富含CpG位点的DNA序列,运用Meth Primer-Design 软件进行AMHRⅡ基因甲基化特异性引物设计(表1)。②按DNA重亚硫酸盐转化试剂盒说明书将提取的DNA样本予重亚硫酸盐处理,处理后的DNA样本做为模板DNA,根据甲基化特异性引物与非特异性引物分别加入两个PCR管中,按照PCR试剂盒操作说明分别进行甲基化特异性PCR。③PCR产物于1%琼脂糖凝胶电泳以检测有无目的条带出现。

表1 AMHR II 甲基化特异性PCR引物设计
注:M为甲基化特异性引物,U为非甲基化特异性引物
三、统计方法
结 果
一、PCOS动物模型的验证
本实验材料来自于同一基金支持下的并行项目[3],按照本实验室既往的方案,实验动物造模成功:PCOS组血清T、E2、AMH水平均高于对照组,且LH/FSH比值升高;PCOS组卵巢组织总体呈典型多囊样改变,子宫内膜增厚、腺体增多。
二、AMHR Ⅱ蛋白在卵巢、子宫内膜中的表达情况
1. 免疫组化蛋白定位结果:AMHR Ⅱ的表达主要定位于细胞膜,PCOS组与对照组中AMHR Ⅱ在子宫内膜腺上皮细胞及间质细胞中均存在着阳性表达(图1A和1B),两者阳性表达无明显差异。PCOS组AMHR Ⅱ在卵巢卵泡卵母细胞及颗粒细胞、卵泡膜细胞均有阳性表达,尤其是在颗粒细胞中表达,卵巢间质中见少量分布(图1C),而对照组AMHR Ⅱ主要在未成熟卵泡颗粒细胞表达,阳性率明显低于PCOS组,卵泡外膜细胞、间质中见少量分布(图1D)。
2. AMHR Ⅱ蛋白的相对定量结果:AMHR Ⅱ在PCOS大鼠卵巢卵泡及间质中表达较对照组增强,其分布在间质及卵泡中的差异均有统计学意义(P<0.05);AMHR Ⅱ在大鼠子宫内膜腺上皮细胞表达较间质中增强,但PCOS组与对照组两者间质及腺上皮细胞的灰度值分析显示无显著性差异(P>0.05)(表2)。
3、AMHRⅡ基因甲基化检测:在大鼠血液和卵巢基因组DNA中,PCOS组与对照组所有样本中均在250 bp附近检出了部分甲基化条带(图2)。电泳条件为:1%凝胶电泳,电压为100 V,电流约20 mA。

A:PCOS组子宫内膜;B:对照组子宫内膜;C:PCOS组卵巢组织;D:对照组卵巢组织图1 AMHR Ⅱ蛋白在PCOS组及对照组卵巢及子宫内膜组织的表达(免疫组化 ×200)

组别卵巢组织子宫内膜组织间质卵泡间质腺上皮细胞对照组113.73±3.93112.04±3.09110.37±11.9796.49±8.82PCOS组104.73±7.04*102.89±3.09*109.36±10.4288.41±8.93
注:与对照组比较,*P<0.05
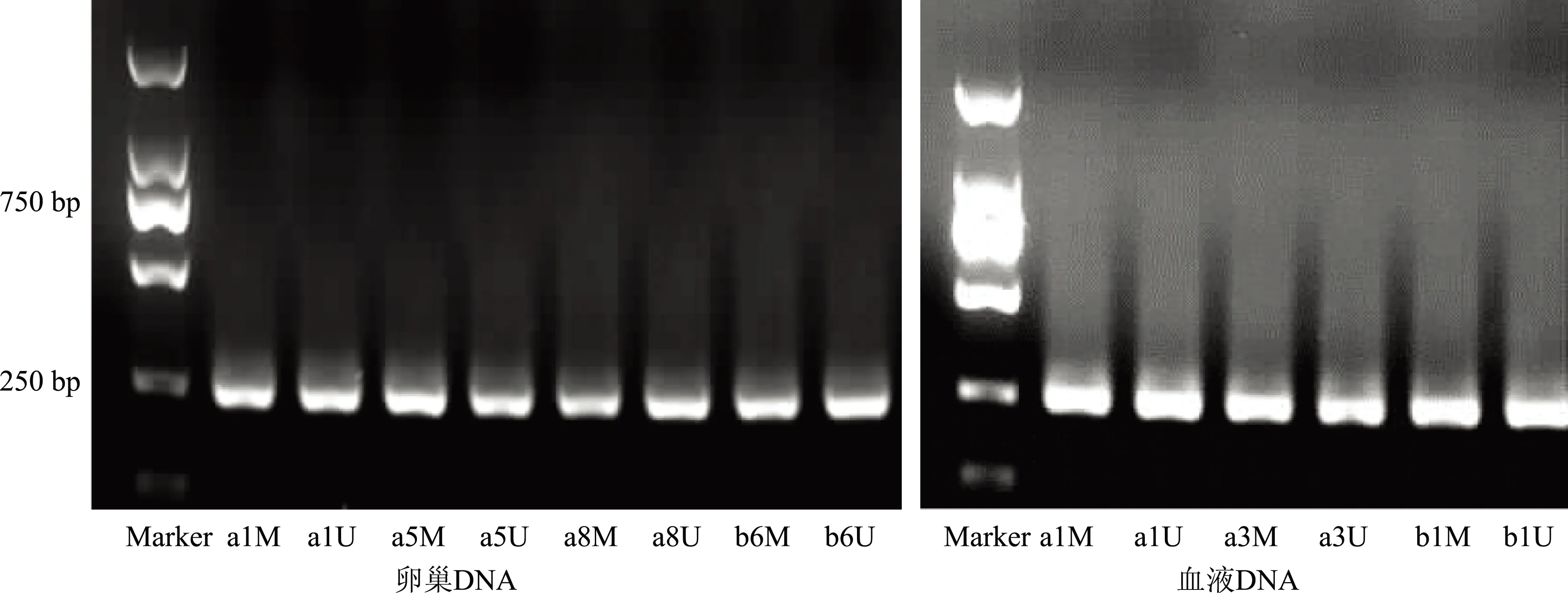
M:甲基化特异性引物;U:非甲基化特异性引物;a:PCOS组;b:对照组;数字代表样品编号图2 大鼠卵巢及血液DNA中AMHR Ⅱ基因甲基化特异性PCR琼脂糖凝胶图像
讨 论
一、AMHR Ⅱ在PCOS生殖器官局部病理变化中的作用
AMH又称为苗勒管抑制因子,最初在男性睾丸组织中发现,与男性胚胎性腺分化阶段苗勒管的退化有关。在女性个体内,AMH主要由处于生长阶段的卵泡颗粒细胞分泌,并与起始卵泡的募集与卵巢生长发育中优势卵泡的产生有关[4],其在血清中的浓度与卵巢中未成熟卵泡的数目有关。与TGF-β家族的其他成员一样,AMH信号传导需经过两种丝氨酸/苏氨酸激酶受体(AMHR I与AMHR Ⅱ)与两种smad蛋白(受体调节smad蛋白R-Smad、普通smad蛋白smad4)。然而AMH主要通过AMHR Ⅱ(一种跨膜的丝氨酸/苏氨酸激酶受体)发生信号传导,而不能通过其他Ⅱ型受体如骨基质发生蛋白Ⅱ型受体,激活素Ⅱ型受体等[5-6]。研究发现AMHRⅡ基因敲除的大鼠并不会出现苗勒管得退化,持续苗勒氏管综合征患者中AMHRⅡ基因存在着突变[7]。
目前关于AMHR Ⅱ在卵巢、子宫内膜等生殖器官局部分布与表达的研究较少,AMHR Ⅱ是否参与了AMH调控卵泡生长发育的过程研究报道结论不一。姜宙等[8]认为AMH通过与卵丘颗粒细胞的特异性受体AMHR Ⅱ结合调控卵母细胞发育,且在卵泡中AMHR Ⅱ mRNA与AMH的表达量变化趋势相同。Rice等[9]研究发现AMHR Ⅱ mRNA在多囊卵巢中的表达存在着特殊阶段性,仅在少数始基卵泡、窦卵泡、次级卵泡中表达,并对AMH抑制卵泡募集提出了质疑。Li[10]等研究也发现在PCOS患者卵巢颗粒细胞中AMHR Ⅱ的mRNA与蛋白表达明显增强。本实验中PCOS模型组血清中AMH浓度明显高于对照组,说明在PCOS大鼠血清中AMH浓度明显升高,这也与国内外众多研究一致。在大鼠卵巢免疫组化切片中发现AMHR Ⅱ在窦前卵泡及窦卵泡中都有表达,而在卵泡膜细胞及间质中也发现存在着少量阳性表达;本研究还发现在PCOS模型组AMHR Ⅱ在卵泡细胞(主要为颗粒细胞)的分布表达强于对照组。因此我们推测可能存在这样的过程:PCOS中窦前卵泡及窦卵泡等未成熟卵泡的增多使得AMH分泌总量增加,血清中AMH浓度升高,AMH分泌量的增加上调了它的受体AMHR Ⅱ的表达,从而增强了其生物学作用抑制卵泡对FSH的敏感性,使卵泡的FSH阈值升高;而在卵巢间质的免疫组化切片中我们也发现存在着AMHR Ⅱ的阳性表达,推测AMH通过AMHR Ⅱ发挥作用的同时可能还受其他卵巢局部生长因子的调节。
国外研究报道[11]在人大脑组织中与TGF-β的激活相关的BMPR-IB(BMPR1B;Alk6)和Smad5依赖的信号转导通路控制着neuroserpin转录,并推测是转化生长因子β家族成员之一的AMH,促进人工培养神经元中neuroserpin的表达,间接表明了在卵巢以外的组织中可能存在着AMH所作用的受体。本研究发现AMHR Ⅱ蛋白在大鼠子宫内膜中同样存在着阳性表达,但是PCOS模型组与对照组之间的表达强度并无明显差异。这在国内是首次观察到的结果。我们推测AMH可能通过AMHR Ⅱ在子宫内膜中发挥相应的生物学作用,而AMHR Ⅱ蛋白的表达量可能与PCOS导致的相应子宫内膜的病变无明显相关性。但是不同基因背景的小鼠对DHEA诱导的反应存在一定的差异[12],目前的小鼠模型都只模拟出了PCOS患者的部分临床表现,集中在生殖方面的缺陷,PCOS的所有临床特征还没有在任何一种模型能够模拟出[13]。而张少娣等[14]研究认为除了分型因素导致的差异,不同亚型PCOS的其他临床生化特征无明显差异。因此相关探讨仍需较多实验数据支持。
二、AMHRⅡ基因及其甲基化在PCOS中的作用
目前研究发现人类AMHRⅡ基因总长度为7.6 kb,位于12号染色体长臂,有11个外显子。关于AMHRⅡ基因的研究,Rigon等[15]研究了76例特发性不孕与100例正常生育的女性,发现AMHRⅡ基因中-482 A>G、IVS 5-6 C>T、IVS 10+77 A>G、146T>G等位基因序列的多态性可能与特发性不孕相关。Kevenaar等[16]研究发现,AMHRⅡ基因多态性与PCOS发生相关,但胡蓉等[17]、Sproul等[18]研究则得出与之相反的结论。
PCOS是遗传与环境相互作用的结果,DNA甲基化是表观遗传研究的热点,那么在PCOS中是否也存在着基因表观遗传学方面的变化呢?因此我们以高雄激素的PCOS的大鼠模型为基础,研究在AMHRⅡ基因的启动子区域的某一片段在其血液及卵巢组织样本中是否存在着甲基化方面的变化,以及这种变化与PCOS的发病与局部病理变化之间有无相关关系。本研究发现在PCOS大鼠与对照组大鼠的所有血液及卵巢组织样本中,通过甲基化特异性PCR的方法均检出了部分甲基化的条带,两组之间无统计学差异。我们推测在PCOS大鼠中,AMHRⅡ基因存在着部分甲基化状态,但是这种甲基化状态可能与PCOS的发病与局部卵巢病理变化无明显相关关系。本实验只是定性分析了AMHRⅡ基因的甲基化状态,下一步需要运用重亚硫酸盐测序法(BSP)去进一步分析,可能得出的结果会有所不同,或许会有更重要的意义。
[1]Doi SA,Towers PA,Scott CJ,et al. PCOS:an ovarian disorder that leads to dysregulation in the hypothalamic-pituitary-adrenal axis? [J].Eur J Obstet Gynecol Reprod Biol,2005,118:4-16.
[2]孙秀红,韦相才,苗竹林,等.两种方法建立多囊卵巢综合征大鼠模型的实验研究[J].中国计划生育学杂志,2011,19:276-279.
[3]殷倩,郝栋栋,钟兴明,等.高雄激素PCOS大鼠模型中胰岛素受体基因甲基化分析[J]. 中国计划生育学杂志,2016,24:79-84.
[4]Lunding SA,Aksglaede L,Anderson RA,et al. AMH as predictor of premature ovarian insufficiency:a longitudinal study of 120 Turner syndrome patients[J]. J Clin Endocrinol Metab,2015,100:E1030-1038.
[5]Josso N,di Clemente N. Transduction pathway of anti-Mullerian hormone,a sex-specific member of the TGF-beta family[J]. Trends Endocrinol Metab,2003,14:91-97.
[6]di Clemente N,Jamin SP,Lugovskoy A,et al.Processing of anti-Müllerian hormone regulates receptor activation by a mechanism distinct from TGF-β[J].Mol Endocrinol,2010,24:2193-2206.
[7]Josso N,Belville C,di Clemente N,et al. AMH and AMH receptor defects in persistent Müllerian duct syndrome[J].Hum Reprod Update,2005,11:351-356.
[8]姜宙,王晓燕,孙贤华,等. 抗苗勒管激素及其Ⅱ型受体与卵母细胞成熟的关系[J].现代妇产科进展,2013,22:635-637.
[9]Rice S,Ojha K,Whitehead S,et al. Stage-Specific expression of androgen receptor,follicle-stimulating hormone receptor,and anti-Müllerian hormone type Ⅱ receptor in single,isolated,human preantral follicles:relevance to polycystic ovaries[J]. J Clin Endocronol Metab,2007,92:1034-1040.
[10]Li Y,Wei LN,Liang XY. Follicle-stimulating hormone suppressed excessive production of antimullerian hormone caused by abnormallyenhanced promoter activity in polycystic ovary syndrome granulosa cells[J].Fertil Steril,2011,95:2354-2358.
[11]Lebeurrior N,Launay S,Macrez R,et al. Anti-müller-hormone-dependent regulation of the brain serine-protease inhibitor neuroserpin[J]. J Cell Sci,2008,121:3357-3365.
[12]Dowling AR,Nedorezov LB,Qiu X,et al.Genetic factors modulate the impact of pubertal androgen excess on insulin sensitivity and fertility[J/OL]. PLoS One,2013,8:e79849.
[13]赖灏,于秋晓,康继宏. 多囊卵巢综合征的小鼠模型[J]. 生理科学进展,2015,46:197-202.
[14]张少娣,张合龙,李萌,等. 不同亚型多囊卵巢综合征患者的临床及生化特征比较[J]. 生殖医学杂志,2014,23:100-104.
[15]Rigon C,Andrisani A,Forzan M,et al.Association study of AMH and AMHRⅡ polymorphisms with unexplained infertility[J].Fertil Steril,2010,94:1244-1248.
[16]Kevenaar ME,Laven JS,Fong SL,et al. A functional anti-mullerian hormone gene polymorphism is associated with follicle number and androgen levels in polycystic ovary syndrome patients[J]. J Clin Endocronol Metab,2008,93:1310-1316.
[17]胡蓉,田春花,田石进,等.抗苗勒管激素及其Ⅱ型受体基因多态性在多囊卵巢综合征患者表达的研究[J]. 实用妇产科杂志,2012,28:739-742.
[18]Sproul K,Jones MR,Mathur R,et al. Association study of four key folliculogenesis genes in polycystic ovary syndrome[J]. BJOG,2010,117:756-760.
[编辑:辛玲]
Expression of anti-müllerian hormone type Ⅱ receptor and its gene methylation in rat model of PCOS
HAO Dong-dong1#,YIN Qian1#,ZHONG Xing-ming2,WEI Xiang-cai1,2*,MIAO Zhu-lin2,WANG Yong-xia2
1.DepartmentofObstetrics&Gynecology,theFirstHospitalAffiliatedtoJinanUniversity,Guangzhou510632 2.FamilyPlanningScience&TechnologyResearchInstituteofGuangdongProvince,Guangzhou510000
Anti-müllerian hormone type Ⅱ receptor;Polycystic ovary syndrome;DNA methylation;Animal model
10.3969/j.issn.1004-3845.2016.09.013
2015-12-10;
2016-01-29
广东省科技计划项目(2009B030801270);广东省自然科学基金项目(10151008010000000)
郝栋栋,女,山东德州人,硕士,住院医师,生殖内分泌专业;殷倩,女,湖北黄石人,硕士,住院医师,生殖内分泌专业.(#共同第一作者;*
,Email:dxcwei@163.com)
