肠内营养对重症急性胰腺炎肠源性感染的影响
2016-09-22徐英生
徐英生
肠内营养对重症急性胰腺炎肠源性感染的影响
徐英生
目的分析肠内营养对重症急性胰腺炎肠源性感染的影响。方法随机将符合纳入标准的70例重症急性胰腺炎患者分为两组各35例,对照组采取肠外营养支持,观察组则行肠内营养支持,比较两组入院时、入院第7天时WBC、CRP、内毒素水平、APACHEⅡ评分、T细胞亚群指标及并发症情况。结果观察组入院第7天WBC、CRP、内毒素水平分别为(13.01±2.05)×109/L、(65.42±11.83)mg/L、(39.28± 15.80)EU/L,均显著低于对照组的(15.86±4.25)×109/L、(153.30±26.71)mg/L、(73.02±21.15)EU/L,差异有统计学意义(P<0.05)。两组入院第7天CD3、CD4、CD4/CD8比较差异均有统计学意义(P<0.05)。观察组感染率、总并发症发生率分别11.4%、20.0%,均显著低于对照组的34.3%、42.9%,差异均有统计学意义(P<0.05)。结论肠内营养支持能明显改善细胞免疫功能指标,促进肠源性感染相关指标恢复,显著减少并发症发生。
肠内营养;重症急性胰腺炎;肠源性感染;T细胞亚群
急性重症胰腺炎(SAP)典型病理特征为胰腺局部炎症,其病死率约10%~30%,因感染引发多脏器功能障碍综合征死亡率占80%,特别是肠源性感染[1]。为此采取有效措施控制SAP患者肠源性感染成为目前研究的重点。近年来营养支持作为一种非手术治疗方法临床应用较多,对SAP转归至关重要。肠外营养过去临床常用,刺激性小且符合SAP高代谢要求,但长时间使用可能造成肠道某种营养物质丢失。近年来肠内营养被发现不仅能帮助肠黏膜修复,而且相对肠外营养更符合生理需求,特别是在减少肠源性感染发生上更有优势[2]。基于此,本研究对我院收治的35例重症急性胰腺炎患者行肠内营养支持,通过与肠外营养支持结果比较,分析其对SAP患者肠源性感染及细胞免疫功能的影响,现报告如下。
资料与方法
一、病例选择
1.诊断标准[3]
①出现胰腺坏死、胰腺脓肿等并发症;②器官功能障碍;③慢性健康状况(APACHEⅡ评分)8分及以上;④影像学确诊。符合上述1项便可判断为SAP。
2.纳入标准
①符合诊断标准;②年龄20~70岁;③满足肠内外营养干预适应证;④经医院伦理委员会批准,患者知情并签署同意书。
3.排除标准
①凝血系统疾病、自身免疫疾病明显者;②哺乳期或妊娠期妇女;③精神异常、认知障碍;④因各种原因无法配合完成治疗及随访者。
二、临床资料
抽取我院2013年2月至2015年2月收治的急性重症胰腺炎70例,随机将其分为对照组与观察组各35例。对照组中男19例,女16例;年龄20~69岁,平均(35.5±5.6)岁;入院时APACHEⅡ评分9~20分,平均(14.26±4.55)分;病因:胆源性13例,酗酒8例,高脂血症7例,暴饮暴食7例。观察组中男21例,女14例;年龄23~70岁,平均(35.8± 5.4)岁;入院时APACHEⅡ评分8~21分,平均(14.75± 5.22)分;病因:胆源性14例,酗酒8例,高脂血症8例,暴饮暴食5例。对比两组性别、年龄、病因、入院时APACHEⅡ评分差异无统计学意义(P>0.05),具有可比性。
三、治疗方法
所有患者入院后均接受禁食、抗生素、胃肠减压等保守治疗,除此之外给予对照组患者肠外营养支持,入院后1~3 d待患者生命体征基本稳定后开始肠外营养支持,根据相关公式计算出患者需要热量。通过外周或中心静脉插管行肠外营养,液体包括安达美、水乐维他、葡萄糖、10%氯化钾、胰岛素等。观察组则于入院1~3 d内待患者生命体征稳定后开始肠内营养支持,胃镜或X线透视下留置鼻空肠营养管,经由造影剂+X线确定营养管位置。肠内营养液主要为百普力,精氨酸0.2 g·kg-1·d-1、谷氨酰胺0.1 g·kg-1·d-1辅助。输注泵持续滴注营养液24 h,起初剂量为25 mL/h,12~24 h后慢慢增加剂量,2~3 d增加剂量到80~100 mL/h,根据患者情况适时调整。同时观察组患者起初几天若热量、氮量不足则通过静脉补充部分。
四、观察指标
两组患者入院时、入院第7天清晨空腹抽取外周静脉血6 mL,通过速率比浊法测定C反应蛋白(CRP);鲎试剂凝胶法测定内毒素;经由流式细胞仪测定两组患者CD3、CD4、CD8、CD4/CD8等细胞免疫功能指标。同时观察记录两组患者入院时、入院第7天APACHEⅡ评分,另外记录感染等并发症发生情况。
结果
一、治疗前后WBC、CRP、内毒素及APACHEⅡ评分
观察组入院第7天WBC、CRP、内毒素、APACHEⅡ评分较入院时均明显下降,且下降幅度均明显大于对照组,差异有统计学意义(P<0.05)。对照组入院第7天APACHEⅡ评分较入院时明显下降(P<0.05),其他指标组内比较均无显著差异(P>0.05),见表1。
二、治疗前后细胞免疫功能情况
观察组入院第7天CD3、CD4、CD4/CD8较入院时明显上升,且上升幅度明显大于对照组,差异有统计学意义(P<0.05)。对照组入院第7天CD4、CD8、CD4/CD8较入院时差异有统计学意义(P<0.05),见表2。
表1 两组治疗前后WBC、CRP、内毒素及APACHEⅡ评分比较(±s)

表1 两组治疗前后WBC、CRP、内毒素及APACHEⅡ评分比较(±s)
注:*与入院时比较,P<0.05;#与对照组比较,P<0.05。
组别nWBC(×109/L)CRP(mg/L)内毒素(EU/L)APACHEⅡ评分(分)入院时入院第7天入院时入院第7天入院时入院第7天入院时入院第7天观察组3517.62±2.4413.01±2.05*#163.76±41.7065.42±11.83*#78.75±25.3739.28±15.80*#14.75±5.226.03±2.12*#对照组3517.00±2.0315.86±4.25162.43±43.72153.30±26.7173.46±20.1473.02±21.1514.26±4.5510.43±2.35* t值-1.1563.5730.13017.7971.0467.5610.4198.225 P值-0.2520.0010.8970.0000.2990.0000.6770.000
表2 两组治疗前后细胞免疫功能指标比较±s)
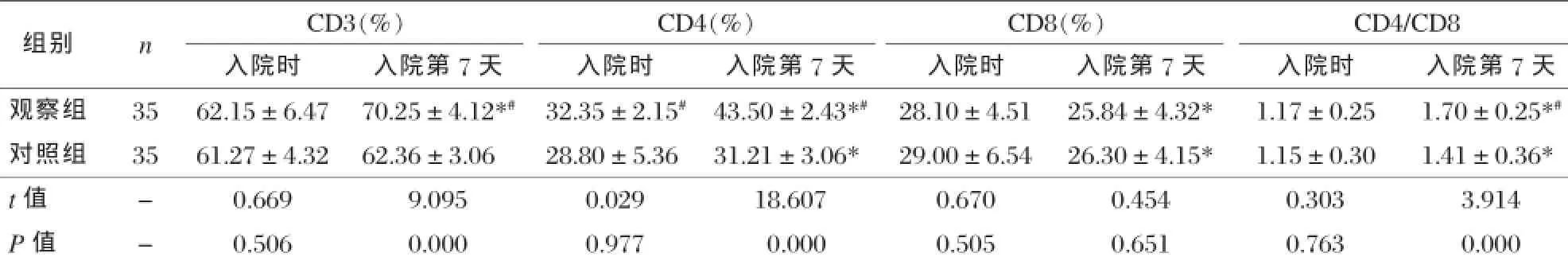
表2 两组治疗前后细胞免疫功能指标比较±s)
注:*与入院时比较,P<0.05;#与对照组比较,P<0.05。
组别nCD3(%)CD4(%)CD8(%)CD4/CD8入院时入院第7天入院时入院第7天入院时入院第7天入院时入院第7天观察组3562.15±6.4770.25±4.12*#32.35±2.15#43.50±2.43*#28.10±4.5125.84±4.32*1.17±0.251.70±0.25*#对照组3561.27±4.3262.36±3.0628.80±5.3631.21±3.06*29.00±6.5426.30±4.15*1.15±0.301.41±0.36* t值-0.6699.0950.02918.6070.6700.4540.3033.914 P值-0.5060.0000.9770.0000.5050.6510.7630.000
三、并发症情况
观察组感染发生率11.4%,总并发症发生率20.0%,较对照组的34.3%、42.9%差异均有统计学意义(P<0.05),见表3。
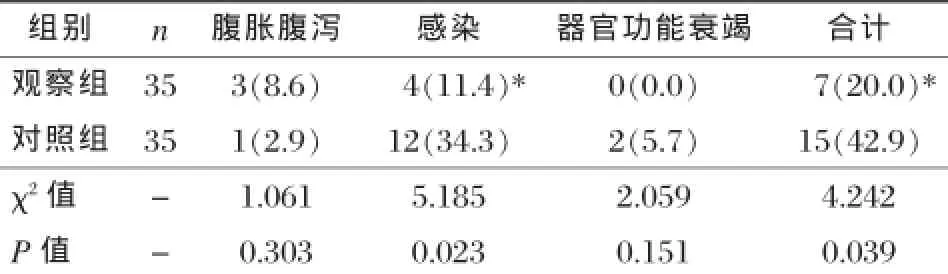
表3 两组并发症发生率比较[n(%)]
讨论
肠源性感染指的是急性重症胰腺炎发病损伤机体肠道黏膜屏障,致使肠道内细菌、内毒素经此进入血液,进而引发腹腔感染等相关继发性感染过程[4]。由此可见肠源性感染发生时出现炎症反应,刺激白细胞上升,为此临床常利用WBC、CRP、内毒素含量对肠源性感染严重程度反应。肖帅等[5]通过与肠外营养支持、入院第4天、第6天肠内营养结果对照分析,表明早期肠内营养支持(发病后第2天)能更好的控制肠源性感染,缩短肠源性感染病程,建议早期营养支持。本文所有患者均于入院后第1~3天行肠外营养或肠内营养支持,这与早期营养支持对肠黏膜屏障功能保护作用更明显有关。本研究结果显示观察组入院第7天时WBC、CRP、内毒素水平较入院时明显下降,差异有统计学意义(P<0.05),而对照组入院第7天与入院时上述指标比较差异无统计学意义(P >0.05)。一方面表明肠外营养干预对SAP患者肠源性感染过程无明显抑制作用,即肠源性感染发生可能性仍较大。另一方面表明早期肠内营养干预能明显控制肠源性感染进程,减少继发性感染发生几率。原因包括:①早期肠内营养经由鼻空肠管行营养液支持可减少胰腺本身感染坏死发生几率,进而减少肠道内细菌内毒素移位[6];②肠内营养对SAP患者肠黏膜完整性有保护作用,促进营养物质摄取以减少肠源性感染发生,而肠外营养则会损伤患者黏膜,严重时甚至萎缩,易造成菌群失衡,增加继发性感染发生风险[7];③肠内营养还具有修复上皮功能、维持正常肠道功能等作用。
肠源性感染发生与SAP患者自身免疫功能下降密切相关。T淋巴细胞亚群在机体免疫系统功能中有重要作用,正常情况下各T淋巴细胞指标相互影响以维持机体正常免疫功能,一旦某种淋巴细胞亚群指标异常则可能造成机体免疫功能紊乱,引发系列病理改变[8]。临床常用T淋巴细胞亚群指标为CD3、CD4、CD8、CD4/CD8等,其中CD3主要用于成熟T细胞总数反应;CD4、CD8主要作用为调控机体免疫应答及维持免疫稳定;CD4/CD8被认为是反应机体免疫状态的敏感指标之一。本研究结果显示观察组入院第7天CD3、CD4、CD4/CD8均明显高于对照组,差异有统计学意义(P<0.05)。表明早期肠内营养支持相比肠外营养干预能明显增强机体免疫功能,与戴丽星等[9]研究结果基本一致。
另外,临床上SAP患者死亡多与继发性感染致使多器官功能障碍有关,为此预防或减少继发性感染、器官功能障碍等并发症发生至关重要。本研究结果显示观察组感染率11.4%,明显比对照组的34.3%低,观察组总并发症发生率20.0%,明显比对照组的42.9%低,差异有统计学意义(P<0.05)。表明肠内营养支持能明显降低SAP患者并发症发生率,与刘玉香等[10]研究结果基本一致。原因包括:肠内营养支持能明显调整T淋巴细胞指标,增强机体免疫功能,进而减少感染发生。
综上所述,肠内营养干预能明显降低SAP患者肠源性感染相关指标水平,有效减轻肠源性感染程度,显著降低相关并发症发生率,这可能与肠内营养支持显著增强机体细胞免疫功能有关。
[1]何发明,曹平,刘琼,等.重症胰腺炎患者早期经皮胃空肠造瘘行肠内营养治疗效果研究[J].激光杂志,2013,34(2):89-90.
[2]许春芳,黄晓曦,沈云志,等.肠内营养与肠外营养对重症急性胰腺炎患者肠屏障功能影响的比较[J].中华内科杂志,2011,50(5):370-373.
[3]中华医学会消化病学分会胰腺疾病学组,《中华胰腺病杂志》编辑委员会,《中华消化杂志》编辑委员会.中国急性胰腺炎诊治指南(2013年,上海)[J].临床肝胆病杂志,2013,29(9):656-660.
[4]王德强,柴虎林.血浆游离氨基酸在重症急性胰腺炎肠内营养后的变化分析[J].中国全科医学,2012,15(20):2289-2291.
[5]肖帅,刘龙飞,孙鑫国,等.不同时机肠内营养对重症急性胰腺炎肠源性感染的影响[J].实用医学杂志,2013,29(1):45-47.
[6]崔玉军.早期肠内营养用于重症急性胰腺炎效果观察[J].山东医药,2010,50(15):83-84.
[7]袁方,王艳,周守凤,等.个性化肠内营养在治疗重症急性胰腺炎中的应用[J].中国实用护理杂志,2015,31(26):1974-1977.
[8]王庆华,王凤,栾顺莲,等.早期肠内营养对重症急性胰腺炎病人营养状况和预后影响[J].肠外与肠内营养,2010,17(5):274-276.
[9]戴丽星,何静.早期肠内营养对重症急性胰腺炎患者免疫功能及感染的影响[J].重庆医学,2014,43(17):2204-2206.
[10]刘玉香.完全胃肠外营养与肠内营养用于重症急性胰腺炎的对照分析[J].现代消化及介入诊疗,2015,20(2):149-150.
(本文编辑:龚伟)
10.3969/j.issn.1672-2159.2016.03.028
436000湖北省鄂州市中心医院营养科
五、统计学方法
应用SPSS 19.0统计软件处理数据,计数资料以%表示,采用χ2检验,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2015-12-22)
