我院药物临床试验中严重不良事件报告233例分析Δ
2016-09-22张田香陆明莹张彩霞袁祖贻西安交通大学第一附属医院临床药理机构办公室西安710061
张田香,陆明莹,张彩霞,袁祖贻(西安交通大学第一附属医院临床药理机构办公室,西安 710061)
我院药物临床试验中严重不良事件报告233例分析Δ
张田香*,陆明莹,张彩霞,袁祖贻(西安交通大学第一附属医院临床药理机构办公室,西安710061)
目的:为药物临床试验中进行质控和保护受试者权益提供参考。方法:收集我院2012年1月-2015年6月上报的药物临床试验中的233例严重不良事件(SAE)报告,按照受试者性别、年龄、上报科室、药物/器械种类、药物/器械名称、SAE的类型、SAE与药物/器械的相关性、受试者合并疾病情况等进行统计分析。结果:男性SAE发生率高于女性(71.2%vs.28.8%);SAE主要发生在50岁以上的人群中(189例,81.1%);心内科SAE发生率最高(137例,58.8%);主要的SAE类型是导致住院(183例,78.5%);大部分SAE与研究药物肯定无关(164例,70.4%);发生SAE的受试者中一半以上自身合并有其他疾病(128例,54.9%)。结论:为确保药物临床试验数据的质量和受试者的安全,临床试验过程中研究者应重点加强对老年和自身合并疾病受试者的管理,确保每例SAE得到及时处理,并如实记录和报告。
严重不良事件;药物临床试验;受试者;分析
严重不良事件(Serious Adverse Event,SAE)是指临床试验过程中发生的,需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件[1]。SAE是药物临床试验过程中重点关注的事件,发生SAE时,研究者应及时采取相应的救治措施,并在规定的时间内报告相应的部门[2]。本文对我院2012—2015年上报的SAE进行分析,以全面了解、掌握我院SAE发生情况,为药物临床试验机构进行质控和最大限度保护受试者的安全提供依据[3]。
1 资料与方法
1.1资料来源
资料来源于我院2012年1月-2015年6月上报的药物临床试验SAE报告233例(含6例妊娠事件),其中2012年82例、2013年75例、2014年47例、2015年上半年29例。
1.2方法
采用SPSS 18.0软件,对233例发生SAE受试者的性别、年龄、上报科室、药物/器械种类、药物/器械名称、SAE类型、SAE与药物/器械的相关性、受试者合并疾病情况等进行统计、分析。
SAE与试验药物/器械相关性判断标准[4]——肯定有关:反应出现符合用药后合理的时间顺序,反应符合所疑药物已知的反应类型;停药后改善,重复给药后再出现该反应,无法用患者疾病或合并用药来解释。可能有关:反应出现符合用药后合理的时间顺序,反应符合所疑药物已知的反应类型;患者的临床状态或其他治疗方式也有可能产生该反应。可能无关:反应出现不太符合用药后合理的时间顺序,反应不太符合所疑药物已知的反应类型;患者的临床状态或其他治疗方式也有可能产生该反应。肯定无关:反应出现不符合用药后合理的时间顺序,反应不符合所疑药物已知的反应类型;患者的临床状态或其他治疗方式也有可能产生该反应,疾病状态改善或停止其他治疗方式反应消除,重复出现其他治疗方式反应出现。无法判定:反应出现与用药后的时间顺序无明确关系,与该药品已知的反应类型相似,同时使用的其他药物也可能引起相同的反应。
2 结果
2.1发生SAE受试者的性别和年龄分布
233例SAE报告中,男性166例(71.2%),女性67例(28.8%),男女性比例为2.48∶1。受试者年龄19~83岁,平均年龄61岁,SAE分布的主要年龄段为60~69岁和50~59岁,构成比分别为33.9%和28.3%。发生SAE受试者的性别和年龄分布见表1。
2.2SAE发生科室分布
所有上报SAE的科室中,心内科数量最多,共137例,构成比为58.8%,其中药物95例、器械42例。SAE发生科室分布见表2。
2.3SAE在不同品种试验药物/器械中的分布
上报的233例SAE中,药物185例(79.4%),器械48例(20.6%),其中主要分布在化学药品,达165例(70.8%)。SAE在不同药物/器械种类中的分布见表3。
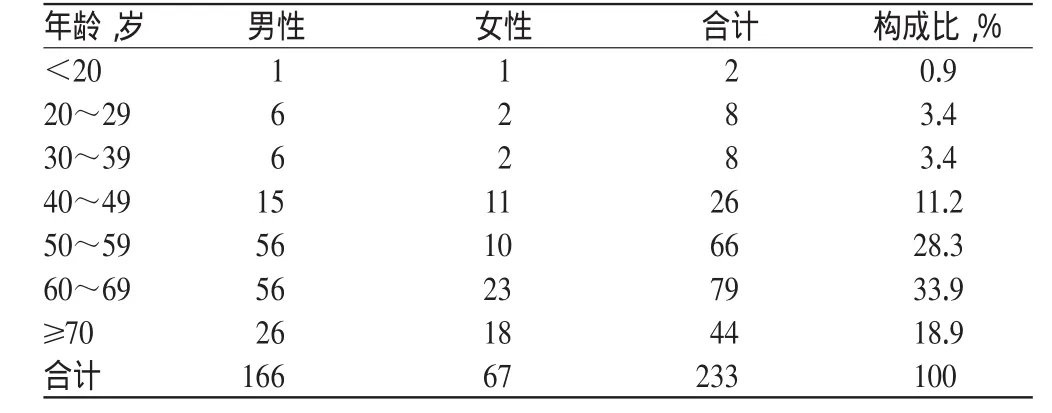
表1 发生SAE受试者的性别和年龄分布(例)Tab 1 Distribution of subjects’gender and age in SAE cases(case)
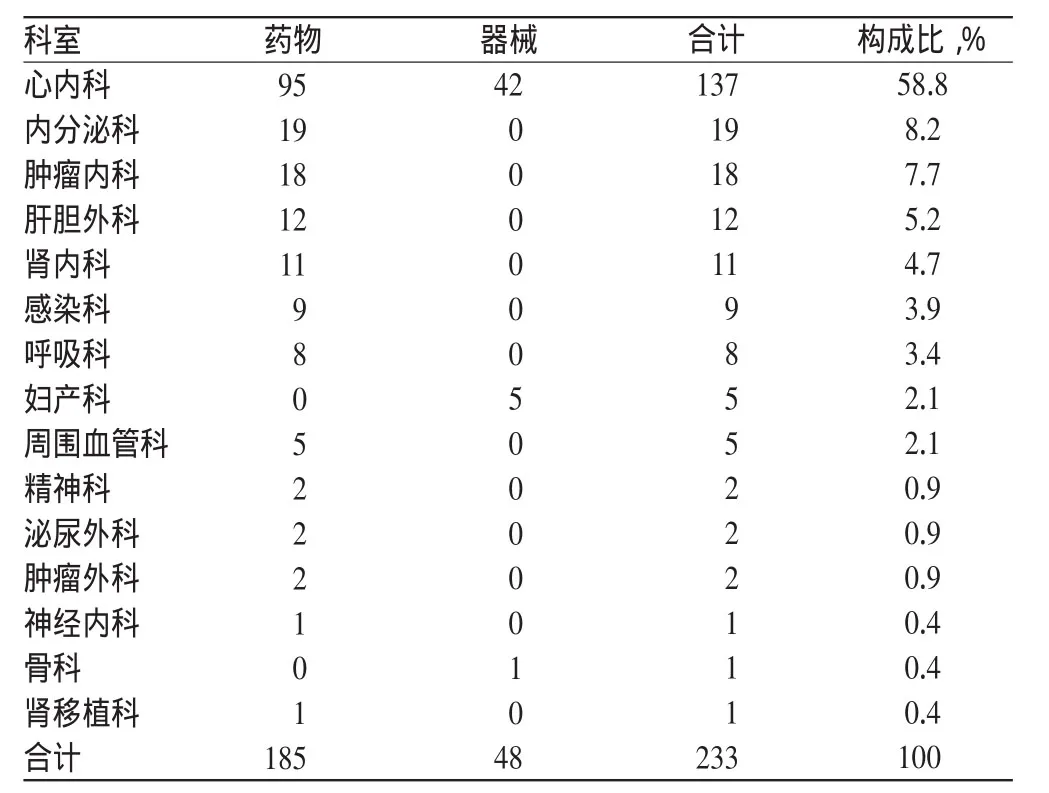
表2 SAE发生科室分布(例)Tab 2 Distribution of SAE cases in clinical departments(case)

表3 SAE在不同药物/器械种类中的分布Tab 3 Distribution of SAE cases in different drug/equipment types
2.4SAE涉及的药物/器械品种
SAE涉及的药物和器械共计61种,主要集中在心血管药物、抗肿瘤药物和心脏支架。其中,上报SAE例数最多的是A心血管药物(25例,10.7%)(注:由于本文中的药物/器械名称涉及保密,故全部用字母表示);器械中SAE上报例数最多的是A冠脉雷帕霉素洗脱支架(11例,4.7%)。发生SAE最多的12种药物/器械见表4。
2.5SAE类型分布
根据我国药物临床试验质量管理规范(GCP)的规定,SAE主要有以下几种类型:死亡、导致住院、延长住院时间、伤残、功能障碍、导致先天畸形和其他重大的医疗事件[5]。在我院上报的233例SAE中,导致住院是最主要的类型,共计183例,构成比为78.5%;死亡达到22例,构成比为9.4%。SAE的类型分布见表5。

表4 发生SAE最多的12种药物/器械Tab 4 Top 12 drug/equipment types in the list of SAE cases
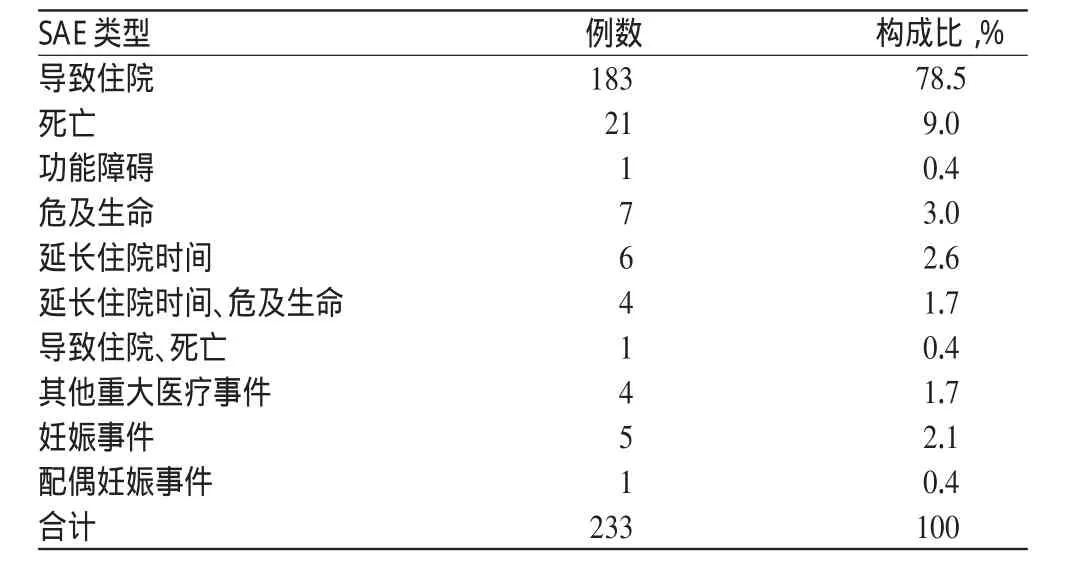
表5 SAE类型分布Tab 5 Distribution of SAE types
2.6SAE与药物/器械的相关性
根据“1.2”项下判断标准,研究者判定与试验药物/器械肯定无关的有164例,占比为70.4%;肯定有关的只有4例,仅占1.7%。SAE与药物/器械的相关性见表6。

表6 SAE与药物/器械的相关性Tab 6 Relationship of SAE with drug/equipment
2.7发生SAE受试者合并疾病情况
发生SAE的受试者中一半以上有合并其他疾病,共计128例,达54.9%。受试者合并疾病情况见表7。
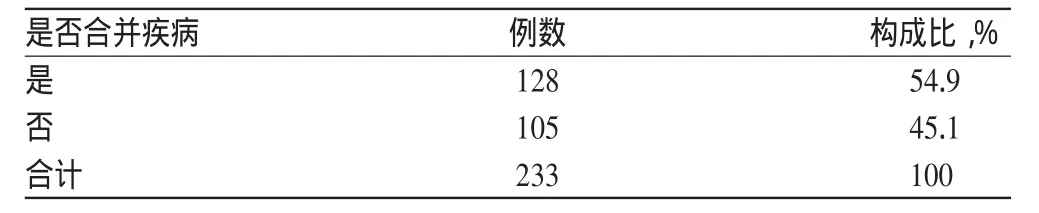
表7 受试者合并疾病情况Tab 7 Subjects’comorbidities
3 讨论
我院上报的SAE中,男性明显多于女性,这可能与纳入我院新药器械临床试验的受试者中,男性所占比例较大有关。上报的SAE案例中,50岁以上年龄段受试者的比例达81.1%;54.9%的受试者合并有其他疾病;而根据研究者的判断,70.4%的SAE是与研究药物/器械肯定无关的。国内大部分临床试验对受试者年龄的要求集中在18~70岁,而老年人各系统生理机能衰退,其合并疾病及突发疾病相对于中青年受试者明显增多,对药物代谢能力明显减弱[6]。我院承担的药物临床试验项目涉及的新药主要为仿制药和国外已上市的药品,与未在国内外上市销售的药品(1.1类新药)相比安全性较高。根据研究者的判断,我院发生的SAE只有1.7%是与研究药物肯定相关的,与我院SAE发生的年龄分布特点和新药类型吻合。我院心内科是药物临床试验的主力科室,承担新药临床试验项目数量达到我院项目总数的20%以上,本研究显示,心内科上报的SAE例数占到我院上报总例数的58.8%,可能与心内科承担的新药和器械临床试验项目和入组受试者相对较多有关;同时,心内科入组受试者主要为心脑血管疾病患者,年龄相对较大,合并疾病较多。在上报的SAE中,化学药品3类发生的SAE例数最多,这与我院承担的化学药品3类的药物临床试验项目数量最多有关。心血管药物是上报SAE占比较高的新药品种,心脏支架是上报SAE较多的器械品种,这与心内科上报SAE例数最多相吻合。抗肿瘤药物上报SAE例数仅次于心血管药物,提示这两个专业的研究者在临床试验中更应该密切关注SAE的发生。
我院2012年至今承担新药和器械临床试验项目200余项,涉及受试者4 000余例。大量的受试者参与到新药和器械临床试验中,为确保药物临床试验数据的质量和受试者的安全,机构办公室和伦理委员会应加强对SAE的管理,确保每例SAE得到合理及时的处理,并如实记录和报告[7]。
[1]国家食品药品监督管理局.药物临床试验质量管理规范[J].中国医药导刊,2003,5(5):367.
[2]赵迎盼,陆芳,訾明杰,等.《药物临床试验质量管理规范》(修订稿)解读[J].中国新药杂志,2015,24(15):1 747.
[3]彭朋,元唯安,胡薏慧,等.药物临床试验的质量问题分析[J].中国新药与临床杂志,2015,34(5):339.
[4]李博,高蕊,李睿,等.药物临床试验不良反应/不良事件关联性判定方法研究探讨[J].中国新药杂志,2014,23 (12):1 465.
[5]国家食品药品监督管理局.药物临床试验管理规范[EB/ OL].(2003-08-06)[2013-09-10].http://www.sda.gov. cn/WS01/CL0053/24473.html.
[6]陈孝虹.我院220例药品不良反应报告分析[J].中国药业,2012,21(5):38.
[7]张田香,陆明莹,张彩霞,等.从机构办公室角度谈药物临床试验的质量控制[J].中国新药与临床杂志,2014,33 (6):429.
(编辑:晏妮)
Analysis of 233 Cases of Severe Adverse Events in Drug Clinical Trials of Our Hospital
ZHANG Tianxiang,LU Mingying,ZHANG Caixia,YUAN Zuyi(Office of Clinical Pharmacology,the First Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710061,China)
OBJECTIVE:To provide reference for performing quality control and protecting the subjects’rights and interests. METHODS:233 severe adverse events(SAE)cases reported by our hospital during Jan.2012-Jun.2015 were collected and analyzed statistically in respects of subjects’gender and age,department,drug/equipment types,SAE types,relationship of SAE with drug/equipment,comorbidities,etc.RESULTS:The incidence of SAE in male was higher than female(71.2%vs.28.8%);SAE mainly occurred in people over the age of 50(189 cases,81.1%);the incidence of SAE in cardiology department was the highest (137 cases,58.8%);main SAE type was hospitalization(183 cases,78.5%);most of SAE had nothing to do with studied drugs (164 cases,70.4%);more than half of the subjects suffered from other comorbidities(128 cases,54.9%).CONCLUSIONS:In order to ensure the quality of drug clinical trial data and safety of subjects,the investigator should strengthen the management of the elderly subjects and those suffering from comorbidities,to ensure that each SAE case is timely processed and accurately recorded and reported.
Severe adverse events;Drug clinical trials;Subjects;Analysis
R969.3文献标志码A
1001-0408(2016)23-3210-03
10.6039/j.issn.1001-0408.2016.23.14
西安交通大学第一附属医院科研发展基金项目(No.2014YK38)
*硕士。研究方向:药物临床试验管理。电话:029-85324094。E-mail:xayyyljd@163.com
2015-11-10
2016-03-22)
