一种新型黄曲霉毒素专用检测器与市售商品化进口荧光检测器的应用性能对比
2016-09-21李少晖关亚风耿旭辉陈士恒谢云峰杨永坛
李少晖 关亚风 耿旭辉 陈士恒 谢云峰 杨永坛*
(1.中粮营养健康研究院,营养健康与食品安全北京市重点实验室,北京 102209;2.中国科学院大连化学物理研究所,大连 116023)
一种新型黄曲霉毒素专用检测器与市售商品化进口荧光检测器的应用性能对比
李少晖1关亚风2耿旭辉2陈士恒1谢云峰1杨永坛1*
(1.中粮营养健康研究院,营养健康与食品安全北京市重点实验室,北京 102209;2.中国科学院大连化学物理研究所,大连 116023)
对比了一种自制LED荧光检测器与市售商品化进口荧光检测器检测黄曲霉毒素的性能差异,利用SPSS统计软件进行数据统计分析。结果显示:自制LED荧光检测器的检出限和信噪比优于市售商品化进口荧光检测器,重复性不逊于市售商品化进口荧光检测器,是一种理想的黄曲霉毒素专用检测器,适合在基层实验室推广。
黄曲霉毒素专用检测器商品化检测器仪器比对统计分析
黄曲霉毒素(aflatoxins,AFT)是黄曲霉菌和寄生曲霉菌在生长过程中分泌产生的一种次级代谢产物,其他真菌如毛霉、青霉、镰孢曲霉等也能产生黄曲霉毒素[1,2]。黄曲霉毒素是一类结构相似的化合物的总称,其存在着多种异构体和衍生物。常见的黄曲霉毒素主要包括黄曲霉毒素B1、B2、G1、G2、M1、M2(AFB1、AFB2、AFG1、AFG2、AFM1、AFM2)等[3],黄曲霉毒素具有很强的毒性、致癌性、致突变性和致畸毒性,其中以黄曲霉毒素B1的毒性最大[4],短期接触大量黄曲霉毒素能够引起急性毒性反应,包括发热、腹痛、呕吐等,严重者会出现肝脾肿大、肝区疼痛、皮肤黏膜黄染、腹水、下肢浮肿及肝功能异常等中毒性肝病症状[5];同时黄曲霉毒素还是潜在的致癌物质,能够诱导人类肝癌的发生和发展。实验表明:黄曲霉毒素B1的毒性为氰化钾的10倍,砒霜的68倍;且其致癌性是二甲基亚硝胺的70倍,基于以上数据,黄曲霉毒素已被国际癌症研究组织(international agency for research on cancer,IARC)确定为I类致癌物[6,7]。
食物中的黄曲霉毒素主要来源于因储存不当等原因而发生霉变的粮食和谷物,特别是霉变后的花生和玉米中的黄曲霉毒素含量较高,使用霉变的花生和玉米所制成的粮油制品中同样存在着较为严重的黄曲霉毒素污染[8]。随着多起黄曲霉毒素污染事件的发生,世界各国相关机构和广大消费者对食品安全愈发关切。我国对食品中黄曲霉毒素B1也采取了严格的限量标准(GB 2761-2011):花生、玉米及其制品中的黄曲霉毒素B1含量≤20 ng/g;大米及其他食用油的黄曲霉毒素B1含量≤10 ng/g,粮食、豆类、发酵食品及调味品中的黄曲霉毒素B1含量≤5 ng/g,乳制品及婴儿配方食品中黄曲霉毒素B1、M1≤10 ng/g[9]。
目前国内外的黄曲霉毒素检测方法主要包括(超)高效液相色谱法、液相色谱-质谱法、薄层色谱法、酶联免疫吸附测定法等[10];薄层色谱法操作简单,检测成本低,但是在检测过程中需要接触大量有毒有害有机试剂,故此方法已逐渐被淘汰[11];质谱法具有高通量、高灵敏度、快速、无需衍生化等优点[7],但是仪器成本及维护费用较高,仪器操作较为复杂,目前在基层实验室还未得到广泛的应用。酶联免疫吸附测定法具有检测速度快、特异性高、前处理简单、成本低等优点[12],但其存在严重的假阳和假阴性等问题[13],而且其结果的稳定性和基质适应性仍未得到有效地改善,故此方法多用于样品快速筛查和现场检测。高效液相色谱-荧光检测器法检测黄曲霉毒素是实验室日常进行黄曲霉毒素检测的主要方法[14],由于黄曲霉毒素B1和G1遇水会发生荧光淬灭,故须用衍生剂对其进行柱前或者柱后衍生,该方法重复性好、检出限低、灵敏度高,仪器及维护成本适中,现已在基层实验室得到了非常广泛的应用[15]。
但是,基层实验室,特别是依托于生产环节的质控实验室的日常检测项目相对集中,关注的风险指标种类范围较窄,通用型检测器(荧光检测器,二极管阵列检测器等)在实际应用中的使用效率较为低下,应用性价比不高。针对食品行业重点关注的风险指标制造有针对性的,廉价的专用型检测器能够在保证日常检测要求的前提下为基层实验室降低仪器购置和维护成本,提高仪器使用效率。专用型检测器一般针对某一种或者某一类物质的检测而设计,将与待测物检测有关的控制设备模块化、检测参数固定化,从而舍去或者简化了通用型检测器中一些不必要的部件,特别是一些易耗部件和高价部件,进而大大降低了检测器的造价和维护成本。
本研究对比了一种自主研发制造的黄曲霉毒素专用LED-荧光检测器(DICP-AF01黄曲霉毒素专用荧光检测器,以下简称DICP-AF01检测器,DICP-AF01 Detector)与市售商品化进口荧光检测器(以下简称商品化检测器,Commercial FLD)的性能差异,通过对比标准品检测数据、实际样品检测数据,使用SPSS软件进行统计学分析,比较两种检测器各方面性能的差异。
1 实验部分
1.1仪器与试剂
某品牌市售商品化进口高效液相色谱仪-荧光检测器系统;Millipore Advantage超纯水机(美国Millipore公司);Allegra 64R台式高速冷冻离心机(美国贝克曼公司);TTL DC 氮吹仪(中国同泰联科技);玻璃纤维滤纸(英国Whatman公司)。黄曲霉毒素总量免疫亲和柱(Romer Labs,COIAC1004);甲醇(色谱纯,迪马公司);黄曲霉毒素(B1、B2、G1、G2)标准品(Sigma公司);实验用水为Millipore超纯水机制备的超纯水。
统计学处理:采用SPSS 19.0(Statistical Product and Service Solutions 19.0,IBM公司)统计软件进行统计分析,使用成对样本t检验比较检出限和重复性,以P<0.05表示差异具有统计学意义。
1.2DICP-AF01黄曲霉毒素专用荧光检测器
DICP-AF01黄曲霉毒素专用荧光检测器为中国科学院大连化学物理研究所研制。该检测器采用正交光学结构,以发光二极管(LED)为激发光源,自研制的AccuOpt光电放大组件为荧光接收器件,采用光线追迹法对检测器全光路进行模拟优化,使用LED、滤光片、透镜,形成大体积、小峰展宽流通池和高信噪比荧光检测池,适用于液相色谱仪。
DICP-AF01检测器整机采用模块化设计,能适用于HPLC、FIA等不同系统;且该检测器功耗小(<300 mW),光源稳定、故障率低,可用于基层实验室检测食品和饲料中的黄曲霉毒素残留。
1.3色谱条件
色谱柱:Welch Ultimate AQ-C18(5μm,150mm×4.6mm);柱温:30℃;进样量:20μL;流动相:甲醇:水=45∶55(等度洗脱),流速:0.8mL/min;碘衍生反应条件:衍生溶液为0.05%碘溶液,衍生液流速为0.2mL/min,衍生反应管温度:70℃。
商品化检测器条件:激发波长360nm,发射波长440nm。
数据采集系统:DICP-AF01黄曲霉毒素专用检测器采用浙大N2000色谱工作站,市售商品化进口荧光检测器采用仪器自带的数据处理系统,其中通过液相色谱仪的触发器连接N2000色谱工作站的数据采集信号开关,实现两个数据采集系统的同步和数据的自动存储,仪器连接方式见图1。
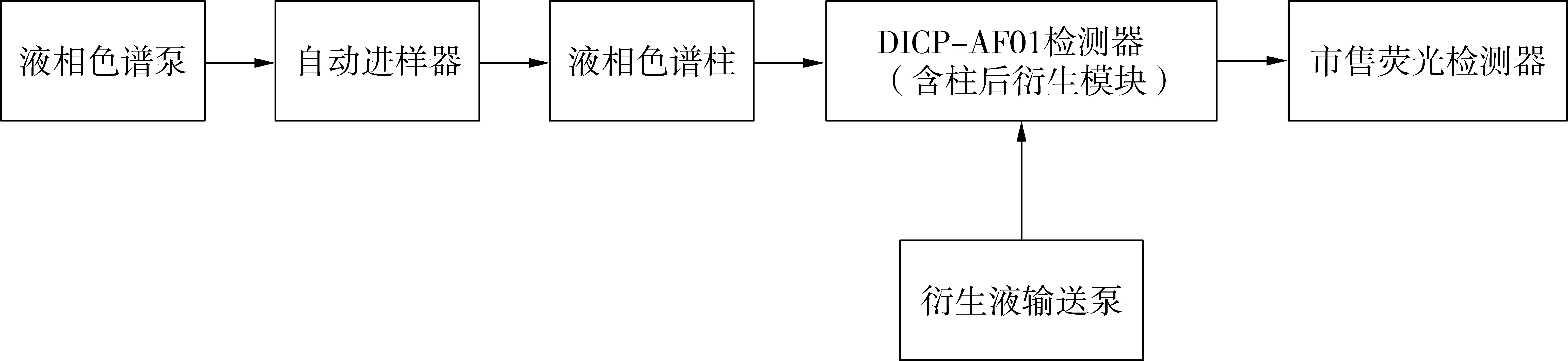
图1 实验装置仪器连接示意图
1.4样品前处理方法
称取5g研磨后的花生样品至50mL离心管,加入1g氯化钠和25mL提取液(甲醇∶水=7∶3),混匀。高速涡旋10min,离心,取提取液用定量滤纸过滤。移取15mL滤液并加入45mL水稀释,混匀。用玻璃纤维滤纸过滤至澄清。取20mL澄清的滤液通过免疫亲和柱,调节压力,使液体以约3mL/min的流速通过亲和柱,直至空气进入亲和柱中。分别用10mL水淋洗亲和柱两次并抽干。再先后用1mL甲醇和1mL水分别洗脱亲和柱并收集全部洗脱液,混匀后HPLC分析测定。
2 实验结果与讨论
2.1两种检测器检测标准品溶液检出限和重复性对比
对专用型检测器的性能的评价主要包括信噪比、重复性、易耗部件寿命、能耗、工作环境耐受度等。本研究主要从实验室应用和方法学适应性的角度考察了检测器的信噪比和重复性。信噪比能够衡量待测物在仪器上所产生的信号相比较于背景噪音和杂质产生的无效信号的明显程度,从而决定待测物质的检出限和定量限。重复性能够反映仪器信号产生的稳定性,从而体现出仪器在检测过程中产生的偶然误差的大小。
本实验首先利用标准品溶液对DICP-AF01检测器与商品化检测器的检出限和重复性进行对比,从而比较背景噪音、电噪音等仪器固有背景信号对4种黄曲霉毒素的检出限和重复性的影响。
使用流动相逐级稀释配制黄曲霉毒素B1、G1浓度相当于0.05ng/mL、0.25ng/mL、0.5ng/mL、1ng/mL、2.5ng/mL、5ng/mL、10ng/mL、20ng/mL的标准品溶液,其中黄曲霉毒素B2、G2的浓度为0.015ng/mL、0.075ng/mL、0.15ng/mL、0.3ng/mL、0.75ng/mL、1.5ng/mL、3ng/mL、6ng/mL。使标准品溶液经过DICP-AF01检测器上的在线柱后衍生模块后依次流入DICP-AF01检测器和商品化荧光检测器(图1),每个浓度的标准品溶液连续进样5次,利用工作站采集处理信息,计算信噪比、检出限和相对标准偏差。
以含黄曲霉毒素B1、G1浓度为0.05 ng/mL,黄曲霉毒素B2、G2浓度为0.015 ng/mL的混合标准溶液进样获得色谱图见图2。
从图2中可以看出,商品化检测器产生的信号中黄曲霉毒素G2、G1、B2的信噪比均小于3,可以判定为未检出;黄曲霉毒素B1的信噪比稍高,基本达到检出限(S/N=3.896)。而DICP-AF01检测器产生的信号中4种黄曲霉毒素均达到检出限,信噪比分别为:3.568、5.362、3.856、6.331。可以看出DICP-AF01检测器的检出限明显低于商品化荧光检测器。
利用SPSS统计分析软件比较两种检测器的检出限和重复性,对每种浓度的标准品溶液的5次平行测定计算相对标准偏差;计算低浓度的标准品溶液(0.05ng/mL、0.25ng/mL、0.5ng/mL、1ng/mL)的检测结果的信噪比。利用SPSS统计分析软件对经过两种检测器采集处理后得到的峰面积和峰高的相对标准偏差以及信噪比进行成对样本t检验,观察其显著性,结果见表1和表2。
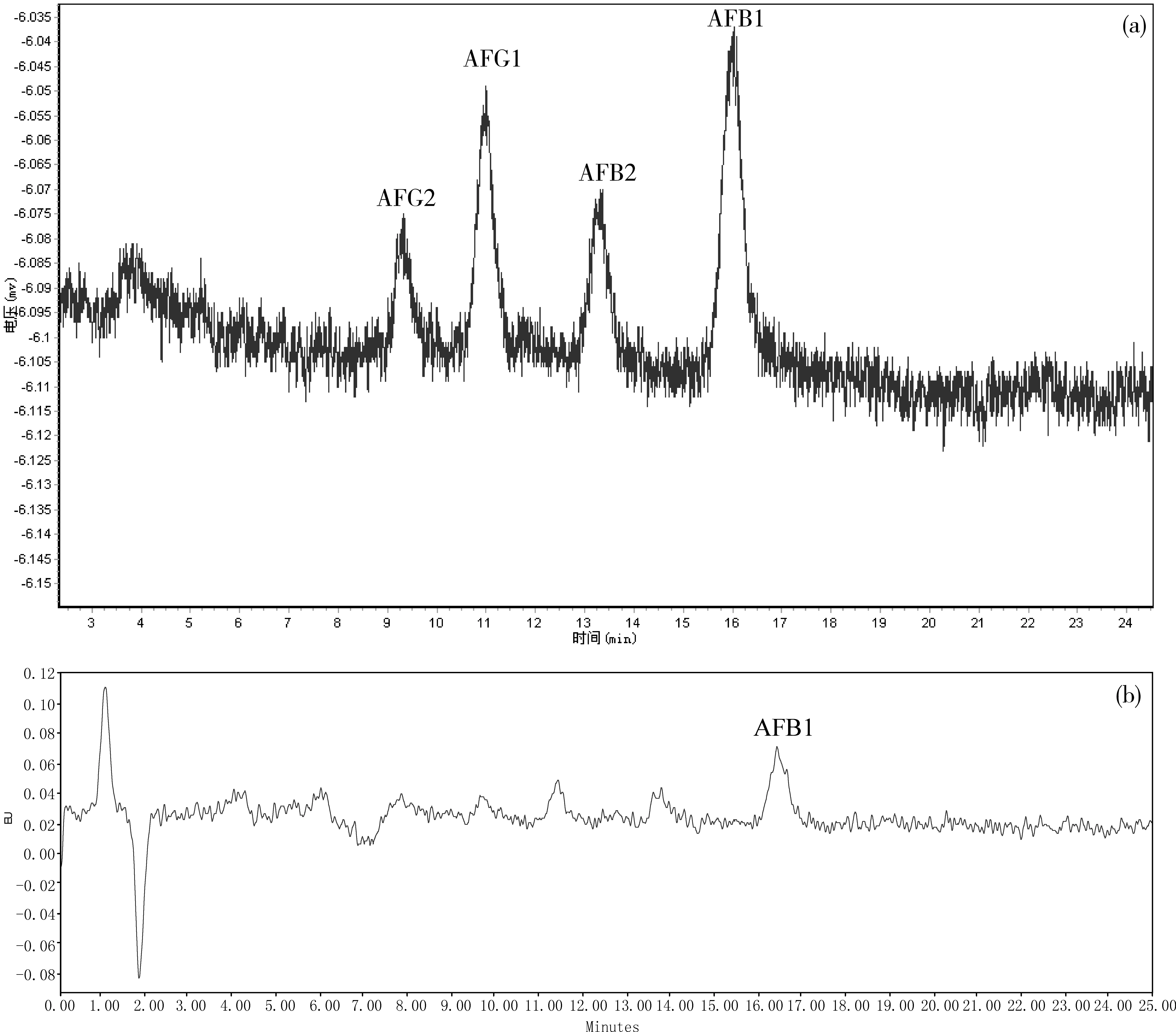
图2 标准品溶液色谱图(a).DICP-AF01检测器;(b).商品化荧光检测器AFB1、AFG1=0.05ng/mL;AFB2、AFG2=0.015ng/mL

黄曲霉毒素样本容量(N)自由度(df)t值p值(双侧)黄曲霉毒素B12019-6.7160.003**黄曲霉毒素B22019-7.5450.003**黄曲霉毒素G12019-13.2330.001**黄曲霉毒素G22019-16.4440.005**
*差异显著**差异极显著
从表1中可以看出,当标准品溶液浓度在0.05ng/mL~1ng/mL范围时,两种检测器检测4种黄曲霉毒素的信噪比差异具有统计学意义且差异极为显著,p<0.01。表1中4种黄曲霉毒素的t值均为负,可以判定在低浓度时DICP-AF01检测器的信噪比、检出限明显优于商品化荧光检测器。
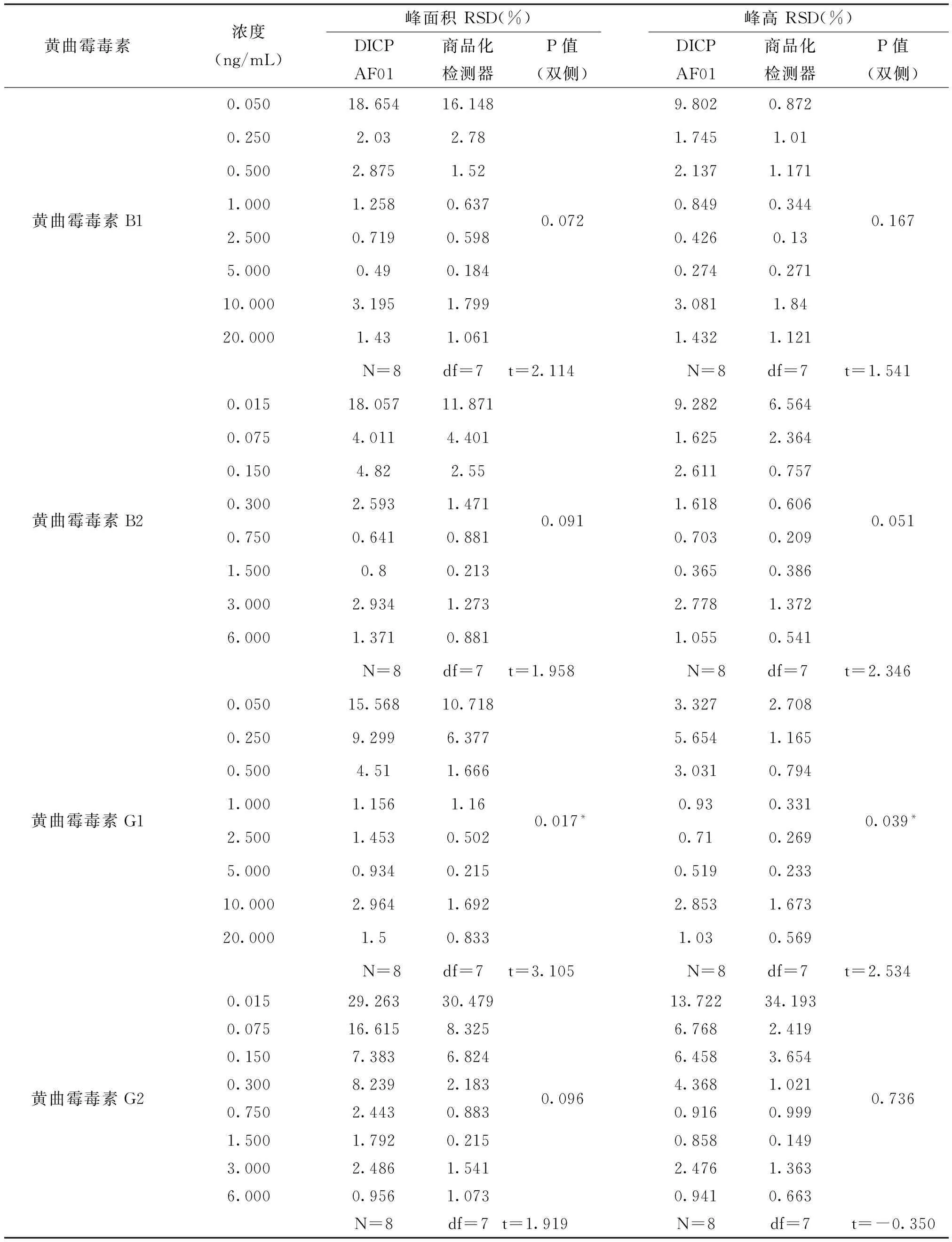
表2 两种两种检测器检测4种黄曲霉毒素标准品溶液相对标准偏差比较(n=8)
*差异显著**差异极显著
从表2中可以看出,黄曲霉毒素G1在两种检测器上连续进样5次所产生信号信号(峰面积、峰高)的相对标准偏差具有统计学意义,p<0.05,且t>0,而黄曲霉毒素B1、B2、G2在两种检测器上连续进样5次所产生信号信号的相对标准偏差没有统计学意义。可以判定,DICP-AF01检测器的检测黄曲霉毒素G1的重复性优于商品化荧光检测器,使用两种检测器其他的3种黄曲霉毒素的重复性无差别。
2.3两种检测器检测实际样品检出限和重复性对比
在实际样品检测中,除了仪器的固有噪音和波动会对检测信号有所影响之外,样品中未被净化完全的杂质和基质物质也会对检测结果产生一定的干扰。
有机溶剂萃取-免疫亲和柱净化是食品中黄曲霉毒素检测最常用的前处理手段[16],免疫亲和柱上载有能够特异性吸附黄曲霉毒素的抗体,样品提取液经过亲和柱后待测物被吸附保留在抗体上,杂质随提取液和淋洗液流出。最终使用含有高浓度有机溶剂的洗脱液破坏抗体,使得待测组分随洗脱液流出,用于检测。由于黄曲霉毒素G1和B1遇水会发生荧光淬灭,所以在使用高效液相色谱-荧光检测器是需要使用衍生剂对其进行柱前或者柱后衍生。
本实验利用花生为基质制备加标阳性样品,加标质量浓度分别为0.5ng/g、5ng/g、20ng/g,对样品进行前处理后利用DICP-AF01检测器和商品化荧光检测器先后对上机溶液进行测定。使上机溶液经过DICP-AF01检测器上的在线柱后衍生模块后依次流入DICP-AF01检测器和商品化荧光检测器(如图1),每个浓度的标准品溶液连续进样3次,利用工作站采集处理信息,计算信噪比和相对标准偏差。利用SPSS统计分析软件对经过两种检测器采集处理后得到的峰面积和峰高的相对标准偏差以及信噪比进行成对样本t检验,观察其显著性,结果见表3和表4。

表3 两种检测器检测花生中4种黄曲霉毒素(0.5ng/g)的信噪比比较(n=6)
*差异显著**差异极显著
从表3中可以看出,在低浓度(0.5ng/g)花生加标样品上机溶液的检测结果中两种检测器检测4种黄曲霉毒素的信噪比差异均具有统计学意义,p(AFB2)<0.05,p(AFB1、G1、G2)<0.01。表中4种黄曲霉毒素的t值均为负,可以判定在花生基质的作用下,DICP-AF01检测器的信噪比、检出限仍明显优于商品化荧光检测器。
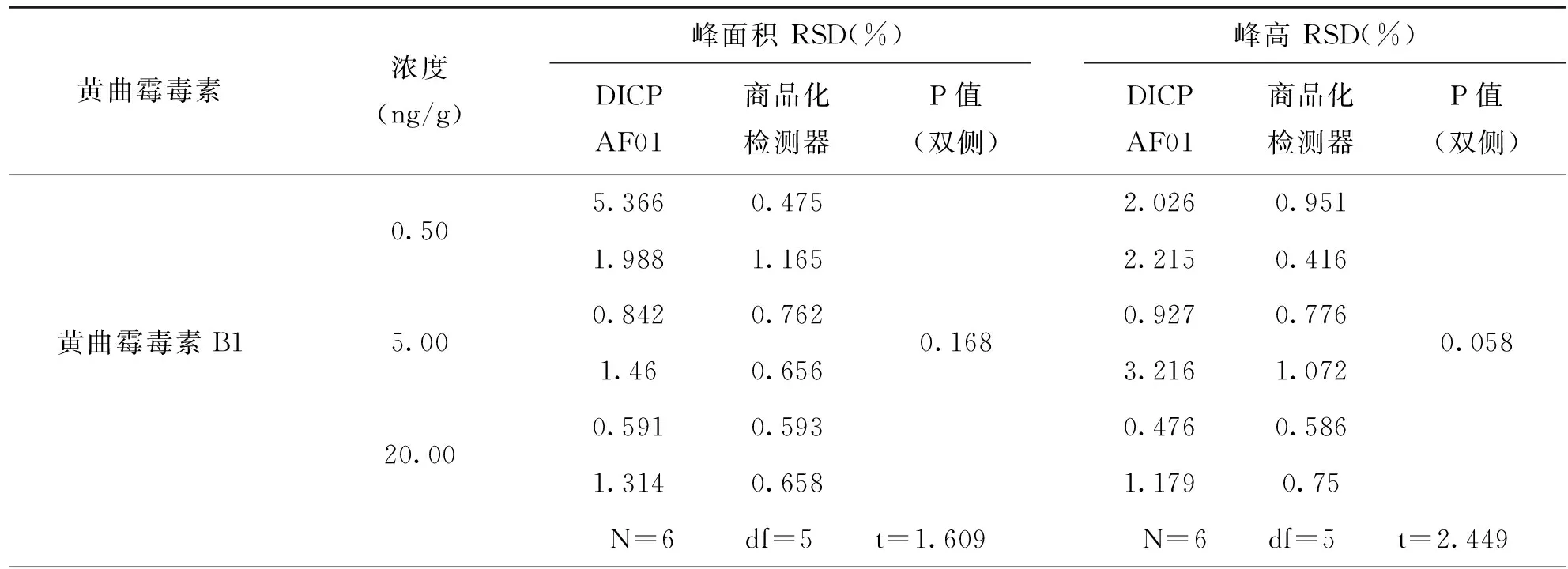
表4 两种检测器检测花生中4种黄曲霉毒素的相对标准偏差比较(n=6)
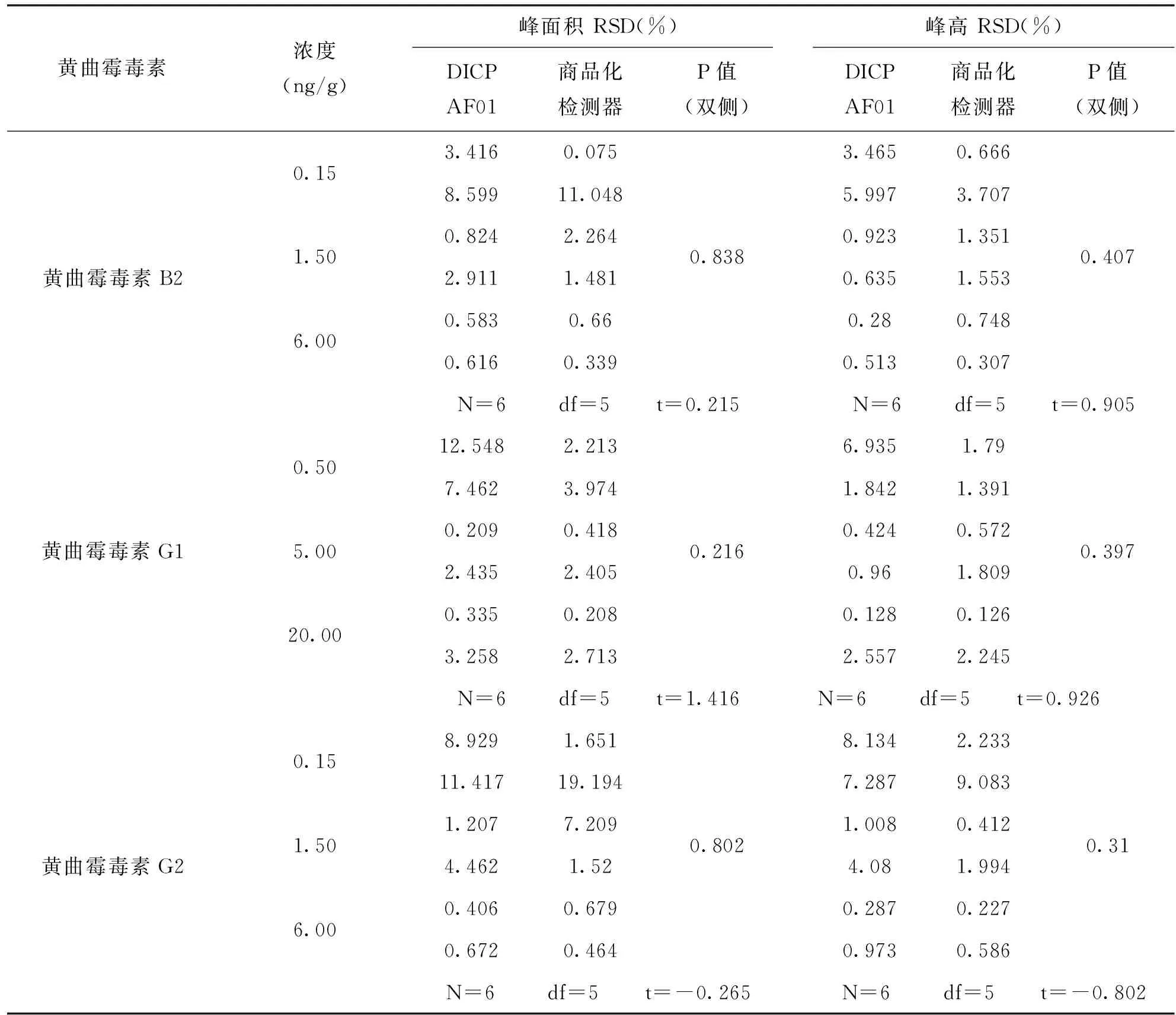
续表4
*差异显著**差异极显著
从表4中可以看出,4种黄曲霉毒素在两种检测器上产生信号的重复性没有统计学意义,p>0.05,故可认为DICP-AF01检测器的检测花生样品中的4种黄曲霉毒素与商品化荧光检测器的重复性无差别。
3 结论
本实验对比了自行开发研制的DICP-AF01黄曲霉毒素专用荧光检测器与市售商品化荧光检测器的性能,并将所得数据利用SPSS统计分析软件进行统计检验。结果显示,DICP-AF01黄曲霉毒素专用荧光检测器的灵敏度和检出限明显优于市售荧光检测器,重复性不逊于市售商品化荧光检测器,是一种理想的专用型黄曲霉毒素在线柱后衍生-荧光检测器。
DICP-AF01黄曲霉毒素专用荧光检测器能够针对性地对黄曲霉毒素进行在线柱后衍生和检测,且操作简单;其光源采用LED发光二极管,成本低,寿命长,非常适合基层实验室展开黄曲霉毒素的专项检测,以应对日益严峻的黄曲霉毒素污染风险的挑战,保障国民粮食安全和身体健康。
[1] Carlson M A,Bargeron C B,Benson R C,et al.An automated,handheld biosensor for aflatoxin[J].Biosens Bioelectron,2000,14(10-11):841-848.
[2] Jaimez J,Fente C A,Vazquez B I,et al.Application of the assay of aflatoxins by liquid chromatography with fluorescence detection in food analysis[J].Journal of Chromatography A,2000,882(1-2):1-10.
[3] Sheng Y J,Eremin S,Mi T J,et al.The Development of A Fluorescence Polarization Immunoassay for Aflatoxin Detection[J].Biomedical And Environmental Sciences,2014,27(2):126-129.
[4] Shyu R H,Shyu H F,Liu H W,et al.Colloidal gold-based immunochromatographic assay for detection of ricin[J].Toxicon,2002,40(3):255-258.
[5] Papp E,H-Otta K,Záray G,et al.Liquid chromatographic determination of aflatoxins[J].Microchemical Journal,2002,73(1-2):39-46.
[6] Egner P A,Wang J B,Zhu Y R,et al.Chlorophyllin intervention reduces aflatoxin-DNA adducts in individuals at high risk for liver cancer[J].Proc Natl Acad Sci U S A,2001,98(25):14601-14606.
[7] Yibadatihan S,Jinap S,Mahyudin N A.Simultaneous determination of multi-mycotoxins in palm kernel cake (PKC)using liquid chromatography-tandem mass spectrometry (LC-MS/MS)[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2014,31(1-2):2071-2079.
[8] 王松雪,鲁沙沙,张艳,等.国内外真菌毒素检测标准制修订现状与进展[J].食品工业科技,2011,32(3):408-412,416.
[9] GB 2761-2011《食品安全国家标准 食品中真菌毒素限量》[S]
[10] 李少晖,任丹丹,谢云峰,等.食品中黄曲霉毒素检测方法研究进展[J].食品安全质量检测学报,2015,6(4):1107-1115.
[11] 黄洁.黄曲霉毒素检测方法研究进展[J].化学分析计量,2013,22(3):100-104.
[12] Song S,Liu N,Zhao Z,et al.Multiplex lateral flow immunoassay for mycotoxin determination[J].Anal Chem,2014,86(10):4995-5001.
[13] Wang X H,Liu T,Xu N,et al.Enzyme-linked immunosorbent assay and colloidal gold immunoassay for ochratoxin A:investigation of analytical conditions and sample matrix on assay performance[J].Anal Bioanal Chem,2007,389(3):903-911.
[14] Alfaro C V,Broto-Puig F,Agut M,et al.Study of the production of aflatoxins B1,G1,B2 and G2 on cashew nuts by Aspergillus parasiticus CECT 2681 by means of ultra-performance liquid chromatography[J].Afinidad,2013,70(563):170-174.
[15] Lv J L,Yang Y L.Determination of aflatoxin B1 and B2 in peanut and peanut oil using cloud point extraction followed by ultra-high-performance liquid chromatography[J].Journal Of Liquid Chromatography &Related Technologies,2013,36(10):1421-1436.
[16] 鲍蕾,吕宁,吴振兴,等.免疫亲和柱同时净化-HPLC法测定植物油中黄曲霉毒素和玉米赤霉烯酮[J].食品工业科技,2013,34(9):306-309.
Comparison of a self-developed dedicated detector for aflatoxin with a commercially available imported fluorescence detector.
Li Shaohui1,Guan Yafeng2,Geng Xuhui2,Chen Shiheng1,Xie Yunfeng1,Yang Yongtan1*
(1.Beijing Key Laboratory of Nutrition Health and Food Safety,Nutrition &Health Research Institute of COFCO Corporation,Beijing 102209,China;2.Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China)
All data were processed with SPSS statistical software.The results indicated that the detection limit of self-developed LED fluorescence detector was superior to commercial fluorescence detector,the reproducibility of self-developed LED fluorescence detector was as equal as commercial fluorescence detector.The self-developed LED fluorescence detector is an ideal aflatoxin dedicated detector,especially suitable for the basic laboratory.
aflatoxin;specific detector;commercial detector;detector comparison;statistic analysis
李少晖,男,硕士,研发专员,主要研究方向为食品质量与安全,E-mail:lishaohui@cofco.com。
杨永坛,男,博士,研究员,主要研究方向为食品质量与安全,E-mail:yangyongtan@cofco.com。
10.3936/j.issn.1001-232x.2016.04.018
2016-02-16
