二穗短柄草被确定为水稻黑条矮缩病毒的新寄主
2016-09-21张爱红邸垫平苗洪芹
张爱红,崔 禹,杨 菲,邸垫平,闫 冲,苗洪芹
(1.河北省农林科学院植物保护研究所,河北省农业有害生物综合防治工程技术研究中心,农业部华北北部作物有害生物综合治理重点实验室,河北保定 071000; 2.河北金融学院,河北保定 071051)
二穗短柄草被确定为水稻黑条矮缩病毒的新寄主
张爱红1,崔 禹2,杨 菲1,邸垫平1,闫 冲1,苗洪芹1
(1.河北省农林科学院植物保护研究所,河北省农业有害生物综合防治工程技术研究中心,农业部华北北部作物有害生物综合治理重点实验室,河北保定 071000; 2.河北金融学院,河北保定 071051)
二穗短柄草(Brachypodiumdistachyon)是一种新兴的模式植物,在病毒-植物的互作研究中具有广阔的应用前景。水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)是一种重要的植物病毒,明确该病毒是否能够侵染二穗短柄草,是进行病毒-寄主互作研究的前提。本研究利用传毒介体灰飞虱将RBSDV人工接种于二穗短柄草Bd21,观察RBSDV是否侵染短柄草,以及侵染后的症状发展过程,同时对病毒进行了PCR检测。结果显示,RBSDV可以侵染二穗短柄草;初期症状为节间缩短,随后表现植株矮缩、心叶扭曲、缺刻等症状;PCR检测有明显的目的条带。由此确定二穗短柄草是RBSDV的新寄主,可作为该病毒与寄主互作的研究材料。这为进行RBSDV抗病基因鉴定、基因组学研究以及农作物的抗病育种奠定了基础。
二穗短柄草; RBSDV;寄主
水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)是一种双链RNA病毒,属于呼肠孤病毒科(Reoviridae)斐济病毒属(Fijivirus),由灰飞虱以持久性方式传播[1]。该病毒的寄主主要包括小麦(Triticumspp.)、大麦(Hordeumspp.)、玉米(Zeamays)、水稻(Oryzasativa)、高粱(Sorghumvulgare)、谷子(Setariaitalica)、马唐(Digitariasanguinali)、风稗(Eechinochloacrusgalli)、燕麦(Avenasativa)、狗尾草(Setariaspp.)、狗牙根(Cynodondactylon)等57种禾本科植物[2]。在我国,RBSDV主要对小麦、玉米、水稻等作物造成严重危害。RBSDV侵染玉米引起玉米粗缩病,侵染小麦引起小麦绿矮病,侵染水稻引起水稻黑条矮缩病,这3种病害是我国小麦、玉米、水稻种植区内重要的共生病毒病害[3]。该类病害曾在中国、日本等东南亚国家流行,对水稻、小麦、大麦、玉米、高粱造成严重的产量损失[4]。研究RBSDV与寄主的互作机制,寻找抗病资源是防治该病毒危害的根本途径,也是当前植物病毒研究的热点。水稻因经济价值较高,并具有模式植物的优点,RBSDV与水稻的互作研究常见报道[5]。但在我国北方,小麦、玉米是RBSDV的主要侵染作物,田间禾本科杂草是完成病毒侵染的桥梁寄主[6-7]。由于水稻生育期较长,需要严格的生长条件,基因组DNA序列与普通小麦、大麦等温带禾本科植物差异较大,限制了水稻作为模式植物在单子叶植物中的通用性[8]。
短柄草(Brachypodiumdistachyon)是一种广泛分布于温带地区的禾本科植物,生育周期短,一年可生长5代,原产于非洲北部、欧洲南部和亚洲中部,与小麦、大麦和燕麦同属早熟禾亚科[9-10]。近几年来,短柄草作为模式植物引起了国内外分子生物学研究者的重视。目前,二穗短柄草的基因组全长已测序完成,通过对二穗短柄草植物学、细胞遗传学、分子生物学特性、基因组学等相关研究,短柄草已成为水稻之外的另一种模式植物[11],可用以获取禾本科基因尤其是麦类基因中所缺少的重要基因共线区信息。
研究表明,麦类作物的白粉病菌、条锈病菌和稻类作物的稻瘟病菌等均能侵染短柄草植株,并引起相应症状[12-13],但是田间危害严重的植物病毒是否侵染短柄草,目前国内外尚无相关报道。RBSDV是一种能对多种作物产生危害的植物病毒,探索RBSDV对其他植物尤其是禾本科模式植物的致病性及其特点,对于建立病毒-植物互作模式系统以及获得新的抗性资源具有重要意义。本研究利用人工接种的方法,将RBSDV接种于二穗短柄草,观察短柄草是否侵染以及其发病特点,以期为下一步建立RBSDV与寄主的互作模式体系,为禾本科作物抗病基因的筛选和鉴定奠定基础。
1 材料与方法
1.1供试材料
采用二穗短柄草二倍体材料Bd21作为实验材料,灰飞虱饲养寄主及毒源繁殖寄主为河北省小麦主要推广品种石新828。
TRIZol植物总RNA提取试剂盒、一步法RT-PCR检测试剂盒均购自北京康为世纪生物科技有限公司。
1.2无毒灰飞虱群体的获得
春季用扣网采集麦田灰飞虱,饲养于防虫罩罩好的小麦苗上。待成虫产卵、1龄若虫孵化后,收集孵化幼虫,转至新鲜小麦苗上继续饲养。在温室环境温度为23±2 ℃、相对湿度为(70±5)%、14 h 光照的条件下,继续扩大繁殖,以此获得无毒灰飞虱群体。
1.3RBSDV毒源的繁殖
大田玉米拔节前,采集田间植株矮化、叶色深绿、叶片背面有蜡白色突起等具有RBSDV侵染典型症状的玉米植株移栽至温室,作为初始毒源。利用无毒灰飞虱将RBSDV传毒至小麦植株。取表现植株矮缩、叶色浓绿、心叶有缺刻及分蘖增多症状的典型小麦病株作为人工接种用毒源。
1.4二穗短柄草的RBSDV侵染
将温室饲养的2~3龄无毒灰飞虱群体饲毒于自繁小麦毒源,饲毒4 d后,将灰飞虱取出置于健康小麦苗上,在环境温度为23±2 ℃的养虫室中渡过循回期,以获得带毒灰飞虱[14]。采用网箱集团接种的方式[14],按照每苗平均5虫的虫量,接种于3叶期二穗短柄草,接种4 d。接种环境温度23±2 ℃、相对湿度(70±5)%、光照14 h/黑暗10 h。同时设未接种对照以及小麦接种对照。逐日调查接种后植株的症状发展过程。
1.5接种后二穗短柄草的分子生物学测定
1.5.1植物总RNA提取
TRIzol植物总RNA提取参照试剂盒说明书进行。采集已接种的二穗短柄草上部叶片,称取0.1 g样品,加入800 μL TRIzol、适量研磨珠,在德国莱驰MM400混合型研磨仪中研磨1.5 min,振动频率为30 HZ·s-1,研磨结束后样品4 ℃静置5 min,加入1/5体积的氯仿,剧烈震荡30 s,4 ℃静置5 min,12 000 r·min-1、4 ℃离心15 min。取上清,加入等体积异丙醇,4 ℃静置10 min,12 000 r·min-1、4 ℃离心10 min,保留沉淀,加入200 μL预冷的75%乙醇,洗涤沉淀,8 000 r·min-1、4 ℃离心5 min,保留沉淀。加入300 μL冷冻无水乙醇,8 000 r·min-1、4 ℃离心5 min,弃上清,在超净工作台风干。每管加入20 μL DEPC处理水,溶解沉淀,-80 ℃保存。
1.5.2一步法RT-PCR检测
根据已报道的RBSDV segment S10序列设计引物。上游引物:5′-TTACCCAACATCACGC AACT-3′,下游引物:5′-GAGCAGGAACTT CACGACAAC-3′,扩增片段大小为337 bp,由上海生工生物工程公司合成。
一步法RT-PCR检测参照其试剂盒说明书进行。在12.5 μL的反应体系中加入2× OneStep RT-PCR Buffer 6.25 μL,上下游引物各0.5 μL,RNA模板1 μL,HiFi-MMLV OneStep RT-PCR EnzymeMix 0.25 μL,用RNase-Free水补足体系。将循环仪预热到45 ℃,将PCR管置于热循环仪中,进行RT-PCR反应,反应条件为反转录45 ℃ 30 min;预变性95 ℃ 2 min,变性94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 30 s,35个循环;终延伸72 ℃ 5 min。反应结束后取5 μL反应产物,加入适量上样缓冲液,进行琼脂糖凝胶电泳检测。
以小麦病株为阳性对照,健康小麦及健康二穗短柄草植株为阴性对照,对显示特定症状的二穗短柄草病株样品进行RT-PCR检测,明确其感染RBSDV的情况。取部分扩增产物送上海生工生物工程公司测序。
2 结果与分析
2.1RBSDV侵染后二穗短柄草的症状表现
在环境温度23±2 ℃、相对湿度(70±5)%、光照14 h/黑暗10 h的条件下,二穗短柄草接种45 d后节间逐渐缩短,50 d后叶片开始扭曲、逐渐变形,55 d后叶片出现缺刻症状,植株逐渐矮化(图1),接种60 d后较正常株(图2)矮化明显。二穗短柄草发病后期可抽穗,但较正常株穗小且不饱满。同等接种条件下,小麦和二穗短柄草表现出的矮化、心叶扭曲、缺刻等症状一致,但小麦接种20 d后即可出现节间缩短的症状,30 d后出现心叶扭曲、缺刻的症状(图3)。由此可见,二穗短柄草接种后典型症状及症状发展过程与小麦一致,但RBSDV在二穗短柄草植株中的潜育期要长于同环境下该病毒在小麦中的潜育期。

A:心叶扭曲;B:缺刻;C:果穗小;D:矮化 A:Leaf distortion;B:Leaf notches;C:Small ears;D:Stunting
2.2RT-PCR检测结果
RT-PCR检测结果显示,阳性对照(小麦病株)扩增出单一且符合预期大小的337 bp的条带,阴性对照(健康的小麦、二穗短柄草植株)未扩增出任何条带,部分接种RBSDV的二穗短柄草植株样品中也扩增到与预期大小一致的片段(图4),包括1株表现侵染症状的植株(图4第6泳道)和1株未表现典型症状的植株(图4第8泳道)。对RT-PCR检测结果为阳性的二穗短柄草病株样品扩增产物直接进行测序,测得的序列于GenBank中进行BLAST比对,结果表明,扩增产物的核苷酸序列与张恒木等[15]测得的RBSDV的segment S10全序列相似性为99%。因此,可以确认上述样品确为RBSDV所感染。

A:心叶;B:穗子;C:植株 A:Leaf;B:Ears;C:Plant

A:心叶扭曲;B:缺刻;C:矮化;D:健康植株 A:Leaf distortion;B:Leaf notches;C:Stunting;D:Healthy plant
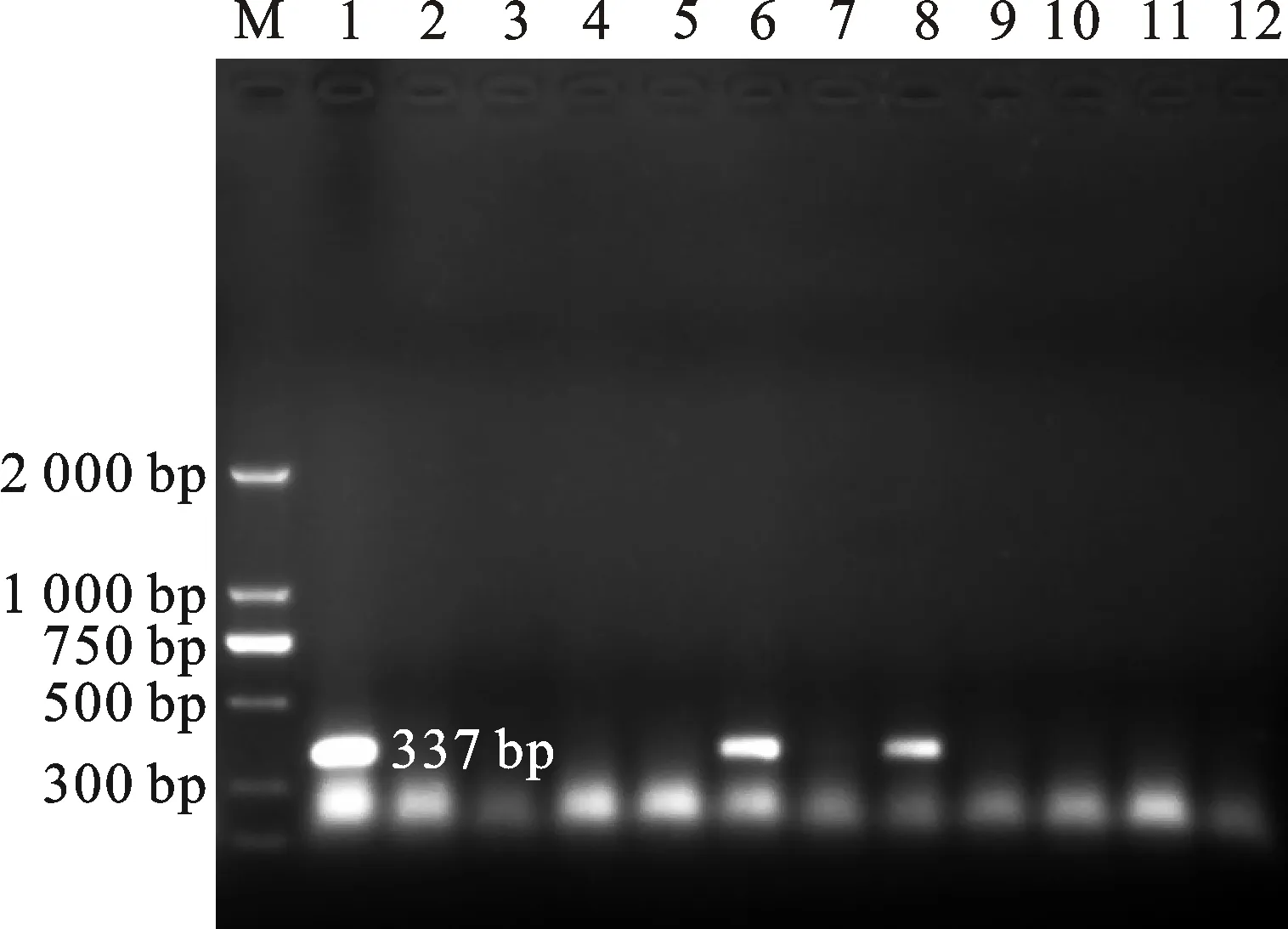
M:DL2000;1:阳性对照(小麦病株);2~3:阴性对照(健康小麦及二穗短柄草植株);4~12:接种RBSDV的二穗短柄草
M: DL2000; 1:Positive control(Triticumspp plant infected by RBSDV); 2-3:Negative control(Healthy plants ofTriticumspp andBranchypodiumdistachyon); 4-12: Samples ofBrachypodiumdistachyon
图4RT-PCR检测结果
Fig.4Results of RT-PCR detection
3 讨 论
本试验利用灰飞虱将RBSDV接种于二穗短柄草,研究了RBSDV在二穗短柄草中的致病过程及特点。结果表明,RBSDV能够侵染二穗短柄草,并表现出系统侵染的症状。这一致病过程及症状与RBSDV侵染小麦后的典型症状极其相似。研究中发现,除表现典型病毒侵染症状的二穗短柄草经RT-PCR能够检出明显条带外,一株未表现出明显症状的二穗短柄草也检测出了条带,只是条带亮度略暗,这可能与RBSDV在其中浓度较低,暂时未引起相关症状有关。灰飞虱是多种植物病毒的传播介体,不仅能够传播RBSDV,还能传播水稻条纹叶枯病毒(Rice stipe virus)[16]、北方禾谷花叶病毒(Northern cereal mosaic virus)[17]、大麦黄条点花叶病毒(Barley yellow striate mosaic rhabdovirus)[18]等多种危害水稻、小麦的病毒病。那么灰飞虱传播其他病毒侵染短柄草也是可能的,这值得进一步研究。
二穗短柄草是禾本科早熟禾亚科第一个被测序的物种,其基因组序列与黑麦草、小麦、大麦等早熟禾亚科植物高度相似。作为一种新的模式植物,二穗短柄草将成为水稻的有力补充。明确RBSDV与寄主之间的致病性、侵染行为以及伴随的基因行为,对明确病毒与植物的互作机理以及挖掘新的抗性资源具有重要的指导作用。
[1]陈声祥,张巧艳.我国水稻黑条矮缩病和玉米粗缩病研究进展[J].植物保护学报,2005,32(1):97-103.
CHEN S X,ZHANG Q Y. Advance in researches on rice black-steaked dwarf disease and maize rough dwarf disease in China [J].JournalofPlantProtection,2005,32(1):97-103.
[2]杨本荣,马巧月.玉米粗缩病的病毒寄主范围研究[J].植物病理学报,1983,13(3):1-8.
YANG B Y,MA Q Y.Study of hosts range on maize rough dwarf virus [J].ActaPhytopathologicaSinica,1983,13(3):1-8.
[3]张恒木,雷娟利,陈剑平,等.浙江和河北发生的一种水稻、小麦、玉米粗缩病是水稻黑条矮缩病毒引起的[J].中国病毒学,2001,16(3):246-251.
ZHANG H M,LEI J L,CHEN J P,etal.A dwarf disease on rice,wheat and maize from Zhejiang and Hebei is caused by rice black-streaked dwarf virus[J].VirologicaSinica,2001,16(3):246-251.
[4]张爱红,路银贵,苗洪芹,等.河北省小麦病毒病种类生物学和血清学鉴定初报[C]//中国植物保护学会2009年学术年会,粮食安全与植保科技创新论文集.武汉:中国农业科学技术出版社,2009:116-120.
ZHANG A H,LU Y G,MIAO H Q,etal. Biological and serological identification on wheat virus disease in Hebei Province [C]//Academic Meeting of China Society of Plant Protection in 2009,Proceedings of Food Security and Plant Protection Science and Technology Innovation China.Wuhan:Agricultural Science and Technology Press,2009:116-120.
[5]倪海平,徐秋芳,兰 莹,等.RBSDV侵染对水稻ABA代谢相关基因表达的影响[J].中国水稻科学,2015,29(3):319-326.
NI H P,XU Q L,LAN Y,etal.Effect of RBSDV infection on transcriptional expression of abscisic acid metabolism related genes in rice[J].ChineseJournalofRiceScience,2015,29(3):319-326.
[6]陈巽祯,杨满昌,刘信义,等.玉米粗缩病的发生规律及综合防治研究[J].华北农学报,1986,1(2):90-97.
CHEN X Z,YANG M C,LIU X Y,etal.The occurrence regulation and integrated control techniques on maize rough dwarf disease[J].ActaAgriculturaeBoreali-Sinica,1986,1(2):90-97.
[7]苗洪芹,陈巽祯,曹克强,等.玉米粗缩病的流行因素与预测模型[J].河北农业大学学报,2003,26(2):60-64.
MIAO H Q,CHEN X Z,CAO K Q,etal.Epidemic factors and predictive models for the disease caused by maize rough dwarf virus [J].JournalofAgriculturalUniversityofHebei,2003,26(2):60-64.
[8]叶兴国.新模式植物短柄草模式特性研究进展[J].作物学报,2008,34(6):919-925.
YE X G.Research outline on some related characteristics ofBrachypodiumdistachyonas a new model plant species [J].ActaAgronomicaSinica,2008,34(6): 919-925.
[9]贾海燕,赵文芳,马正强.禾本科新型模式植物二穗短柄草的研究进展[J].麦类作物学报,2009,29(6):1123-1128.
JIA H Y,ZHAO W F,MA Z Q.Advance in study ofBrachypodiumdistachyonas a new model plant specie for grass crop[J].JournalofTriticeaeCrops,2009,29(6):1123-1128.
[10]DRAPER J,MURLA J,JENKINS G,etal.Brachypodiumdistachyon.A new model system for functional genomics in grasses [J].PlantPhysiology,2001,127:1539-1555.
[11]SILVIA C A,BARBARA W,VERA T,etal. High-throughputAgrobacterium-mediated transformation ofBrachypodiumdistachyon(line Bd21) for functional genomics [R/OL].2007-12-10[2015-10-01].http://www.jic.ac.uk/staff/philippe-vain/brachypodium.htm.
[12]刘子记,朱 婕,华 为,等.小麦抗白粉病基因 pm42的EST连锁图谱构建和比较基因组学分析[J].作物学报,2011,37(9): 1569-1576.
LIU Z J,ZHU J,HUA W,etal.Comparative genomics analysis and constructing EST markers linkage map of powdery mildew resistance gene pm42 in wheat [J].ActaAgronomicaSinica,2011,37(9): 1569-1576.
[13]王小艳,王教瑜,姜 华,等.稻瘟病菌对新型模式植物二穗短柄草的致病性研究[J].中国水稻科学,2011,25(3):314-320.
WANG X Y,WANG J Y,JIANG H,etal.Pathogenicity of rice blast fungus magnaporthe oryzae onBrachypodiumdistachyon[J].ChinaJournalRiceSinica,2011,25(3):314-320.
[14]张爱红,邸垫平,张晓芳,等.高效、准确的玉米粗缩病人工接种鉴定技术[J].植物保护学报,2015,42(1):87-92.
ZHANG A H,DI D P,ZHANG X F,etal.Efficient and accurate artificial inoculation of rice black-streaked dwarf virus to maize [J].JournalofPlantProtection,2015,42(1):87-92.
[15]张恒木,陈剑平,薛庆中,等.水稻黑条矮缩病毒基因组片段S10 的cDNA 克隆及全序列分析[J].中国水稻科学,2002,16(1):24-28.
ZHANG H M,CHEN J P,XUE Q Z,etal.cDNA cloning and sequence analysis of genome segment S10 from rice black-streaked dwarf virus [J].ChineseJorunalofRiceScience,2002,16(1):24-28.
[16]蔡小卫,赵俊玲,邵 英,等.灰飞虱传播水稻条纹病毒的研究综述[J].中国植保导刊,2011,31(9):14-17.
CAI X W,ZHAO J L,SHAO Y,etal.Research progress on transmission of rice stripe virus byLaodephaxstriatellus(Fallen) [J].ChinaPlantProtection,2011,31(9):14-17.
[17]段西飞,邸垫平,张爱红,等.中国北方四省小麦丛矮病病原鉴定[J].植物病理学报,2013,43(1):91-94.
DUAN X F,DI D P,ZHANG A H,etal.Molecular detection and identification of the pathogen causing wheat rosette stunt disease in the north of China [J].ActaPhytopathologySinica,2013,43(1):91-94.
[18]DI D P,ZHANG Y L,YAN C,etal.First report of barley yellow striate mosaic virus on wheat in China [J].PlantDisease,2014,98(10):1450.
Brachypodiumdistachyon,a New Host of Rice Black-Streaked Dwarf Virus
ZHANG Aihong1,CUI Yu2,YANG Fei1,DI Dianping1,YAN Chong1,MIAO Hongqin1
(1.Plant Protection Institute of Hebei Academy of Agricultural and Forestry Science/Integrated Pest Management Center of Hebei Province/Key Laboratory of Integrated Pest Management on Crops in Northern Region of North China,Ministry of Agriculture,Baoding,Hebei 071000,China; 2.Hebei Finance University,Baoding,Hebei 071051,China)
Brachypodiumdistachyonis a relatively ideal model plant for gramineous plants research at present.Rice black-streaked dwarf virus(RBSDV) is one of the most important virus in China, where it causes severe yield loss.Whether RBSDV infectedBrachypodiumdistachyonor not, is the premise to establish virus-host interaction model. An inoculation method was developed to investigate the infection process and symptom development. Meanwhile, RBSDV was detected with PCR inB.distachyon.The results show that:B.distachyoncould be infected by RBSDV. Typical symptoms such as stunting of plants, leaf distortion, small ears, outward-pointing notches could be observed in the plants. Furthermore, a clear single target band indicates thatB.distachyoncould be infected by RBSDV. According to these results,B.distachyon, a new host of RBSDV, can be used as a candidate to study virus-plant interactions.
Brachypodiumdistachyon; Rice black-streaked dwarf virus;Host
2016-01-12
2016-02-26
973计划项目(2014CB138400)
E-mail:zhangaihong08@163.com
苗洪芹(E-mail:miao5058345@163.com)
S512.9;S435.1
A
1009-1041(2016)08-1101-05
网络出版时间:2016-08-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160801.1123.026.html
