微电场对滋养细胞迁移/侵袭相关MMPs/TIMPs表达的影响*
2016-09-21李明勇
张 娟,李明勇,贺 元,白 怀,范 平
(1.四川省医学科学院/四川省人民医院检验科,成都 610072;2.四川大学华西第二医院/西部妇幼医学研究院,成都 610041)
·论著·
微电场对滋养细胞迁移/侵袭相关MMPs/TIMPs表达的影响*
张娟1,李明勇1,贺元1,白怀2,范平2
(1.四川省医学科学院/四川省人民医院检验科,成都 610072;2.四川大学华西第二医院/西部妇幼医学研究院,成都 610041)
目的探讨生理性微电场对体外培养的人胎盘滋养细胞迁移/侵袭相关分子金属基质蛋白酶(MMPs)/组织金属蛋白酶抑制剂(TIMPs)表达的影响。方法用150 mV/mm的直流微电场刺激滋养细胞,测定其迁移情况并观察形态变化。实时荧光定量PCR和Western blot检测刺激前后MMP2、MMP9和TIMP1、TIMP2基因和蛋白表达水平。结果未加电刺激的滋养细胞,其运动缓慢,迁移方向随机;在含有10%小牛血清的培养基中,150 mV/mm电场刺激下滋养细胞向负极迁移,迁移速度和距离明显增加(P<0.01),胞体拉长,垂直于电场方向排列。电场刺激后,胞内MMP2 mRNA和蛋白表达水平明显升高(P<0.05),MMP9、TIMP1和TIMP2表达水平无明显变化。结论生理性直流微电场可介导滋养细胞定向迁移和排列,MMP2表达水平的上调可能与微电场促进滋养细胞迁移/侵袭功能有关。
滋养细胞;金属基质蛋白酶;组织抑制因子;迁移;侵袭;电场
人类滋养细胞是一群特殊的细胞,源于胚胎期的胚外层。在受精卵种植的7~8 d,胚外层细胞分化,形成原始滋养细胞,于受精后2周左右该群细胞形成绒毛的初始结构。此后,滋养细胞进一步分化为无侵袭能力的绒毛滋养层细胞(villous trophoblasts,VTs)和有侵袭能力的绒毛外滋养层细胞(extravillous trophoblasts,EVTs) 两部分。滋养细胞侵袭功能的破坏会引起胎盘功能障碍,导致多种产科疾病如流产、子痫前期和胎儿宫内生长受限等。
滋养细胞浸润主要由以下过程组成:蛋白酶水解、周围基质降解、组织重建等,这个过程具有严格的时间和空间调控特性[1]。金属基质蛋白酶(matrix metalloproteinases,MMPs) 是胚胎植入过程中降解细胞外基质主要的蛋白酶,MMPs按其作用底物的不同分为4类:胶原酶、明胶酶(MMP2、MMP9)、基质分解素和膜型MMPs。其中,MMP2是所有MMPs中分布最广的成员,由多种细胞以无活性的酶原形式分泌,可被蛋白酶和有机汞制剂等激活,也可被同时活化的MMPs活化[2]。MMP9的分子量在MMPs家族中最大,由巨噬细胞、中性粒细胞、血管内皮细胞和滋养细胞等多种细胞分泌。MMP2和 MMP9的主要功能是降解细胞外基质中的Ⅳ型胶原和明胶,是迄今报道最多的两种与滋养细胞迁移/侵袭功能相关的MMPs。
MMPs是胚胎植入过程中降解细胞外基质主要的蛋白酶,该酶的生物学活性受到其组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMPs)的抑制[2-3]。目前,控制绒毛外滋养细胞浸润的分子机制目前还不清楚,迄今报道较多的主要是化学因子的作用,如细胞因子、生长因子、激素和细胞外基质糖蛋白以及多种转录因子等。这些因子可通过调控MMPs/TIMPs表达而促进妊娠滋养细胞的迁移/侵袭功能,但微电场对滋养细胞功能的影响是否与MMPs/TIMPs的表达有关仍不清楚。
生物电现象是生命活动的基本属性,在机体的一切生命活动中都伴随着生物电的产生[4]。作者前期的研究工作发现[5-6],微电场中培养的滋养细胞能产生定向运动的应答反应,提示微电场可能作为一种重要信号促进滋养细胞的迁移等功能。因此,推测微电场对滋养细胞迁移的影响可能通过对迁移/侵袭相关的重要蛋白酶MMPs及其抑制分子TIMPs的表达的调节来实现。因此,本实验拟研究微电场刺激对滋养细胞迁移/侵袭相关MMPs/TIMPs表达的影响。
1 材料与方法
1.1材料与试剂人胎盘滋养细胞HTR-8/Svneo由四川大学华西第二医院彭冰教授惠赠。RPMI-1640培养基(GIBCO),加入青霉素(100 U/mL)、链霉素(100μg /mL),临用前加入终浓度为10%的胎牛血清(GIBCO)。MMP2抗体、MMP9(G657) 抗体、TIMP2 (H-140)抗体、TIMP1 (N1C3) 抗体均购自Cell Signaling公司, Paxillin (N-term) 抗体、Paxillin Phospho (pY118) 抗体购自博士德公司。FITC-Phalloidin和DAPI均购自Sigma公司。
1.2实验方法
1.2.1滋养细胞的培养及加电滋养细胞以RPMI-1640在5%CO2、37 ℃细胞培养箱中培养,培养基含有20%的小牛血清、0.04 mmol/L的谷氨酰胺、青霉素104 U/L、链霉素100 mg/L。每次实验前24 h将冻存的细胞复苏后以5×103个细胞/cm的密度接种于预制的细胞培养槽中,该培养槽由2片24 mm×22 mm、平行放置、相距10 mm的盖玻片通过硅酮胶(Dow Corning)固定于100 mm×20 mm的组织培养皿的底面而形成一个两端开放的细胞培养小室。对培养小室内细胞电场刺激后,收集细胞,用RIPA裂解,提取蛋白,常规Western blot方法检测胞内相关信号通路蛋白的活化水平。
1.2.2实时荧光定量PCR总RNA的提取加电完成后取出细胞培养皿,弃培养基,冷PBS清洗,加入1 mL Trizol,反复吹打,将裂解液转入DEPC处理过的Eppendorf管,室温静置10 min;加入氯仿(200 mL/1 mL Trizol),剧烈震荡15 s,室温静置5 min;4 ℃离心,12 000 g×15 min,小心移取上层水相(0.45 mL)至另一1.5 mL Eppendorf管,加入等体积异丙醇,混匀,室温静置10 min,4 ℃离心,12 000 g×10 min,弃上清,加入DEPC水配制的75%乙醇1 mL洗涤沉淀,4 ℃离心,12 000 g×10 min,弃上清,离心后的沉淀置于室温干燥5 min,加入30 μL DEPC水,必要时55 ℃孵育10 min以利于RNA沉淀的溶解,核酸蛋白分析仪检测RNA含量与纯度。测得A260/280在1.8~2.0,含量大于 0.4 g/L,电泳28 S/18 S≥2,示RNA样本达到要求。再根据Fermentas实时荧光定量试剂盒说明操作,将RNA逆转录成cDNA。扩增MMP2、TIMP2、MMP9、TIMP1、GAPDH的引物,见表1。
1.2.3Western blotWestern blot检测采用常规方法,收集细胞,用RIPA裂解细胞提取总蛋白质,BCA法测定蛋白浓度,确定上样量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行凝胶电泳,蛋白转移至硝酸纤维素膜。分别与MMP2、MMP9、TIMP1、TIMP2、p-FAK、FAK、p-Paxillin、Paxillin、GAPDH蛋白抗体及二抗反应后化学发光显色,阳性条带以凝胶吸光度分析软件测定积分吸光度值为其蛋白量。

表1 实时荧光定量PCR引物序列
2 结 果
2.1微电场对滋养细胞迁移行为的影响研究结果显示,在含有10%胎牛血清的培养基中,在150 mV/mm的直流电场刺激下,滋养细胞向负极定向迁移,电刺激10 h后,滋养细胞胞体拉伸,胞内骨架蛋白F-actin垂直于电场方向排列如图1(10 h) 所示,未加电场刺激的细胞未发生上述反应,如图1(0 h) 所示。滋养细胞在电场作用下向负极定向迁移,且迁移距离和迁移速度明显高于未加电场刺激的对照组[5](P=0.021)。
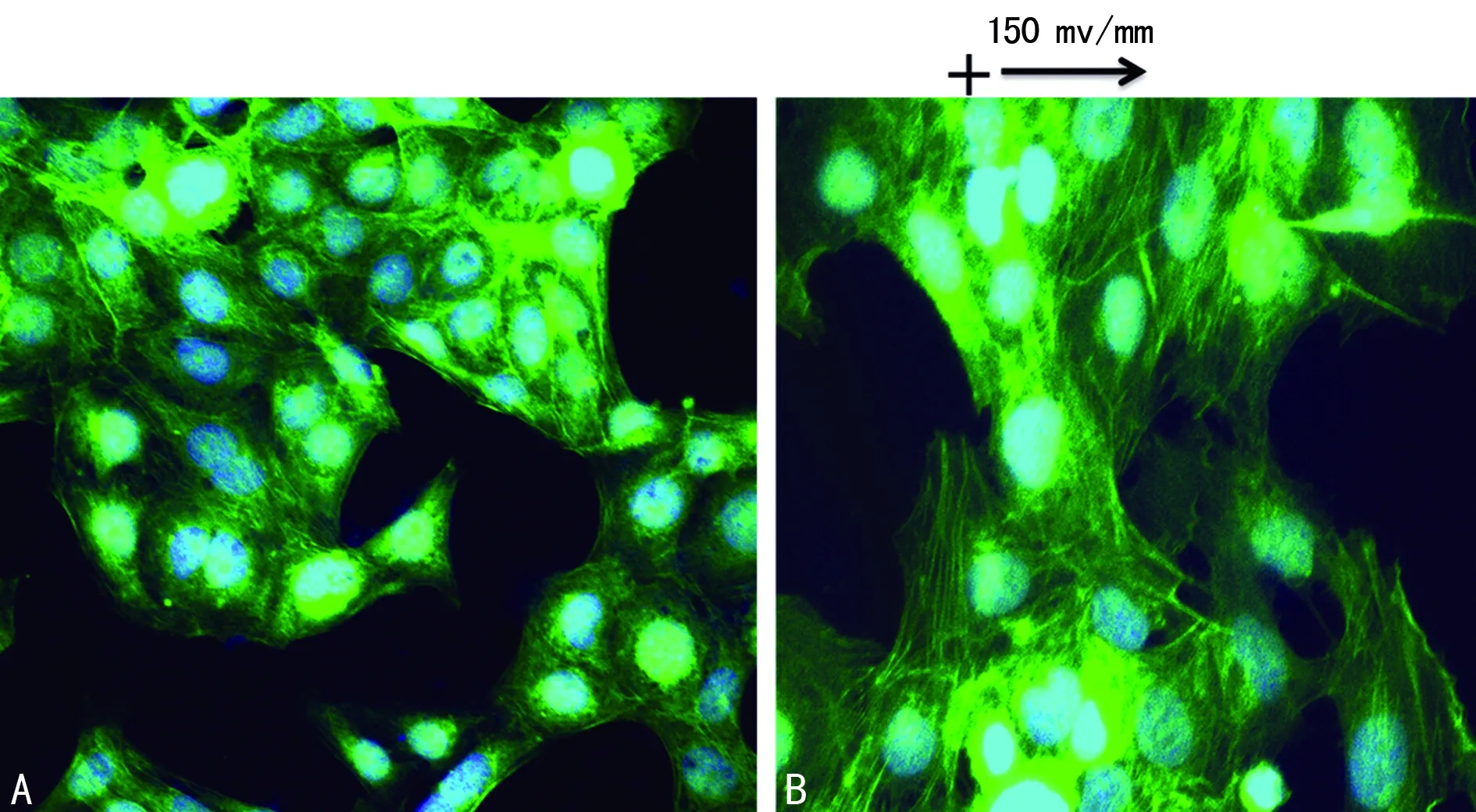
A:0 h;B:10 h。
图1滋养细胞在电场中向负极定向迁移,垂直于电场方向排列
2.2微电场刺激对滋养细胞MMPs/TIMPs表达的影响
2.2.1微电场对滋养细胞MMP2/TIMP2表达的影响实时荧光定量PCR结果显示,150 mV/mm微电场刺激5、10 h,与未加电场刺激的细胞(0 h)相比较,MMP2 mRNA表达水平逐渐增加,分别为0 h的1.16倍和1.35倍,差异有统计学意义(P=0.042),见图2A;MMP2 蛋白表达水平逐渐增加,分别为0 h的1.46倍和1.77倍,差异均有统计学意义(P=0.039;P=0.026),见图2B。TIMP2是MMP2的生理性抑制剂。实时荧光定量PCR结果显示,150 mV/mm微电场刺激滋养细胞5、10 h,与未加电场刺激的细胞(0 h)相比较,TIMP2 mRNA表达水平降低,分别为0 h的0.81倍和0.85倍,见图3A;TIMP2 蛋白表达水平变化不明显,差异无统计学意义(P>0.05),见图3B。
2.2.2微电场对滋养细胞MMP9/TIMP1表达的影响实时荧光定量PCR结果显示,150 mV/mm微电场刺激滋养细胞5、10 h,与未加电场刺激的细胞(0 h)相比较,MMP9 mRNA表达水平无明显改变,见图4A;MMP9 蛋白表达水平也无明显改变,见图4B。TIMP1是MMP9的生理性抑制剂。实时荧光定量PCR结果显示,150 mV/mm微电场刺激5、10 h,与未加电场刺激的细胞(0 h)相比较,TIMP1 mRNA表达无明显改变,见图5A;TIMP1蛋白表达水平降低,差异无统计学意义(P>0.05),见图5B。
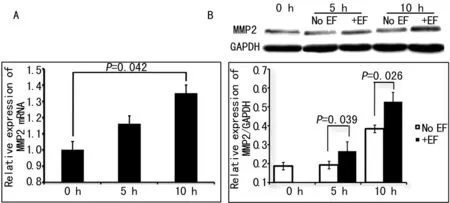
图2 微电场刺激促进滋养细胞MMP2基因和 蛋白的表达的影响

图3 微电场刺激对滋养细胞TIMP2基因 和蛋白表达的影响
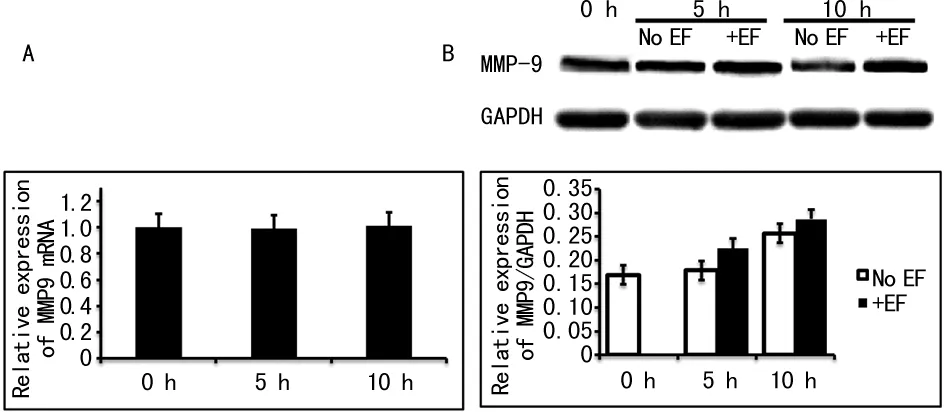
图4 微电场刺激对滋养细胞MMP9基因和 蛋白表达的影响

图5 微电场刺激对滋养细胞TIMP1基因和 蛋白表达的影响
2.3微电场对滋养细迁移相关FAK分子及下游Paxillin磷酸化的影响
2.3.1微电场对滋养细胞FAK磷酸化活性的影响[6]在150 mV/mm微电场作用下,FAK Tyr397位点于5 min内就已开始出现明显磷酸化水平,10 min继续加强(P=0.030),30 min达到较高磷酸化水平(P=0.020),60 min仍维持在较高水平(P=0.001)。总的FAK水平无明显改变,结果见图6。对FAK Tyr576/577位点磷酸化水平影响不如FAK Tyr397位点明显(结果未显示)。
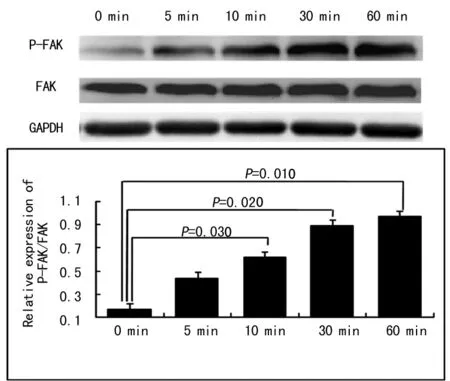
图6 微电场刺激促进滋养细胞FAK Tyr397位点磷酸化
2.3.2微电场对滋养细胞Paxillin磷酸化的影响在相关信号传导通路中,Paxillin位于FAK分子的下游,受FAK活化信号的激活。Western blot结果显示,Paxillin在150 mV/mm微电场刺激细胞5 min和10 min出现磷酸化,30 min后磷酸化水平进一步升高(P=0.03),60 min达较高水平(P=0.02),Paxillin总蛋白表达水平无明显改变,结果见图7。
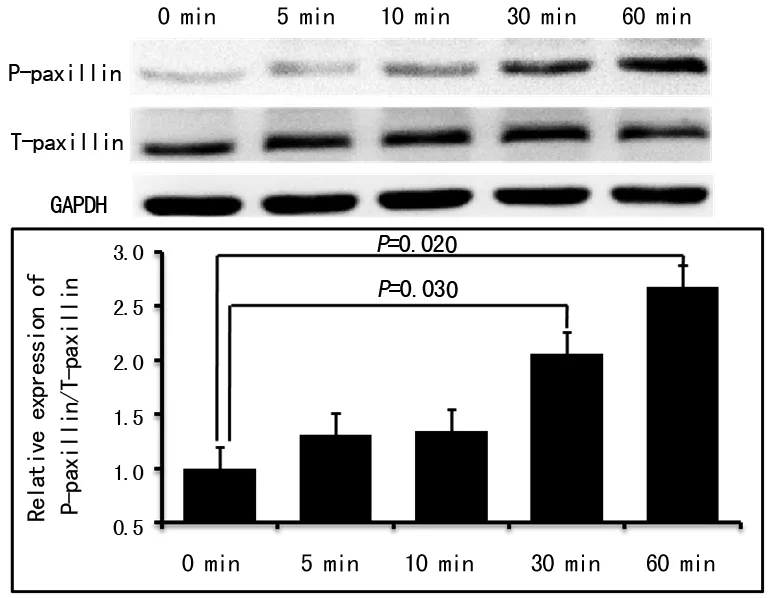
图7 微电场刺激促进滋养细胞Paxillin 磷酸化
3 讨 论
生理状态下,妊娠胚胎植入早期,EVTs侵入蜕膜组织和子宫螺旋动脉,并使后者发生改建变成低阻、高容量血管,维持足够的母体血液流入绒毛间支持胎盘的功能。EVTs适度地侵入子宫内膜是维持妊娠和胎儿发育的前提条件。EVTs侵入不足所致的胎盘缺血缺氧,可导致异常产科结局如流产、子痫前期和胎儿宫内生长受限等的发生。研究显示,滋养细胞适度侵入与MMPs/TIMPs的表达以及妊娠滋养细胞疾病 (gestational trophoblastic disease,GTD)密切相关[7]。
滋养细胞侵入子宫内膜由黏附、定植、降解细胞外基质等环节构成。其中蛋白酶的降解是滋养细胞侵入的关键环节。MMPs是参与细胞外基质降解的主要蛋白酶类。其中MMP2和MMP9是其最重要成员,它们通过降解细胞基底膜Ⅳ型胶原、纤维连接蛋白(fibronectin,FN)、层粘连蛋白(laminin,LN)、弹性蛋白(elastin,EN)、蛋白聚糖(proteoglycans)和明胶(gelatin)等,促进滋养细胞的侵袭功能。研究报道显示,一系列的化学因子可以调控MMPs的表达,并且能影响滋养细胞的重要功能[8-13],如白血病抑制因子(LIF)、肿瘤坏死因子(TNF)、转化生长因子(TGF-β)、白介素1和6(IL-1和IL-6)、胰岛素样生长因子结合蛋白1(IGFBP-1)、AP-1转录因子以及滋养细胞分泌的人绒毛膜促性腺激素和leptin等,均能显著影响MMP2和MMP9的分泌和(或)活性。这些细胞因子主要是通过对转录因子磷酸化水平的作用而对细胞的行为产生影响。本研究结果显示,微电场可促进滋养细胞的定向迁移和垂直于电场方向排列,促进滋养细胞MMP2 mRNA和蛋白的表达,表明微电场可通过作用于滋养细胞使其活性增加,从而促进滋养细胞的浸润,改善由于浸润不足导致的各种产科疾病。本研究结果提示,微电场可能是调控滋养细胞MMP2表达的又一重要因素,为改善由于浸润不足所致的妊娠相关疾病提供了又一重要的理论依据和实践方法。
生理情况下,滋养细胞MMPs的表达依赖于其抑制因子TIMPs的调控。组织抑制因子是一类具有多种生理功能的多肽,能以非共价键的形式与MMPs结合,从而对MMPs的活性产生特异性抑制。TIMPs在减慢细胞外基质降解、维持细胞外基质成分的更新与自稳过程中发挥重要作用。其中,TIMP1(28.5×103)广泛存在于组织和体液中,能被多种细胞因子诱导产生,是MMP9的特异抑制因子[2-3];TIMP2(21.0×103)常随MMP2的表达而表达,受细胞因子的诱导作用较小,是MMP2的特异抑制因子[2-3]。本研究未发现微电场对滋养细胞TIMP 2的表达有明显的影响,提示微电场对滋养细胞侵袭功能相关蛋白酶的作用主要与上调MMP2表达有关。此外,本研究未发现150 mV/mm直流微电场对滋养细胞MMP9及其抑制因子TIMP1的表达水平有明显影响。这可能是因为MMP2是胚胎植入较早期滋养细胞表达的蛋白酶,妊娠11周以后,MMP2的表达水平才开始降低[2-3],而MMP9在胚胎植入较晚期胎盘滋养细胞的表达才增加。微电场显著影响滋养细胞MMP2的表达水平,提示微电场可能对胚胎植入早期滋养细胞迁移/侵袭起到重要的影响作用,为胚胎植入早期应用微电场刺激促进滋养细胞功能,防治胎盘缺血缺氧性疾病的发生奠定了一定的理论基础。
滋养细胞接受胞外信号的刺激发生相应的应答反应,产生特定的生物学效应,具有复杂的细胞内信息传递机制。迄今从化学分子如细胞外基质分子、生长因子、细胞因子和激素等作用于滋养细胞,促进其迁移作用的研究结果表明,有多条信号通路参与滋养细胞的迁移功能的调控,包括FAK、MAPK、PI3K/AKT和STAT3等信号通路的活化[14]。本研究结果发现,微电场刺激滋养细胞能使胞内FAK及其下游Paxillin分子发生磷酸化而激活胞内相关的信号通路[6,15],提示微电场刺激可能是通过活化与细胞迁移/侵袭功能相关的蛋白激酶FAK及其下游Paxillin分子从而上调MMP2的表达水平,活化胞内相关信号传导通路,最终促进滋养细胞的迁移/侵袭功能。关于其详细的调控机制仍需要进一步深入研究。
本研究获得的成果对微电场作为一种可能的生理性信号促进滋养细胞的功能及其机制的探索以及将微电场用于促进胎盘功能,防治胎盘缺血缺氧性疾病的发生奠定了理论基础,具有实际意义和应用前景。
[1]Halasz M,Szekeres-Bartho J.The role of progesterone in implantation and trophoblast invasion[J].J Reprod Immunol,2013,97(1):43-50.
[2]Rasstrigina IM,Milovanov AP,Fokina TV,et al.The intensity of expression of matrix metalloproteinases type 2 and type 9 by invasive trophoblast cells in uncomplicated pregnancy and preeclampsia [J].Arkh Patol,2014,6(3):24-29.
[3]Jia RZ,Ding GC,Gu CM,et al.CDX2 enhances HTR-8/SVneo trophoblast cell invasion by altering the expression of matrix metalloproteinases[J].Cell Physiol Biochem,2014,34(3):628-636.
[4]Wu SY,Hou HS,Sun YS,et al.Correlation between cell migration and reactive oxygen species under electric field stimulation[J].Biomicrofluidics,2015,9(5):054120.
[5]罗薛峰,黄燚,白怀.体外培养滋养细胞受电场作用后迁移行为及形态的变化[J].四川大学学报:医学版,2010,41(5):771-774.
[6]Zhang J,Ren RM,Luo XF,et al.A small physiological electric field mediated responses of extravillous trophoblasts derived from HTR8/SVneo cells:involvement of activation of focal adhesion kinase signaling[J].PLoS One,2014,3(9):e92252.
[7]Ngan HY,Seckl MJ,Berkowitz RS,et al.Update on the diagnosis and management of gestational trophoblastic disease[J].Int J Gynaecol Obstet,2015,131 Suppl 2:S123-126.
[8]Zhang Z,Zhang L,Jia L,et al.AP-2α suppresses invasion in BeWo cells by repression of matrix metalloproteinase-2 and -9 and up-regulation of E-cadherin[J].Mol Cell Biochem,2013,381(1/2):31-39.
[9]Li Y,Klausen C,Cheng JC,et al.Activin A,B and AB increase human trophoblast cell invasion by up-regulating N-cadherin[J].J Clin Endocrinol Metab,2014,99(11):E2216-2225.
[10]Law J,Zhang G,Dragan M,et al.Nodal signals via β-arrestins and RalGTPases to regulate trophoblast invasion[J].Cell Signal,2014,26(9):1935-1942.
[11]Suman P,Godbole G,Thakur R,et al.AP-1 transcription factors,mucin-type molecules and MMPs regulate the IL-11 mediated invasiveness of JEG-3 and HTR-8/SVneo trophoblastic cells[J].PLoS One,2012,7(1):e29745.
[12]Yu N,Yan W,Yin T,et al.HCG-activated human peripheral blood mononuclear cells(PBMC) promote trophoblast cell invasion[J].PLoS One,2015,10(6):e0125589.
[13]Wang H,Cheng H,Shao Q,et al.Leptin-promoted human extravillous trophoblast invasion is MMP14 dependent and requires the cross talk between Notch1 and PI3K/Akt signaling[J].Biol Reprod,2014,10,90(4):78.
[14]Fritz R,Jain C,Armant DR.Cell signaling in trophoblast-uterine communication[J].Int J Dev Biol,2014,58(2/3/4):261-271.
[15]张娟,白怀,范平.微电场对胎盘滋养细胞迁移/侵袭相关信号通路活性的影响[J].国际检验医学杂志,2015,36 (16):2294.
Effect of small direct-current electrical stimulation on migration and invasion related MMPs/TIMPs expression of trophoblast cells*
ZhangJuan1,LiMingyong1,HeYuan1,BaiHuai2,FanPing2
(1.DepartmentofClinicalLaboratory,SichuanAcademyofMedicalScience/SichuanProvincialPeople′sHospital,Chengdu,Sichuan610072,China;2.WestChinaSecondHospitalofSichuanUniversity/WesternWomen′sandChildren′sMedicalResearchInstitute,Chengdu,Sichuan610041,China)
ObjectiveTo investigate the effect of small direct-current electrical stimulation on migration and invasion related MMPs/TIMPs expression of trophoblast cells.MethodsThe trophoblast cells were exposed to the direct current electrical field at 150 mV/mm for 5 and 10 hours.Cell images were recorded with continuous photographing and analyzed by image analyzer.The expression levels of MMP2,MMP9,TIMP1 and TIMP2 were measured using quantitative RT-PCR and Western blot.ResultsIn non-electrical field culture trophoblast cells migrated slowly with random directions.Trophoblast cells cultured in media containing 10% calf serum with the application of 150 mV/mm direct current electrical stimulation,showed marked cathodal migration (P<0.01),the cell body stretched,perpendicular to the direction of the electric field.Compared with the non-electrical field stimulation controls,trophoblasts under the electrical field stimulation had the increased MMP2 mRNA and protein expression (P<0.05),while MMP9,TIMP1 and TIMP2 had no obvious changes of mRNA or protein expressions.ConclusionPhysiological direct-current electrical fields might induce directed migration and perpendicular orientation of trophoblast cells.The enhanced MMP2 expression may play an important role in the migration and invasive activity of trophoblast cells in small electrical field.
trophoblasts cells;matrix metalloproteinases;tissue inhibitor of metalloproteinase;migration;invasion;electrical field
10.3969/j.issn.1671-8348.2016.07.002
国家自然科学基金资助项目(30872774/H0418);四川省卫生和计划生育委员会基金资助项目(140071)。作者简介:张娟(1982-),主管技师,博士,主要从事妊娠相关疾病机制研究及临床血液和生化检验工作。
R714.21
A
1671-8348(2016)07-0869-04
2015-09-08
2015-11-28)
