热处理光滑念珠菌对大鼠气道上皮细胞Dectin-1、IL-6和TNF-α表达的影响*
2016-09-21骆雪萍王玉春吴呈霖
张 雪,骆雪萍△,白 剑,王玉春,吴呈霖,赵 莹
(1.桂林医学院第二附属医院重症医学科,广西桂林 541100;2.桂林医学院,广西桂林 541004;3.桂林医学院第二附属医院检验科,广西桂林 541100)
·论著·
热处理光滑念珠菌对大鼠气道上皮细胞Dectin-1、IL-6和TNF-α表达的影响*
张雪1,骆雪萍1△,白剑2,王玉春3,吴呈霖1,赵莹1
(1.桂林医学院第二附属医院重症医学科,广西桂林 541100;2.桂林医学院,广西桂林 541004;3.桂林医学院第二附属医院检验科,广西桂林 541100)
目的探讨大鼠气道上皮(RTE)细胞与热处理光滑念珠菌孵育后Dectin-1、IL-6和TNF-α的表达及意义。方法以体外培养的RTE细胞与热处理光滑念珠菌孵育后分别于2、4、6 h观察RTE细胞形态变化,以未与光滑念珠菌孵育的RTE细胞为对照组。用Western blot法检测Dectin-1蛋白的表达;实时荧光定量PCR检测IL-6和TNF-α mRNA的表达;ELISA法检测上清液IL-6和TNF-α的分泌。结果随着孵育时间的延长,RTE细胞破坏逐渐加重及Dectin-1、IL-6和TNF-α 的表达呈进行性增高。孵育2 h组与对照组比较、孵育4 h组与孵育2 h组比较、孵育6 h组与孵育4 h组比较,Dectin-1、IL-6和TNF-α 的表达差异有统计学意义(P<0.05)。结论RTE细胞具有天然免疫功能,其Dectin-1参与了对热处理光滑念珠菌的识别,并激活IL-6和TNF-α的分泌,介导炎性反应。IL-6起负性调节作用。
热处理光滑念珠菌;Dectin-1受体;大鼠气道上皮细胞;肿瘤坏死因子α;白细胞介素6
近年由于广谱抗菌药物、免疫抑制剂等的应用,使侵袭性真菌感染(invasive fungal infection,IFI)的发病率增高,尤以重症监护病房(ICU)最多见[1]。ICU患者多以侵袭性肺部真菌感染(invasive pulmonary fungal infection,IPFI)最为常见,IPFI已成为导致重症患者死亡的主要原因之一。以往IFI的病原菌以白色念珠菌为主,近年非白色念珠菌所占比例明显增加,其中光滑念珠菌和热带念珠菌占较大比例,有报道光滑念珠菌几乎成为ICU非白色念珠菌中首位致病菌[2]。本研究通过大鼠气道上皮(rat tracheal epithelia,RTE)细胞与热处理光滑念珠菌孵育,探讨热处理光滑念珠菌对RTE 细胞Dectin-1受体、IL-6和TNF-α表达的影响。
1 材料与方法
1.1细胞培养RTE细胞购于北京协和细胞资源中心。培养于DMEM F12 1∶1混合培养基中(含10%胎牛血清及青链霉素)。常规培养、传代,培养条件37 ℃、5%CO2细胞培养箱生长。
1.2菌种标准光滑念珠菌,编号9627,购自上海酶联生物科技有限公司。将光滑念珠菌标准菌株接种于沙堡培养基,在37 ℃真菌培养箱培养48 h后,挑取菌落于高温高压灭菌PBS冲洗2次,配制成悬液,血球计数板倒置显微镜下计数,1 200 rpm 4 ℃离心弃上清,用无菌PBS缓冲液重悬,于56 ℃环境下进行热处理30 min[3],4 ℃储存备用。
1.3RTE细胞与热处理光滑念珠菌孵育实验
1.3.1孵育前细胞准备弃培养基,PBS冲洗,弃PBS,胰酶消化,终止消化,离心,血球计数板倒置显微镜下计数,调整细胞密度至5×105/mL,每孔各取1 mL细胞悬液加入6孔板,放入培养箱培养24 h。
1.3.2孵育实验及分组稀释光滑念珠菌液,计数,调整浓度为5×106/mL,每孔加100 μL菌液,孵育复数(multiplicity of infection,MOI)为1[4]。第1次向六孔板任意一孔加入菌液后,每隔2 h,分别再向其他六孔板任意一孔加入菌液,总共加菌液3次,分别标记孵育6 h组、孵育4 h组和孵育2 h组。再从剩余孔中随机选取一孔,此标记为对照组。
1.4Western blot检测Dectin-1蛋白终止各组孵育,将细胞收集加入蛋白裂解液,离心提取上清液。应用BCA定量法计算蛋白浓度。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将凝胶中蛋白转移至PVDF膜上。TBS-T洗膜,封闭后,与一抗孵育,次日与二抗孵育。TBS-T洗膜后加入化学发光试剂,X线胶片曝光。应用Image J软件分析并计算各组条带灰度值。
1.5实时荧光定量PCR检测IL-6和TNF-α终止各组孵育,收集细胞加入1 mL Trizol,按照说明书提取RNA。以2 μg总RNA为模板,按照说明书配制逆转录反应体系,合成cDNA第一链。IL-6引物序列:上游5′-ACA GCG ATG ATG CAC TGT CA-3′,下游5′-ACG GAA CTC CAG AAG ACC AG-3′;TNF-α引物序列:上游5′-CAC CAC GCT CTT CTG TCT ACT-3′,下游5′-AGA TGA TCT GAG TGT GAG GGT C-3′;β-acting引物序列:上游5′-GGA GAT TAC TGC CCT GGC TCC TA-3′,下游5′-GAC TCA TCG TAC TCC TGC TTG CTG-3′。实时荧光定量PCR反应条件:94 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40循环。基因相对表达量以2-△△Ct表示。
1.6上清液ELISA检测IL-6和TNF-α因子终止各组孵育,分别取100 μL共培养细胞上清液,按ELISA 检测试剂盒说明进行,绘制曲线,得出各组IL-6和TNF-α的表达浓度。
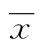
2 结 果
2.14组RTE细胞光镜观察RTE细胞与热处理光滑念珠菌孵育光镜下见对照组RTE细胞形态清晰、完整;孵育2、4、6 h组可见RTE细胞形态不完整,边缘模糊。孵育2 h 组与对照组比较、孵育4 h组与孵育2 h组比较、孵育6 h组与孵育4 h组比较,RTE细胞碎片及光滑念珠菌孢子逐渐增多。见图1。
2.24组Dectin-1受体蛋白的表达及比较Western blot印迹见图2。4组Dectin-1的表达见表1。孵育2 h组与对照组比较、孵育4 h组与孵育2 h组比较、孵育6 h组与孵育4 h组比较,Dectin-1蛋白的表达差异有统计学意义(P<0.05)。

A:对照组;B:孵育2 h组;C:孵育4 h组;D:孵育6 h组。
图14组RTE细胞与热处理光滑念珠菌孵育光镜观察(×20)
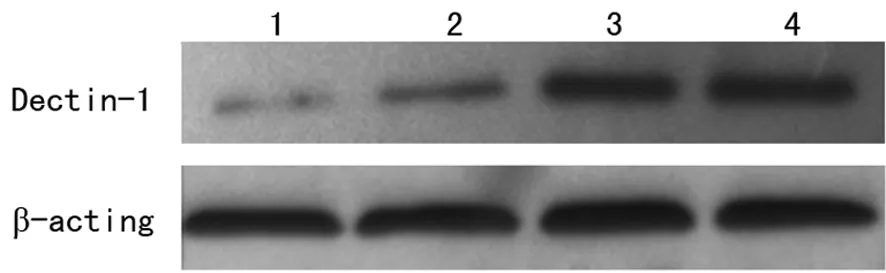
1:对照组;2:孵育2 h组;3:孵育4 h组;4:孵育6 h组。
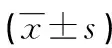
图2 4组RTE细胞受体Dectin-1蛋白表达 表1 4组Dectin-1蛋白的表达
a:P<0.05,与对照组比较;b:P<0.05,与孵育2 h组比较;c:P<0.05,与孵育4 h组比较。
2.34组IL-6和TNF-α mRNA实时荧光定量PCR结果及比较实时荧光定量PCR(图3~6)示待测基因的荧光信号真实可信。 RTE细胞与热处理光滑念珠菌孵育后,4组IL-6和TNF-α mRNA的表达见图7、8,表2、3。孵育2 h组与对照组比较、孵育4 h组与孵育2 h组比较、孵育6 h组与孵育4 h组比较,IL-6和TNF-α mRNA的表达均明显增高,差异有统计学意义(P<0.05)。
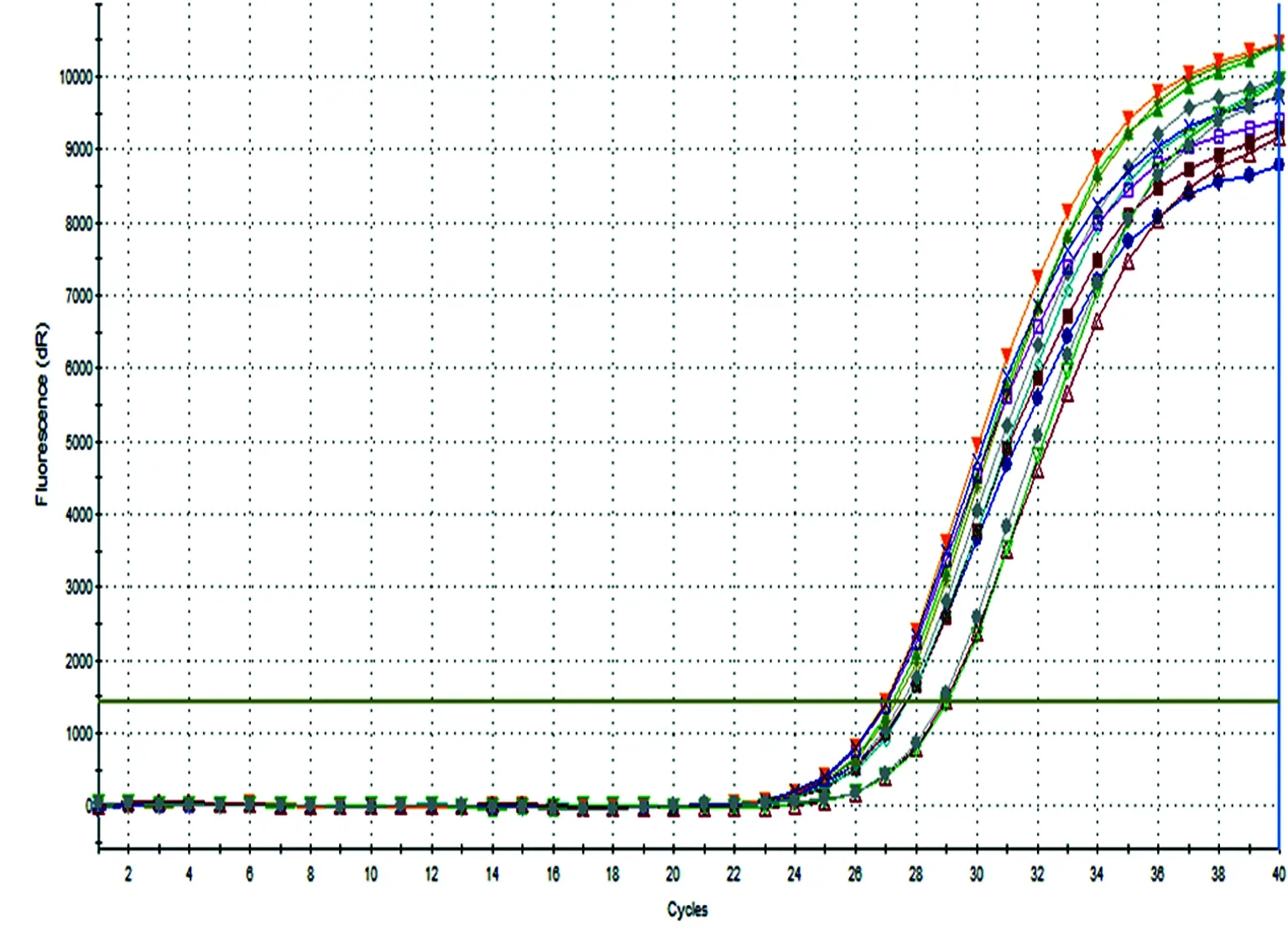
图3 IL-6 mRNA扩增产物溶解曲线分析

图4 IL-6 mRNA实时荧光定量PCR扩增曲线
图5 TNF-α mRNA扩增产物溶解曲线分析
图6 TNF-α mRNA实时荧光定量PCR扩增曲线

图7 4组RTE细胞中IL-6 mRNA 实时荧光定量PCR表达
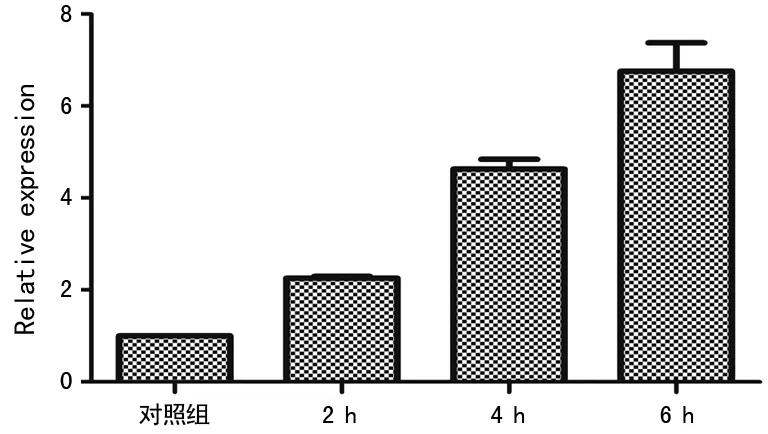
图8 4组RTE细胞中TNF-α mRNA实时 荧光定量PCR的表达表2 4组IL-6 mRNA实时荧光定量PCR的表达

组别IL-6mRNA对照组1.0000±0.00000孵育2h组1.6310±0.10742a孵育4h组2.1915±0.16894b孵育6h组3.5987±0.13098c
a:P<0.05,与对照组比较;b:P<0.05,与孵育2 h组比较;c:P<0.05,与孵育4 h组比较。

表3 4组TNF-α mRNA实时荧光定量PCR的表达
a:P<0.05,与对照组比较;b:P<0.05,与孵育2 h组比较;c:P<0.05,与孵育4 h组比较。
2.44组IL-6和TNF-α因子ELISA检测的结果及比较ELISA显示,孵育2 h组与对照组比较、孵育4 h组与2 h组比较,孵育6 h组与4 h组比较,IL-6和TNF-α的表达均显著升高(P<0.05)。见表4、5。

表4 4组上清液IL-6因子的表达
a:P<0.05,与对照组比较;b:P<0.05,与孵育2 h组比较;c:P<0.05,与孵育4 h组比较。

表5 4组上清液TNF-α因子的表达
a:P<0.05,与对照组比较;b:P<0.05,与孵育2 h组比较;c:P<0.05,与孵育4 h组比较。
3 讨 论
当真菌进入呼吸道,首先接触气道上皮细胞。一般情况下当纤毛清除系统有效运行时真菌能被迅速清除。当宿主免疫力低下、免疫状态抑制或吸入真菌数量远远超过气道防御屏障清除能力时,真菌即可侵入机体导致真菌感染。此时,气道上皮细胞的早期识别能力和免疫趋化等天然免疫功能显得尤为重要。以往气道上皮细胞仅被认为起着机械物理屏障作用,但随着深入研究发现气道上皮细胞还是呼吸道应对病原微生物感染产生免疫应答的前哨细胞(sentinel cell)。更重要的是气道上皮细胞可通过病原识别受体(pathogen recognition receptor,PRR)识别真菌并构成强大的免疫屏障,从而成为抵抗真菌等病原微生物入侵机体的第一道防线[5]。
真菌侵入机体后,首先通过PRR对真菌表面病原相关分子模式(pathogen associated molecular pattern,PAMP)进行识别启动天然免疫。PRR是启动整个天然免疫应答的枢纽[6]。真菌细胞壁任何成分都可能是潜在的 PAMP,位于细胞壁最内层的β-葡聚糖是重要的PAMP。由于β-葡聚糖被甘露聚糖-甘露糖蛋白层覆盖,从而阻止PRR对其的直接识别。当细胞壁破坏时β-葡聚糖被释放,宿主受体对暴露的β-葡聚糖碎片识别启动天然免疫。本研究发现随着RTE细胞与热处理光滑念珠菌孵育时间的延长,RTE细胞形态完整性逐渐破坏,细胞溶解、被吞噬现象越来越严重,细胞碎片逐渐增多,菌群数量不断增多,甚至几乎覆盖全部RTE细胞。以上现象均提示热处理的光滑念珠菌仍具有很强致病性,通过热处理[3]可使光滑念珠菌细胞壁内层的β-葡聚糖暴露,而暴露了的β-葡聚糖是光滑念珠菌致病的重要成分,这与本研究团队在大鼠整体实验中的研究结果一致[7]。
C型凝集素受体(C-type lectin receptors,CLR)是天然免疫中重要的PRR之一,CLR能诱导细胞内信号传导[8]。CLR家族中的树突状细胞相关性Dectin-1与真菌感染密切相关,是识别真菌β-葡聚糖重要的PRR[9]。Dectin-1由胞外糖识别结构域(carbohydrate recognition domains,CRDs)、跨膜区域和细胞质免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs,ITAM)结构域构成[10]。正常情况下Dectin-1呈低表达。本实验研究结果显示随着RTE细胞与热处理光滑念珠菌孵育时间延长,Dectin-1的表达呈进行性升高,具有时间依赖性。由此可见,RTE细胞不仅具有气道的屏障功能,同时还有抗真菌的天然免疫功能,其Dectin-1是识别光滑念珠菌β-葡聚糖的重要PRR。
Dectin-1识别β-葡聚糖后还可诱发一系列的下游细胞因子的表达及炎性反应。Li等[11]研究发现用白色念珠菌β-葡聚糖体外刺激人急性单核白血病细胞,能引起固有免疫反应并使下游因子TNF-α、IL-6和IL-8表达增加。Gow等[3]研究也发现用人外周血单核细胞、鼠腹膜巨噬细胞分别与白色念珠菌孵育,热处理组白念珠菌释放更高的TNF-α、IL-6、IL-10和IFN-γ等因子。本实验结果同样显示RTE细胞与热处理光滑念珠菌孵育后IL-6 和TNF-α mRNA的表达、IL-6 和TNF-α的分泌均随孵育时间延长而显著上调,与Li等[11]和Gow等[3]用白色念珠菌β-葡聚糖与细胞孵育TNF-α和IL-6等因子表达水平明显升高的研究结果一致。Leal等[12]研究发现敲除Dectin-1基因的小鼠真菌感染时IL-1β等细胞因子生成受阻,粒细胞浸润减少和菌丝清除能力下降,尤其是在高表达β-葡聚糖真菌感染时上述表现更明显。然而,目前对于IL-6在真菌感染中发挥的作用尚未完全明确,甚至有争议。传统认为在真菌感染期间,IL-6的分泌对于机体是起保护防御作用的。但近期研究[13]显示,在真菌性血流感染中IL-6和TNF-α的分泌量与疾病的严重程度有关。本实验研究发现随着IL-6和TNF-α表达的进行性增高,RTE细胞被侵蚀、溶解更加显著,提示IL-6起了负性调节的作用,与真菌性血流感染的研究结果相似。由此可见,在真菌感染过程中,过强的免疫反应及过度的免疫应答会引起大量的炎性介质释放产生局部免疫损伤,这些对宿主自身是不利的。
综上所述,具有气道重要屏障功能的RTE细胞同样具有抗真菌的天然免疫功能。RTE细胞的Dectin-1参与了对热处理光滑念珠菌的识别,经热处理的光滑念珠菌仍具有较强的致病性,其暴露了的β-葡聚糖可直接作为PAMP被RTE细胞Dectin-1识别,并诱导下游细胞因子及炎性因子IL-6和TNF-α的表达。IL-6作为免疫反应中的重要的细胞因子在RTE细胞光滑念珠菌感染中起到了负性调节作用。因此,充分认识Dectin-1及IL-6可能在免疫学方面为临床抗真菌治疗提供一个新的靶点。
[1]Groll AH,Lumb J.New developments in invasive fungal disease[J].Future Microbiol,2012,7(2):179-184.
[2]Paramythiotou E,Frantzeskaki F,Flevari A,et al.Invasive fungal infections in the ICU:how to approach,how to treat[J].Molecules,2014,19(1):1085-1119.
[3]Gow NA,Netea MG,Munro CA,et al.Immune recognition of Candida albicans beta-glucan by dectin-1[J].J Infect Dis,2007,196(10):1565-1571.
[4]Seider K,Gerwien F,Kasper L,et al.Immune evasion,stress resistance,and efficient nutrient acquisition are crucial for intracellular survival of Candida glabrata within macrophages[J].Eukaryot Cell,2014,13(1):170-183.
[5]Che CY,Jia WY,Xu Q,et al.The roles of surfactant protein D during Aspergillus fumigatus infection in human corneal epithelial cells[J].Int J Ophthalmol,2012,5(1):13-17.
[6]Evans SE,Xu Y,Tuvim MJ,et al.Inducible innate resistance of lung epithelium to infection[J].Annu Rev Physiol,2010,72:413-435.
[7]吴呈霖,骆雪萍,吴晔,等.大鼠侵袭性肺部热处理光滑念珠菌感染肺组织Dectin-1和IL-10的表达[J].广东医学,2014,35(22):3468-3470.
[8]Gringhuis SI,Kaptein TM,Wevers BA,et al.Dectin-1 is an extracellular pathogen sensor for the induction and processing of IL-1β via a noncanonical caspase-8 inflammasome[J].Nat Immunol,2012,13(3):246-254.
[9]Dambuza IM,Brown GD.C-type lectins in immunity:recent developments[J].Curr Opin Immunol,2015,32:21-27.
[10]Marakalala MJ,Kerrigan AM,Brown GD.Dectin-1:a role in antifungal defense and Consequences of genetic polymorphisms in humans[J].Mamm Genome,2011,22(1/2):55-65.
[11]Li M,Liu ZH,Chen Q,et al.Insoluble beta-glucan from the cell wall of Candida albicans induces immune responses of human THP-1 monocytes through Dectin-1[J].Chin Med J (Engl),2009,122(5):496-501.
[12]Leal SM,Cowden S,Hsia YC,et al.Distinct roles for Dectin-1 and TLR4 in the pathogenesis of Aspergillus fumigatus keratitis[J].PLoS Pathog,2010,6:e1000976.
[13]梁珺,张洲,徐元宏.TNF-α、IL-6、IL-10、VCAM-1、E-Selectin在真菌性血流感染中的作用[J].安徽医科大学学报,2013,48(1):47-50.
Effects of heat-treated candida glabrata on the expression of Dectin-1,the production of IL-6 and TNF-α in rat tracheal epithelial cells*
ZhangXue1,LuoXueping1△,BaiJian2,WangYuchun3,WuChenglin1,ZhaoYing1
(1.DepartmentofICU,theSecondAffiliatedHospitalofGuilinMedicalCollege,Guilin,Guangxi541100,China;2.GuilinMedicalCollege,Guilin,Guangxi541004,China;3.DepartmentofClinicalLaboratory,theSecondAffiliatedHospitalofGuilinMedicalCollege,Guilin,Guangxi541100,China)
ObjectiveTo explore the effects of co-cultured heat-treated candida glabrata with rat tracheal epithelial (RTE) cells on the expression of Dectin-1 and the production of IL-6 and TNF-α.MethodsRTE cells in vitro were co-cultured with heat-treated candida glabrata bacteria liquid for 2,4,6 h,while without co-cultured RTE cells were used as control group.We observed the morphological changes of RTE cells,detected the protein expressions of Dectin-1 by Western blot,used real-time PCR to detecte the mRNA expressions of IL-6 and TNF-α and measured protein expression of IL-6 and TNF-α by ELISA.ResultsWith the passing of time,the RTE cells were damaged extensively and the expression of Dectin-1,IL-6 and TNF-α became more and more significant.Obviously,there had significant difference in the expression of Dectin-1,IL-6 and TNF-α between the co-cultured 2 h group and the control group,the co-cultured 4 h group and the co-cultured 2 h group,the co-cultured 6 h group and the co-cultured 4 h group (P<0.05).ConclusionRTE cells have natural immune function.The Dectin-1 involves in the recognition of heat-treated Candida glabrata,activating secretion of IL-6 and TNF-α and mediating inflammatory reaction.IL-6 plays a negative regulation role.
heat-treated candida glabrata;Dectin-1 receptor;rat tracheal epithelial cells;tumor necrosis factor-α;interleukins-6
10.3969/j.issn.1671-8348.2016.07.001
广西医疗卫生重点科研课题(重2012007);广西自然科学基金资助项目(2013GXNSFAA019209)。作者简介:张雪(1987-),住院医师,硕士,主要从事重症感染方面的研究。△
,E-mail:xueping-l@sohu.com。
R519
A
1671-8348(2016)07-0865-04
2015-09-14
2015-11-26)
