野生蒜头果丛枝菌根真菌和深色有隔内生真菌调查研究
2016-09-18卯吉华贾代顺景跃波陈福李荣波耿云芬
卯吉华,贾代顺*,景跃波,陈福,李荣波,耿云芬
(1.云南省林业科学院油茶研究所,云南广南663300;2.云南省林业科学院,昆明650201)
野生蒜头果丛枝菌根真菌和深色有隔内生真菌调查研究
卯吉华1,贾代顺1*,景跃波2,陈福1,李荣波2,耿云芬2
(1.云南省林业科学院油茶研究所,云南广南663300;2.云南省林业科学院,昆明650201)
为探明我国特有濒危野生植物资源蒜头果根系中丛枝菌根真菌(AMF)和深色有隔内生菌(DSE)的定殖状况,对蒜头果的天然分布中心—云南省广南县4个蒜头果主要分布点的AMF及DSE自然定殖情况进行调查研究。结果表明:蒜头果根系能被AMF及DSE双重定殖,并形成良好的共生关系,且DSE的平均定殖率(52.69%)高于AMF平均定殖率(46.96%)。其AMF和DSE的自然定殖率因立地条件而异,在4个分布点中,以旧莫乡汤盆村AMF自然定殖率最高,达70.75%,以懂堡乡三仙洞村DSE定殖率最高,达76.58%。
丛枝菌根真菌;深色有隔内生菌;野生蒜头果
蒜头果(MalaniaoleiferaChun et SK Lee),为铁青树科(Olacaceae)蒜头果属高大乔木,又称山桐果(广南)、马兰后(壮语),是我国特有的单种属重点保护珍希濒危植物[1-2]。野生蒜头果资源仅分布于云南东南部(广南、富宁)及广西西部(大新、田林、乐业、巴马)的狭长区域[3-4]。广南是该物种的野生天然分布中心,现保存的野生蒜头果资源有85%分布于广南县境内。蒜头果种含油率达60%以上,其种仁油脂中的脂肪酸是提起神经酸以及人工合成名贵的麝香所需的理想植物资源[5],因此其潜在的开发价值较高。
丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF)是植物根系与根际土壤中的丛枝菌根真菌形成的共生体,是土壤生态系统中最普遍、最重要的一类共生关系[6]。90%以上的陆生高等植物,如粮食作物、果树、蔬菜、花卉等都具有丛枝菌根[7]。AMF真菌在土壤中形成许多菌丝网络,增加植物根系的吸收面积,从而促进寄主植物对水分和营养物质的吸收;增强植物对逆境如冷、热、旱、碱、重金属污染等的耐受能力;改善植物根际的微生态条件。深色有隔内生真菌(Dark Septate Endophytes, DSE)泛指一群定居于健康植物根的表皮、皮层甚至维管束组织的细胞内或细胞间隙的一类小型共生真菌,这种小型真菌为棕色或深棕色,菌丝较粗,有明显隔膜,能够在植物细胞内形成微菌核[8]。DSE从植物根部延伸出的粘质菌丝可帮助植物在干旱环境中维持水分和营养的运输。DSE通过改善寄主植物的营养状况,从而增强植物在胁迫生境中的抗旱、抗病、抗寒、耐重金属污染的能力[9]。自20世纪70年代以来,已有不少蒜头果的研究报道,但所见报道对它濒危机制、生态保护、育苗技术、病害防治和开发利用等方面的研究居多[10],然而,有关蒜头果AMF和DSE方面的研究尚未开展过。本研究针对国内外在蒜头果AMF和DSE研究方面的空白,选择蒜头果的主要生态分布中心广南县的4个野生分布点,调查自然条件下,野生蒜头果根系中AMF和DSE的定殖状况,了解不同立地条件以及不同树龄的蒜头果对AMF和DSE定殖率的影响,为AMF和DSE生物技术在蒜头果培育中的应用研究奠定基础。
1 材料与方法
1.1样品采集与处理
采样地点为蒜头果的野生分布中心—广南县,2013年6月在广南县野生蒜头果分布较多的4个点(懂堡乡三仙洞村、旧莫乡汤盆村、旧莫乡花掌村、莲城镇幕咪村),每个点随机选择5株生长良好的植株,去掉表层土5cm,在距主干10~30cm的范围,采集附带根际土壤的根样,用自封袋封好,贴上标签,带回实验室,存放在4℃冰箱内,尽快对根样进行测定。
1.2AMF真菌和DSE定殖状况观察与测定
将所采集的根样在碱解离—酸性品红染色法的基础上,稍做调整(用英雄纯蓝墨水203染色)进行制片[6]。具体操作是:将采集的蒜头果根系用清水冲洗2~3次,去掉根系表面附着的土壤颗粒,剪成1cm左右的根段,然后放入试管中,加入10%的氢氧化钠约10 mL(以淹没根段为宜),置于90℃的水浴锅中煮1.5h,然后倒出氢氧化钾,再用蒸馏水漂洗数次根样,再加入10mL乳酸浸泡约5~10min,然后用蒸馏水清洗数次后即可加入英雄牌纯蓝墨水,置于酒精灯上染色2~3min,再用蒸馏水清洗数次后用乳酸甘油进行脱色,最后选50个细小根段,按照McGonigle 等的十字交叉法[6],于光学显微镜(OLYMPUS- BH 2)下观察各根样中AMF真菌(菌丝、泡囊、丛枝、菌丝圈)及DSE(深色有隔内生菌、微菌核)的定殖情况。典型的标本于显微镜(Nikon 80i, Japan)下拍照保存图片。
定殖率(%)=被定殖根段数/镜检总根段数×100%
1.3数据分析
采用DPS统计软件和Microsoft Excel 2007进行数据分析。
2 结果与分析
2.14个野生蒜头果分布点蒜头果生长概况
4个野生蒜头果分布点是目前广南县蒜头果产量较高的地方,但都受到不同程度的人为破坏,尤其是旧莫乡花掌村和莲城镇幕咪村人为破坏及其严重,经初步调查30%以上的大树树干和枝桠被人为乱砍过;立地类型为喀斯特岩溶类型和土山地类型;地理范围23°89′~24°36′ N,104°73′~105°26′ E;海拔范围1240~1360m;主要伴生植物有:麻栎、云南松、滇青冈、滇油杉、清香木等;树势除旧莫乡花掌村生长中等外,其它3个点的生长旺盛;树高10~17m;胸径18~52cm;树龄20~55a。

表1 4个野生蒜头果分布区采样点概况
2.24个野生蒜头果分布点AMF定殖状况
由表2可知,从懂堡乡三仙洞村、旧莫乡花掌村、旧莫乡汤盆村、莲城镇幕咪村4个野生蒜头果分布点植株根系中都检测到AMF的定殖,4个分布点AMF的平均总定殖率达46.96%,蒜头果根系中AMF的总定殖率最高的是旧莫乡汤盆村(70.75%),其次是莲城镇幕咪村,AMF总定殖率最低的是懂堡乡三仙洞村(30.41%),AMF总定殖率除懂堡乡三仙洞村和旧莫乡花掌村差异不显著外,其它两两之间的差异均达到极显著水平。在4个野生蒜头果分布点的根系中都观察到AMF的典型结构,即菌丝、泡囊、丛枝和菌丝圈,其中菌丝的平均定殖率最高(38.75%),其次是丛枝定殖率,而菌丝圈的平均定殖率最低(10.84%);方差分析结果表明,泡囊定殖率在4个蒜头果分布点之间存在极显著的差异,而菌丝、菌丝圈和丛枝定殖率除在懂堡乡三仙洞村和旧莫乡花掌村之间差异不显著外,其它不同分布点两两之间存在极显著的差异。
本研究发现,在4个野生蒜头果分布点的蒜头果植株根系中均有AMF定殖,说明AMF真菌能与蒜头果形成良好的共生关系,蒜头果是一个典型的丛枝菌根营养型树种。在4个不同的野生蒜头果分布点之间,尽管都是天然的野生蒜头果,但是立地条件、海拔、气候、土壤、寄主植物种类等方面的差异,都影响着AMF在植物根系中的定殖程度,因此,导致4个分布点蒜头果根系中的AMF定殖率各不相同。另外,值得注意的是随着蒜头果树龄的增长,AMF定殖率有下降趋势,45年和55年生蒜头果根系AMF定殖率普遍很低,而20年和30年生蒜头果根系AMF定殖率较高。这一结果与李素美等在苹果树根系的研究结果一致,苹果的AMF定殖率随着树龄的增大而下降[11]。一方面大龄树生长势逐渐下降,新根的更新较慢,而AMF对新生根的侵染率较强,另一方面,随着树龄的不断增长,根系皮层细胞的木质化程度不断加大,从而不利于AMF的定殖。因此,对于老树,应加强土壤深翻、施农家肥等措施,提高土壤的通透性,从而促进AMF的生长发育,以提高植株生产力。

表2 4个野生蒜头果分布区根系中丛枝菌根真菌的定殖状况(%)
注:表中数据为平均值±标准差,每一列后面不同的小写字母表示不同分布区该平均值的多重比较在0.05的水平上有显著差异,不同的大写字母表示不同分布区该平均值的多重比较在0.01的水平上有极显著差异。
2.34个野生蒜头果分布点DSE定殖状况
中懂堡乡三仙洞村DSE的定殖率最高,达76.58%,其次是旧莫乡花掌村,定殖率为58.97%,DSE定殖率最低的是旧莫乡汤盆村,为29.51%,且4个分布点的总定殖率两两之间的差异达到显著水平。通常,深色有隔菌丝和微菌核被认为是DSE在植物根内的两种典型结构[8],本研究在蒜头果的全部根系样品中都检测到DSE的典型结构,即深色有隔菌丝和微菌核。深色有隔菌丝分布于蒜头果根的皮层,颜色为深棕色至浅棕色,且随着菌丝的延伸,颜色逐渐变浅,菌丝壁较厚,具明显的横隔。 微菌核为“脑状”,由细胞壁加厚的膨大细胞紧密堆积形成,颜色多为深棕色,形状大小不一,分布于细胞表皮,偶见与其相连的菌丝。在4个分布点均表现出深色有隔菌丝的定殖数较微菌核的定殖数多,深色有隔菌丝的平均定殖率达42.99%,而微菌核的平均定殖率仅为12.16%。4个野生蒜头果根系中深色有隔菌丝和微菌核的定殖率从高到低依次是懂堡乡三仙洞村、旧莫乡花掌村、莲城镇幕咪村、旧莫乡汤盆村,深色有隔菌丝定殖率在4个分布点的两两之间的差异达到显著水平,微菌核定殖率在懂堡乡三仙洞村与旧莫乡花掌村和旧莫乡汤盆村与莲城镇幕咪村之间的差异不显著。
本研究发现,4个野生蒜头果分布点的蒜头果植株根系中均有DSE定殖,且定殖率高,说明蒜头果能与DSE形成良好的共生关系。DSE在懂堡乡三仙洞村喀斯特岩溶石山的定殖率极显著高于其它3个土山地类,在胁迫生态环境(干旱、寒冷、重金属污染)中DSE常常产生大量的深色有隔菌丝和微菌核,对宿主植物忍受干旱、寒冷和重金属污染具有重要的作用,因此,通常DSE在干旱、寒冷和重金属污染严重的生境中定殖率较高[12]。 而本研究的4个野生蒜头果分布点中,懂堡乡三仙洞村的蒜头果生长于喀斯特岩溶石山的阳坡,长期生长于这种极端干旱的环境中,需要产生大量的菌丝和微菌核,扩大根系的吸收面积,从而促进蒜头果能够吸收更多的矿质营养和水分,以满足自身生长发育对水分和养分的需求。
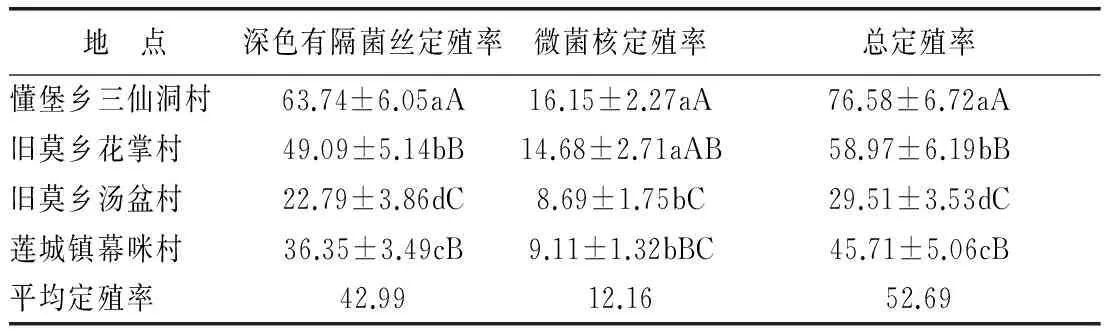
表3 4个野生蒜头果分布区根系中深色有隔内生菌的定殖状况(%)
注:表中数据为平均值±标准差,每一列后面不同的小写字母表示不同分布区该平均值的多重比较在0.05的水平上有显著差异,不同的大写字母表示不同分布区该平均值的多重比较在0.01的水平上有极显著差异。
3 结论与讨论
3.1本研究首次探讨了野生蒜头果AMF和DSE的定殖状况,结果表明,AMF和DSE往往同时存在于蒜头果根系的同一根段,AMF和DSE普遍双重定殖于蒜头果根系,在蒜头果根内或根与根之间形成紧密的菌丝网络,共同作用于蒜头果,为蒜头果进行水分、矿质养分和其他代谢物的输送与传递,AMF和DSE的双重定殖可能是蒜头果适应亚热带干旱山地和喀斯特岩溶石山环境的有效途径。
3.2在野生蒜头果根系中DSE的总定殖率高于AMF总定殖率,但在不同的分布点AMF和DSE的定殖率各不相同,在AMF定殖率较高的旧莫乡汤盆村和莲城镇幕咪村根系中DSE的定殖率较低,而在DSE的定殖率较高的懂堡乡三仙洞村和旧莫乡花掌村根系中AMF的定殖率较低。这可能与不同分布点蒜头果生长状况有关,或与DSE在一些干旱生境的植物根系中有较高的定居率有关。
3.3AMF和DSE是野生蒜头果根系上普遍存在的现象,且自然定居率较高,这表明蒜头果能与AMF和DSE形成良好的共生关系,AMF和DSE是蒜头果根系的一个重要组成部分,这为蒜头果菌根化苗木的培育提供了可能。在不同的野生蒜头果分布点,蒜头果的AMF和DSE定殖率差异显著,表明蒜头果的AMF和DSE定殖率受生态环境的影响大。因此,在今后蒜头果菌根化苗的培育过程中,应针对不同的栽培区,摸索出最适宜蒜头果深色有隔内生真菌和从枝菌根发育的环境条件,培育优质的蒜头果菌根苗木。另外可充分利用DSE与植物病原菌的拮抗关系,在蒜头果苗期接种土著的DSE菌种,为蒜头果苗期严重的根腐病提供具有生防价值的工程菌,从而增强蒜头果的抗病性,减少农药、化肥的施用量,在植被恢复、保护生态环境以及对促进蒜头果产业的健康发展方面具有非常重要的意义。
3.4本研究只针对野生环境中蒜头果的AMF和DSE定殖状况进行了初步研究,这只迈出蒜头果丛枝菌根和深色有隔内生真菌研究工作的第一步,今后还需要对野生蒜头果的AMF和DSE真菌孢子进行湿筛分离,筛选出蒜头果土著的高效、优质菌种,开展蒜头果接种试验研究,将分离得到的优质土著菌种接种于蒜头果苗木中。而有关AMF和DSE在胁迫环境中对蒜头果的双重作用机理也有待进一步研究。另外,蒜头果是我国特有珍稀濒危植物,目前野生蒜头果资源退化极其严重,因此对野生蒜头果AMF和DSE资源进行研究和利用,保藏一些稀有菌种,对于丰富我国菌种资源及其菌种的合理开发利用具有重要意义。
[1]李树刚.油料植物一新属—蒜头果属[J].东北林学院植物研究室汇刊,1980,1(6):67-72.
[2]李树刚.广西现代植物分类学研究的发展[J].广西植物,1995,15(3):256-267.
[3]国家环境保护局.珍稀濒危植物保护与研究[M].北京:中国环境科学出版社,1991.
[4]傅立国.中国植物红皮书[M].北京:科学出版社,1991.
[5]李用华,朱亮锋,欧乞缄,等.蒜头果油合成麝香酮简报[J].云南植物研究,1983,5(3):238.
[6]卯吉华,宁德鲁,李荣波,等.云南不同栽培区油橄榄的丛枝菌根研究[J].西部林业科学,2015,44(1):114-120.
[7]郭绍霞,孟祥霞,张玉刚,等.牡丹AMF菌根菌自然侵染率的调查[J].中国农学通报,2003,19(3):77-78,83.
[8]刘茂军,张兴涛,赵之伟.深色有隔内生真菌(DSE研究进展[J].菌物学报,2009, 28(6): 888-894.
[9]张玉洁,植物深色有隔内生真菌(DSO)的研究进展[J].文山学院学报,2010,23(1):145-150.
[10]吴彦琼.蒜头果保护的初步研究[D].南宁:广西大学,2002.
[11]李素美,洪滨,维华,等.山东东部果树种植园丛枝菌根发育状况[J].青岛农业大学学报,2013,30(4):235-239.
[12]徐浩博,贺学礼,许伟,等.蒙古沙冬青根围丛枝菌根和深色有隔内生真菌的空间分布[J].贵州农业科学,2013,41(12):105-109.
Survey Study of Wild Malania oleifera AMF and DSE
Mao Jihua1,Jia Daishun1,Jing Yuebo2,Chen Fu1,Li Rongbo2,Geng Yunfen2
(1. Camellia Research Institute of Yunnan Academy of Forestry, Guangnan,Yunnan 663300;2. Yunnan Academy of Forestry, Kunming 650201)
In order to explore the colonization of arbuscular mycorrhizal fungi (AMF) and dark septate endophyte (DSE) in root system ofMalaniaoleifera, a kind of rare and endangered wild plant species endemic to China, root samples of natural growing tree were collected from four sites of Guangnan county of Yunnan province and studied using microscopic method. The results showed that the roots ofMalaniaoleiferawere colonized by both AMF and DSE. The colonization percentages of AMF and DSE were 46.96 % and 52.69% respectively. The colonization percentage of AMF and DSE varied with sample collecting site. Among the four sites, the AMF colonization percentage ofMalaniaoleiferaroots collected from Tangpen village of Jiumo township was 70.75%, which was the highest among the four sites. The DSE colonization percentage of roots collected from Sanxiandong village of Dongbao township was 76.58%, which was the highest among all the four sites.
Arbuscular mycorrhizal fungi; Dark septate fungi;Malaniaoleifera
2016-04-20
国家林业局引进国际先进林业科学技术项目(2014-4-23)和油茶、蒜头果的基因技术快速良种选育、高效栽培技术攻关与运用示范项目(2015IC056)共同资助
卯吉华(1984-),女,研究实习员,主要从事经济林木丛枝菌根研究,E-mail:1244587886@qq.com;*通讯作者:贾代顺(1974-),男,工程师,主要从经济林良种繁育及高效栽培的研究。
S718.81
A
DOI.:10.13268/j.cnki.fbsic.2016.05.001
