上皮细胞粘附分子在肝动脉化疗栓塞治疗肝癌中的表达改变及其功能
2016-09-16白文林常秀娟李因茵荣光华
楼 敏,白文林,常秀娟,刘 泽,李因茵,荣光华,曾 珍
上皮细胞粘附分子在肝动脉化疗栓塞治疗肝癌中的表达改变及其功能
楼 敏,白文林,常秀娟,刘 泽,李因茵,荣光华,曾 珍
目的 明确肝动脉化疗栓塞(transcatheter hepatic arterial chemoembolization, TACE)治疗对肝细胞癌(hepatocellular carcinoma, HCC)肿瘤组织中肿瘤干细胞指示分子——上皮细胞粘附分子(epithelial cell adhesion molecule, EpCAM)表达及肝癌干细胞生物学行为的影响。方法 用实时PCR分别检测30例经TACE治疗和30例未经TACE治疗的HCC患者肿瘤组织中EpCAM的表达水平。在此基础上,用EpCAM的siRNA载体,在HCC细胞系HepG2和高侵袭性的MHCC-97H中检测EpCAM对抗肿瘤药物作用的影响;在MHCC-97H细胞系中,检测降低EpCAM表达对MHCC-97H侵袭作用的影响。结果 接受TACE治疗的HCC患者肿瘤组织中的EpCAM表达水平升高(P<0.05)。与对照组相比,在HepG2细胞中转染EpCAM的siRNA能够显著上调HepG2细胞对分子靶向抗肿瘤药物索拉非尼以及细胞毒性化疗药物奥沙利铂和表柔比星的敏感性。在MHCC-97H中转染EpCAM的siRNA能够显著抑制其侵袭作用。结论 TACE治疗可引起HCC组织中EpCAM的表达水平明显升高;降低HCC细胞中EpCAM表达水平,可导致HCC细胞的肿瘤干细胞特征如侵袭性显著下降,对抗肿瘤药物的敏感性升高。
肝细胞癌;EpCAM;TACE治疗;肿瘤干细胞
肝细胞癌(hepatocellular carcinoma, HCC)是人类常见的恶性肿瘤之一,列世界肿瘤相关死亡第三位[1-3]。在我国,大部分HCC患者初诊即为进展期,失去肝移植及外科手术等根治性治疗的机会[2-4],由于HCC对传统的放疗和化疗均不敏感,惟一的分子靶向药物索拉非尼(sorafenib)临床总有效率不足30%[5-6],使得目前进展期HCC的临床综合治疗总体疗效不佳,患者整体中位生存期仅有3~6个月[6]。肝动脉化疗栓塞(transcatheter hepatic arterial chemoembolization, TACE)是目前进展期肝癌患者中最常用的姑息性治疗方法,能够明显抑制肿瘤生长,延缓疾病进展,并显著降低患者肿瘤负荷,部分患者经TACE治疗后可实现肿瘤负荷“降阶梯”并最终能够接受根治性治疗。但已有不少研究报道[7],尽管TACE治疗有可能杀死部分肿瘤细胞以降低患者的肿瘤负荷,但另一方面有可能改变残存肿瘤组织的生物学性状,发挥类似于“克隆筛选”的作用,使肿瘤病灶中对治疗等胁迫因素耐受的肿瘤干细胞(cancer stem cell, CSC)亚群相对富集[8-9],进而诱导其对后续治疗的耐受,并且与根治性治疗(手术切除或肝移植)后肿瘤复发和转移等不良事件明显相关,但其相关分子机制尚不完全清楚。
1 对象与方法
1.1 对象 本研究共纳入了2010年1月—2014年9月间在解放军第三○二医院经TACE“降阶梯”治疗后接受根治性治疗的30例HCC患者(26例行肝癌切除术、4例行肝移植术),同时选择30例未接受TACE,直接接受肝癌切除术或肝移植术的患者作为对照组。所有患者诊断均符合原卫生部2011版《原发性肝癌诊疗规范》相关规定[2-3],本研究获本院伦理委员会批准,患者或家属均签署知情同意书。2组临床基线资料均衡,具有可比性(表1)。

表1 2组的临床基线资料Table 1 The baseline of 2 group patients
1.2 药品和试剂化疗药物 索拉非尼购自大连美仑生物技术有限公司;奥沙利铂(oxaliplatin)和表柔比星(epirubicin)购自美国Sigma公司;胰蛋白酶、DMEM培养基和胎牛血清(FBS)等购自美国Gibco公司;MTT检测试剂盒及DMSO等购自美国Ameresco公司;EpCAM的siRNA表达载体及相应空载体(Control)购自美国Santa Cruz公司;Lipofectamine 2000转染试剂购自Invitrogen公司;RNA提取(PARISTM Kit)和实时-PCR试剂盒等购自美国Applied Biosystems公司;蛋白印迹实验(Western blot)检测试剂盒(包括蛋白Marker、SDS-蛋白电泳Loading Buffer以及PVDF膜等)购自美国Bio-Rad公司;蛋白印迹实验所用抗体购自Santa Cruz公司;化学发光试剂盒(北京,Qiangen公司);细胞培养瓶、Trans-well用小室/24孔培养板以及96空细胞培养板等购自美国Corning公司;ECM购自美国Sigma公司。
1.3 主要设备 多功能酶标仪(Wallac公司);TS-100倒置相差显微镜购自日本Nikon公司;荧光实时定量PCR仪(Applied Biosystems 7500 Detection system)购自美国Applied Biosystems公司。
1.4 TACE方法 TACE操作采取经典改良式Seldinger行股动脉穿刺,在数字减影血管造影引导下行肠系膜上动脉和腹腔动脉及肝动脉造影,发现肿瘤及肿瘤滋养血管后,用SP微导管插入肿瘤供血动脉,注入表柔比星60 mg,氟尿嘧啶1000 mg,并对病灶供血动脉行碘油/明胶海绵栓塞。
1.5 实时PCR方法 肝切除术中留取新鲜肿瘤组织和相应癌旁组织,提取RNA,利用real-time qRT-PCR[12]方法比较2组肿瘤组织中EpCAM的相对表达量。所用引物[13]由北京赛百盛基因技术有限公司合成:EpCAM(NM_002354.1)的上游引物为5'-TGCTGTTATTGTGGTTGTGGTG-3',下游引物为5'-TACTTTGCCATTCTCTTCTTTCT-3';内参GAPDH(NM_002046.4)的上游引物为5'-AGAAGGCTGGGGCTCATTTG-3',下游引物为5'-AGGGGCCATCCACAGTCTTC-3'。
1.6 细胞培养和转染实验 ①细胞培养。HCC细胞株HepG2和高侵袭性HCC细胞株MHCC-97H均由本实验室保存,添加10% FBS于DMEM高糖培养液中,置37℃,5% CO2孵箱中培养。②转染实验。先分别将0.5 μl的Lipofectamine 2000转染试剂和200 ng质粒(由0.5 μl无血清无抗生素的RPMI-1640培养基溶解与稀释)加入到2管(含24.5 μl无血清无抗生素培养基)中,混匀,室温静置15 min后,将2管液体等比例混合,混匀后室温静置15 min。
1.7 蛋白免疫印迹实验 基本按照文献的方法进行[12],抗体稀释条件:兔抗人EpCAM单抗(1∶2000稀释),兔抗人GAPDH多抗(1∶5000稀释),HRP-羊抗兔单克隆抗体(1∶5000稀释)。
1.8 细胞抑制率实验 将HepG2或MHCC-97H细胞接种于24孔板中,待细胞密度达到80%~90%后换新鲜培养基(每孔1 ml);配置系列浓度梯度的药物工作液(表2),按照1∶1000比例加入24孔板中(每孔加入1 μl工作液),使药物达到相应终浓度(表3);药物处理细胞48 h后,每孔加入100 μl MTT试剂,继续孵育4 h后,使用10%SDS或DMSO溶解,使用多功能酶标仪在490 nm 波长处测定吸光度(A490 nm),并计算细胞增殖抑制率。抑制率(%)=(对照组A490 nm-药物处理组A490 nm)/(对照组A490 nm-溶剂对照组A490 nm)× 100%。

表2 抗肿瘤药物的工作液浓度Table 2 The working fluid concentration of anti-tumor agents
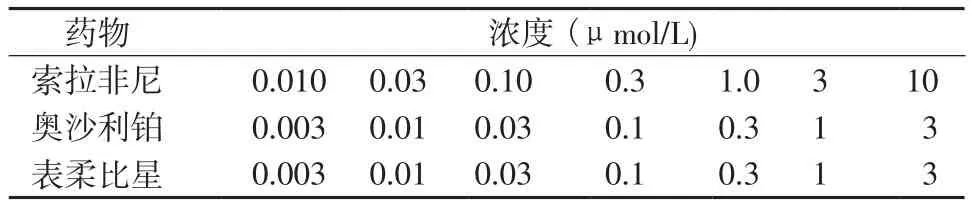
表3 抗肿瘤药物的最终浓度Table 3 The final concentration of anti-tumor agents
1.9 Trans-well实验 参照Chen等[14]的方法进行实验。使用无血清DMEM培养基按1∶5比例稀释ECM胶后,预铺Trans-well小室(每孔40 μl),37 ℃孵育4 h;将转染相应表达载体的MHCC-97H细胞消化并使用无血清RPMI-1640培养基重悬至5×105细胞/ml后,每孔0.2 ml加入Trans-well小室中。24孔细胞培养板中加入含有20% FBS的DMSO培养基,将小室放入24孔板;37°C孵育4~6 h后使用结晶紫染色,每孔5个视野使用倒置显微镜拍照,使用冰醋酸洗脱后检测吸光度值(A546 nm)。相对侵袭细胞数= 实验组A546 nm / 对照组A546 nm。在图2中标明标尺。
1.10 统计学处理 使用Origin 8.0软件计算药物作用的IC50值。用CHISS 2004进行统计分析。计量资料呈正态分布或近似正态分布,用±s差表示,2组间比较用成组t检验(组间方差齐);2组计数资料比较用四格表χ2检验或校正χ2检验;结果变量为有序变量的列联表频数比较用秩和检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 EpCAM表达与TACE治疗的关系 EpCAM 在HCC组织中的表达量均明显高于相应癌旁组织(t=10.732,P=0.013)。TACE治疗不改变癌旁组织中EpCAM的表达水平(t=0.522,P=0.647)。TACE治疗组HCC组织中EpCAM的表达水平显著高于非TACE治疗组HCC组织中的EpCAM表达(t=37.475,P=0.001)。见图1。

图1 EpCAM在HCC临床标本中的表达Figure 1 The expression of EpCAM in HCC clinical specimens
2.2 转染EpCAM siRNA的HepG2细胞对3种抗肿瘤药物的敏感性 与对照组相比,在HepG2细胞中转染EpCAM的siRNA能够显著上调HepG2细胞对索拉非尼、奥沙利铂和表柔比星的敏感性(P均<0.05),其IC50值显著下调(P均<0.05)。见表4。
表4 转染EpCAM siRNA的HepG2细胞对3种抗肿瘤药物的IC50(±s,μmol/L)Table 4 Transfection of EpCAM siRNA enhances the sensitivity of HepG2 cells to sorafenib, oxaliplatin or epirubicin

表4 转染EpCAM siRNA的HepG2细胞对3种抗肿瘤药物的IC50(±s,μmol/L)Table 4 Transfection of EpCAM siRNA enhances the sensitivity of HepG2 cells to sorafenib, oxaliplatin or epirubicin
组别 n 索拉菲尼 奥沙利铂 表柔比星对照组 30 1.12±0.25 0.41±0.13 0.85±0.25转染组 30 0.26±0.07 0.10±0.03 0.22±0.05 t值 18.144 12.727 13.535 P值 0.000 0.000 0.000
2.3 转染EpCAM siRNA对MHCC-97H细胞侵袭作用的影响 高侵袭性的HCC细胞MHCC-97H具有明显的侵袭作用,对照和空白对照MHCC-97H细胞的侵袭作用无差别。与对照相比,在MHCC-97H细胞中转染EpCAM的siRNA载体能够抑制MHCC-97H的侵袭作用。见图2。

图2 EpCAM siRNA能够下调MHCC-97H细胞的侵袭作用Figure 2 Transfection of EpCAM siRNA inhibits the invasion of MHCC-97H cells
3 讨 论
HCC严重危害人类健康,其具有的多药耐受性(multi-drug resistance, MDR)特性使其对传统细胞毒性化疗药物均不敏感,而目前惟一的一线治疗药物索拉非尼,其临床获益也并不确定[1-3]。TACE等姑息性治疗虽能够在短期内显著抑制肿瘤生长并改善病人肿瘤负荷,但也存在后续治疗耐受以及根治性治疗(手术切除或肝移植)后肿瘤复发和转移等不良事件。因此探究相关分子机制,寻找新的治疗靶标具有重要的意义。由于MAPK相关信号通路在HCC中的突变极少[15],包括HGF/MET等信号通路的代偿性活化[16],PXR/CAR/LXR等药物代谢相关核受体[17],以及Notch-1等细胞存活相关信号通路[18]以及miR-153[14]、PTEN[14]和miR-34a[19]等药物敏感型指示分子可能与MDR相关,但目前上述研究仍属初步,也没有明确的治疗靶标和临床干预策略。最近的研究显示,包括上皮细胞间质转型和CSC等可能是HCC MDR新的作用机制。实体肿瘤具有异质特性,其中可能存在一定比例的细胞群,具有分化程度极低、相对静止、代谢缓慢和对胁迫因素耐受等特性,上述特性和干细胞类似,因此研究者提出了CSC概念[20]。CSC被认为是肿瘤治疗耐受、侵袭和复发的关键因素[20-21],可能通过逃逸抗肿瘤药物的杀伤作用在化疗过程中存活。另一方面,抗肿瘤药物也有可能作为一种选择和胁迫因素,改变实体肿瘤的生物学特性,使部分普通肿瘤细胞也相应具有干细胞特征。目前,相关研究集中在肿瘤干细胞指示分子的识别与鉴定,包括ABCG5、ALDH1、CD24 (HSA)、CD44、CD90(THY1)、CD133(Prominin 1)、EpCAM和Hoechst SP等被证实和肿瘤干细胞相关[8-9, 20-21],但其在肿瘤干细胞生物学行为调控中的作用及上述因子表达阳性的普通肿瘤细胞是否具有CSC特性仍须进一步研究。本研究的结果显示,EpCAM高表达能够使肿瘤细胞具有干细胞特征,利用siRNA下调EpCAM的表达,能够上调抗肿瘤药物对HepG2细胞的杀伤作用并显著抑制MHCC-97H的侵袭。这表明,EpCAM不仅是HCC实体肿瘤中CSC亚群的标识物[10],也参与调控HCC细胞的侵袭等生物学行为,是HCC治疗的潜在靶标。
我们的前期结果也表明[11],TACE可能作为一种选择因素,能够通过杀伤普通肿瘤细胞改变HCC实体肿瘤中CSC亚群的比例,在短期缓解症状的同时诱发后续不良事件。TACE能够破坏实体肿瘤组织及其微血管,有可能诱导肿瘤组织内部的缺氧,CSC可在此影响的胁迫下最终部分迁移进入循环系统,这可能是HCC患者肝移植后复发的危险因素。基于这一原因,本研究利用临床HCC标本,在接受TACE治疗及对照组中检测EpCAM的表达水平,明确发现接受TACE治疗的患者组织中CSC的比例显著高于对照组,而癌旁组织中EpCAM的表达无明显差异的数据。但必须指出,尽管已有大量研究证实缺氧损伤等胁迫因素可能诱导CSC的产生[8-9, 20-21],但在肝癌中CSC的成因和其离开肿瘤发生远处转移尚无明确机制,仍须后续深入探讨。
[1] Bruix J, Sherman M. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5):1208-1236.
[2] Wang C, Wang H, Yang W, et al. A multicenter randomized controlled trial of percutaneous cryoablation versus radiofrequency ablation in hepatocellular carcinoma[J]. Hepatology, 2015,61(5):1579-1590.
[3] 周霖,曾珍,石峰,等. 氩氦刀冷冻消融治疗乙型肝炎病毒相关性肝细胞癌前后PD-1的变化及其与预后的关系[J].解放军医学杂志,2011,36(10):1031-1036.
[4] Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol. 2009, 10(1):25-34.
[5] Abou-Alfa GK, Schwartz L, Ricci S, et al. Phase Ⅱ study of sorafenib in patients with advanced hepatocellular carcinoma[J]. J ClinOncol, 2006, 24(26):4293-4300.
[6] Yang Y, Lu Y, Wang C, et al. Cryotherapy is associated with improved clinical outcomes of sorafenib therapy for advanced hepatocellular carcinoma[J]. Cell Biochem Biophys, 2012,63(2):159-169.
[7] Zen C, Zen Y, Mitry RR, et al. Mixed phenotype hepatocellular carcinoma after transarterial chemoembolization and liver transplantation[J]. Liver Transpl, 2011, 17(8):943-954.
[8] Zeuner A, De Maria R. Not so lonely at the top for cancer stem cells [J]. Cell Stem Cell, 2011, 9(4):289-290.
[9] Visvader JE, Lindeman GJ. Cancer stem cells in solid tumours: accumulating evidence and unresolved questions[J]. Nat Rev Cancer, 2008, 8(10):755-768.
[10] Yamashita T, Forgues M, Wang W, et al. EpCAM and alphafetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma[J]. Cancer Res, 2008, 68(5):1451-1461.
[11] Zeng Z, Ren J, O'Neil M, et al. Impact of stem cell marker expression on recurrence of TACE-treated hepatocellular carcinoma post liver transplantation[J]. BMC Cancer, 2012,12:584.
[12] Kang J, Kim E, Kim W, et al. Rhamnetin and cirsiliol induce radiosensitization and inhibition of epithelial-mesenchymal transition (EMT) by miR-34a-mediated suppression of Notch-1 expression in non-small cell lung cancer cell lines[J]. J Biol Chem, 2013, 288(38):27343-27357.
[13] Yu WZ, Chen XM, Niu WB, et al. Role of Wnt5a in the differentiation of human embryonic stem cells into endometriumlike cells[J]. Int J Clin Exp Pathol, 2015, 8(5):5478-5484.
[14] Chen Y, Feng F, Gao X, et al. MiRNA153 Reduces effects of chemotherapeutic agents or small molecular kinase inhibitor in HCC cells[J]. Curr Cancer Drug Targets, 2015, 15(3):176-187.
[15] Calvisi DF, Ladu S, Gorden A, et al. Mechanistic and prognostic significance of aberrant methylation in the molecular pathogenesis of human hepatocellular carcinoma[J]. J Clin Invest, 2007,117(9):2713-2722.
[16] Carr BI, Wang Z, Wang M, et al. c-Met-Akt pathway-mediated enhancement of inhibitory c-Raf phosphorylation is involved in vitamin K1 and sorafenib synergy on HCC growth inhibition[J]. Cancer Biol Ther, 2011, 12(6):531-538.
[17] Staudinger JL, Goodwin B, Jones SA, et al. The nuclear receptor PXR is a lithocholic acid sensor that protects against liver toxicity [J]. Proc Natl Acad Sci USA, 2001, 98(6):3369-3374.
[18] Yang F, Li QJ, Gong ZB, et al. MicroRNA-34a targets Bcl-2 and sensitizes human hepatocellular carcinoma cells to sorafenib treatment[J]. Technol Cancer Res Treat, 2014, 13(1):77-86.
[19] Gyöngyösi B, Végh E, Járay B, et al. Pretreatment microRNA level and outcome in sorafenib-treated hepatocellular carcinoma[J]. J Histochem Cytochem, 2014, 62(8):547-555.
[20] Clevers H. The cancer stem cell: premises, promises and challenges [J]. Nat Med, 2011,17(3):313-319.
[21] Beck B, Blanpain C. Unravelling cancer stem cell potential[J]. Nat Rev Cancer, 2013, 13(10):727-738.
(2016-05-12收稿 2016-07-16修回)
(责任编委 王永怡 本文编辑 卢福昱)
The influence and alteration of EpCAM expression in TACE treated hepatocellular carcinoma
LOU Min, BAI Wen-Lin, CHANG Xiu-juan, LIU Ze, LI YIN-yin, RONG Guang-hua, ZENG Zhen*Center for Therapeutic Research of Hepatocarcinoma, 302 Military Hospital of China, Beijing 100039, China *Corresponding author, E-mail: zengzhen1970@sina.com
Objective To determine whether transcatheter arterial chemoembolization (TACE) treatment modulates (cancer stem cell, CSC) marker expression and the detailed function of EpCAM in HCC cells via its siRNA. Methods The expression levels of EpCAM were detected by qPCR in 30 HCC patients with TACE treatment and 30 HCC patients without TACE treatment, respectively. On this basis, we detected the effect to anti-tumor agents action of EpCAM in HCC cell lines HepG2 and high invasive MHCC-97H by siRNA carrier of EpCAM. Next, the siRNA of EpCAM was transfected to determine whether EpCAM modulates HCC cells' in vitro invasion and the sensitivity to anti-tumor agents. Results EpCAM expression levels in tumor tissues of HCC patients treated with TACE were significantly higher (P<0.05).In contrast to the control group, Transfection of EpCAM siRNA enhanced the sensitivity of HepG2 to sorafenib, oxaliplatin and epirubicin. In addition, EpCAM siRNA also disrupted the invasion of MHCC-97H cells. Conclusions TACE can increase EpCAM expression level in HCC significantly; Reduce of EpCAM expression levels in HCC cells can lead to HCC cells of tumor stem cell characteristics such as invasion significantly decreased, and increase sensitivity to chemotherapeutic drugs.
HCC; EpCAM; TACE-treatment; CSC
[中国图书资料分类号] R735.7 A
1007-8134(2016)04-0209-05
10.3969/j.issn.1007-8134.2016.04.004
[基金课题 ] 军队“十二五”面上课题(CWS12J024);国家自然基金面上课题(81372248)
100039 北京,解放军第三〇二医院肝脏肿瘤诊疗与研究中心(楼敏、白文林、常秀娟、刘泽、李因茵、荣光华、曾珍)[通讯作者 ] 曾珍,E-mail: zengzhen1970@sina.com
上皮细胞粘附分子(epithelial cell adhesion molecule, EpCAM)是CSC最经典的指示分子之一,在CSC调控和HCC分期/分型中发挥作用,但其功能和调控机制目前尚不清楚[10]。我们在前期研究中发现,在接受肝移植的HCC患者中,移植前经TACE“降阶梯”治疗的患者较未接受TACE“降阶梯”治疗的患者,肝移植后HCC复发比例显著升高[11]。而对肝移植后HCC复发的患者进行分析,EpCAM表达升高是肿瘤复发的独立危险因素[11]。为此,本研究围绕肝癌CSC指示分子EpCAM,深入研究TACE治疗对HCC肿瘤干细胞生物学行为的影响及其相关分子机制。
