原发性肝细胞癌体部立体定向放疗的疗效及安全性
2016-09-16程书蕙王维虎
程书蕙,王维虎
原发性肝细胞癌体部立体定向放疗的疗效及安全性
程书蕙,王维虎
近年来,随着肿瘤放疗技术进展,原发性肝细胞癌(hepatocellular carcinoma, HCC)的放疗引起越来越多的关注,越来越多的证据也表明其较好的疗效。其中,体部立体定向放疗(stereotactic body radiation therapy, SBRT)对于不适合一线手术或经皮射频消融技术的HCC患者,在提高局部控制率方面发挥了重要作用。SBRT的研究已经开展了很多,也获得了明确的疗效。但关于恰当治疗适应证,合理剂量分割等方面的研究仍有限。本文综述SBRT对于不可手术的HCC患者的有效性、安全性、适应证和剂量分割模式。
癌, 肝细胞;放射疗法;放射生物学;立体定向放射治疗
肝癌在全球恶性肿瘤发病率中位居第五位,病死率位居第三位[1]。其中,约有50%的新发和死亡病例发生在中国[2]。原发性肝细胞癌(hepatocellular carcinoma, HCC)占原发性肝癌的70%~85%,是其主要病理类型[3]。
酒精、病毒性肝炎、自身免疫性肝炎、血吸虫和非酒精性脂肪性肝炎等引起的肝硬化为HCC发生的高危因素。肝硬化患者多伴有肝功能损害,而肝功能损伤的程度直接影响HCC的预后和治疗策略。目前最常用的肝功能评价方法是Child-Pugh(CP)分级。
HCC的预后影响因素除了CP分级外,还有肿瘤的分期和治疗手段。多种分期系统用于HCC[4],其中,巴塞罗那(Barcelona clinic liver cancer, BCLC)分期将HCC分为极早期/早期、中期、进展期和终末期。
1 HCC的标准治疗
早期HCC的治疗手段主要为手术和肝移植。对于无血管侵犯的单发肿瘤、CP A级且无门脉高压的患者,手术可取得较好的疗效,手术的5年生存率约为50%,但术后复发率高达70%。
若肝脏功能及一般状况不能耐受手术,经皮射频消融、局部大剂量放疗也能在部分患者中达到同手术媲美的效果。介入治疗是最常用的非手术治疗手段。Meta分析显示:介入治疗的2年生存率为41% (19%~63%),有效率为35%(16%~61%)。靶向治疗对于中晚期HCC也有一定疗效, Sharp研究和Orintal研究显示,索拉非尼治疗组中位生存时间分别是10.7个月[5]和6.5个月[6]。
多数HCC患者诊断时已为中期或晚期,肿瘤大或弥散、侵犯大血管、长期肝炎或肝硬化导致肝功能差及全身状况差,或肿瘤位置不适合手术,移植肝源匮乏,使85%以上的患者失去接受根治性手术的机会[7]。因此,改善这部分患者的生存成为HCC治疗的重大挑战之一。
2 HCC的常规放疗
HCC α/β≥10(相当于低分化鳞癌),对放疗相对敏感,而且研究证实部分肝脏可以安全地接受较高的放疗剂量[8]。同时,随着计划系统、呼吸门控、三维适形放疗(3-dimensional conformal radiation therapy, 3DCRT)、调强放疗(intensity modulated radiation therapy, IMRT)及图像引导放疗(image guided radiation therapy, IGRT)等放疗新技术的发展,使得肿瘤局部可获得更高的放疗剂量,并且肿瘤周围的正常组织可以得到更好地保护。
Dawson[9]分析了放疗在肝癌局部治疗中的地位,BCLC分期中的多个期别均适合放疗。O'Connor等[10]报道,对于不适合手术、肝移植或经皮射频消融治疗的患者,放疗还可作为肝移植前的过渡治疗。2015年发表的1篇Meta分析论文比较了放疗联合介入治疗的疗效,研究包括25篇文献,含 11个小样本的随机对照研究,14个非随机对照研究,共计2577例HCC患者[11]。结果发现,在治疗有效率方面,达到完全缓解(complete remission, CR)和部分缓解(partial remission,PR)的几率,放疗+介入治疗明显优于单纯介入治疗(P<0.001)。生存率方面,放疗+介入治疗和单纯介入治疗的中位生存时间分别为22.7个月和13.5个月(P<0.001)。可见放疗联合介入治疗的疗效明显优于单纯介入治疗,是不能手术HCC患者最有效的综合治疗手段之一。
3 体部立体定向放疗(stereotactic body radiation therapy, SBRT)
随着肿瘤放射治疗技术进展, SBRT成为国内外研究热点。传统的SBRT是通过立体定位装置固定体位,采用单、多源聚焦或多叶光栅技术,将高剂量单次或者多次精确施照,肿瘤区域接受高剂量,肿瘤周围正常组织接受低剂量照射的一种精确放疗技术。
SBRT最早用于颅内肿瘤的治疗,此后,逐渐应用到颅外肿瘤治疗。Blomgren等[12]在20世纪90年代率先采用SBRT治疗HCC 8例,处方剂量为15~45 Gy/1~3f,1年的局部控制(local control, LC)率为100%。
SBRT的实施须要处理好体位固定、呼吸管理、肿瘤靶区运动的不确定性、体位验证、治疗中靶区体积变化以及周围危及器官形变等问题,临床实施SBRT须在IGRT下完成。
3.1 SBRT的适应证 须要严格把握适应证,建议首先由多学科协作组(multidisciplinary team, MDT)讨论并综合考量后选择合适的患者。
SBRT和HCC的其他局部治疗手段可以实现优势互补,Sanuki[13]推荐了HCC不同治疗手段的适应证。见表1。对于早期HCC患者,由于各种原因不适合或患者拒绝手术和经皮射频消融治疗时,SBRT是较好的替代治疗。对于靠近消化道的病变,由于可能出现穿孔、出血及溃疡等风险,SBRT实施有一定的风险。对于肿瘤体积巨大、伴门静脉瘤栓、有肝功能损害及合并严重肝硬化的患者,SBRT应该慎重选择。SBRT的适应证一般包括:瘤体相对规则、最大直径<6 cm。病变位于肝门区或临近大血管或胆管系统,或病变位于横隔之下或肝脏表面也可行SBRT。

表1 HCC不同治疗手段适应证及疗效Table 1 Indications and efficacy of different treatment modalities for HCCs
3.2 SBRT治疗HCC的疗效和剂量分割
3.2.1 疗效 SBRT的研究仍处于探索阶段,既往文献多为小样本、单中心的研究,但一致证实其极佳的LC率和总生存(overall survival, OS)率。对于直径<6 cm的肝癌,SBRT治疗后1年LC 率为72%~100%,OS率为72.7%~100%;2年LC率为64.4~100%,OS率为45.3%~87.9% 。关于SBRT的一些研究结果见表2。
既往的回顾性研究多集中在直径<6 cm的 HCC,除证实SBRT的良好耐受性以外,发现影响LC率的重要因素包括:放疗总剂量、单次剂量、生物有效剂量(biological effective dose, BED)和肿瘤大小等。Kwon等[17]2010年报道Cyberknife治疗42例肝癌患者,中位随访29个月,剂量分割为30~39 Gy/3f,照射野内病灶CR率为59.6%,PR率为26.2%,照射野内1年、3年无进展生存率(progression-free survival, PFS)为72.0%与67.0%,1年、3年OS率分别为92.9%与58.6%。多因素分析肿瘤体积<32 ml患者具有生存优势(HR=6.33,P=0.036)。Scorsetti等[21]在2015年采用容积调强弧形治疗了43例HCC患者的63枚病灶,30枚(48%)直径<3 cm病灶采用45~75 Gy/3f。33枚直径介于3~6 cm病灶采用36~60 Gy/6f,1年、2年LC率为85.8%、64.4%,1年、2年OS率为77.9%、45.3%,中位OS为18.0±5.8个月,单因素分析 BED>100 Gy,大体肿瘤体积(gross tumor volume, GTV)<5 cm是LC、OS的影响因素。当肿瘤位于重要危及器官附近时,短程SBRT可能不够安全。Park等[22]针对26例位于危及器官胃、十二指肠2 cm以内的<6 cm的HCC,采用40~50 Gy/10f,1年、2年OS率分别为88.5%与67.2%,2年LC率为87.6%,2年肝内无复发生存率(recurrence-free survival, RFS)、远处无转移生存率(distant failure-free survival, DFS)分别为36.5%与68.2%。1例患者出现≥3级肝脏毒性。2周分割方案是治疗靠近危及器官的HCC的安全有效的替代选择。

表2 SBRT治疗HCC的疗效和毒性Table 2 Efficacy and toxicity of SBRT for HCC
目前SBRT治疗HCC相关的前瞻性研究不多。Mendez等[15]在2006年开展了第一项SBRT的前瞻性研究,入组25例肝癌患者,其中8例为HCC。试验给予无肝硬化或有肝硬化但肿瘤大小≤4 cm 的HCC患者37.5 Gy/3f的剂量,给予有肝硬化或肿瘤大小>4 cm的HCC患者30.0 Gy/3f的剂量。结果发现,1年LC率为75%,OS率为48%。8例HCC患者中,CP A级6例,CP B级2例,2例中其中1例患者出现了5级的非典型RILD,研究者建议对于肝功能B级的患者应用SBRT应该更为谨慎。
Cárdenes 等[16]则前瞻性地研究肝脏功能不同状态对SBRT耐受情况。于2010年开展SBRT治疗直径<6 cm肝癌的I期前瞻性剂量爬坡临床研究, CP-A级患者放疗剂量由36 Gy/3f攀升至48 Gy/3f,未出现剂量限制性毒性;2例CP B级患者出现3级肝脏毒性反应,6例患者进行了肝移植,结果显示1年LC率为100%、OS率为 75%。该I期临床研究显示SBRT治疗合理选择肝癌患者(即CP A或B级、病灶不超过3个、最大直径不超过6 cm),则耐受性好,疗效令人鼓舞。
Seo等[26]前瞻性研究SBRT治疗38例无法手术的直径<10 cm的HCC。作为经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)后复发的挽救治疗,肿瘤体积11~464 ml(中位40.5 ml),肿瘤体积<300 ml者接受33~57 Gy/3f,GTV介于301~500 ml者接受40~44 Gy/4f,中位随访15个月,38例中22例出现进展,肝内复发为主,1年与2年LC率为78.5%、66.4%,1年与2年PFS为46.4%、37.5%,1年、2年、3年OS率分别为68.4%、61.4%、42.1%,中位OS为32个月,SBRT治疗后3个月CR率+PR率为63%,6例患者(16%)出现1~2级肝功能异常,1例(2.7%)患者出现3级软组织毒性。多因素分析剂量≥42 Gy/3f为OS的独立预后因素,SBRT可作为TACE后复发补救治疗[19]。
此后,Tse等[23]于2008年开展了一项运用基于有效肝脏体积而选择剂量的6次分割模型的前瞻性Ⅰ期研究,研究SBRT治疗不可切除的31例CP A级HCC,其中28例为BCLC分期B/C期, 16例HCC伴有静脉癌栓,研究给予患者中位剂量36 Gy (24~54 Gy)/6f,肿瘤中位体积173 ml。结果发现,疗效方面,中位OS为11.7个月,1年OS率为48%。癌栓CR率为6%、PR率为19%、SD率为38%。1例SBRT后18个月显示门/腔静脉癌栓完全缓解。毒副反应方面,SBRT后3个月内8例(25.8%)出现3级肝功能异常,5例出现CP评分由A级降为B级。出现以上毒副反应的患者大都肿瘤大,正常肝脏体积小,接受低剂量SBRT后更容易出现肿瘤进展。该研究报道的1年OS率仅为48%,其原因是肝癌体积大,中位体积为173 ml,远大于其他SBRT研究中的入组患者。该研究结论认为采用个体化6次分割治疗不可切除HCC是一种安全的治疗选择。
Bujold等[24]于2013年报道一项大宗的进展期HCC的SBRT的Ⅰ/Ⅱ期前瞻性研究,2004—2010年,入组102例不适合其他局部治疗的局部晚期HCC,肝功能基线均为CP A级, BCLC C期占65.7%,55.0%患者有癌栓,61.0%患者多病灶,最大病灶中位直径7.2 cm(1.4~23.1 cm),12.0%有肝外转移,治疗中位剂量36 Gy/6f/2周。1年影像学CR率为11%,PR率为43%,LC率、OS率分别为87%与55%,中位OS为 17个月。该研究认为LC率与剂量相关,剂量与GTV体积相关。笔者所在单位近年已开展SBRT治疗不可手术的HCC患者,举例如图1。
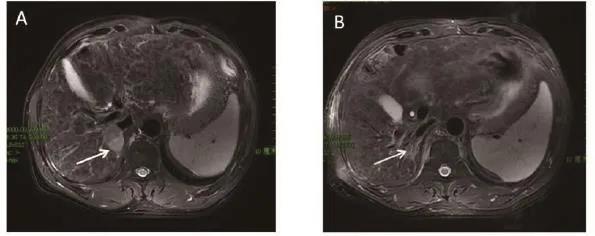
图1 SBRT治疗HCC患者MRI(箭头所示为大体肿瘤部位)
3.2.2 与其他治疗手段比较 与晚期肝癌标准治疗相比,以上研究的OS均不劣于索拉非尼的SHARP研究(中位OS为10.7个月)和Orintal研究(中位OS为6.5个月),且治疗成本更具优势。
Wahl等[25]回顾比较研究SBRT与射频消融治疗不可手术HCC的疗效。1年、2年LC率分别为97.4%、83.8%和83.6%、80.2%,3级及以上急性毒副反应分别为5%和11%。在射频治疗组,随着肿瘤直径增加,LC率下降。肿瘤直径≥2 cm者,SBRT组LC率优于射频消融组(P=0.025)。
3.2.3 剂量分割模式 关于SBRT的剂量分割,不同的研究采取的处方剂量和治疗策略都不尽相同,目前还没有公认的最佳剂量分割模式。由于HCC病因和治疗在各个国家之间存在着异质性,处方剂量也应该根据情况变化[13]。
既往的研究中,SBRT治疗HCC的剂量分割模式主要分为3种:3次×(10~20 )Gy,(4~6)次×(8~ 10 )Gy,10次 ×(5~5.5) Gy。Wang 等[27]根据肿瘤大小和CP分级确定剂量分割方案。对于直径<3 cm,肝功能储备良好的HCC患者(CP A级5分),处方剂量建议3次×(15~25)Gy。对于直径在3~5 cm之间,相对肝功能储备不足的HCC患者(CP A级6分),处方剂量建议5次×(10~12) Gy。对于直径>5 cm,肝功能储备不良的HCC患者(CP B级),处方剂量建议10次×(5.0~5.5 )Gy。
Johnson等[28]在RTOG1112研究中建议,CP A级HCC患者可根据正常肝平均剂量(mean liver dose, MLD)等确定放疗剂量,正常肝定义为全肝体积减GTV的差值。见表3。

表3 RTOG1112研究处方剂量推荐Table 3 Recommendation for prescription dose by RTOG1112
3.3 SBRT的毒性反应及剂量限定 Bujold等[24]报道一项大宗的晚期HCC的SBRT的Ⅰ/Ⅱ期前瞻性研究。该研究入组102例HCC患者, 30%患者出现≥3级毒副反应,29%患者在SBRT后3个月出现CP 分级变差;7例患者出现治疗相关性死亡,包括5例肝衰竭(2例因为癌栓进展),1例SBRT后出现胆管炎,1例十二指肠出血。
Jang等[29]报道,病变临近胃肠道或胃肠道接受了相对高剂量的HCC患者更容易发生3~4级的胃肠道毒性反应。因此,对于肝脏周围的危及器官的剂量限定应该严格执行,尤其是胃和十二指肠[23]。目前未见文献报道SBRT后的胆管损伤,SBRT对于位于或临近胆道系统的HCC是较为安全的[13]。RTOG1112研究建议的正常组织(危及器官)剂量限制条件见表4。

表4 RTOG 1112 正常组织剂量限制Table 4 Normal tissue limits in dosage by RTOG1112
肝癌SBRT治疗显示出比常规治疗更好的LC率,但不可避免会出现放疗毒副反应,严重不良反应包括肝功能衰竭、胃肠出血穿孔等,须根据肿瘤大小、位置、临近器官、肝脏基线功能及患者体质等制定可行的个性化剂量分割方式及危及器官剂量限制。同时,治疗过程中的每日质控尤为重要。
3.4 展望 HCC患者SBRT的失败模式最常见于照射野外复发,因此联合其他局部或全身治疗理论上是合理的。RTOG也正在进行一项关于SBRT联合索拉非尼治疗HCC的Ⅲ期临床研究,结果值得期待[28]。SBRT治疗HCC的疗效还需要更大样本、多中心前瞻研究来证实。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: globocan 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
[3] Perz JF, Armstrong GL, Farrington LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide[J]. J Hepatol, 2006, 45(4):529-538.
[4] Forner A, Reig ME, de Lope CR, et al. Current strategy for staging and treatment: the BCLC update and future prospects[J]. Semin Liver Dis, 2010, 30(1):61-74.
[5] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4):378-390.
[6] Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1):25-34.
[7] Yamamoto M, Takasaki K, Otsubo T, et al. Favorable surgical outcomes in patients with early hepatocellular carcinoma[J]. Ann Surg, 2004, 239(3):395-399.
[8] Hawkins MA, Dawson LA. Radiation therapy for hepatocellular carcinoma[J]. Cancer, 2006, 106(8):1653-1663.
[9] Dawson LA. Overview: Where does radiation therapy fit in the spectrum of liver cancer local-regional therapies[J]. Semin Radiat Oncol, 2011, 21(4):241-246.
[10] O'Connor JK, Trotter J, Davis GL, et al. Long-term outcomes of stereotactic body radiation therapy in the treatment of hepatocellular cancer as a bridge to transplantation[J]. Liver Transpl, 2012, 18(8):949-954.
[11] Huo YR, Eslick GD. Transcatheter arterial chemoembolization plus radiotherapy compared with chemoembolization alone for hepatocellular carcinoma[J]. JAMA Oncology, 2015, 1(6):756.
[12] Blomgren H, Lax I, Näslund I, et al. Stereotactic high dose fraction radiation therapy of extracranial tumors using an accelerator. Clinical experience of the first thirty-one patients[J]. Acta Oncol, 1995, 34(6):861-870.
[13] Sanuki N. Role of stereotactic body radiation therapy for hepatocellular carcinoma[J]. World J Gastroenterol, 2014,20(12):3100-3111.
[14] Sanuki N, Takeda A, Oku Y, et al. Stereotactic body radiotherapy for small hepatocellular carcinoma: a retrospective outcome analysis in 185 patients[J]. Acta Oncol, 2014, 53(3):399-404.
[15] Mendez RA, Wunderink W, Hussain SM, et al. Stereotactic body radiation therapy for primary and metastatic liver tumors: a single institution phase i-ii study[J]. Acta Oncol, 2006, 45(7):831-837.
[16] Cárdenes HR, Price TR, Perkins SM, et al. Phase I feasibility trial of stereotactic body radiation therapy for primary hepatocellular carcinoma[J]. Clin Transl Oncol, 2010, 12(3):218-225.
[17] Kwon JH, Bae SH, Kim JY, et al. Long-term effect of stereotactic body radiation therapy for primary hepatocellular carcinoma ineligible for local ablation therapy or surgical resection. Stereotactic radiotherapy for liver cancer[J]. BMC Cancer, 2010,10:475.
[18] Andolino DL, Johnson CS, Maluccio M, et al. Stereotactic body radiotherapy for primary hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4):e447-e453.
[19] Yoon SM, Lim YS, Park MJ, et al. Stereotactic body radiation therapy as an alternative treatment for small hepatocellular carcinoma[J]. PLoS One, 2013, 8(11):e79854.
[20] Kimura T, Aikata H, Takahashi S, et al. Stereotactic body radiotherapy for patients with small hepatocellular carcinoma ineligible for resection or ablation therapies[J]. Hepatol Res,2015, 45(4):378-386.
[21] Scorsetti M, Comito T, Cozzi L, et al. The challenge of inoperable hepatocellular carcinoma (HCC): results of a single-institutional experience on stereotactic body radiation therapy (SBRT) [J]. J Cancer Res Clin Oncol, 2015, 141(7):1301-1309.
[22] Park JH, Yoon SM, Lim YS, et al. Two-week schedule of hypofractionated radiotherapy as a local salvage treatment for small hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2013,28(10):1638-1642.
[23] Tse RV, Hawkins M, Lockwood G, et al. Phase I study of individualized stereotactic body radiotherapy for hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J]. J Clin Oncol, 2008, 26(4):657-664.
[24] Bujold A, Massey CA, Kim JJ, et al. Sequential phase I and II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma[J]. Journal of Clinical Oncology, 2013, 31(13):1631-1639.
[25] Wahl DR, Stenmark MH, Tao Y, et al. Outcomes after stereotactic body radiotherapy or radiofrequency ablation for hepatocellular carcinoma[J]. J Clin Oncol, 2016, 34(5):452-459.
[26] Seo YS, Kim MS, Yoo SY, et al. Preliminary result of stereotactic body radiotherapy as a local salvage treatment for inoperable hepatocellular carcinoma[J]. J Surg Oncol, 2010, 102(3):209-214.
[27] Wang P, Chung N, Hsu W, et al. Stereotactic body radiation therapy in hepatocellular carcinoma: Optimal treatment strategies based on liver segmentation and functional hepatic reserve[J]. Rep Pract Oncol Radiother , 2015, 20(6):417-424.
[28] Johnson PJ, Qin S, Park JW, et al. Brivanib versus sorafenib as first-line therapy in patients with unresectable, advanced hepatocellular carcinoma: results from the randomized phase III BRISK-FL study[J]. J Clin Oncol, 2013, 31(28):3517-3524.
[29] Jang WI, Kim MS, Bae SH, et al. High-dose stereotactic body radiotherapy correlates increased local control and overall survival in patients with inoperable hepatocellular carcinoma[J]. Radiat Oncol, 2013, 8:250.
(2016-05-20 收稿 2016-07-17 修回)
(责任编委 李 军 本文编辑 卢福昱)
Efficacy and safety of stereotactic body radiation therapy for hepatocellular carcinoma
CHENG Shu-hui, WANG Wei-hu*Department of Radiation Oncology, Cancer Hospital , Chinese Academy of Medical Sciences, Beijing 100021, China. *Corresponding author, E-mail: wangweihu88@163.com
In recent years, with the progress of tumor radiotherapy, radiotherapy of primary hepatocellular carcinoma (HCC) has attracted more and more attention, and more and more evidences show that it has a good therapeutic effect. SBRT has been critical in improving local control or potential cure in liver lesions not amenable to first-line surgical resection or radiofrequency ablation. Active investigations of SBRT have recently started, yielding promising local control rates. However, the researches on optimal treatment indications, doses, and methods remain limited. Herein, this review discussed the emerging role of SBRT as current indications, optimal doses, efficacy and safety in non-surgical patients with primary HCC.
carcinoma, hepatocellular ; radiotherapy; radiobiology; stereotactic radiotherapy
[中国图书资料分类号] R735.7 A
1007-8134(2016)04-0203-06
10.3969/j.issn.1007-8134.2016.04.003
100021 北京,中国医学科学院肿瘤医院放疗科(程书蕙、王维虎)
王维虎,E-mail: wangweihu88@163.com
