西地那非对主动脉弓缩窄诱导大鼠心肌肥大的保护作用
2016-09-14王阿慧孙晓鸥刘青胡婷婷韩婷金亚谭文华南理工大学生物科学与工程学院生物医药前孵化器研究中心广东省发酵与酶工程重点实验室广东广州510006
王阿慧,孙晓鸥,刘青,胡婷婷,韩婷,金亚,谭文(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广东广州510006)
西地那非对主动脉弓缩窄诱导大鼠心肌肥大的保护作用
王阿慧,孙晓鸥,刘青,胡婷婷,韩婷,金亚,谭文
(华南理工大学生物科学与工程学院/生物医药前孵化器研究中心/广东省发酵与酶工程重点实验室,广东广州510006)
目的探讨西地那非对大鼠心肌肥大疾病发展过程中的保护作用及其作用机制。方法 采用主动脉弓缩窄法(TAC)建立大鼠心肌肥大模型,假手术组(Sham)、模型组(TAC)、西地那非组(SIL)各取3、6、9周3个时间点,测定大鼠血流动力学参数后分离左心室,测定胫骨长度。大鼠左心室心肌组织经HE染色和天狼星红染色后,显微镜下观察大鼠心肌细胞肥大和纤维化程度。荧光实时定量PCR(Realtime PCR)检测各组大鼠的左心室心肌组织心钠肽(ANP)的mRNA表达水平。结果 与假手术组比较,模型组3、6、9周组大鼠的左心质量/胫骨长度、心肌细胞横截面积、心肌纤维化、ANP mRNA表达水平均显著升高(P<0.05);与模型组相比,西地那非组这些指标均显著降低(P<0.05);ANP mRNA表达具有时间依赖性,随着3、6、9周时间的增加表达水平逐渐降低。结论西地那非在大鼠心肌肥大发生发展过程中具有保护作用,能增强心功能,抑制心肌纤维化,并且随着时间的延长发挥作用越明显,其作用机制可能与阻止胚胎基因ANP的再激活有关。
西地那非;心肌肥大;Wistar大鼠;心钠肽
心肌肥大是高血压、冠心病等多种心血管疾病的一种共同的病理生理变化,是心肌对各种刺激产生的一种适应性反应,可使心肌缺血、心律失常、心力衰竭和猝死的几率增加6~10倍[1-2]。心肌肥大多以心肌细胞增生肥大、心肌成纤维细胞增殖和心肌间质胶原合成增多为主要病变[3-4]。对心肌肥大的病理机制和有效的药物治疗研究具有重要的理论和临床意义。
西地那非(sildenafil,SIL)在临床上作为治疗男性性功能障碍药物已有多年历史,近年来SIL作为心肌保护药进行开发,对心血管疾病的应用备受关注。研究表明,SIL能够抑制主动脉弓缩窄(transverse aortic constriction,TAC)诱导小鼠心肌肥大[5],其作用机制可能是通过抑制5型磷酸二酯酶(PDE5)的活性,使环磷酸鸟苷(cGMP)含量增加,cGMP激活PKG等下游通路,达到治疗心肌肥大的作用。但是不同的动物,甚至同一种动物不同种系(大鼠、小鼠)在实施手术后,其疾病发展进程、心功能改变等都不尽相同,并且已有的研究中并未表明血流动力学指标和心肌细胞横截面积在疾病发展过程和治疗过程中的变化。目前,SIL在大鼠心肌肥大发展过程中是否起到与其在小鼠心肌肥大模型中相同的心肌保护作用及相应的作用机制尚不清楚。
近年来研究表明,心肌肥厚、心力衰竭等患者心钠肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)水平显著升高,已成为诊断和评估疾病严质量程度的生物指标[6-8]。进一步研究证实,ANP是心肌肥大的代表性标志物之一[9-11]。心肌肥大是一个复杂的病理生理过程,其中ANP的动态表达是否参与SIL对心肌肥大的保护作用有待深入研究。
本研究旨在通过TAC法建立大鼠心肌肥大动物模型,评价SIL药物治疗后3、6、9周的心指数、血流动力学参数、心肌细胞横截面积、心肌纤维化多个指标的变化,并同时检测肥大基因ANP的mRNA表达水平,探索SIL在TAC诱导的大鼠心肌肥大发展过程中的保护作用及初步的作用机制,为SIL治疗心肌肥大的基础和临床研究提供依据。
1 材料与方法
1.1实验动物
SPF级Wistar大鼠,雄性,8~10周龄,体质量(200±20)g,购于广州中医药大学动物实验中心,生产许可证号:SCXK(粤)2013-0034。
1.2主要仪器
手术器械(广州器化医疗设备有限公司);小动物呼吸机(Harvard Apparatus,Holliston,MA,USA);PowerLab数据采集分析系统(AD Instruments Inc.);组织脱水机、石蜡包埋机冷台、石蜡包埋机热台、旋转式切片机、多功能染色机(德国 Leica);NANODROP 2000型超微量生物检测器(美国Thermo);7500型荧光定量 PCR仪(美国 life technology)
1.3主要试剂
戊巴比妥钠(德国Merck);枸橼酸西地那非(进口分装原料药);伊红-苏木素染色液(Merk,进口分装);天狼星红染色液(华迈科生物技术有限责任公司);RE-03011型RNA提取试剂盒(FOREGENE);6210A型逆转录试剂盒(TaKaRa);SYBR Green荧光定量PCR试剂盒(美国life technology)
1.4方法
1.4.1大鼠心肌肥大TAC模型建立[12]大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,固定于手术台上;经口气管插管接呼吸机控制呼吸;手术区域备皮消毒,逐层剪开皮、胸大肌、胸小肌;在第2~3肋骨间开胸,分离胸腺,暴露主动脉弓;穿线,将主动脉结扎于外径为0.8 mm的针头;抽出针头,各组织归位,关胸,缝皮,放回鼠笼继续饲养。假手术组除不结扎主动脉弓以外,其他步骤与模型组相同。
1.4.2分组与给药 将45只雄性Wistar大鼠随机分为9组:假手术组、模型组、西地那非组各取3、6、9周3个时间点,每组5只。西地那非组在TAC手术后3 d开始灌胃给药SIL(70 mg/kg/d),另外6组以等量的空白溶剂每日灌胃,早晚给药2次,12 h明暗交替。
1.4.3手术3、6、9周后血流动力学参数测定 取出手术后3周、6周、9周的Wistar大鼠,称质量后腹腔注射戊巴比妥钠(50 mg/kg)麻醉;固定于手术台上,通过16通道的Powerlab监测心电图;钝性分离左侧股动脉,导管经左侧股动脉插管,监测并记录动脉压;钝性分离颈总动脉,导管经颈总动脉到达左心室,监测并记录左心室压[13]。
1.4.4手术3、6、9周后大鼠体质量、心脏质量、胫骨的测定和组织处理 麻药处死大鼠,迅速开胸,剪下心脏并放入冰冻的生理盐水中,把心腔内的血液挤出,用干净的滤纸吸干水分,记录心脏的湿质量,分离左心室游离壁,称质量后横切左心室,一部分放进10%(φ)中性甲醛溶液中固定保存,其余组织液氮急冻后保存于-80℃备用,测定胫骨长度。
1.4.5病理学观察 左心室心肌组织石蜡包埋切片后进行HE染色和天狼星红染色,显微镜下观察,用Image-Pro Plus 6.0软件计算每只大鼠心肌细胞横截面积大小和胶原面积占整个心肌面积的百分比,评价心肌细胞肥大和纤维化程度。
1.4.6荧光实时定量PCR(Real-time PCR) 在每组5只大鼠中随机选取3只,每只大鼠取20 mg左心室心肌组织,严格按照RNA试剂盒提取总RNA。Nanodrop测定RNA的浓度和纯度。用逆转录试剂盒获得cDNA。采用SYBR Green荧光定量PCR试剂盒,以GAPDH为内参基因,△△Ct法检测肥大基因ANP mRNA的相对表达水平。按照试剂盒说明书所示,配制荧光定量的反应体系。其中,cDNA的模板上样量约为2 ng,最终的反应体系为10 μL。Real-time PCR反应程序为:50℃ 2 min;95℃2 min;95℃ 15 s;60℃ 1 min;40个循环。引物由上海捷瑞生物工程有限公司合成,序列如下: GAPDH上游:5′-TTCAACGGCACAGTCAAGG-3′,下游:5′-CACCAGTGGATGCAGGGAT-3′;ANP上游: 5′-CATAACCAAGGGCTTCTTCCTCTTC-3′,下游:5′-TTATCTTCGGTACCGGAAGCTGTTG-3′。
1.5统计学分析
2 结果
2.1大鼠心肌肥大不同时间点的左心质量/体质量和左心质量/胫骨长度指标
如图1,与Sham组相比,TAC 3周、6周、9周组大鼠的左心质量/体质量(LV/BW)、左心质量/胫骨长度(LV/TL)均显著增加(P<0.01或P<0.05),说明3、6、9周后,大鼠心肌肥大模型建立成功。SIL组与TAC组相比,LV/BW在SIL 3周组中P<0.05,在6周组中P<0.01,在9周组中差异无统计学意义;从图1-B得出,LV/TL在SIL 3、6、9周中均显著降低(P<0.05)。
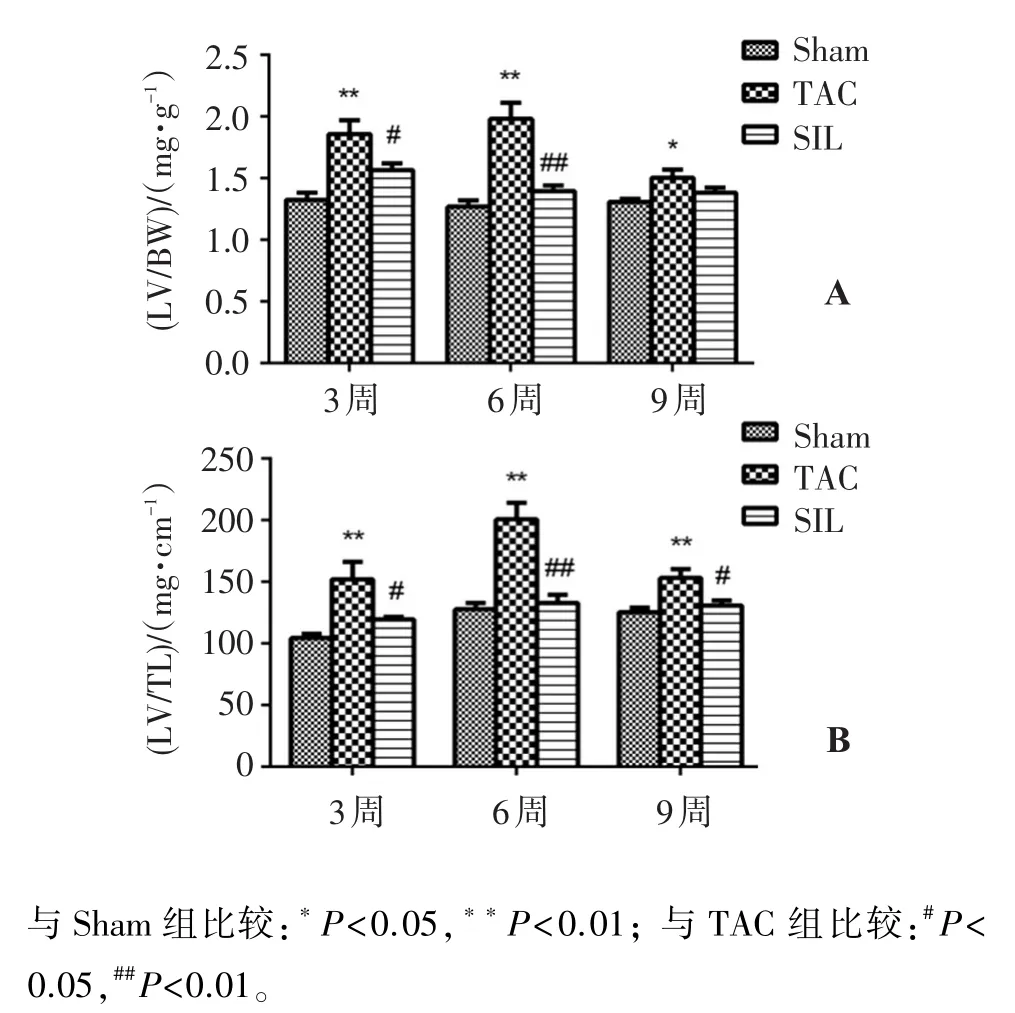
图1 手术3、6、9周后各组大鼠的LV/BW(A)、LV/TL(B)Figure 1 Ratio of left ventricular weight/body weight,left ventricular weight/tibial length in three groups after 3,6 and 9 week surgery(s,n=5)
2.2大鼠心肌肥大不同时间点的血流动力学指标
如表1所示,与Sham组相比,TAC 3周、6周、9周组大鼠的左心室压力最大上升速率(dp/dtmax)均显著升高(P<0.05或P<0.01);与TAC组相比,SIL治疗9周后dp/dtmax显著降低(P<0.01)。TAC 3、6周时左心室压力最大下降速率(dp/dtmin)的绝对值显著升高(P<0.05),9周时增加不显著。左心室舒张末压(LVEDP)在TAC 6、9周时显著升高(P<0.01),在3周组中升高不显著。相对应的给予SIL治疗 6周、9周中均能显著降低 LVEDP (P<0.05)。TAC 3、6、9周中平均左心室压(Mean LVP)显著升高(P<0.01),SIL治疗后能降低平均左心室压。TAC 9周后平均动脉压(MAP)与Sham组相比显著升高(P<0.01);SIL治疗后能降低TAC组的平均动脉压(P<0.05)。
表1 手术3、6、9周后各组大鼠的血流动力学指标Table 1 Cardiac function parameters in three groups after 3,6 and 9 week surgery(s,n=5)

表1 手术3、6、9周后各组大鼠的血流动力学指标Table 1 Cardiac function parameters in three groups after 3,6 and 9 week surgery(s,n=5)
与Sham组比较:*P<0.05,**P<0.01;与TAC组比较:#P<0.05,##P<0.01。
组别 Mean LVP/ mmHg LVEDP/ mmHg MAP/ mmHg (dp/dtmax)/ (×103mmHg·s-1)(dp/dtmin)/ (×103mmHg·s-1)3周 Sham组 76.38±5.35 5.21±0.43 136.30±5.86 8.65±1.52 -6.78±0.66 TAC组 106.20±3.37** 5.87±0.35 148.50±4.66 12.24±0.36* -9.10±0.35*SIL组 91.59±4.54# 6.12±0.31 144.00±16.98 11.78±1.81 -8.29±0.10 6周 Sham组 61.68±4.33 6.11±0.47 104.30±5.14 7.65±0.66 -5.92±0.52 TAC组 96.64±3.50** 10.75±0.32** 143.30±5.35* 11.34±0.18** -8.80±0.32**SIL组 93.96±4.66 9.02±0.60# 141.40±4.84 12.97±1.04 -9.96±0.54 9周 Sham组 68.49±3.55 7.23±0.53 128.50±7.92 7.97±0.78 -7.03±0.56 TAC组 97.02±6.60** 13.89±1.21** 163.60±6.64** 12.87±1.12** -7.65±0.57 SIL组 86.20±1.74 10.85±0.39# 130.00±10.80# 8.55±0.61## -8.08±0.57
2.3大鼠心肌肥大不同时间点的心肌细胞横截面积大小
由图2、图3可知,与Sham组相比,TAC 3、6、9周后的大鼠心肌细胞横截面积均显著增加(P<0.01),说明TAC手术后,心肌细胞明显肥大,造模成功;与TAC组相比,SIL组均明显降低心肌细胞的横截面积(P<0.01),说明给予SIL治疗3、6、9周时均能显著抑制心肌肥大。

图2 心肌组织HE染色结果(400×)Figure 2 Cardiac tissues stained by H&E staining in three groups(400×)
2.4大鼠心肌肥大不同时间点的心肌纤维化程度
由图4、图5可知,与Sham组相比,TAC 3、6、9周后的大鼠心肌纤维化面积均明显增加(P<0.01),说明TAC引起大鼠心肌胶原分泌,导致心肌纤维化,造模成功;与TAC组相比,给予SIL治疗3、6、9周均能显著抑制心肌纤维化(P<0.01或P<0.05)。
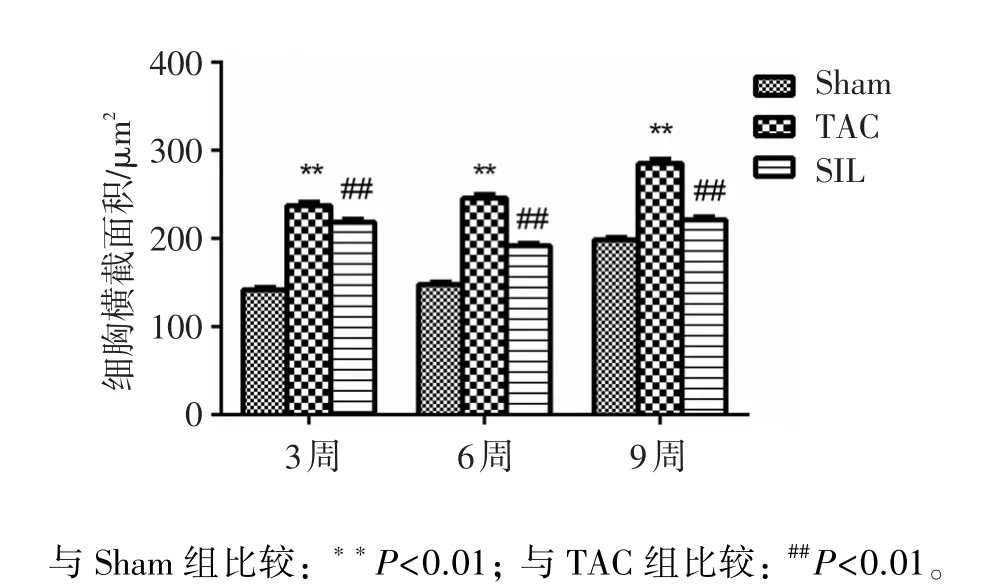
图3 手术3、6、9周后各组大鼠心肌细胞横截面积(μm2)大小Figure 3 Myocyte cross-sectional area in three groups after 3,6 and 9 week surgery(,n=5)
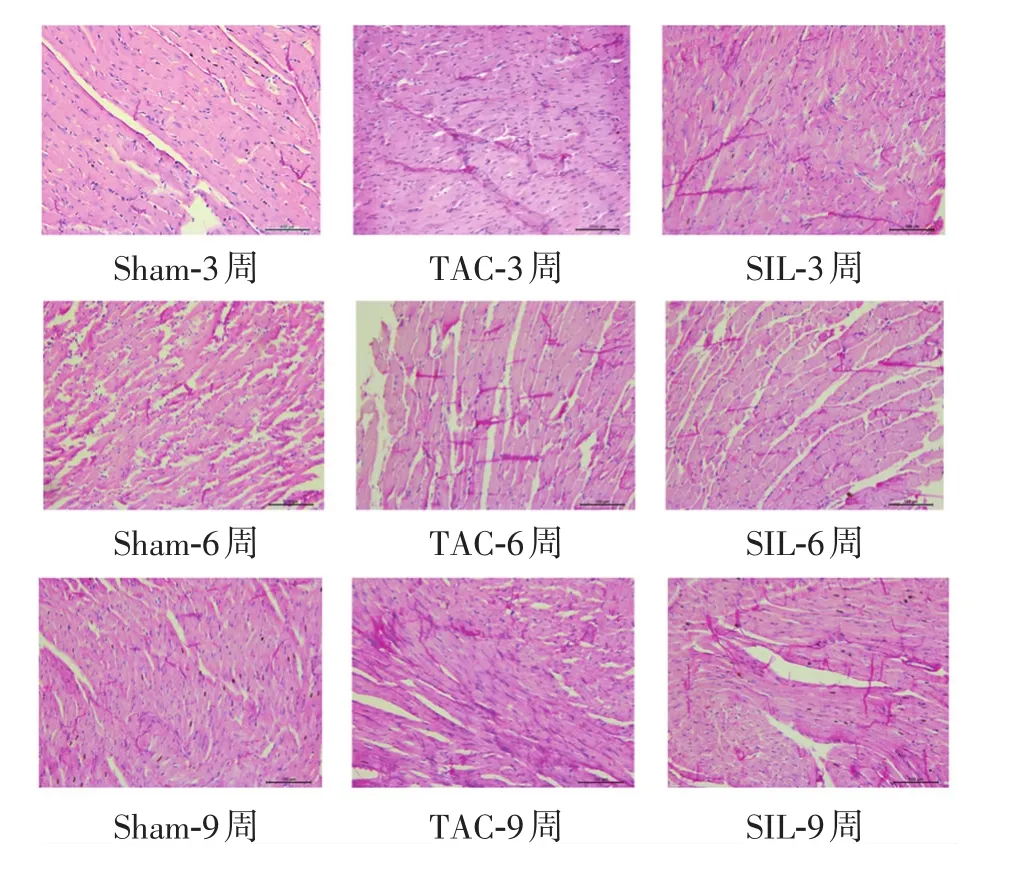
图4 心肌组织天狼星红染色观察心肌纤维化结果Figure 4 Myocardial fibrosis by Sirius red staining in three groups(200×)
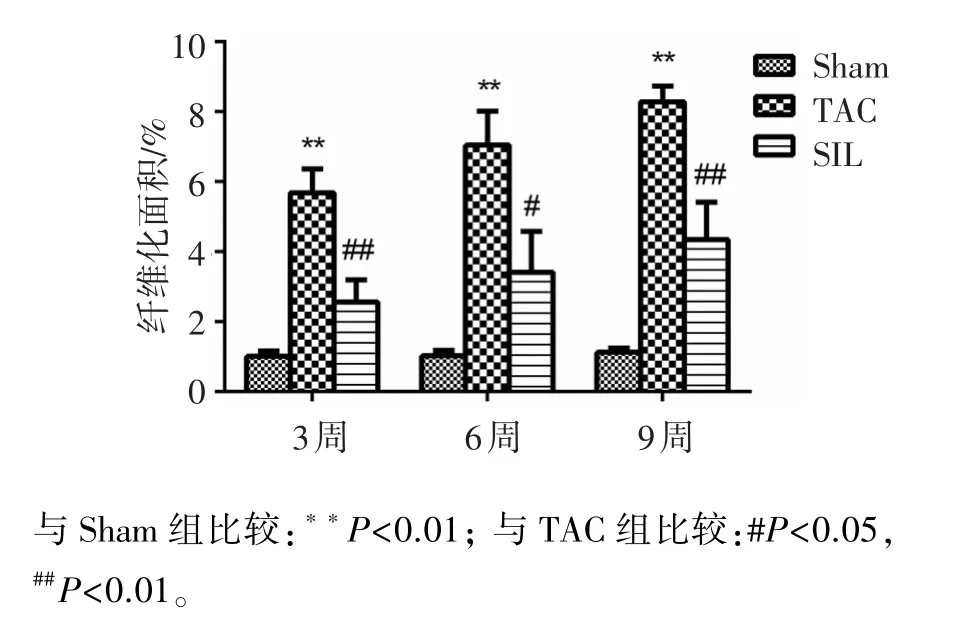
图5 手术3、6、9周后各组大鼠心肌纤维化面积百分比Figure 5 Myocardial fibrosis area in three groups after 3,6 and 9 week surgery(,n=5)
2.5大鼠心肌肥大不同时间点的ANP mRNA相对表达量
由图6可知:与Sham组相比,TAC 3、6、9周的ANP mRNA的相对表达量均升高,其中6周组表达量最高。与TAC组相比,给予SIL能降低TAC 6周、9周组ANP mRNA的表达水平,且随着时间的延长逐渐降低,具有一定的时间依赖性。

图6 手术3、6、9周后各组心肌组织的ANP mRNA相对表达量Figure 6 Expression of ANP mRNA in three groups after 3,6 and 9 week surgery(,n=3)
3 讨论
当前,心肌肥大已被公认是心衰、猝死等心血管疾病主要的危险致病因素,同时由心肌肥大导致的心衰是全世界发病率和死亡率最高的疾病之一[14],对其深入研究具有重要意义。
本研究中,SIL组与TAC组相比,TAC组3周、6周组LV/BW中差异有统计学意义,9周组差异无统计学意义,这是由于TAC 9周组大鼠心脏质量增加的同时体质量也显著增加。此外,LV/TL在TAC 3、6、9周中均显著降低,结果表明,当体质量变化显著时,用LV/BW评价心肌肥大可能缺乏可靠性。胫骨长度的生长曲线不受疾病和体质量变化的影响,LV/TL可作为判断心肌肥大程度的可靠指标。
实验结果显示,与Sham组相比,TAC 3、6、9周组大鼠的LV/TL、心肌细胞横截面积、心肌纤维化、ANP mRNA表达水平均显著升高,说明大鼠心肌肥大模型建立成功;与TAC组相比,给予SIL治疗能够降低LV/TL比值,改善心肌肥大大鼠的血流动力学,增强心功能,抑制心肌纤维化。
已有研究表明,心脏负荷增加可诱导组蛋白去乙酰化酶-4出核信号、组蛋白去甲基和异染色质蛋白-1分解,促使ANP等胚胎基因的再表达[11]。本研究中,TAC 3、6、9周后,ANP mRNA的相对表达量均升高,说明心肌肥大时内源性心脏激素系统的代偿作用使ANP分泌增多。ANP mRNA表达具有时间相关性。其中6周组表达量最高,9周组有所下降可能是由于心脏开始进入失代偿期,心功能开始下降所致。给予SIL治疗后ANP mRNA的表达量在3周组比TAC组有所上升,在6周和9周组中均比相应的TAC组有所下降,并且给予SIL治疗的3、6、9周中ANP mRNA的表达水平随着时间的延长逐渐降低,具有一定的时间依赖性,推测可能由于给予SIL治疗后诱发ANP应激性反应,ANP与其相应的受体结合,舒张血管进而降低血压、减轻心脏负荷,但随着时间的延长,ANP过表达导致心肌损伤加重,SIL能够通过抑制ANP的表达达到治疗作用。提示给予SIL治疗可能随着时间的延长发挥作用越明显。
综上结果提示,SIL可能通过抑制心脏负荷诱导组蛋白去乙酰化酶-4出核信号、组蛋白去甲基和异染色质蛋白-1分解,阻止胚胎基因ANP的再激活,改善心肌肥大大鼠血流动力学,增强心功能,抑制心肌纤维化,并且可能随着时间的延长发挥作用越明显。但也有文献表明,SIL对临床心衰病人的左心室舒张功能和肺动脉收缩压没有明显的改善[15],其长期的作用机制还需要进一步的研究。后期将同时设置小鼠模型进行对比,为心肌肥大动物模型的最佳选择提供参考依据。
[1]COOPER G.Basic determinants of myocardial hypertrophy:a review of molecular mechanisms[J].Annu Rev Med,1997,48:13-23.
[2]DIWAN A,DORN G W.Decompensation of cardiac hypertrophy:cellular mechanisms and novel therapeutic targets[J].Physiology,2007,22(2):56-64.
[3]CAMELLITI P,GREEN C R,KOHL P.Structural and functional coupling of cardiac myocytes and fibroblasts[J]. Adv Cardiol,2006,42:132-149.
[4]YUAN Yuan,ZONG Jing,ZHOU Heng,et al.Puerarin attenuates pressure overload-induced cardiac hypertrophy [J].J Cardiol,2014,63(1):73-81.
[5]TAKIMOTO E,CHAMPION H C,Li M,et al.Chronic inhibition of cyclic GMP phosphodiesterase 5A prevents and reverses cardiac hypertrophy[J].Nat Med,2005,11(2): 214-222.
[6]RICHARDS A M.The natriuretic peptides in heart failure [J].Basic Res Cardiol,2004,99(2):94-100.
[7]SAITO S,MATSUMIYA G,SAKAGLLCHI T,et al.Cardiac fibrosis and cellular hypertrophy decrease the degree of reverse remodeling and improvement in cardiac function duing left ventricular assist[J].J Heart Lung Transplant,2010,29(6):672-679.
[8]IQBAL N,ALIM K S,ARAMIN H,et al.Novel biomarkers for heart failure[J].Expert Rev Cardiovasc Ther,2013,11 (9):1155-1169.
[9]CHOPRA S,CHERIA D,VERGHESE P P,et al.
Physiology and clinical significance of natriuretic hormones[J].India J Endocrinol Metab,2013,17(1):83-90.
[10]HOHL M,WAGNER M,REIL J C,et al.HDAC4 controls histone methylation in response to elevated cardiac load [J].J Clin Invest,2013,123(3):1359-1370.
[11]YU C M,SANDERSON J E,SHUM I O,et al.Diastolic dysfunction and natriuretic peptides in systolic heart failure.Higher ANP and BNP levels are associated with the restrictive filling pattern[J].Eur Heart J,1996,17 (11):1694-1702.
[12]ZHONG M,ALONSO C E,TAEGTMEYER H,et al. QuantitativePETimagingdetectsearlymetabolic remodeling in a mouse model of pressure-overload left ventricular hypertrophy in vivo[J].J Nucl Med,2013,54 (4):609-615.
[13]LIU L,WANG W,MENG X,et al.Left ventricular hypertrophy induced by abdominal aortic banding and its prevention by angiotensin receptorblocker telmisartan-a proteomic analysis[J].J Physiol Biochem,2010,66(4): 329-338.
[14]LI Minghui,ZHANG Yaojun,YU Yihui,et al.Berberine improves pressure overload-induced cardiac hypertrophy and dysfunction through enhanced autophagy[J].Eur J Pharm,2014,740(1):67-76.
[15]REDFIELD M M,CHEN H H,BORLAUG B A,et al. Effectofphosphodiesterase-5inhibitiononexercise capacity and clinical status in heart failure with preserved ejection fraction:a randomized clinical trial[J].JAMA,2013,309(12):1268-1277.
(责任编辑:幸建华)
Protective effect of Sildenafil on rat cardiac hypertrophy induced by transverse aortic constriction
WANG Ahui,SUN Xiaoou,LIU Qing,HU Tingting,HAN Ting,JIN Ya,TAN Wen
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China;Pre-incubator for Innovative Drugs and Medicine Center,South China University of Technology,Guangzhou 510006,China;Guangdong Provincial Key Laboratory of Fermentation and Enzyme Engineering,Guangzhou 510006,China)
Objective To explore the protective effect and mechanism of Sildenafi(SIL)on rat cardiac hypertrophy induced by transverse aortic constriction(TAC).Methods TAC method was used to establish the model of cardiac hypertrophy in rats.The rats were randomly divided into three groups,including the sham group,the TAC group and the SIL group.At 3,6 and 9 weeks,hemodynamic parameters were measured in rats,followed by separation of left ventricle and measurement of tibial length.After H&E staining and Sirius red staining,cardiac myocyte hypertrophy and fibrosis were observed by microscopy.The expression of ANP mRNA was detected by real-time PCR.Results Compared with the sham group,left ventricular weight/tibia length,cross-sectional area of myocardial cells,myocardial fibrosis and ANP mRNA expression were significantly higher in TAC rats(P<0.05).Compared with the TAC group,these indicatorswere significantly reduced in rats after SIL treatment(P<0.05).Meantime,the expression of ANP mRNA was gradually reduced at 3,6 and 9 weeks in a time-dependent manner.Conclusion SIL can inhibit rat cardiac hypertrophy with enhancement of cardiac function and suppression of myocardial fibrosis at different time points,which may be associated with inhibition of embryonic tissue gene ANP re-activation.
Sildenafil;cardiac hypertrophy;Wistar rats;ANP
R965;R543.1
A
1006-8783(2016)04-0475-06
10.16809/j.cnki.1006-8783.2016051801
2016-05-18
国家自然科学基金青年科学基金项目(31400798);2015年度广东省发酵与酶工程重点实验室开放基金(FJ2015004);中央高校基本科研业务费(2015ZZ121)
王阿慧(1991—),女,2013级硕士研究生,Email:791573406@qq.com;通信作者:金亚,女,副教授,主要从事蛋白质组学研究,Email:yajin@scut.edu.cn;谭文,男,教授,主要从事医药生物学研究,Email:went@scut.edu.cn。
网络出版时间:2016-07-04 15:41 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160704.1541.006.html
