一株产蓝色素菌株的筛选及初步鉴定
2016-09-13叶碧霞王小龙杨小龙
左 勇,江 鹏,叶碧霞,王小龙,傅 彬,杨小龙,张 晶
(四川理工学院生物工程学院,四川自贡 643000)
一株产蓝色素菌株的筛选及初步鉴定
左勇,江鹏,叶碧霞,王小龙,傅彬,杨小龙,张晶
(四川理工学院生物工程学院,四川自贡 643000)
从自贡地区土壤中分离得到一株产蓝色素细菌,编号为T2013。通过形态特征观察、生理生化实验分析和全细胞脂肪酸检测以及16S rDNA比对分析,确定了该细菌为杜擀氏菌属的一种。通过系统进化树显示该细菌与菌株Duganellanigrescensstrain YIM H16(EF584756)具有较高的同源性。T2013可能为新种,命名为Duganellasp.T2013。
细菌,鉴定,蓝色素,16S rDNA
色素作为一种食品添加剂,必须严格保证无毒(低毒)和安全。如今,大多数合成色素因有致癌、致畸的作用,其使用受到限制,开发天然、绿色、无毒、营养的天然色素,将成为食品科技工作者的重要任务之一。
微生物色素是一种由微生物代谢产生的天然色素,其生产具有不受环境、空间和季节等因素限制的优越性[1]。研究表明,许多微生物色素除了可以作为潜在的食品添加剂(由于其被认为无毒或安全性高)外,还具有多种营养或药用等价值[2-4]。自然界中,微生物生产色素种类较为丰富,但发酵产生蓝色素却较罕见[5]。目前,国内研究最多的是链霉菌产生的蓝色素[6],除此之外,还有许多产蓝色素的菌株,如紫色色杆菌属、詹森菌属、假单胞菌属、交替假单胞菌属、杜擀氏菌属等[7-12]。
本研究拟从土壤中分离得到产蓝色素的菌株,再对目的菌株进行形态特征观察、生理生化实验分析和全细胞脂肪酸检测以及系统发育树分析,确定目的菌株分类地位,为进一步研究和应用该菌株奠定基础。
1 材料与方法
1.1材料与仪器
土样四川某坡地土壤;TaqDNA polymerase、dNTPs、DL2000TMDNA Marker宝生物工程(大连)有限公司;其余试剂和药品均为国产分析纯。PCR扩增使用通用引物27F和1492R[9]进行扩增。通用引物27F序列为5′-AGAGTTTGATCCTGGCTCAG-3′,和1492R序列为5′-GGTTACCTTGTTACGACTT-3′。
牛肉膏蛋白胨培养基、马铃薯葡萄糖培养基(PDA培养基)和高氏I号培养基[13]。
BD-30生物显微镜深圳市博视达光学仪器有限公司;DYY-12型电泳仪北京六一仪器厂;Bio-best200E凝胶成像分析系统美国西蒙公司;PCR仪美国Thermo公司;6890N气相色谱质谱联用仪安捷伦公司;D3024台式高速微量(冷冻型)离心机大龙创新实验仪器(北京)有限公司。
1.2实验方法
1.2.1样品的处理在无菌条件下将土壤研细后,称取10.0 g土壤于90 mL带玻璃珠的无菌水中,振荡20 min,静置1 min。
1.2.2筛选方法采用稀释涂布法筛选菌株,取10-3、10-4、10-5的稀释液各0.1 mL进行平板涂布。置于30 ℃下培养24 h,挑取产色素的(有颜色)单菌落进行划线分离得到纯种,并保存于相应的斜面培养基上。选取产蓝色素的菌株作为目的菌株。
1.2.3细菌全细胞脂肪酸鉴定先将菌株T2013采用划线法(划四个区)接种在含牛肉膏蛋白胨培养基的平板上,30 ℃倒置培养,1 d。再用无菌竹签刮取40 mg第三区生长培养物(40 mg细菌),置于8mL的螺口玻璃管中,通过分离提取脂肪酸以及甲基化后经气相色谱分析脂肪酸组分。具体操作方法按张文俊[14]等人的方法进行实验。
1.2.4细菌形态观察及生理生化实验通过平板法观察菌落特征,采用光学显微观察菌体特征。选取吲哚实验、V-P实验、甲基红实验、反硝化实验、硫化氢实验、接触酶实验、淀粉水解实验、明胶液化实验及碳源利用等生理生化实验对菌株进行鉴定,具体方法参见东秀珠等编著的《常见细菌系统鉴定手册》[15]、R.E.布坎南和N.E.吉本斯等编著《伯杰细菌鉴定手册》[16]。
1.2.516S rDNA的鉴定细菌T2013基因组DNA的提取采用水煮法[17-18]。挑取2环斜面活化24 h的菌株,接种于盛有50 mL液体高氏I号培养基的250 mL的摇瓶中,30 ℃,200 r/min,培养24 h。吸取1 mL培养液于1.5 mL的无菌离心管中,7000 r/min,离心2 min。弃上清,加入200 μL ddH2O,100 ℃恒温15 min。10000 r/min离心10 min。将上清液作为PCR扩增模板。
PCR扩增体系(50 μL反应体系、冰上操作)为:10×PCR缓冲液(Mg2+free)5 μL、dNTP MIX(2.5 mmol/L)4 μL、MgCl2(25 mmol/L)4 μL、引物27F(10 pmol·μL-1)0.5 μL、引物1492R(10 pmol·μL-1)0.5 μL、基因组DNA模板 2 μL、DNA Taq酶(5 U·μL-1)0.5 μL、ddH2O 33.5 μL。
PCR扩增循环参数为:95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共35个循环,反应前预变性(95 ℃)5 min,循环结束后应延伸10 min(72 ℃)。PCR产物用1%的琼脂糖凝胶电泳进行检测并送上海杰李生物技术有限公司进行测序。
1.2.6系统发育树分析将所测基因组序列的拼接序列在NCBI网页上的GenBank数据库中进行相似性分析,并下载相近菌种的16S rDNA序列,以“.Fasta”格式保存。用Clustal X软件进行序列比对,以MEGA5.05软件进行数据分析以及采用Neighbor-Joining(N-J)构建系统发育树(自举1000次),分支聚类的稳定性用Boot-strap方法进行评价。
2 结果与分析
2.1菌株的筛选
在所取的100多个土样中分离得到52株产色素的菌株,其中大多数菌株产红色、紫红色、紫色、棕红色、褐色、橙色或橙红色色素,其中1株产绿色素,有2株产蓝色素,筛选得到的2株产蓝色素的菌株如图1所示。

图1 两株产蓝色素的菌株Fig.1 Two strains produce blue pigment
通过形态特征观察,左图可能为放线菌(编号为D2013),右图可能为细菌(编号为T2013)。由于细菌T2013的发酵周期短,放线菌D2013发酵周期长,且放线菌D2013产色素条件苛刻,因此以细菌T2013为后续研究对象。
2.2菌株T2013的形态特征
以产蓝色素的细菌T2013作为目的菌株进行平板划线分离培养及形体的显微观察,然后对挑取单菌落进行液态培养,培养结束后对代谢产生的色素进行提取,结果如图2所示。
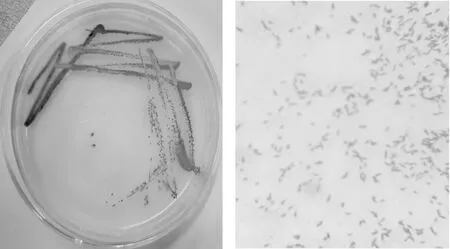
图2 菌株T2013的菌体、菌落照片Fig.2 Micrograph of strain T2013 and its colonies
由图2中的左图(高氏I号中菌落照片)可知,在高氏I号培养基中菌落光滑、边缘较整齐、湿润、呈紫色或蓝紫色、易挑起,培养后期菌体较干燥,菌体呈蓝色、蓝黑或蓝紫色;图2中的右图(结晶紫染色显微照片)可知菌株T2013为短杆菌。
2.3菌株T2013的生理生化鉴定
2.3.1菌株T2013的脂肪酸鉴定菌株T2013的全细胞脂肪酸经抽提分离及甲基化后,通过高效液相色谱的测定脂肪酸的成分。测定结果表明菌株T2013含有的脂肪酸为C10∶0(0.26%),3-OH C10∶0(3.64%),2-OH C12∶0(1.93%),3-OH C12∶0(3.41%),3-OH C12∶1(0.10%),C14∶0(0.65%),C16∶0(34.6%),C17∶0 cyclo(9.15%),C17∶0(0.25%),C17∶1 w7c(0.27%),C18∶0(0.36%),C19∶0 cyclo w8c(0.44%)。T2013的全细胞脂肪酸成分与杜擀氏菌的一致。
2.3.2菌株T2013的生理生化鉴定菌株T2013革兰氏染色呈阴性,接触酶实验、明胶液化实验、淀粉水解等实验均为阳性,产H2S实验、吲哚实验、V-P实验、甲基红实验、反硝化实验等均为阴性。菌落形态较小,呈蓝紫色,圆形,低突起,光滑,较湿,易挑取。T2013菌株于高氏I号培养基中培养,最适温度在28 ℃左右。可利用的碳源有纤维二糖、D-(+)木糖、七叶灵、水杨苷、葡萄糖、蔗糖及D-甘露糖等。(具体见表1)。
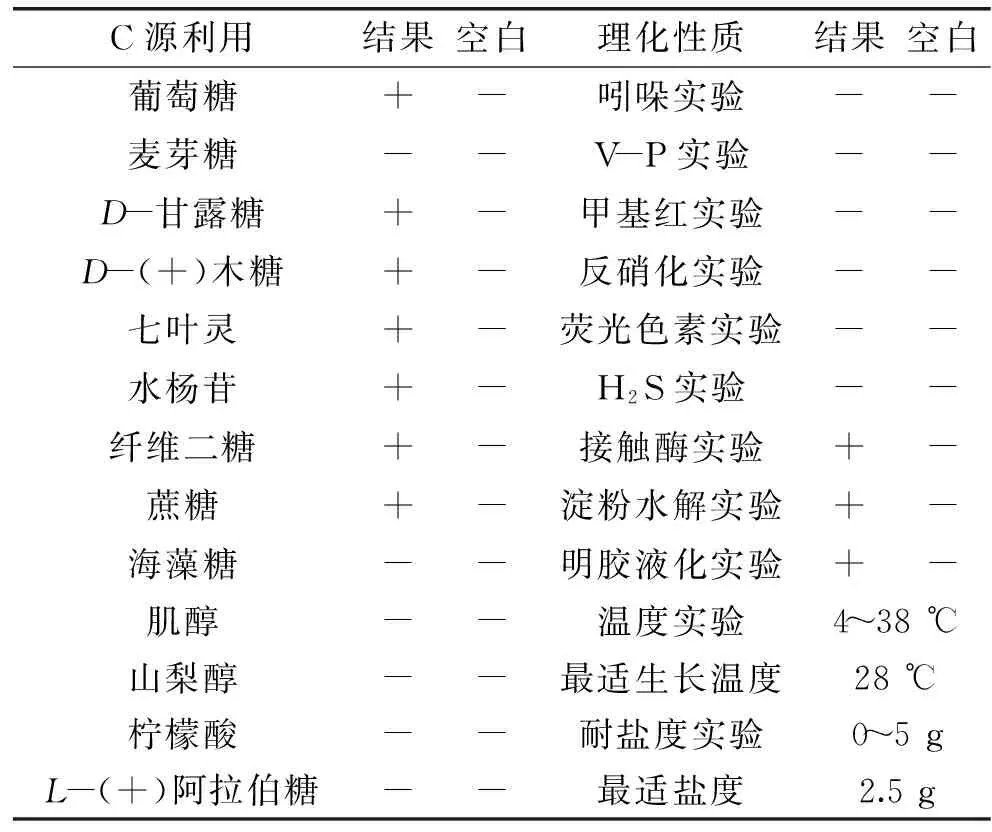
表1 菌株T2013的生理生化特征Table 1 The physiological and biochemical characteristics of the strain T2013
注:“+”表示该反应呈阳性;“-” 表示该反应呈阴性。
通过生化实验,并结合形态学鉴定结果,菌株T2013为一株产蓝色素的杜擀氏菌。
2.4PCR产物电泳图
从图3可知该菌株的16S rDNA产物的PCR产物的碱基对大约为1400 bp。PCR产物进行序列分析。注:图3中1为DNA Marker,2为阴性对照和3为菌株T2013 16S rDNA的PCR产物。所使用的DNA Marker为DL2000。

图3 PCR产物电泳图Fig.3 The electrophoresis of PCR products
2.5菌株T2013的16S rDNA的序列测定
PCR扩增产物经纯化后,于上海杰李生物科技有限公司测序。将所测序列经过拼接后得到的1321bp,碱基序列如下:

将所测基因组序列的拼接序列在 NCBI 网页上的 GenBank 数据库中进行相似性分析及注册细菌T2013 DNA序列的登录号。菌株T2013与杜擀氏菌的同源性较高,从97% 到 99%,。菌株T2013的16S rDNA序列在GenBank的核酸序列数据库中的为登录号为KP250653。
2.6系统发育分析
由图4可知,菌株T2013与DuganellanigrescensstrainYIM H16(EF584756)、Pseudoduganellasp. NI28(KM087999)、Duganellasp. BAB-3519(KJ871607)的相似性较高,与DuganellanigrescensstrainYIM H16的相似最大,可信度较高。据此可知菌株T2013属于杜擀氏菌属,Duganellasp.T2013很可能是杜擀氏菌属一个新种,命名为Duganellasp.T2013。
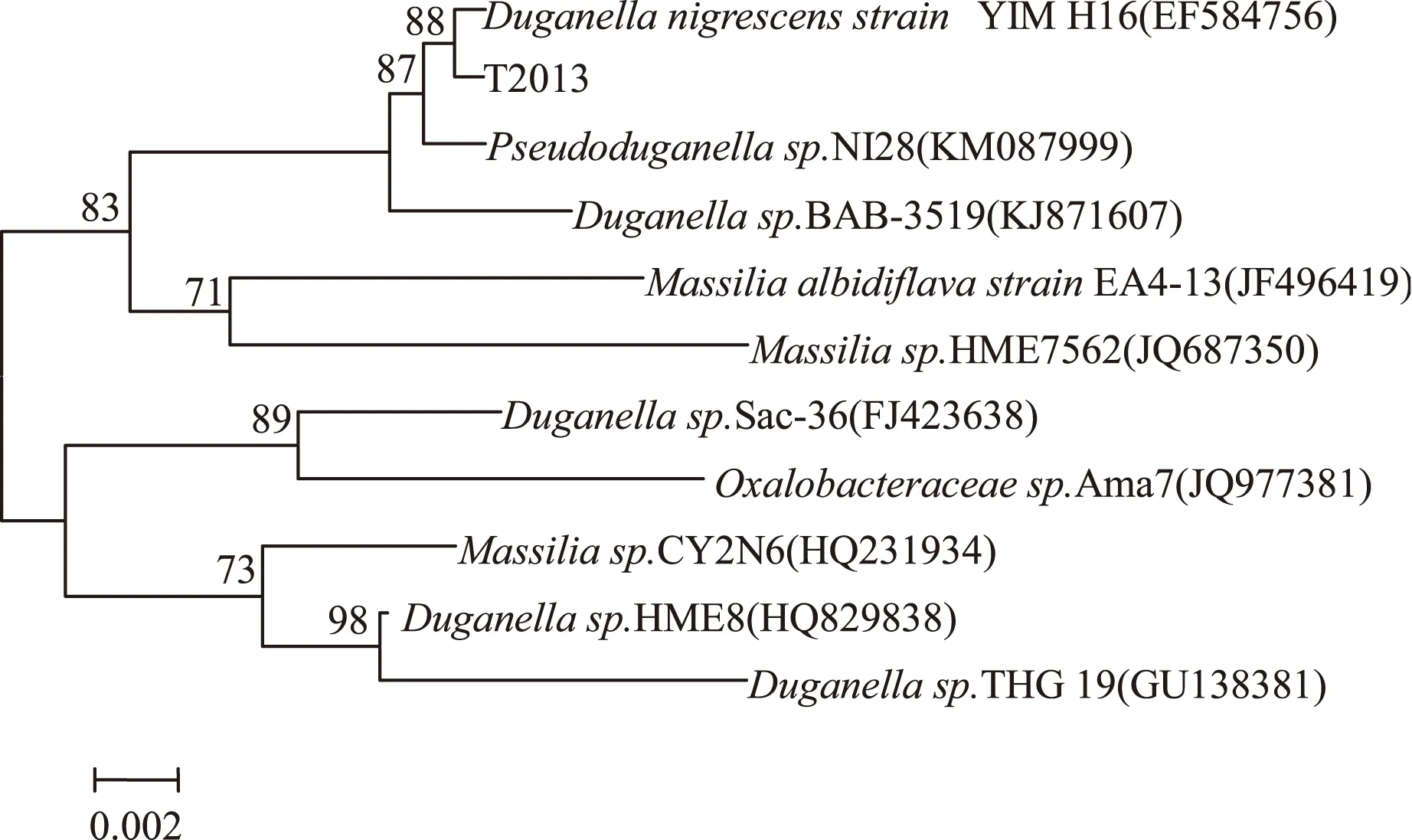
图4 菌株T2013的系统发育树Fig.4 Phylogenetic tree of strain T2013
3 结论
本研究组从土壤中分离了一株产蓝色素的细菌T2013,经形态观察及革兰氏染色,发现其为革兰氏阴性杆菌,经形态特征的观察和生理生化实验分析以及16S rDNA 基因序列比对及系统进化树分析确定了该细菌是一株杜擀氏菌。该菌株能够产生胞内蓝色素,其产生的蓝色素的性质及安全性还有待进一步研究。
[1]Moselio S.Encyclopedia of Microbiology(Third,Edition)[M]. San Diego Calif:Academic Press,2009,457-471.
[2]Lu Yuan,Wang Liyan,Xue Yuan,et al. Production of violet pigment by a newly isolated psychrotrophic bacterium from a glacier in Xinjiang,China[J].Biochemical Engineering Journal,2009,43(2):135-141.
[3]Chidambaram Kulandaisamy Venil,Zainul Akmar Zakaria,Wan Azlina Ahmad,et al. Bacterial pigments and their applications[J]. Process Biochemistry,2013,48(7):1065-1079.
[4]李洪波,杜巍,赵凯,等.灵菌红素研究进展[J].生物技术通讯,2011,22(1):139-142.
[5]赵辉,闫华晓,王霞,等.一株产天然蓝色素海洋链霉菌的筛选鉴定[J],生物学杂志,2011,28(3):63-65.
[6]李一苇,陈晓琳,张明,等.一株产蓝色素菌株生物学特性及色素基本性质的研究[J],生物学杂志,2007,
24(1):41-43.
[7]张志东,楚敏,唐琦勇,等.一株蓝色素产生菌的鉴定及色素特性[J],食品科学,2012,33(9):236-239.
[8]王海胜,卢元,薛园,等.杜擀氏菌B2的蓝色素成分的分离及化学结构解析[J],化工学报,2008,59(3):630-635.
[9]Pemberton J M,Vincent K M,Penfold R J.Cloning and heterologous expression of the violacein biosynthesis gene cluster from Chromobacterium riolaceum. Current Microbiology,1991,22(6):355-358
[10]孙爱飞,庄荣玉,王国良.海洋细菌E18菌株的生物学特性及其蓝紫色素稳定性的研究[J],微生物学通报,
2007,34(4):691-694.
[11]温露,袁保红,李厚金,等.南海海洋细菌Pseudomonas sp.产生的一种抗肿瘤蓝色素[J],中山大学学报(自然科学版),2005,44(4):63-69.
[12]张瑞萍,蒋培霞,李春,等.重组柠檬酸杆菌合成紫色杆菌素的工艺条件优化[J],化工学报,2010,61(6):1495-1505.
[13]沈萍,陈向东.微生物学实验[M].第4版.北京:科学出版社,2007:15-20
[14]张文俊.产类胡萝卜素海洋微生物的分离鉴定及其特性研究[D].上海:上海海洋大学,2010.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-370.
[16]R.E.布坎南和 N.E.吉本斯等编著.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[17]夏涵,府伟灵,陈鸣,等.快速提取细菌DNA方法的研究[J],现代预防医学,2005,32(5):571-573.
[18]郑维,权春善,朴永哲,等.一种快速提取细菌总DNA的方法研究[J],中国生物工程杂志,2006,26(4):75-80.
Isolation and preliminary identification of strains producing blue pigment
ZUO Yong,JIANG Peng,YE Bi-xia,WANG Xiao-long,FU Bin,YANG Xiao-long,ZHANG Jing
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
A bacteria T2013 producing blue pigment was isolated from the soil in Zigong. According to morphological observation,biochemical and physiological characteristics experiment,whole-cell fatty acid detection and 16S rDNA sequence alignment,the strain was identified as one strain of the genusDuganellasp.. Phylogenetic analysis showed that strain T2013 had high homology withDuganellanigrescensstrainYIM H16(EF584756).This strain isolated was likely to be a new member of theDuganellasp.,tentatively namedDuganellasp. T2013.
bacteria;strain identification;blue pigment;16S rDNA
2015-04-23
左勇(1972-),男,硕士,教授,主要从事发酵工程方面的研究, E-mail:sgzuoyong@tom.com。
四川省教育厅成果转化项目(11ZZ016)。
TS201.3
A
1002-0306(2016)03-0166-04
10.13386/j.issn1002-0306.2016.03.027
