枸杞子总黄酮含量检测方法优化
2016-09-13刘景煜高锦明董娟娥
刘景煜,李 晨,高锦明,董娟娥,*
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.西北农林科技大学理学院,陕西杨凌 712100)
枸杞子总黄酮含量检测方法优化
刘景煜1,李晨1,高锦明2,董娟娥1,*
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.西北农林科技大学理学院,陕西杨凌 712100)
目的:筛选出枸杞子总黄酮适宜的提取及脱色素方法。方法:本研究通过比较考察脱色方法、提取溶剂、提取方法等对枸杞子总黄酮含量检测方法进行优化,并对新疆产的15份和宁夏产的40份枸杞子中总黄酮含量进行分析。结果:枸杞子总黄酮提取方法为:用95%乙醇回流提取,将提取液低温冷藏,除去沉淀,上清液浓缩至近干后用无水甲醇萃取,萃取液用于总黄酮含量分析。该方法可有效去除枸杞子中的水溶性色素。对不同产地枸杞子进行分析,结果表明宁夏产枸杞子总黄酮含量平均为1.134%,变异范围为0.851%~1.466%;新疆产枸杞子总黄酮含量平均为1.020%,变异范围为0.888%~1.241%。结论:该方法可简单有效的除去水溶性色素以减少其对总黄酮检测结果的影响,两产地间枸杞子总黄酮含量无显著差异(p>0.05)。
枸杞子,总黄酮,提取,新疆,宁夏
枸杞子为茄科植物宁夏枸杞LyciumbarbarumL.的干燥成熟果实,具有滋肝补肾、益精明目等功效[1],在我国宁夏、新疆、甘肃、青海、内蒙古等省均有栽培[2]。研究表明枸杞子有抑制癌细胞增长、降血糖、降血脂、抗氧化、提高免疫力和改善骨髓造血[3-8]等作用。枸杞子中有效成分包括多糖、甜菜碱、总黄酮、类胡萝卜素、多酚等[9-10]。目前,《中国药典》(2015版)仅对枸杞子多糖和甜菜碱作了含量限度的规定。
总黄酮是枸杞子中重要的活性成分之一,有较好的抗氧化、清除自由基、抗炎及抑制血管增生[11-15]等作用。因此,总黄酮也可作为衡量枸杞子品质的指标之一。目前,总黄酮的含量检测方法大多是利用黄酮类化合物分子结构上具有的邻二酚羟基可以与铝离子络合,在碱性条件下形成稳定的红色化合物,且在可见光区域(大多为510 nm)有较强吸收的原理进行。由于枸杞子提取液也为红色,且在可见光区有吸收,很大程度上影响了枸杞子总黄酮检测的准确性。目前报道的枸杞子总黄酮的检测方法仅对脂溶性色素进行了脱除[16],枸杞子中还含有大量的水溶性色素,会干扰检测结果的准确性,检测时应尽量排除水溶性色素的影响。目前枸杞子黄酮的提取方法有回流提取法、超声波提取法和微波提取法等[17-18]。提取方法不同枸杞子总黄酮提取得率不同,检测结果也会有很大差异。因此,有必要对枸杞子总黄酮的检测方法进行优化,建立一种准确度、加标回收率高的枸杞子总黄酮检测方法。
本研究通过考察脱色方法、提取溶剂、提取方法等对枸杞子总黄酮含量检测结果的影响,筛选出能够准确反映枸杞子中总黄酮含量的适宜提取和检测方法,并利用优化后的方法对来自宁夏40个和新疆15个不同产地的枸杞子样品中总黄酮含量进行分析,旨在为枸杞子中以总黄酮为指标的质量评价提供依据,也为枸杞子资源的开发利用及枸杞子产地的筛选奠定基础。
1 材料与方法
1.1材料与仪器
1.1.1材料来源及处理产自宁夏(40个)和新疆(15个)不同产地的枸杞子均为宁夏枸杞研究所提供,本研究中对各产地的样品按数字顺序标号。每个样品称取约20 g枸杞子,去除果柄后于105 ℃烘至恒重,冷却后粉碎,过40目筛,密封保存,备用。
1.1.2主要仪器与试剂DK-S26电热恒温水浴锅上海森信实验仪器有限公司;101A电热鼓风干燥箱上海实验仪器有限公司;FW400-A高速万能粉碎机北京中兴伟业仪器有限公司;RE-52AA旋转蒸发器上海亚荣生化仪器厂;UV-1800紫外-可见分光光度计上海美谱达仪器有限公司。
芦丁标准品中国药品生物制品检定所;95%乙醇、无水甲醇、亚硝酸钠、硝酸铝、氢氧化钠等试剂均为分析纯。
1.2实验方法
1.2.1标准曲线的绘制称取40 mg芦丁,无水甲醇溶解定容至100 mL,配制成浓度为0. 4 mg/mL的标准溶液。精密吸取0.5、1.0、1.5、2.0、2.5、3.0 mL分别置于10 mL容量瓶中,分别补加无水甲醇至总体积为3 mL,加0.5 mL 5% NaNO2水溶液,摇匀静置6 min,加0.5 mL 10% Al(NO3)3水溶液,摇匀静置6 min,加4 mL 4% NaOH水溶液,水定容,摇匀放置15 min。以不添加NaOH溶液(用4 mL蒸馏水代替NaOH溶液)的反应液为空白,于紫外-可见光分光光度计510 nm波长下测各浓度标准溶液吸光度。
以吸光度A为横坐标,芦丁标准溶液浓度C(mg/mL)为纵坐标做标准曲线,得到回归方程:C=0.0958A+0.0044,R2=0.9994。在0.02~0.12 mg/mL范围内有较好的线性关系。
1.2.2脱色方法选择
1.2.2.1对照组精密称取1.0000 g枸杞子粉末,50 mL 80%乙醇回流提取2次,1 h/次,过滤,合并滤液,定容至100 mL,待测。
1.2.2.2石油醚回流脱脂溶性色素精密称取1.0000 g枸杞子粉末,石油醚回流脱脂至提取液无色,过滤,残渣烘干后用50 mL 80%乙醇回流提取2次(每次1 h),过滤,合并滤液,定容至100 mL,待测。
1.2.2.3石油醚萃取脱脂溶性色素精密称取1.0000 g枸杞子粉末,50 mL 80%乙醇回流提取2次,1 h/次,过滤,合并滤液,减压回收至近干,用30 mL蒸馏水分散均匀,石油醚萃取至石油醚层无色,水相减压浓缩至近干,80%乙醇定容至100 mL,待测。
1.2.2.4活性炭吸附脱脂溶性色素精密称取1.0000 g枸杞子粉,加50 mL 80%乙醇回流提取2次,1 h/次,过滤,合并滤液,加入0.1 g活性炭,摇匀放置2 h,过滤,滤液用80%乙醇定容至100 mL,待测。
1.2.2.5水溶性色素脱除方法精密称取1.0000 g枸杞子粉,用50 mL 95%乙醇于80℃回流提取2次,1 h/次,过滤,合并滤液,滤液4 ℃冷藏2 h,过滤。滤液减压浓缩至近干,用无水甲醇定容至100 mL。摇匀,待测。
1.2.3提取溶剂对总黄酮检测结果的影响精密称取1.0000 g枸杞子粉,分别用50 mL 80%、95%乙醇于80 ℃回流提取2次,1 h/次,过滤,合并滤液,滤液4 ℃冷藏2 h,过滤。80%乙醇提取物用80%乙醇定容至100 mL;95%乙醇提取物的滤液减压浓缩至近干,用无水甲醇定容至100 mL。摇匀,测定总黄酮含量及加标回收率。
1.2.4提取方法对总黄酮检测结果的影响精密称取1.0000 g枸杞子粉末,按照崔大明等的方法[19],用50 mL 95%乙醇25 ℃超声提取2次,0.5 h/次;80 ℃回流提取2次,1 h/次,过滤,合并滤液,减压浓缩至近干,用无水甲醇定容至100 mL。摇匀,测定总黄酮含量及加标回收率。
1.2.5枸杞子总黄酮含量检测方法学考察
1.2.5.1供试液的制备精密称取1.0000 g枸杞子样品,50 mL 95%的乙醇80 ℃水浴回流提取2次,1 h/次,过滤,合并滤液,提取液4 ℃冷藏2 h,过滤,滤液减压浓缩至近干,无水甲醇分次溶解浓缩物,过滤,滤液用无水甲醇定容到100 mL,摇匀待测。
1.2.5.2精密度实验精密吸取同一供试品溶液2.0 mL于10 mL容量瓶中,显色、测吸光度,重复6次。
1.2.5.3重复性实验精密称取6份同一枸杞子样品1.0000 g,制备供试品溶液,计算枸杞子中总黄酮含量。
1.2.5.4加标回收率实验精密称取6份已知含量的枸杞子样品1.0000 g,分别加入11.0 mg芦丁标品,制备供试品溶液,计算加标回收率。
1.2.5.5稳定性实验分别将供试品显色液、供试品提取液、遮光处理的供试品提取液放置不同时间,每隔0.5 h测定一次吸光度,考察样品的稳定性。
1.2.6样品中总黄酮含量测定处理不同产地的样品,得到供试液,显色,测定吸光度,通过标准曲线方程计算得到枸杞子中总黄酮的含量(X),公式如下:
式中:X为总黄酮的含量(%);C为通过标准方程计算的样品比色液中的芦丁浓度(mg/mL);v为比色液体积(mL);d为稀释比例;m为样品的质量(g)。
1.3数据统计分析
数据用SPSS19.0软件进行方差分析,设置显著水平为p<0.05,数据用平均值±标准差(x±s)表示。
2 结果与讨论
2.1脱色方法对枸杞子总黄酮检测结果的影响
本实验对几种脂溶性色素脱除方法和水溶性色素脱除方法处理前后枸杞子中总黄酮含量差异性进行了考察,结果见图1。通过SPSS 19.0方差分析发现,脂溶性色素脱除各组总黄酮含量与对照组相比均无显著性差异(p>0.05),说明石油醚脱色、活性炭吸附脱色虽然除去了枸杞子中的脂溶性色素,但均不能有效去除枸杞子中影响总黄酮检测结果的有色物质。用脱除水溶性色素的方法处理后所检测的总黄酮含量显著低于对照组。枸杞子红色素为强极性分子,有弱碱性[20],其水溶液在波长520 nm处有最大吸收[21],在强碱性溶液中不稳定,随pH增加吸光度会增大[22]。用“亚硝酸铵-硝酸铝”法测定总黄酮含量的显色液最大吸收波长在510 nm处,因为显色剂中有氢氧化钠,枸杞子水溶性红色素的存在会干扰枸杞子总黄酮的检测,导致检测结果偏大。

表1 提取溶剂对枸杞子总黄酮检测结果的影响

图1 脱脂方法对枸杞子总黄酮检测结果的影响Fig.1 Effect of degreasing method on the contents of total flavonoids of L. Barbarum注:*表示与对照组相比差异显著(p<0.05)。
2.2提取溶剂对枸杞子总黄酮检测结果的影响
本实验以加标回收率为考察指标,对文献中常用的提取溶剂(80%乙醇)与95%乙醇的提取效果进行了比较。以80%乙醇和95%乙醇作为提取溶剂时,检测得到样品中总黄酮的含量分别为1.21%和1.10%。向样品中添加标准品后,再分别用80%乙醇和95%乙醇提取、检测,经计算加标回收率发现(表1),以95%乙醇为提取溶剂,检测样品总黄酮含量,加标回收率均在95%~105%范围内,符合检测要求;而以80%乙醇为提取溶剂,检测的加标回收率均大于110%,检测结果偏高,不符合检测要求。充分证实了前文“水溶性红色素导致检测结果偏大”的结论。本研究利用95%乙醇提取枸杞子中总黄酮,冷藏静置后发现有大量红色沉淀析出,沉淀可能是回流过程中溶于热乙醇的色素,温度降低使其溶解度降低而析出。当用80%乙醇提取时,将提取液冷藏静置后无红色沉淀析出,进一步证实了枸杞子中的有色杂质多为水溶性,不溶于高浓度乙醇。为了除去干扰总黄酮含量检测的有色杂质,将经过冷却除去大量红色素的提取液浓缩至近干,用无水甲醇萃取,得到的溶液用于总黄酮含量检测,以减少杂质的溶出。本法完全避免了水溶性色素对检测结果的干扰,使检测结果准确可靠。
2.3提取方法对枸杞子总黄酮含量的影响
本实验比较了回流提取和超声波提取对枸杞子总黄酮含量的影响,结果见图2。方差分析发现回流提取法的总黄酮含量显著高于超声波提取法的含量(p<0.05),因此选取回流提取法作为枸杞子总黄酮的提取方法。枸杞子总黄酮常用提取方法有微波提取法、回流提取法与超声波提取法[17-18]。采用微波提取时,由于在微波炉中无法进行溶剂回流,在加热过程中乙醇会不断挥发对溶剂浓度无法控制,无可比性,本文没有考察微波提取法。本文发现,回流提取法提取枸杞子总黄酮的含量比超声波提取法高。一般来说,回流过程中细胞内外成分达到浓度平衡所需的时间较长,在提取较短时间和较低温度下,超声法的提取效率高于回流提取法。但在大功率或长时间的超声提取条件下,会破坏成分的结构及活性[23],同时,由于超声波的热效应使提取温度难以保持恒定不变。通过优化回流提取的条件,可以使目标成分较完全提取出来,可作为提取黄酮类化合物的首选方法。
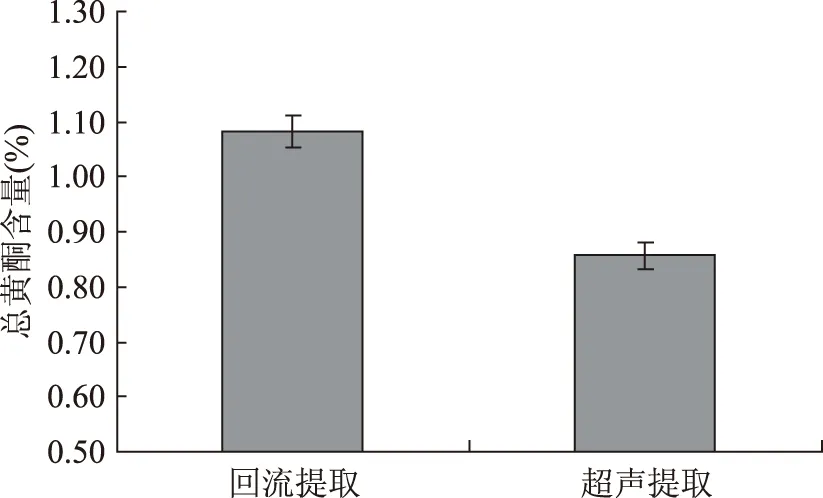
图2 提取方法对枸杞子总黄酮提取得率的影响Fig.2 Effect of extraction method on the contents of total flavonoids of L. barbarum
2.4枸杞子总黄酮含量检测方法考察
2.4.1精密度实验精密度实验结果见表2。经计算,相对标准偏差RSD=0.65%,显示仪器精密度良好。

表2 精密度实验结果
2.4.2重复性实验重复性实验结果见表3。经计算,相对标准偏差RSD=2.41%,符合分析要求,显示该方法重复性好。

表3 重复性实验结果
2.4.3加标回收率实验加标回收率结果见表4。按照本实验建立的方法测定总黄酮含量,各样品加标回收率均在95%~105%之间,平均加标回收率为99.63%,RSD=1.33%,符合检测要求,显示本方法在提取过程中总黄酮损耗少,准确度高。

表4 加标回收率实验结果
2.4.4稳定性实验稳定性实验结果见图3。表明随着放置时间的延长,各处理组的吸光度均会降低。供试液经遮光保存显色后吸光度在3.5 h内较稳定;供试液未遮光保存显色后吸光度在1.5 h内较稳定;供试品显色液吸光度在2.5 h开始明显降低。综上可知,供试品溶液应遮光保存,且在3.5 h内完成测量,显色液应在2.5 h内测定其吸光度。

图3 稳定性实验结果Fig.3 The results of stability test
2.5不同产地枸杞子总黄酮含量分析
本研究对宁夏及新疆产枸杞子总黄酮含量进行分析比较,结果见图4~图6。宁夏产枸杞子总黄酮含量(1.134%)略高于新疆产枸杞子(1.020%),两产地枸杞子总黄酮含量差异不显著(p>0.05)。

图4 宁夏及新疆产枸杞子总黄酮含量比较Fig.4 Comparison of total flavonoids contents of L. barbarum from Ningxia and Sinkiang province

图5 新疆产枸杞子各样品中总黄酮含量Fig.5 The contents of total flavonoids of L. barbarum from Sinkiang province注:小写字母不同表示差异显著(p<0.05),图6同。

图6 宁夏产枸杞子各样品中总黄酮含量Fig.6 The contents of flavonoids of L. barbarum from Ningxia province
宁夏不同产地枸杞子总黄酮含量平均为1.134%,变异范围0.851%~1.466%,分为4个差异水平。其中N-22号、N-23号、N-28号和N-31号枸杞子中总黄酮含量最高(a水平),变异范围为1.352%~1.459%;而N-2号、N-11号、N-12号、N-16号、N-39号枸杞子样品中总黄酮含量处于最低水平(d水平),变异范围为0.860%~0.980%。方差分析结果显示,宁夏产枸杞子总黄酮含量差异显著(p<0.05),各产地枸杞子总黄酮含量差异较大。
新疆不同产地枸杞子总黄酮含量平均为1.020%,变异范围为0.888%~1.241%,分为3个差异水平。其中X-10号、X-11号枸杞子中总黄酮含量最高(a水平),变异范围为1.159%~1.241%;而X-1号、X-2号、X-3号、X-5号、X-14号枸杞子总黄酮含量处于低水平(c水平),变异范围0.888%~0.966%。方差分析结果显示,新疆产枸杞子总黄酮含量差异显著(p<0.05)。
上述结果表明,新疆产枸杞子总黄酮含量略低于宁夏产枸杞子,但无显著性差异(p>0.05),但宁夏产的枸杞子质量参差不齐,不是所有产自宁夏的都是优质枸杞子。应制定相应的质量标准,严格控制枸杞子质量,防治以次充好现象。
3 结论
筛选出能够准确反映枸杞子中总黄酮含量的适宜提取和检测方法:用95%乙醇回流提取枸杞子总黄酮,将提取液低温冷藏,除去沉淀,上清液浓缩至近干后用无水甲醇萃取,萃取液用NaNO2-Al(NO3)3比色法检测总黄酮含量。该方法准确度和精密度高,重现性好,可以简单有效的除去水溶性色素以减少其对总黄酮检测结果的影响,为枸杞子中以总黄酮为指标的质量评价提供依据,也为枸杞子资源的开发利用及枸杞子产地的筛选奠定基础。
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:249.
[2]徐常青,刘赛,徐荣,等. 我国枸杞主产区生产现状调研及建议[J]. 中国中药杂志,2014,39(11):1979-1984.
[3]梁淑轩,马二红,许成燕,等. 枸杞多糖的硒化及其对人宫颈癌细胞的抑制作用[J]. 食品科学,2010,31(9):243-247.
[4]单铁英,赵如同,杨书良,等. 枸杞多糖对人肝癌细胞Bel-
7402的抑制作用及凋亡的研究[J]. 时珍国医国药,2010,21(8):1928-1929.
[5]李朝晖,马晓鹂,吴万征. 枸杞多糖降血糖作用的细胞实验研究[J]. 中药材,2012,35(1):124-128.
[6]龚涛,王晓辉,赵靓,等. 枸杞多糖抗氧化作用的研究[J]. 生物技术,2010,20(1):84-87.
[7]单铁英,关华,苏安英,等. 枸杞多糖对人外周血淋巴细胞免疫调节功能的影响[J]. 实用医学杂志,2010,26(3):361-265.
[8]任非非,刘敬霞,俞维,等. 枸杞不同制剂对环磷酰胺致血虚大鼠全血细胞及骨髓造血功能的影响[J]. 中国实验方剂学杂志,2012,18(3):187-190.
[9]王益民,张珂,许飞华,等. 不同品种枸杞子营养成分分析及评价[J]. 食品科学,2014,35(1):34-38.
[10]B Stephen Inbaraj,Lu H,Kao T H,et al.H. Simultaneous determination of phenolic acids and flavonoids in Lycium barbarum Linnaeus by HPLC-DAD-ESI-MS[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,51(3):549-556.
[11]S Magiera,M Zaręba. Chromatographic Determination of Phenolic Acids and Flavonoids in Lycium barbarum L. and Evaluation of Antioxidant Activity[J]. Food Analytical Methods,2015,8(10):2665-2674.
[12]CC Wang,SC Chang,B Stephen Inbaraj,et al. Isolation of carotenoids,flavonoids and polysaccharides from Lycium barbarum L. and evaluation of antioxidant activity[J]. Food Chemistry,2010,1:184-192.
[13]夏娜,赵丽凤. 黑果枸杞功能性成分抗氧化活性及对线粒体的保护作用研究[J]. 食品工业科技,2014,35(22):162-168.
[14]钱建亚,葛庆丰,刘松,等. 枸杞极性溶剂提取物的自由基淬灭性质[J]. 食品科学,2005,26(7):102-105.
[15]Wen-Bin Wu,Dian-Kun Hung,Fung-Wei Chang. Anti-inflammatory and anti-angiogenic effects of flavonoids isolated from Lycium barbarum Linnaeus on human umbilical vein endothelial cells[J]. FOOD and FUNCTION,2012,3(10):1068-1081.
[16]贾韶千,吴彩娥,杨剑婷,等. 枸杞中黄酮类化合物纯化工艺的研究[J]. 南京林业大学学报(自然科学版),2010,34(2):85-88.
[17]吴韶梅,哈婧,冀亚敏. 枸杞总黄酮的提取及抗氧化作用研究[J]. 中国食品添加剂,2013,5:133-137.
[18]杨鹏,巨敏,朱沛沛,等. 正交优化微波辅助提取枸杞中总黄酮的工艺研究[J]. 食品工业,2012,1:28-30.
[19]崔大明,张益波,付璐,等. 响应面法优化超声法提取枸杞中总黄酮工艺[J]. 食品研究与开发,2011,3:55-59.
[20]鲁晓丽,刘继婷,张自萍. 大孔吸附树脂脱除枸杞多糖色素技术研究[J]. 食品工业科技,2014,35(18):293-297.
[21]刘咏,罗建平. 枸杞中食用红色素的提取及稳定性研究[J]. 食品科学,2005,26(5):168-170.
[22]李宏燕,黄小花,赵广涛. 宁夏枸杞色素的提取及其稳定性研究[J]. 食品研究与开发,2013,34(5):66-68.
[23]薛峰,李春娜,李朋收,等. 超声提取在中药化学成分提取中的应用[J]. 中国实验方剂学杂志,2014,20(18):231-234.
Optimization on test method of total flavonoids fromLyciumbarbarumL.
LIU Jing-yu1,LI Chen1,GAO Jin-ming2,DONG Juan-e1,*
(1.College of Life Sciences,Northwest A&F University,Yangling 712100,China;2.College of Sciences,Northwest A&F University,Yangling 712100,China)
In this study,determination methodology of total flavonoids fromLyciumbarbarumwas optimized employing decolorization,extraction solvent,and extraction method. The optimal conditions were determined as follows:theLyciumbarbarumwas extracted with reflux by 95% ethyl alcohol. Subsequently,the obtained extracting solution was refrigerated to remove the precipitate and the up-phase was concentrated. Furthermore,the concentrated solution was purified by extracting with absolute methanol. The purified solution was subsequently used for detecting the total flavonoids. With the optimized determination methodology,the average content of total flavonoids was 1.134% deriving from NingxiaLyciumbarbarumwhile 1.020% from Sinkiang,and the variation range were 0.851% to 1.466% and 0.888% to 1.241%,respectively. This research can effectively remove the water soluble pigment which influenced the determination accuracy of total flavonoids.
LyciumbarbarumL.;general flavones;extraction;Sinkiang;Ningxia
2015-12-08
刘景煜(1992-),女,在读硕士研究生,研究方向:中药质量控制,E-mail:liujingyu1023@163.com。
董娟娥(1968- ),女,博士,教授,主要从事药用植物次生代谢和天然产物开发利用的教学和研究工作,E-mail:dzsys@nwsuaf.edu.cn。
TS201.1
B
1002-0306(2016)13-0304-05
10.13386/j.issn1002-0306.2016.13.054
