解淀粉芽孢杆菌果聚糖的化学修饰与抗氧化、抗肿瘤活性研究
2016-09-13张丽姣孙媛霞
张 颖,曾 艳,张丽姣,郁 鹏,孙媛霞,*
(1.中国科学院天津工业生物技术研究所,天津 300308;2.天津科技大学生物工程学院,天津 300457)
解淀粉芽孢杆菌果聚糖的化学修饰与抗氧化、抗肿瘤活性研究
张颖1,2,曾艳1,张丽姣1,2,郁鹏2,孙媛霞1,*
(1.中国科学院天津工业生物技术研究所,天津 300308;2.天津科技大学生物工程学院,天津 300457)
对解淀粉芽孢杆菌果聚糖(L)进行乙酰化、磺酰化、硫酸化修饰,对获得的相应化学修饰产物(YL,HL,SL)进行抗氧化与抗肿瘤活性研究。发现经化学修饰后,解淀粉芽孢杆菌果聚糖的抗氧化性与抗肿瘤活性显著提高(p<0.05),不同化学修饰的影响不同。各果聚糖通过ABTS自由基清除能力、DPPH自由基清除能力和铁还原力测试的抗氧性顺序为SL>HL>YL>L,硫酸化修饰产物的抗氧化效果最明显。各果聚糖对对宫颈癌细胞Hela的抑制活性顺序为YL>HL>SL>L,乙酰化修饰产物的抗肿瘤活性效果最明显。上述结果说明化学修饰对微生物多糖的功能活性提升具有积极的作用。
解淀粉芽孢杆菌果聚糖,化学修饰,抗氧化性,抗肿瘤活性
由于多糖的活性直接或间接地受其分子结构的影响,化学官能团在多糖糖链上的引入,有可能改进多糖物化性能,提高其生物活性,扩大其药理应用范围。因此,近年来多糖分子结构的修饰受到人们的广泛关注。目前对多糖进行修饰的常见方法有硫酸化、磷酸化、乙酰化、烷基化、磺酰化、羧甲基化等[1-2]。然而关于多糖化学分子修饰的文献主要集中在植物多糖和真菌子实体多糖上[3-5],涉及微生物多糖的研究较少。微生物多糖具有生产周期短、产量稳定、分离纯化简单等生产优势[6-7]。如果化学修饰能明显提高或开拓微生物多糖的功能,必能促进其工业生产的更好发展。
解淀粉芽孢杆菌(Bacillusamyloliquefaciens)属于革兰氏阳性、好氧型杆状细菌,是公认安全菌株[8]。目前已有解淀粉芽孢杆菌多糖发酵生产与功能研究的相关报道。如李彦岩等筛选得到一株解淀粉芽孢杆菌LPL061,优化的多糖发酵产率为4.46 g/L。其发酵胞外多糖具有免疫调节作用[9-10]。Chen YT等发现来源于冬麦的解淀粉芽孢杆菌的胞外多糖能够抑制胃癌细胞MC-4和SGC-7901生长活性[11]。然而,微生物发酵产率仍是制约解淀粉芽孢杆菌多糖应用推广的要素。与此同时,解淀粉芽孢杆菌多糖的结构解析、修饰以及构效关系的研究也有待深入。本课题组于2015年报道了解淀粉芽孢杆菌多糖的微生物发酵高效生产(104.37 g/L)[12],并鉴定发酵产物为果聚糖结构。
本文以解淀粉芽孢杆菌发酵生产的果聚糖L(本文简称为L)为原料,对其分别进行乙酰化,磺酰化和硫酸化修饰,并对果聚糖L及其化学修饰产物的抗氧化性、抗肿瘤活性进行测试比较,探讨化学修饰对解淀粉芽孢杆菌果聚糖活性的影响。
1 材料与方法
1.1材料与仪器
甲酰胺、N-溴代丁二酰亚胺、N,N-二甲基甲酰胺、三正丁胺、盐酸羟胺、乙酸酐、吡啶、氢氧化钠、乙酸钠、过硫酸钾、硫酸亚铁、三氯化铁、乙醇、甲苯-4-磺酰氯分析纯,国药试剂化学试剂有限公司;氯磺酸分析纯,山东西亚试剂公司;2,2-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2-azinobis(3-ehtylbenzothiazolin-6-sulfnic acid)diammoniumsalt,ABTS)、2,4,6-三吡啶基三嗪(2,4,6-tri(2-pyridyl)-1,3,5-triazine,TPTZ)、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)分析纯,美国Sigma-Aldrich公司;人宫颈癌细胞Hela由天津科技大学制药工程实验室提供。
85-2型恒温磁力搅拌器上海司乐仪器有限公司;冷冻干燥机(FD-1-50)北京博医康实验仪器有限公司;VERTEX70型傅立叶变换红外光谱仪德国Bruker公司;紫外分光光度计(UV-1800)日本岛津公司;CO2培养箱(HERAcell 150i) 美国Thermo公司。
1.2实验方法
1.2.1乙酰化修饰参照Wang等[13]的方法对解淀粉芽孢杆菌果聚糖L进行乙酰化修饰。称取400 mg果聚糖L加入到20 mL的甲酰胺中,待其完全溶解后,加入10 mL乙酰化试剂(10 mg N-溴代丁二酰亚胺溶于10 mL乙酸酐),混合物于60 ℃反应4 h后,加入4 mL的二次水终止反应,用1 mol/L氢氧化钠调节反应溶液pH至中性,然后将混合物转移至7000 u的透析袋中,去离子水透析4 d后,收集透析液,冷冻干燥后得到乙酰化多糖,简称为YL。
1.2.2磺酰化修饰参照Liu等[14]的方法进行磺酰化衍生。于冰浴条件下加入4 mL二甲基亚砜溶解1 g多糖L,加入4 mL吡啶和2.8 g甲苯-4-磺酰氯,混合后于常温反应6 h,加入少量二次水终止反应。加入3倍体积无水乙醇,过夜沉淀多糖,去离子水复溶多糖,调pH至中性,将混合物转移至7000 u的透析袋中,去离子水透析4 d后,收集透析液,冷冻干燥后得到磺酰化多糖,简称为HL。
1.2.3硫酸化修饰参照Zhang等[15]的方法进行硫酸化修饰。在冰浴条件下滴加5 mL氯磺酸到30 mL N,N-二甲基甲酰胺配制硫酸化试剂。称取400 mg果聚糖L加入20 mL的甲酰胺中,于50 ℃溶解30 min后,加入7.5 mL硫酸化试剂,反应混合物于50 ℃反应3 h后,用1 mol/L氢氧化钠调节反应液pH至中性,然后将混合物转移至7000 u的透析袋中,去离子水透析4 d后,收集透析液,冷冻干燥后得到硫酸化多糖,简称为SL。
1.2.4红外光谱分析取适量样品经KBr压片后,于红外光谱仪在4000~400 cm-1扫描。
1.2.5抗氧性测试采用张颖等[16]的方法进行DPPH自由基清除能力、ABTS自由基清除能力和铁还原能力测试。
ABTS自由基清除能力测试:100 μL样品溶液与3000 μL由磷酸盐缓冲液(10 mmol/L,pH7.4)稀释的ABTS自由基溶液(其在734 nm处吸光值为0.70±0.02)快速混匀后,避光反应6 min,测定反应液在734 nm处的吸光度。按照公式1计算ABTS自由基清除率:
ABTS自由基清除率(%)=(Ablank-Asample)/Ablank×100
式(1)
式中:Ablank为空白样品吸光度;Asample为测试样品吸光度。
DPPH自由基清除能力测试:1 mL样品溶液、1 mL由无水乙醇配制0.2 mmol/L的DPPH溶液和1 mL二次水快速混匀后,避光反应30 min,测定反应液在5l7 nm处的吸光值。按照公式(2)计算DPPH自由基清除率:
DPPH自由基清除率(%)=(Ablank-Asample)/Ablank×100
式(2)
式中:Ablank为空白样品吸光度;Asample为测试样品吸光度。
铁还原能力测试:取100 μL样品溶液与3 mL铁还原(FRAP)试剂混匀后于37℃水浴中反应5 min,测定593 nm处吸光值。同时取浓度0~1.0 mmol/L FeSO4溶液各100 μL代替样品反应,以593 nm处吸光值为纵坐标,FeSO4浓度为横坐标,制作标准曲线。通过标准曲线计算样品对应的FeSO4浓度,表示铁还原能力。
1.2.6抗肿瘤活性测试采用MTT法测试多糖对体外培养的宫颈癌细胞Hela的抑制活性。用DMEM将样品母液3 mg/mL稀释成系列浓度:0.1、0.5、1.5、3.0 mg/mL,作为实验样品;取对数生长期的Hela细胞,以5×104个/mL的密度接种于96孔板内,每孔100 μL,于37 ℃、5% CO2培养箱中孵育24 h使细胞完全贴壁。移除培养基,每孔加入含不同质量浓度的样品100 μL。实验设阳性对照组、阴性对照组和实验组。阳性对照组加入顺铂(终浓度10 μg/mL),阴性对照组不加多糖样品而加入等体积的DMEM培养基,实验组加入含不同浓度多糖(终浓度0.05~3 mg/mL)的DMEM培养基,每个浓度均设3个平行孔。继续培养24 h,然后每孔加入10 μL的MTT溶液,其终浓度为0.5 mg/mL,继续孵育4 h后,4500 r/min离心10 min,弃去上清,加入150 μL DMSO,溶解活细胞与MTT生成的甲瓒,37 ℃震荡10 min,利用酶标仪测定其在490 nm的吸光值。按照式(1)~式(3)计算细胞抑制率:
抑制率(%)=(A0-A)/A0×100
式(3)
式中:A0为阴性对照组吸光度;A为测试样品组吸光度。
1.2.7数据处理方法采用SPSS19.0 对实验数据进行分析,抗氧化性与抗癌性测试结果由平均值±标准偏差表示。组间两两比较采用方差分析中的两两比较t检验。
2 结果与分析
2.1化学修饰结果
以解淀粉芽孢杆菌果聚糖L为原料进行化学修饰,其乙酰化产物YL为白色样品,得率34.4%。磺酰化产物HL为淡黄色样品,得率43.2%。而硫酸化产物SL为黄色样品,得率28.5%。与未修饰前的L相比,三种衍生物的总糖含量均降低,这与先前报道一致[14-15]。主要原因是多糖的羟基发生乙酰酯、硫酸酯化反应,或者被磺酸基团取代,使得组成多糖的单糖比例下降。经测试,衍生物YL、HL和SL的取代度分别为0.14、0.16和2.02。
2.2红外光谱分析
解淀粉芽孢杆菌果聚糖L及其化学修饰产物(YL,HL,SL)的红外光谱如图1所示,所有的样品均具有3350~3400 cm-1的O-H键的伸缩振动峰和2940 cm-1的C-H键的伸缩振动峰,说明仍具有典型的多糖结构,在化学修饰过程中多糖的官能团未发生变化。与L比较,乙酰化产物YL在1688 cm-1出现新的对应于C=O键的伸缩振动吸收峰和1376 cm-1对应于C-O-C键的伸缩振动峰[17],磺酰化产物HL在1249 cm-1和812 cm-1出现的增强吸收峰对应于S=O键伸缩振动峰与C-O-S键伸缩振动峰[18],与此类似,硫酸化产物SL分别在1255 cm-1和815 cm-1出现对应于S=O键伸缩振动峰与对应于C-O-S键伸缩振动峰[19],证明三种化学修饰产物制备成功。
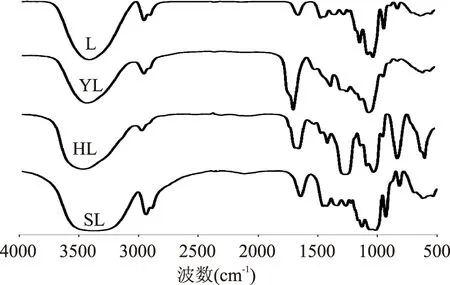
图1 解淀粉芽孢杆菌果聚糖与其化学修饰产物的红光光谱Fig.1 IR spectra of levan from Bacillus amyloliquefaciens and its chemical modified products
2.3抗氧化性分析
抗氧化剂的作用机制非常复杂,包括清除自由基、络合金属离子、终止链式激发反应、降解过氧化物和阻断持续的脱氢反应等[20]。而多糖抗氧化性强弱可通过测定其对自由基的清除效率或对还原性物质的保护作用来评价[21]。本实验采用了常见的DPPH自由基清除,ABTS自由基清除与铁还原能力评价化学修饰对解淀粉芽孢杆菌果聚糖抗氧化性的影响。
如图2所示,解淀粉芽孢杆菌果聚糖L对DPPH自由基没有明显的清除效果。而乙酰化、磺酰化与硫酸化的产物对DPPH自由基都有一定的清除作用,而且随着样品浓度增大,自由基清除作用增大,两者呈现正相相关关系。各果聚糖清除DPPH自由基能力顺序为SL>HL>YL>L。ABTS自由基清除测试结果与DPPH自由基清除测试结果一致。在化学修饰前,解淀粉芽孢杆菌果聚糖L几乎不具备清除ABTS自由基的能力。而在化学修饰后,衍生果聚糖的ABTS自由基清除能力增强(p<0.05)。各果聚糖清除ABTS自由基能力顺序依旧为SL>HL>YL>L(图3),清除效果均随浓度增加。在铁还原能力测试中,解淀粉芽孢杆菌果聚糖L本身几乎不具有铁还原能力,但经乙酰化、磺酰化与硫酸化后,铁还原能力都有一定增强,测试的铁还原能力顺序为SL>HL>YL>L(表1)。虽然果聚糖L经化学修饰后的抗氧化性效果并未达到理想状态,但由于多糖的活性受其结构如单糖组成,分子量大小,糖苷键链接方式等诸多因素影响[22],化学修饰后的抗氧化测试结果依旧能说明化学修饰对提高多糖抗氧化性具有积极的应用价值。
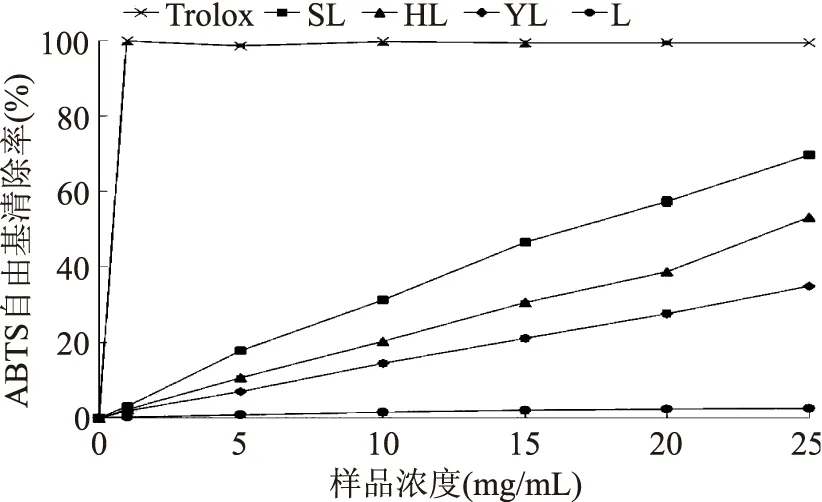
图3 解淀粉芽孢杆菌果聚糖与其化学修饰产物的ABTS自由基清除能力Fig.3 The ABTS radical scavenging activity of levanfrom Bacillus amyloliquefaciens and its chemical modified products

表1 解淀粉芽孢杆菌果聚糖与其化学修饰产物的铁还原能力
Zhang[23]等认为多糖的羟基被其他化学基团取代后,有诸多原因会促使样品的抗氧化性增强。如修饰后样品的水溶性增加,对H2O2诱导产生的Fe3+等金属离子螯合作用增强,供氢和供电子能力增强。此外,样品的极性与分子间氢键的变化对化学修饰多糖的抗氧化性也会有所影响。由于DPPH自由基清除效果主要依赖于抗氧化剂的供氢能力[15],而ABTS自由基清除与铁还原效果主要依赖于抗氧剂的供电子能力[24-25]。由此可推断,本实验的三种化学修饰均能提高解淀粉芽孢杆菌果聚糖的供氢与供电子能力,其中以硫酸化衍生效果最佳。这一现象与Chen等对化学修饰玉米丝多糖的抗氧化性测试结果相似。与未修饰的玉米丝多糖和乙酰化的玉米丝多糖相比,硫酸化的玉米丝多糖的DPPH自由基清除能力与铁还原效果更好[26]。
2.4抗肿瘤活性分析
本实验采用MTT比色法进行了解淀粉芽孢杆菌果聚糖L及其化学修饰产物对宫颈癌细胞Hela的抑制活性研究,结果如图4所示,L、SL、HL和YL对宫颈癌细胞Hela均具有一定的抑制效果,且随着样品浓度的升高,抑制活性升高,呈剂量依赖性。在0.5~3 mg/mL浓度范围内,较其它三种修饰多糖而言,乙酰化果聚糖YL对宫颈癌细胞Hela具有较好的抑制活性,在3 mg/mL时,YL对Hela细胞的抑制率为65.23%,是0.01 mg/mL阳性对照顺铂抑癌效果的79.67%。当样品浓度为1 mg/mL时,L、SL、HL和YL对Hela细胞的抑制率分别为44.47%、48.28%、49.50%和53.71%,即YL>HL>SL>L。
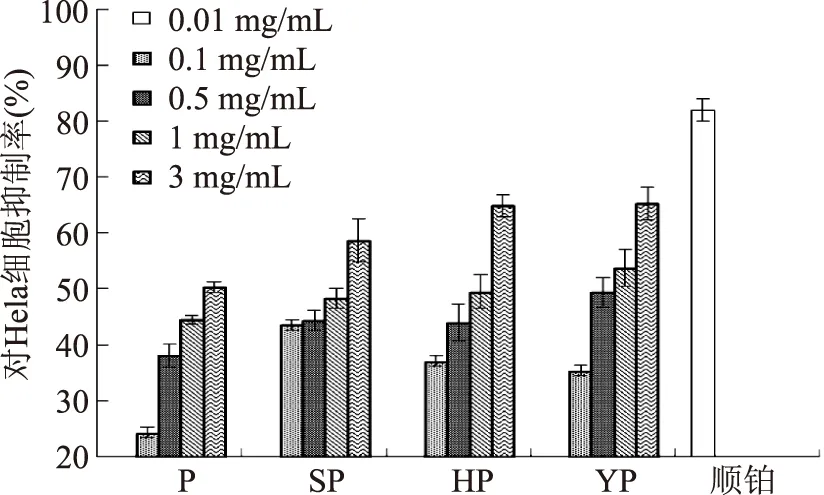
图4 解淀粉芽孢杆菌果聚糖与其化学修饰产物对宫颈癌细胞Hela的抑制活性Fig.4 The inhibitory activity of levanfrom Bacillus amyloliquefaciens and itschemical modified products on Hela cells
在经化学修饰的杏鲍菇多糖抑制白血病K562细胞生长研究中,陈琳[27]等发现,乙酰化修饰对多糖抗肿瘤活性的提高效果比硫酸化修饰更强。这一报道与本实验结果类似。硫酸根基团能提高多糖糖链的屈伸程度,乙酰基则可以改变多糖的横次序和定向性。这种引入官能团对多糖结构的作用差异,可能是化学修饰造成多糖活性不同的主要原因。然而针对化学修饰后多糖的构效关系与作用机制的研究目前较少,依然有待进一步的深入。
3 结论
解淀粉芽孢杆菌果聚糖经化学修饰,在糖链上引入了乙酰酯、硫酸酯或磺酸基团,抗氧化性与抗肿瘤活性明显增加。推测解淀粉芽孢杆菌果聚糖经化学修饰后的抗氧化性提高与其供氢与供电子能力提高有关,而抗肿瘤活性的增强则与多糖糖链的屈伸程度、横次序和定向性的改变有关。三种化学修饰中,硫酸化修饰对果聚糖抗氧化性提高效果最佳,乙酰化修饰对果聚糖抗肿瘤活性提高效果最佳。说明不同的化学修饰衍生试剂对微生物多糖功能提升具有不同的效果。
[1]李玉华,王凤山,贺艳丽. 多糖化学修饰方法研究概况[J].中国生化药物杂志,2007,28(1):62-65.
[2]孟思彤,徐艳芝,王振月. 多糖的化学修饰对其生物活性影响研究进展[J]. 天然产物研究与开发,2014,26(11):1901-1905.
[3]曲瑾郁,任大明. 蛹虫草多糖的化学修饰及体外抗氧化能力[J]. 食品科学,2011,32(15):58-61.

[5]Du XJ,Zhang JS,Lv ZW,et al. Chemical modification of an acidic polysaccharide(TAPA1)fromTremellaaurantialbaand potential biological activities[J]. Food Chemistry,2014,(143):336-340.
[6]郭敏,张宝善,金晓辉. 微生物发酵生产多糖的研究进展[J]. 微生物学报,2008,35(7):1084-1090.
[7]Donot F,Fontana A,Baccou JC,et al. Microbial exopolysaccharides:Main examples of synthesis,excretion,genetics and extraction[J]. Carbohydrate Polymers,2012,87(2):951-962.
[8]张娟,杨彩梅,曹广添,等.解淀粉芽孢杆菌及其作为益生菌的应用[J].动物营养学报,2014,26(4):863-867.
[9]李彦岩,张彩,范熠,等.一株解淀粉芽孢杆菌产糖条件的优化[J].食品科学,2013,34(7):185-189.
[10]范熠,刘丽莎,韩玉竹,等.解淀粉芽孢杆菌胞外多糖的理化性质及免疫调节作用[J].中国农业大学学报,2014,19(1):131-136.
[11]Chen YT,Yuan Q,Shan LT,et al.Antitumor activity of bacterial exopolysaccharides from the endophyteBacillusamyloliquefacienssp. isolated fromOphiopogonjaponicas[J]. Oncology Letters,2013,5(6):1787-1792.
[12]张丽姣,曾艳,张颖,等.解淀粉芽孢杆菌胞外多糖发酵条件的优化[J].食品工业科技,2015,36(9):214-219.
[13]Wang J,Zhang QB,Zhang ZS,et al. Synthesized phosphorylated and aminated derivatives of fucoidan and their potential antioxidant activityinvitro[J]. International Journal of Biological Macromolecules,2009,44(2):170-174.
[14]Liu XX,Wan ZJ,Shi L, et al.Preparation and antiherpetic activities of chemically modified polysaccharides fromPolygonatumcyrtonemaHua[J]. Carbohydrate Polymers,2011,83(2):737-742.
[15]Zhang ZS,Zhang QB,Wang J,et al. Preparation of the different derivatives of the low-molecular-weight porphyran from Porphyrahaitanensis and their antioxidant activitiesinvitro[J]. International Journal of Biological Macromolecules,2009,45(1):22-26.
[16]张颖,曾艳,张丽姣,等. 不同食用菌菌糠多糖的组分分析与抗氧化活性评价[J]. 食品科学,2015,36(5):18-23.
[17]Zhang Z,Wang X,Yu S,et al.Synthesized oversulfated and acetylated derivatives of polysaccharide extracted fromEnteromorphalinzaand their potential antioxidant activity[J]. International Journal of Biological Macromolecules,2011,49(5):1012-1015.
[18]Mendes SF,Santos O,Barbosa AM,et al. Sulfonation and anticoagulant activity of botryosphaeran from Botryosphaeriarhodina MAMB-05 grown on fructose[J]. International Journal of Biological Macromolecules,2009,45(3):305-309.
[19]Song Y,Ni Y,Hu X,Li Q.Effect of phosphorylation on antioxidant activities of pumpkin(Cucurbitapepo,Ladygodiva)polysaccharide[J]. International Journal of Biological Macromolecules,2015,81:41-48.
[20]Vasconcelos AFD,Dekker RFH,Barbosa AM,et al. Sulfonation and anticoagulant activity of fungal exocellularβ-(1→6)-D-glucan(lasiodiplodan)[J]. Carbohydrate Polymers,2013,92(2):1908-1914.
[21]谢明勇,王之珺,谢建华. 多糖的硫酸化修饰及其结构与生物活性关系研究进展[J].中国食品学报,2015,15(2):1-8.
[22]Zeng Y,Zhang Y,Zhang L,et al. Structural characterization and antioxidant and immunomodulation activities of polysaccharides from the spent rice substrate ofCordycepsmilitaris[J]. Food Science and Biotechnology,2015,24(5):1591-1596.
[23]Zhang Z,Jin J,Shi L. Antioxidant Activity of the Derivatives of Polysaccharide Extracted from a Chinese Medical Herb(Ramulusmori)[J]. Food Science and Technology Research,2008,14(2):160-168.
[24]Li LY,Li LQ,Guo CH. Evaluation ofinvitroantioxidant and antibacterial activities ofLaminariajaponicapolysaccharides[J]. Journal of Medicinal Plants Research,2010,4(21):2194-2198.
[25]Zou C,Du YM,Li Y,et al. Preparation of lacquer polysaccharide sulfates and theirantioxidant activityinvitro[J].Carbohydrate Polymers,2008,73(2):322-331.
[26]Chen S,Chen H,Tian J,et al. Chemical modification,antioxidant andα-amylase inhibitory activities of corn silk polysaccharides[J].Carbohydrate Polymers,2013,98(1):428-437.
[27]陈琳,郝长春,梁涛,等. 化学修饰杏鲍菇多糖对K562细胞的抑制作用[J]. 陕西师范大学学报,2015,43(2):74-78.
Chemical modification of levan fromBacillusamyloliquefaciensand antioxidant and antitumor activity of its products
ZHANG Ying1,2,ZENG Yan1,ZHANG Li-jiao1,2,YU Peng2,SUN Yuan-xia1,*
(1.Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China;2.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
Using levan fromBacillusamyloliquefaciensas raw material,acetylated levan(YL),sulfonylated levan(HL),and sulfated levan(SL)were prepared through chemical modification. Their antioxidant and antitumor activities were further studied. The result showed that after modification,the antioxidant and antitumor ability of levan fromBacillusamyloliquefacienswas improved significantly(p<0.05),and different chemical modification had different effects. The antioxidant activity detected by ABTS and DPPH radical scavenging activity as well as iron reducing ability,was in the order of SL>HL>YL>L. The modified product SL showed the best antioxidant activity in the four polysaccharides. The antitumor activity tested on Helainvitrowas in the order of YL>HL>SL>L. The modified product YL showed the best antitumor activity in the four polysaccharides. These results demonstrated that chemical modification played an active role in improving functional activities of microbial polysaccharides.
levan fromBacillusamyloliquefaciens;chemical modification;antioxidant activity;antitumor activity
2015-12-14
张颖(1990-),女,硕士研究生,研究方向:多糖的发酵与功能,E-mail:zhang_y1@tib.cas.cn。
孙媛霞(1963-),女,博士,研究员,研究方向:功能糖与天然活性物质, E-mail:sun_yx@tib.cas.cn。
国家高技术研究发展计划(863计划)项目(2013AA102105)。
TS201.1
B
1002-0306(2016)13-0096-05
10.13386/j.issn1002-0306.2016.13.011
