哺乳期过量的内源性大麻素干预导致成年鼠胰岛素抵抗
2016-09-13高啸许腾廖丹胡军
高啸 许腾 廖丹 胡军⋆
哺乳期过量的内源性大麻素干预导致成年鼠胰岛素抵抗
高啸 许腾 廖丹 胡军⋆
目的 评估长期使用内源性大麻素(AEA)对成年鼠的体重、附睾脂肪组织和代谢相关参数的影响。方法 雄性鼠从哺乳期全程口服豆油乳化的AEA 20μg/g。断奶后每10d对其摄食和体重进行记录。成年后行葡萄糖-胰岛素耐受测试。随后,处死小鼠得到其附睾脂肪,并对其血浆中的胰岛素、瘦素、非酯化脂肪酸、甘油三酯和胆固醇进行测定。结果 哺乳期AEA处理组的小鼠在成年后表现出比较对照组较高的摄食量、较重的体重和较多的附睾脂肪。对附睾脂肪组织的CBR1蛋白的测定中,AEA处理组比对照组小鼠增高约1.5倍。AEA处理组小鼠外周循环中有较高的葡萄糖、胰岛素、瘦素、甘油三酯、胆固醇和非酯化脂肪酸。且AEA处理组小鼠表现出一系列显著的胰岛素抵抗的指标。结论 在小鼠哺乳期使用AEA处理后其成年小鼠的体重、脂肪积累和对代谢产生干扰。
内源性大麻素 超重 胰岛素抵抗 内源性大麻素系统 脂肪组织
超重和肥胖是能量摄入和能量消耗的平衡失调造成的,这一现象甚至可以追溯到婴儿期的高风险因素所导致的成年之后的疾病的高发[1]。最近研究表明,能量的平衡受控于复杂的中枢系统和外周系统的内源性大麻素系统的调控,且内源性大麻素系统在能量平衡的过程中以及对肥胖的进展中发挥了极其重要的作用[2]。2014年3月至8月作者通过实验研究,探讨哺乳期高浓度内源性大麻素的干预对成年后的代谢影响。
1 材料与方法
1.1 材料 CD-1小鼠购于北京维通利华实验动物技术有限公司;内源性大麻素(AEA)购于Sigma公司。
1.2 方法 (1)CD-1小鼠饲养于SPF级动物房内,保持适度的温度和湿度以及12h:12h的昼夜时间比。整个实验中给予正常饮食4Kcal/g[3]。小鼠分两组,对照组:哺乳期<21d,给予口服1μl/(g·d)豆油。AEA处理组小鼠:哺乳期<21d,给予口服1μl/(g·d)豆油,并按照小鼠体重给予AEA 20μg/g,21d后断奶并将其与母鼠分离单独饲养至150d。在此期间对其进行体重、摄食、基础代谢率、葡萄糖耐受和胰岛素敏感性测试。在实验结150d取血标本进行代谢标志物的检测。
1.3 West blot检测CB1R在附睾中的表达 取对照组和AEA处理组小鼠附睾脂肪组织,使用RIPA裂解缓冲液,12% SDS-PAGE聚丙烯酰胺凝胶分离并转至PVDF膜,BSA封闭PVDF膜后使用CB1R多克隆与之结合,再使用HRP-抗兔IgG二抗杂交,使用化学发光进行检测。同时以B-actin作为内参。
1.4 (1)葡萄糖和胰岛素耐受的检测:小鼠禁食6h后给予葡萄糖溶液,按照体重给予含葡萄糖1.5mg/g,在15min、30min、60min、90min和120min分别收集尾部血液评估葡萄糖水平;禁食6h后,腹腔注射胰岛素0.75U/kg后,在15min、30min、60min、90min和120min分别收集尾部血液评估葡萄糖水平。(2)血浆葡萄糖、血脂和激素水平检测:使用RD公司ELISA夹心法检测血浆中瘦素含量。使用Linco Research检测血浆中胰岛素含量。葡萄糖、甘油三酯和胆固醇使用DIALAB公司试剂盒检测。非酯化脂肪酸使用Wako Chemicals试剂盒检测。
1.5 统计学方法 采用SPSS 13.0软件。数据以(x±s)表示,使用Mann-Withney U 检验或ANOVA统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 AEA处理小鼠在哺乳期前后体重的变化 新生小鼠口服AEA后在哺乳期内与未经AEA处理组小鼠比较,其体重略有升高,但是其差异无统计学意义(P>0.05),见图1A。而在哺乳期结束后至150d的动态观察中发现,AEA处理组小鼠体重的增长远高于正常饲养小鼠,在90d和150d的测量数据显示,两组间差异有统计学意义(P<0.05),见图1B。在第150d时处死小鼠,取其附睾脂肪组织称重,并计算附睾脂肪指数:附睾脂肪组织与体重的比值,结果显示AEA处理组小鼠附睾脂肪组织重量(1.965±0.176)g 高于未处理组vs(1.135±0.185)g,差异有统计学意义(P<0.05),见图2A。附睾脂肪指数的统计结果显示,AEA处理组达3.5%,未处理组2.4%,两组比较差异有统计学意义(P<0.05),见图2B。
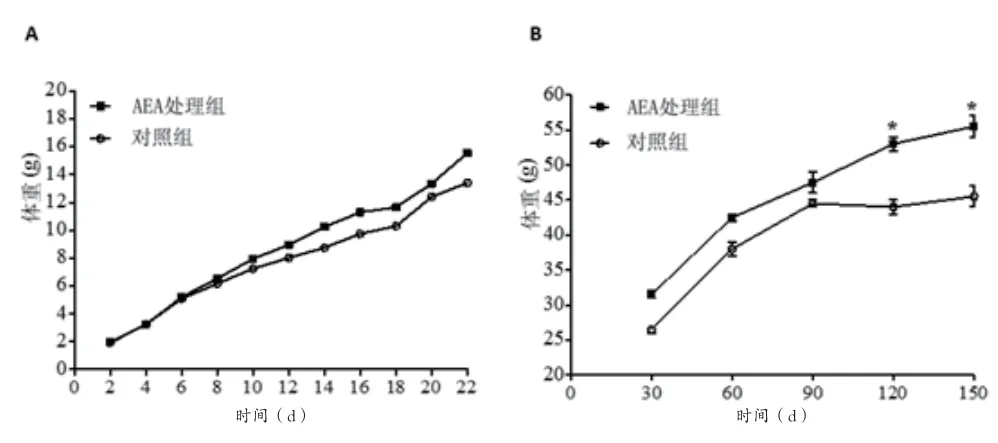
图1 A哺乳期两组小鼠体重不同时间点的比较;B哺乳期后两组小鼠体重不同时间点的比较,120d和150d时,AEA处理组小鼠体重明显高于未处理组(⋆P<0.05)。
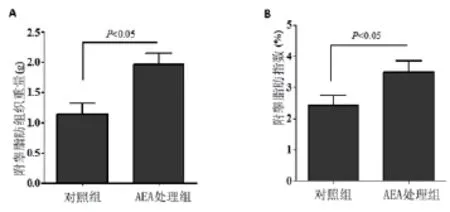
图2 A 150d时 AEA处理组小鼠附睾脂肪组织重量高于对照组小鼠附睾脂肪组织(P<0.05);B 150d时 AEA处理组小鼠附睾脂肪指数高于对照组小鼠附睾脂肪指数(⋆P<0.05)。
2.2 附睾脂肪组织CB1R的检测 通过western blot 检测两组小鼠附睾脂肪组织中CB1R的表达情况,并将对CB1R和内参B-actin条带进行灰度扫描。结果显示AEA处理组CB1R表达量显著高于未处理组,差异有统计学意义(P<0.05),见图3。
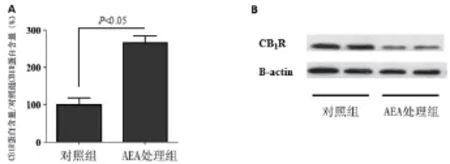
图3A AEA处理组与未处理组间CB1R含量的比较,AEA处理组CB1R显著高于未处理组,(P<0.05);B western blot鉴定AEA处理组与未处理组附睾脂肪组织中CB1R的表达。
2.3 葡萄糖耐量和胰岛素耐受试验 对两组小鼠分别进行葡萄糖耐量试验结果显示,小鼠血液中葡萄糖的增加量随着时间的延长逐渐升高,20min时达到峰值,30min后逐渐下降,120min时仍高于给予葡萄糖时的血葡萄糖浓度,两组小鼠血葡萄糖浓度比较显示,AEA处理组小鼠血糖浓度在15~120min,各时间点均高于未处理组,差异均有统计学意义(P<0.05),见图4A。而给予胰岛素注射后,AEA处理组小鼠的血葡萄糖浓度在60min仍呈现出上升趋势,而未处理组小鼠血糖下降的程度随着时间的延长逐渐升高。见图4B。
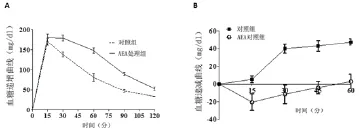
图4A AEA处理组和未处理组小鼠葡萄糖耐量的比较,AEA处理组小鼠血糖在15~120min各时段升高值均高于未处理组;B胰岛素耐受实验,同时给予葡萄糖和胰岛素后60min,AEA处理组小鼠清除葡萄糖的能力低于未处理组
2.4 AEA处理对血中各代谢指标的影响 在150d时检测小鼠各项代谢指标,结果显示,AEA处理组小鼠甘油三酯、胆固醇、非酯化脂肪酸、血糖、胰岛素和瘦素的含量均高于未处理组小鼠,差异具有统计学意义(P<0.05),见表1。

表1 AEA处理组和未处理组小鼠血浆各代谢指标的比较(x±s)
3 讨论
内源性大麻素系统主要由大麻受体I和大麻受体II组成,其是内源性的配体被称之为内源性大麻素。研究最为广泛的两种内源性大麻素AEA和2-AG。I型大麻素受体主要表达在中枢神经系统和少数外周组织,如肝脏、肌肉、脂肪组织,其可以被AEA活化[4~6]。II型大麻素受体主要表达在免疫细胞和造血细胞中,其可以被2-AG激活。最近有报道,II型大麻素受体在某些中枢神经系统和肝脏、胰腺中亦有表达[7,8]。但I型大麻素受体在对饮食控制和能量平衡上仍发挥主要作用[9]。因此活化下丘脑中的I型大麻素受体可以增加食欲[10,11],并促使脂质在脂肪细胞中的累积[12],并导致脂肪肝[5]。有研究使用I型大麻素受体的拮抗剂AM-25,可以改善过量内源性大麻素造成的代谢特征[13]。在随后的研究中,哺乳期间母乳中高浓度的内源性大麻素同样可以造成脂质的代谢异常[14]。
本资料中,作者使用过量的AEA处理哺乳期的小鼠,在对其成年后的观察结果显示,AEA处理组的小鼠体重增加、附睾脂肪组织累积并且产生胰岛素抵抗。因此推论其幼体的干预是发育阶段较为关键的时段,从而对个体成年后产生影响,而CB1R在这个干预的过程中发挥着重要的作用。有研究表明在动物肥胖模型中也有内源性大麻素的升高的现象[5,15,16],当然在对人体的研究过程中也存在类似的想象,体内过度活化的大麻素系统导致机体能量失衡[17~19]。而本资料显示,AEA处理组的小鼠食量高于未处理组,其能量消耗却较未处理组低,在预实验中作者使用CB1R拮抗剂,明显能够降低小鼠食欲以及体重减轻,这与现有报道一致[20,21]。
肥胖所导致的一系列代谢症状如,甘油三酯、非酯化脂肪酸等的升高从而导致外周组织对胰岛素耐受,进而发展为2型糖尿病[22]。而本资料中AEA处理组的小鼠所表现出的附睾脂肪组织增加、高血糖、高血脂及胰岛素抵抗。与报道一致。且许多研究结果证实高血脂及脂肪的异位沉积与胰岛素抵抗是相互促进的[23,24],这个现象在本次实验中也有所体现。本资料中哺乳期的高水平的AEA干预导致CB1R水平升高,进而使得脂肪沉积,与现有报道较为一致[12]。
综上所述,哺乳期使用CB1R的激动剂AEA可以对成年后的机体代谢产生影响。也为早期2型糖尿病的预测及预防提供一个新型的思路。
1 Barker DJ, Osmond C.Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales .Lancet,1986,1():1077~1081.
2 Engeli S. Central and peripheral cannabinoid receptors as therapeutic targets in the control of food intake and body weight . Handb Exp Pharmacol2012, 209: 357~381.
3 Valenzuela C, Castillo V, Aguirre C, Ronco AM, Llanos M. The CB1receptor antagonist SR141716A reverses adult male mice overweight and metabolic alterations induced by early stress .Obesity,2011,19:29~35.
4 Devane WA, Hanus L, Breuer A, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor . Science, 1992, 258:1946~1949.
5 Osei-Hyiaman D, Depetrillo M, Pacher P, et al. Endocannabinoid activation at hepatic CB1 receptor stimulates fatty acid synthesis and contributes to diet-induced obesity . J Clin Invest, 2005, 115:1298~1305.
6 Bensaid M, Gary-Bobo M, Esclangon A, et al. The cannabinoid CB1 receptor antagonist SR141716 increased Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and culture adipocyte cells . Mol Pharmacol, 2003, 63: 908~914.
7 Lotersztajn S, Teixeira-Clerc F, Julien B, et al. CB2 receptors as new therapeutic targets for liver diseases . Br J Pharmacol,2008,153:286~289.
8 Juan-Picó P, Fuentes E, Bermúdez-Silva FJ,et al.Cannabinoid receptors regulate Ca(2+)signals and insulin secretion in pancreatic betacell . Cell Calcium, 2006, 39:155~162.
9 Pagotto U, Marsicano G, Cota D, et al. The emerging role of endocannabinoid system in the endocrine regulation and energy balance. Endocr Rev, 2006, 27:73-100.
10 Jo Y, Chen Y, Chua S, Talmage D, Role L. Integration of endocannabinoid and leptin signaling in an appetite-related neural circuit . Neuron, 2005, 48: 1055~1066.
11 Miller C, Murray T, Freeman K, Edwards G. Cannabinoid agonist,CP 55, 940, facilitates intake of palatable foods when injected into the hindbrain . Physiol Behav, 2004, 80: 611~616.
12 Cota D, Marsicano G, Tschöp M, Grübler Y, et al. The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis .J Clin Invest, 2003, 112: 423~431.
13 Di Marzo V, Matias I. Endocannabinoid control of food intake and energy balance .Nat Neurosci, 2005, 8:585~589.
14 Hill M, Patel S, Campolongo P, Tasker J, Wotjak C, Bains J. Functional interactions between stress and the endocannabinoid system: from synaptic signaling to behaviour output . J Neurosci,2010,30:14980~14986.
15 Chung J, Nguyen AK, Henstridge DC, et al. HSP72 protects against obesityinduced insulin resistance . Proc Natl Acad Sci USA, 2008, 105:1739~1744.
16 Matias I, Gonthier MP, Orlando P, Martiadis V, et al. Regulation,function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia . J Clin Endocrinol Metab, 2006, 91: 3171~3180.
17 Di Marzo V, Goparaju SK, Wang L, et al. Leptin-regulated endocannabinoids are involved in maintaining food intake . Nature,2001,410:822~825.
18 Blüher M, Engeli S, Klöting N, Berndt J, et al. Dysregulation of the peripheral and adipose tissue endocannabinoid system in human abdominal obesity . Diabetes, 2006, 55: 3053~3060.
19 Engeli S, Böhnke J, Feldpausch M, et al.Activation of the peripheral endocannabinoid system in human obesity . Diabetes, 2005, 54:2838~2843.
20 Vickers SP, Webster LJ, Wyatt A, Dourish CT, Kennett GA. Preferential effects of the cannabinoid CB1 receptor antagonist, SR 141716, on food intake and body weight of obese(fa/fa)compared to lean Zuckers rats .Psychopharmacology,2003,167:103~111.
21 Richey J, Woolcott O, Stefanovski D, etal. Rimonabant prevents additional accumulation of visceral and subcutaneous fat during highfat feeding in dogs .Am J Physiol Endocrinol Metab, 2009, 296:E1311~1318.
22 Griffin ME, Marcucci MJ, Cline GW, Bell K,et al.Free fatty acidinduced insulin resistance is associated with activation of protein kinase C theta and alterations in the insulin signalling cascade. Diabetes, 1999,48: 1270~1274.
23 Taube A, Eckardt K, Eckel J:Role of lipid-derived mediators in skeletal muscle insulin resistance . Am J Physiol Endocrinol Metab, 2009, 297:1004~1012.
24 Unger R, Orci L.Lipotoxic disease of nonadipose tissues in obesity .Int J Obes Relat Metab Disord, 2000, 24: S28~S32.
Objective To evaluate long-term effects of AEA treatment during lactation on body weight,epididymal fat accumulation and related metabolic parameters during adulthood. Method Male mice pups were orally treated with a solution of AEA(20 μg/g body weight in soy oil)or vehicle during the whole lactation period. After weaning,food intake and body weight were recorded every 10 days. Adult animals were subjected to glucose and insulin tolerance tests. Subsequently,animals were sacrifi ced and epididymal fat pads were extracted. Circulating levels of plasma insulin,leptin,non-sterifi ed fatty acids(NEFA),triglyceride and cholesterol were also evaluated. Results AEA-treated mice during lactation showed a signifi cant increase in accumulated food intake,body weight and epididymal fat during adulthood when compared to control mice. When evaluating CB1R protein expression in epididymal fat,the AEA-treated group showed a 150 % increase in expression compared to the control mice. This group also displayed signifi cantly higher levels of circulating glucose,insulin,leptin,triglycerides,cholesterol and NEFA. Moreover,a marked state of insulin resistance was an important fi nding in the AEA-treated group. Conclusion This study showed that overweight,accumulation of visceral fat and associated metabolic disturbances,such as a higher lipid profi le and insulin resistance,can be programmed by a treatment with the endocannabinoid AEA during lactation in adult mice.
Anandamide Overweight Insulin resistance Endocannabinoid system Adipose tissue
430077 华中科技大学同济医学院附属梨园医院内分泌科
