反油酸处理对人HepG2细胞代谢组的影响
2016-09-10刘会昌石建新
刘 莹,刘会昌,石建新
(上海交通大学生命科学技术学院,上海 200240)
反油酸处理对人HepG2细胞代谢组的影响
刘莹,刘会昌,石建新*
(上海交通大学生命科学技术学院,上海 200240)
本研究以人细胞(HepG2)为模型,通过MTT实验研究反油酸对HepG2细胞存活率的影响,选择1.2 mmol/L和1.5 mmol/L的反式油酸处理HepG2细胞6和12 h,利用UPLC-MS/MS和GC-MS对HepG2细胞的代谢组进行检测,以了解人细胞对反式油酸的代谢反应。结果表明,反油酸处理引起了HepG2细胞代谢水平的广泛变化。反油酸处理促进了脂肪酸合成,引起细胞磷脂代谢显著变化及细胞膜的重构,也增加了胆固醇和酰基甘油代谢中间产物的水平;同时,反油酸引起糖类和氨基酸代谢途径的增强,为脂肪酸合成提供原料。本研究获得的体外代谢组水平的变化为揭示反式脂肪酸与人类健康的不良关系提供了新的证据。
反油酸,反式脂肪酸,代谢组学,胆固醇代谢,HepG2细胞
反式脂肪酸(TFA)是一类包含一个或多个反式构型双键的不饱和脂类分子。日常膳食中的反式脂肪酸主要来源于人造氢化植物油(iTFA),少量来源于天然反式脂肪酸(rTFA)。流行病学研究表明,rTFA对人体健康无害也无益,但iTFA可以增加心血管疾病的风险,与II型糖尿病和代谢综合症等疾病有一定的相关性[1]。研究证实,iTFA对血脂产生不良的影响,主要表现在增加胆固醇和低密度脂蛋白-胆固醇的含量,减少高密度脂蛋白-胆固醇的水平[2]。目前的研究大多集中在动物实验和流行病学方面,实验方面的研究主要集中在胆固醇及脂蛋白相关途径中单分子水平和活性的测定[3],然而,iTFA对人体健康的影响应该是多种分子共同影响的结果。
代谢组学是揭示生物体系(细胞、组织或生物体)受外界刺激后其内源代谢产物种类、数量及其浓度整体变化规律的学科。代谢物是细胞调控或生化过程的终端产物,其变化反映的是被干扰生物体系最终生命活动的结果。同时,通过代谢途径中关键代谢物的功能分析可发掘重要的生物标志物,以便用于疾病或反式脂肪酸的暴露监控管理[4-5]。
目前只有脂肪组学技术被用于研究反油酸对人体细胞脂肪组代谢的影响[6]。事实上,反式脂肪酸对人体健康影响并不局限于脂类代谢。因此,本研究采用非靶标代谢组学技术全面揭示反油酸处理对人HepG2细胞代谢组的影响,为揭示反式脂肪酸影响人类健康的分子机制提供代谢组依据。
1 材料与方法
1.1材料与仪器
HepG2细胞中科院上海生命科学研究院细胞资源中心;反油酸(EA),油酸(OA),二甲基亚砜(DMSO),噻唑蓝(MTT)均为美国Sigma公司产品;DMEM培养基为美国Invitrogen公司产品;胎牛血清(FBS)法国Biowest公司;青霉素链霉素溶液和0.25%胰酶Solarbio公司。其它所用试剂均为分析级。
超净工作台苏州施威克环保科技有限公司;SHY-2A型数显水浴恒温振荡器上海豫康科教仪器设备有限公司;酶标仪和高速离心机基因有限公司;CO2恒温培养箱上海三腾仪器有限公司;倒置显微镜上海豫光仪器有限公司;冷冻干燥机上海安普科技有限公司;超高效液相色谱-线性离子阱质谱联用仪沃特斯(Waters)公司;气相色谱质谱联用仪热电(Thermo)公司。
1.2实验方法
1.2.1细胞培养HepG2细胞采用DMEM培养基(含10%胎牛血清+1% 100×青霉素链霉素溶液)进行培养,培养箱条件为37 ℃,5% CO2。细胞每隔两天换一次培养基,一周传代2次。反油酸和油酸采用不含脂肪酸的BSA促进溶解,实验时稀释成不同的浓度。空白对照组采用不含反油酸和油酸并添加与实验组等浓度BSA的培养基培养。
1.2.2MTT实验采用MTT实验评估反油酸对HepG2细胞存活率的影响。在96孔板中培养细胞(5×103/孔)细胞,每组设有6个重复。8 h后,待细胞贴壁,将培养基换成分别含有0、0.75、1.0、1.2、1.5 mmol/L反油酸的培养基继续培养12,24和40 h,1.5 mmol/L油酸作为对照。培养结束后,加入MTT(5 mg/ml)20 μL并继续培养,4 h后,吸净培养基,加入150 μL DMSO溶解甲瓒。恒温振荡器震荡10 min后,采用酶标仪检测570 nm处的OD值,细胞存活率=1-(空白组OD值-实验组OD值)/空白组OD值。
1.2.3代谢组样品制备基于MTT实验结果,采用1.2 mmol/L和1.5 mmol/L反油酸,1.5 mmol/L油酸和DMEM培养基(空白对照组)对HepG2细胞分别进行6 h和12 h培养,每组有四个重复。培养结束后,将HepG2细胞收集到2 mL EP管中,4 ℃、1000 r/min离心2 min,弃上清,用冷的PBS洗两遍,将细胞沉淀放在-80 ℃冰箱备用。
1.2.4代谢组分析采用美国METABOLON公司比较成熟的UPLC-MS/MS和GC-MS代谢组平台检测不同处理组HepG2细胞代谢物。对于样品的抽提,向细胞沉淀中加适量体积的超纯水,震荡悬浮,吸取悬浮液100 μL至96深孔板中,加入适量甲醇提取液,使用Geno Grinder 2000(Glen Mills INC.,Clifton,NJ)680 r/min振荡2 min,振荡结束后,4 ℃ 3000 r/min离心5 min,吸取三份上清分别用于LC-MS/MS(+),LC-MS/MS(-)和GC-MS检测。所得到的数据经过标准化处理后比对到Metabolon公司的数据库,进行检索、鉴定和相对定量[7]。
1.2.5代谢物途径和功能分析采用t-test检验(p<0.05)得到与空白对照相比显著变化的代谢物,并通过错误发现率(FDR)的计算对p值进行校正,FDR值小于0.1说明结果可信;通过SIMCA-P+11软件对得到的数据进行主成分分析(PCA)和判别分析(PLS-DA)来确定与对照组的差异[8],最后使用KEGG和HMDB数据库对变化显著的代谢物进行途径和功能分析。
2 结果与分析
2.1反油酸对细胞存活率的影响
由图1可知,低浓度(0.75 mmol/L)的反油酸对HepG2细胞的增值有促进作用,当浓度大于等于1 mmol/L时,反油酸以浓度和时间依赖的方式降低HepG2细胞存活率。经终浓度为1.2 mmol/L和1.5 mmol/L的反油酸处理12 h后,细胞存活率分别为88%和67%;经终浓度为1.2 mmol/L和1.5 mmol/L的反油酸处理24 h后,细胞存活率分别降至66%和48%,而经1.5 mmol/L油酸处理12 h和24 h的HepG2细胞的存活率没有显著差异。当处理时间达到40 h时,1 mmol/L的反油酸使HepG2细胞的存活率降至25%,显著低于1.5 mmol/L油酸处理组(p<0.05)。基于此分析结果,1.2和1.5 mmol/L反式油酸处理6 h(短期处理)和12 h(长期处理)后的HepG2细胞被用来进行代谢组学分析。
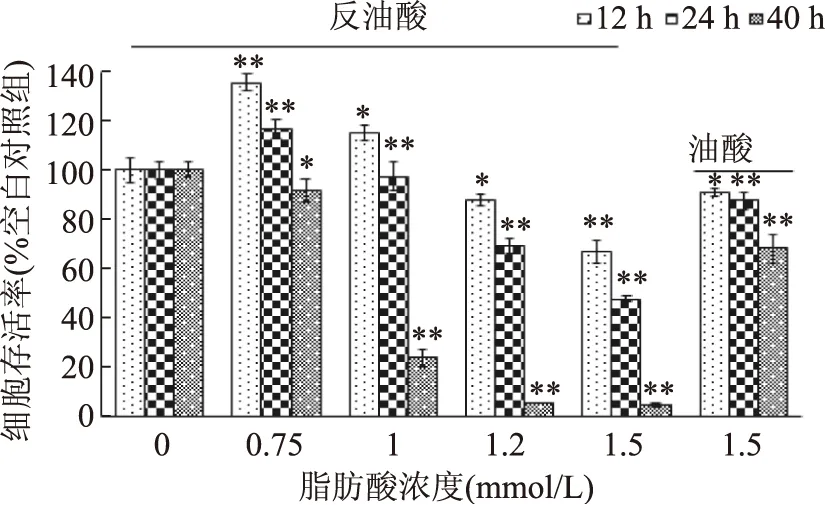
图1 反油酸和油酸处理对HepG2细胞存活率的影响Fig.1 Effects of elaidic acidand oleic acid on HepG2 cells viability注:与空白组比较:*代表差异显著(p<0.05),**代表差异极显著(p<0.01)。
2.2反油酸对细胞代谢的影响
经LC-MS/MS和GC-MS检测,在HepG2细胞中总鉴定到212种不同的化合物,其中氨基酸57种,脂类68种,糖类29种,核苷酸22种,辅酶和维他命14种,多肽16种,其它代谢物6种。由主成分分析(PCA)(图2)可知,处理6 h后,与油酸处理组相比,反油酸处理组样品和空白对照样品有较好的分离,而12 h后,油酸处理样品和空白对照样品也能分开,表明油酸长时间处理也会导致细胞代谢组的变化。反油酸处理导致的代谢组的差异更为明显,无论是6 h组样品还是12 h组样品,反油酸处理样品和空白样品以及反油酸处理样品和油酸处理样品之间均存在明显的分离。由偏最小二乘判别分析(PLS-DA)可知,33种代谢物在反油酸处理6 h和12 h同步显著变化(表1),它们对区分反油酸和油酸处理样品至关重要。这些代谢物包括22种脂类(脂肪酸、磷脂、胆固醇等)、2种糖类、5种氨基酸和3种辅酶。

表2 反油酸和油酸处理对HepG2细胞代谢组的影响
注:图中数字表示反油酸和油酸处理引起细胞中显著变化的代谢物数量(p<0.05)。
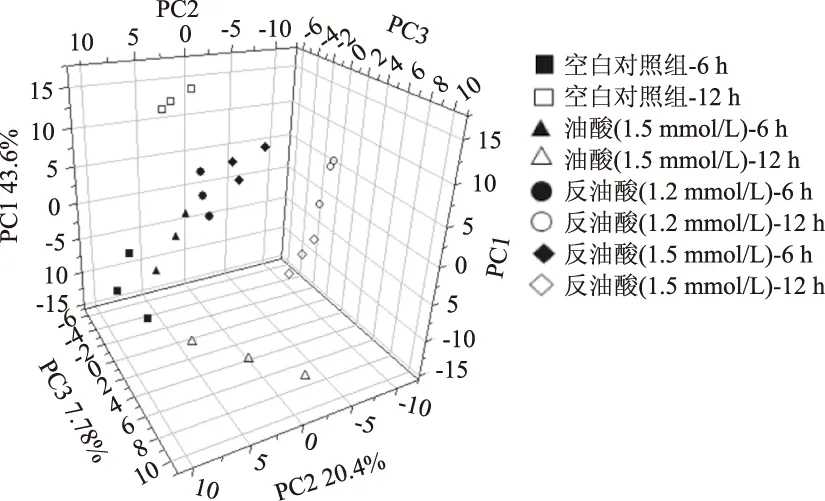
图2 不同处理组间细胞代谢物的主成分分析Fig.2 Principle component analysis(PCA)of detected cell metabolites of different treatments

VarID(Primary)参与代谢途径6h12hM1.VIP[6]M1.VIP[6]油酸(18∶1n9)脂肪酸1.65631.4987丙酰肉碱脂肪酸1.55881.0516二十二碳五烯酸(n6DPA;22∶5n6)脂肪酸1.09411.3105二十二碳五烯酸(n3DPA;22∶5n3)脂肪酸1.06461.288510-十七碳烯酸(17∶1n7)脂肪酸1.05641.2985顺式十八碳烯酸(18∶1n7)脂肪酸1.05241.3592二十二碳六烯酸(DHA;22∶6n3)脂肪酸1.03891.3788二十碳三烯酸(20∶3n9)脂肪酸1.01121.2677花生四烯酸(20∶4n6)脂肪酸1.00761.3066二十二碳二烯酸(22∶2n6)脂肪酸1.00371.2451甘油磷脂胆碱(GPC)磷脂1.70951.3213胆碱磷脂1.60151.5907胞苷二磷酸胆碱磷脂1.44371.6312磷酸乙醇胺磷脂1.38591.3258角鲨烯胆固醇1.65501.1197环氧化鲨烯胆固醇1.59201.2727
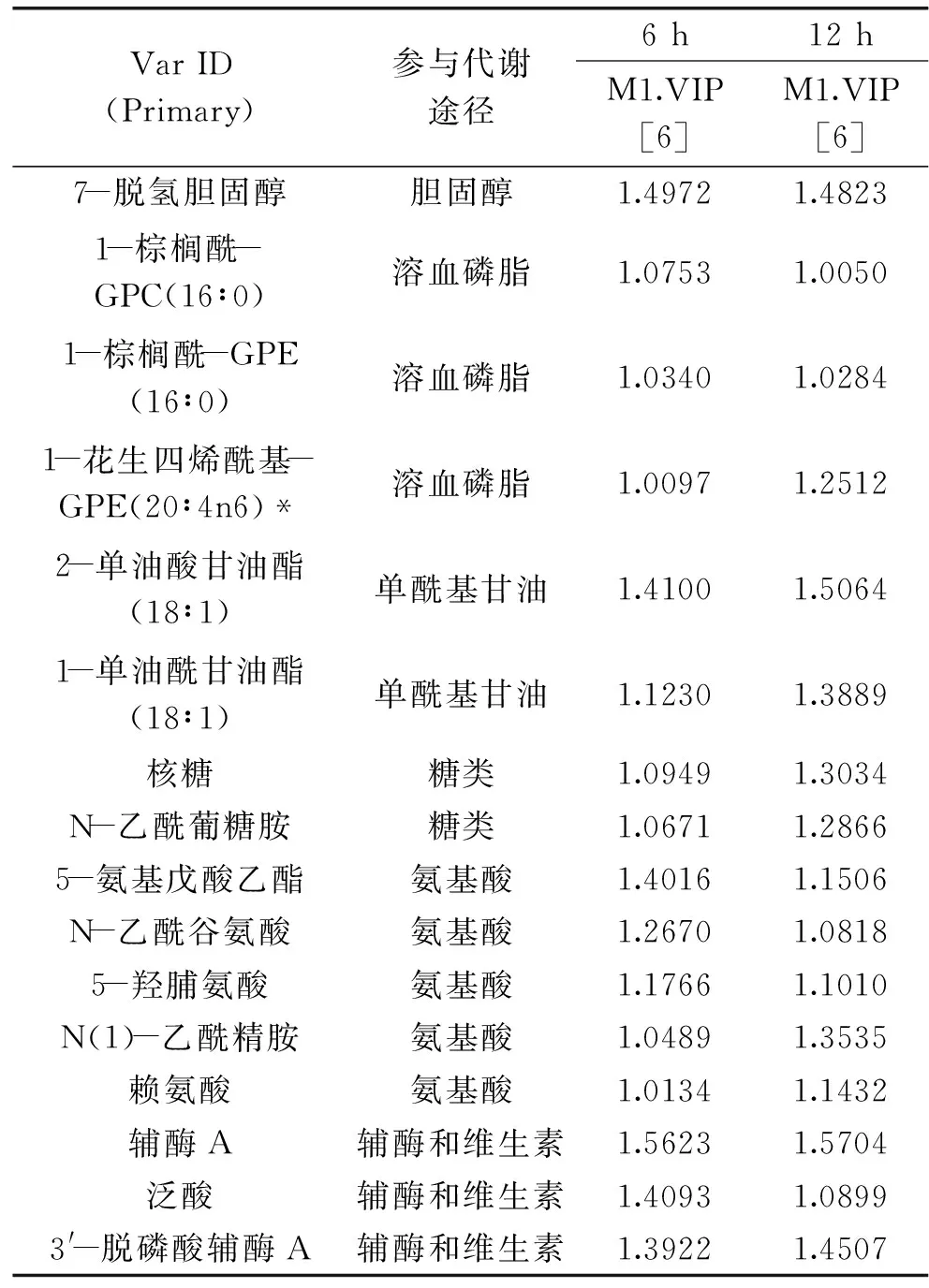
续表
反油酸处理引起的差异变化代谢物参与的主要代谢途径有脂类代谢、氨基酸代谢和碳代谢,变化最显著的是脂类代谢(表2)。其中,差异代谢物中的甘油磷酰胆碱和磷酸乙醇胺被证实与心血管疾病的发生有一定的相关性[5]。
2.2.1反油酸对脂肪酸合成的影响与油酸相比,反油酸对细胞中脂肪酸合成的影响最为显著。细胞内游离脂肪酸的增加主要是用于脂肪酸合成以及脂肪酸长链延伸。由图3(根据KEGG和HMDB数据库绘制)可知,处理6 h时,与油酸相比,反油酸引起棕榈酸、硬脂酸、十八碳烯酸、DHA和花生四稀酸等脂肪酸水平的提高,其可能的原因是促进了棕榈酸合成限速酶(ACACA)的表达[9]。
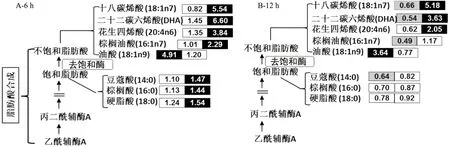
图3 反油酸和油酸对脂肪酸合成的影响Fig.3 Effects of elaidic acid and oleic acid on fatty acid synthesis注:背景数字代表处理组与空白组相比代谢物水平显著上升或下降的倍数:白色背景表示无显著变化,灰色背景表示显著下降,黑色背景表示显著上升。代谢物后面左边的数字代表油酸处理引起的变化倍数,右边的数字代表反油酸处理引起的变化倍数。图4、图5和图6同。
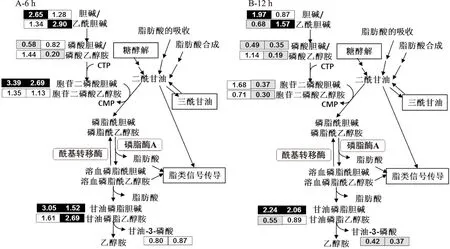
图4 反油酸和油酸对磷脂代谢的影响Fig.4 Effects of elaidic acid and oleic acid on phospholipid metabolism
经反油酸处理12 h时,细胞内不饱和脂肪酸仍保持高水平,说明反油酸处理持续激活脂肪酸链伸长和去饱和过程。这个结果与文献中已报道的反油酸可增加固醇调节元件结合蛋白1(SREBP-1)目的基因表达水平一致,该元件的过量表达可以促进脂肪酸合成过程[9-10]。值得注意的是,油酸处理对细胞脂肪酸合成的影响与反油酸不同:油酸处理6 h和12 h后,细胞中油酸水平均显著升高;其次,经油酸处理12 h的细胞中棕榈油酸、二十二碳六烯酸和豆蔻酸水平均显著下降(图3)。
2.2.2反油酸对磷脂代谢的影响甘油磷脂是细胞膜的主要组成成分,对细胞起到保护作用并参与多种细胞信号传导及囊泡运输。由图4可知,反油酸和油酸处理均导致细胞甘油磷脂含量发生显著变化。处理6 h和12 h时后,油酸主要影响磷脂酰胆碱的代谢,体现为胞苷二磷酸胆碱酯和甘油磷脂胆碱水平的上升,以及磷酸胆碱和1-棕榈酰-GPC(16∶0)水平的下降,表明油酸对细胞膜重建的影响主要限制在磷脂酰胆碱途径。与油酸相比,反油酸对细胞磷脂代谢和细胞膜重建的影响更为广泛。6 h和12 h的反油酸处理显著降低了细胞的磷酸乙醇胺和胞苷二磷酸乙醇胺的水平(图4)。6 h和12 h的反油酸处理还显著提高了细胞的乙酰胆碱、1-油酰基-GPE(18∶1)、1-油酰基-GPI(18∶1)和1-油酰基-GPS(18∶1)的水平(表3)。这三种油酰基磷脂酸衍生物是溶血性磷脂代谢的中间产物并参与磷脂酰肌醇和磷脂酰丝氨酸代谢,它们的水平提高在缺血性脑卒(脑梗死)患者中曾有报道[11]。这些油酰基磷脂酸衍生物的变化可能与反式脂肪酸引起细胞中负责磷脂合成及重构的转录因子(PCYT2)的表达变化[12-13]相关。此外,这些变化也可能与反油酸可替代细胞膜磷脂中不饱和脂肪酸的脂肪酸基团相关[14]。综上所述,反油酸处理影响了细胞膜重建及磷脂代谢。
2.2.3反油酸对胆固醇代谢的影响由图5可知,经反油酸和油酸处理6 h,细胞中胆固醇水平未发生显著变化;处理时间为12 h时,反油酸和油酸处理组细胞中胆固醇水平均显著降低。油酸和反油酸处理12 h后导致细胞内胆固醇含量下降的可能原因是油酸和反油酸处理导致胆固醇结合脂肪酸形成胆固醇脂,或增加胆固醇酯和胆固醇的流出量,从而导致胞内胆固醇含量降低[13,15]。从胆固醇合成中间产物含量的变化来看,6 h 和12 h时的反油酸和油酸处理均显著提高了细胞中角鲨烯、角鲨烯环氧化物、羊毛甾醇和7-脱氢胆固醇等胆固醇合成中间产物的水平。反油酸处理比油酸处理引起的胆固醇中间代谢物的变化更明显。
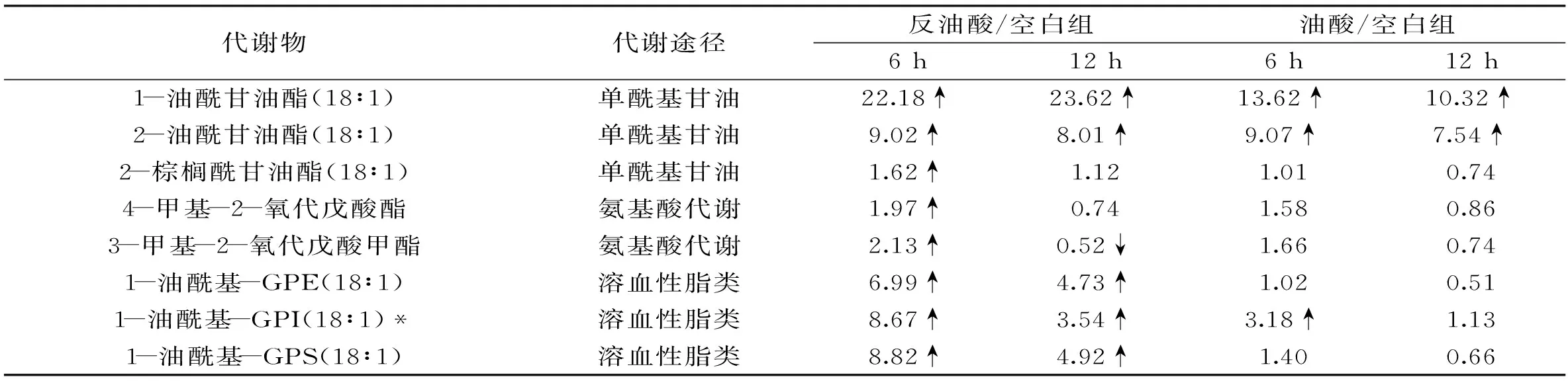
表3 反油酸和油酸对HepG2细胞单酰基甘油代谢的影响
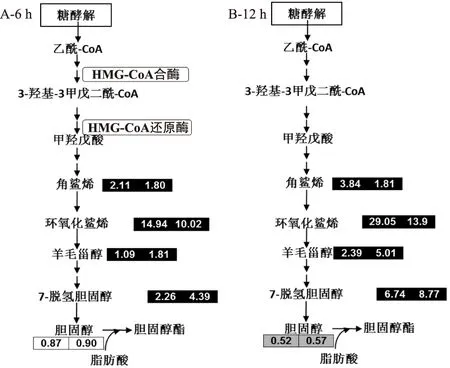
图5 反油酸和油酸对胆固醇代谢的影响Fig.5 Effects of elaidic acidand oleic acid on cholesterol synthesis
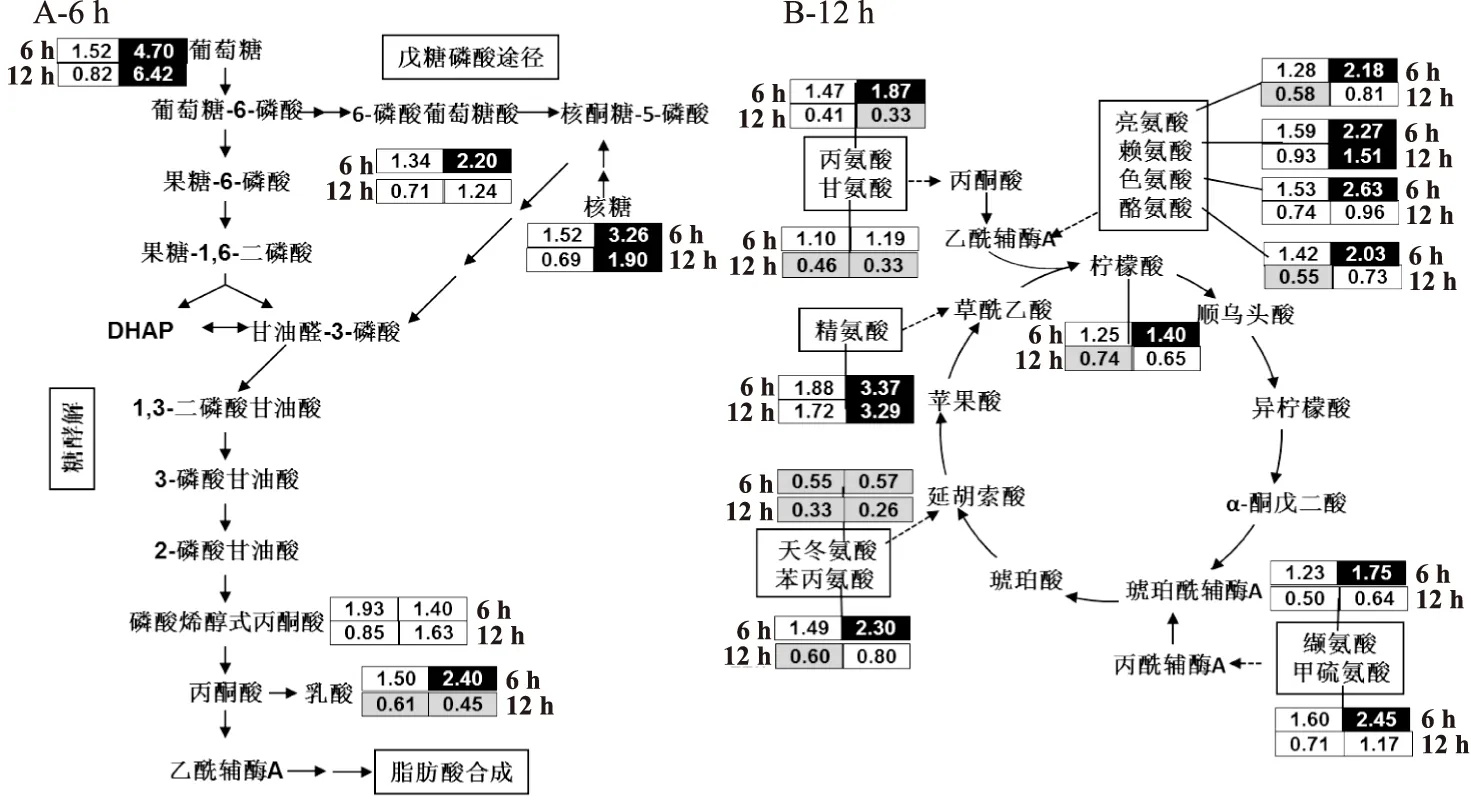
图6 反油酸和油酸对糖酵解、戊糖磷酸途径和氨基酸回补反应的影响Fig.6 Effects of elaidic acid and oleic acid on glycolysis,pentose phosphate pathway and amino acid anaplerosis
注:↑和↓分别表示代谢物水平显著上升和下降(p<0.05),未标注表示变化不显著。
2.2.4反油酸对单酰基甘油代谢的影响由表3可得,处理时间为6 h和12 h时,反油酸和油酸均显著影响单酰基甘油的代谢,表现为细胞内1-油酰甘油酯(18∶1)和2-油酰甘油酯(18∶1)单酰基甘油水平的上升。反油酸处理6 h后,细胞内2-棕榈酰甘油酯(18∶1)的水平显著增加。总体来讲,反油酸处理影响的单酰基甘油的种类更多。单酰基甘油酯可以分解为脂肪酸和甘油,也可在甘油酯激酶的催化下产生溶血磷脂酸,重新进入酯化反应形成三酰基甘油或者参与信号传导。有研究发现反油酸可以引起三酰甘油代谢过程中PNPLA3基因表达水平的增加[9,16],而PNPLA3基因的表达与三酰甘油和二酰甘油的含量呈正相关,在脂肪生成过程中发挥重要的作用[9,16]。本实验结果从代谢水平上说明反油酸可以引起酰基甘油代谢的变化。
2.2.5反油酸对碳氮代谢的影响细胞内脂肪酸的主要来源于胞外摄取和胞内自身合成两个途径,其中胞内自身合成需要糖酵解途径和氨基酸回补的支持[17]。由图6可知,与油酸组相比,反油酸处理组葡萄糖和核糖水平显著上升,说明细胞需要吸收葡萄糖来满足反油酸引起的合成代谢增加的能量需求。经反油酸处理6 h的细胞中磷酸戊糖途径的中间产物6-磷酸葡萄糖酸和核糖水平显著升高,表明细胞通过增强磷酸戊糖途径为脂肪酸合成提供支持。此外,细胞还通过增加氨基酸的摄入及代谢水平为细胞代谢提供支持,特别是支链氨基酸(亮氨酸和缬氨酸)和芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)代谢。氨基酸的回补反应还体现在氨基酸降解过程中4-甲基-2-氧代戊酸酯和3-甲基-2-氧代戊酸甲酯等中间体含量的升高(见表3)。综上可知,与油酸相比,反油酸处理显著影响糖代谢和氨基酸代谢,为脂肪酸合成提供原料。
3 结论
反油酸可以引起HepG2细胞代谢组的显著变化,主要涉及脂类代谢的各个方面,特别是脂肪酸合成、磷脂代谢、胆固醇和酰基甘油代谢,从而影响到细胞脂肪酸从头合成、胆固醇合成、磷脂代谢以及细胞膜的重建。反油酸还显著影响糖酵解、戊糖磷酸途径和氨基酸代谢,从而影响细胞的生命活动。反油酸对人体细胞代谢水平的影响为理解反式脂肪酸对人体健康不利的分子机制提供了代谢组学依据。结合其它组学技术,该研究结果将有助于发现人体细胞对反式脂肪酸的暴露和效应标志物。由于本研究采用的是非靶标代谢组学技术,因而鉴定到的显著变化的代谢物比较多,变化的代谢通路也比较多。这些结果有助于整体认识反油酸对人体细胞的毒害机制,但还不能一一深入揭示其毒害机制。单从代谢水平上来看,今后要针对反油酸对不同代谢途径的影响开展靶标性的代谢组研究,进一步从代谢途径水平明确其毒理。此外,目前获得的可能生物标志物(代谢物)还需要结合转录组和/或蛋白组的数据进行最后的确认,使研究结果真正服务于食品中反式脂肪酸的风险评估和监管。
[1]Dorfman S E,Laurent D,Gounarides J S,et al. Metabolic implications of dietary trans-fatty acids[J]. Obesity,2009,17(6):1200-1207.
[2]Gebauer S K,Psota T L,Kris-Etherton P M. The diversity of health effects of individual trans fatty acid isomers[J]. Lipids,2007,42(9):787-799.
[3]Subbaiah P V,Subramanian V S,Liu M. Trans unsaturated fatty acids inhibit lecithin:cholesterol acyltransferase and alter its positional specificity[J]. Journal of Lipid Research,1998,39(7):1438-1447
[4]Basak T,Varshney S,Hamid Z,et al. Identification of metabolic markers in coronary artery disease using an untargeted LC-MS based metabolomic approach[J]. Journal of Proteomics,2015,127:169-177.
[5]Jain M,Nilsson R,Sharma S,et al. Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation[J]. Science,2012,336(6084):1040-1044.
[6]刘 莹,刘会昌,石建新. 膳食反式脂肪酸的风险评估研究进展[J].食品安全质量检测学报,2015,6(8):3160-3166.
[7]Evans AM,DeHaven CD,Barrett T,et al. Integrated,nontargeted ultrahigh performance liquid chromatography/electrospray ionization tandem mass spectrometry platform for the identification and relative quantification of the small-molecule complement of biological systems. Analytical Chemistry[J],2009,81(16):6656-6667.
[8]Hu C,Shi J,Quan S,et al. Metabolic variation between japonica and indica rice cultivars as revealed by non-targeted metabolomics[J]. Scientific Reports,2014,4.
[9]Nielsen LV,Krogager TP,Young C,et al. Effects of elaidic acid on lipid metabolism in HepG2 cells,investigated by an integrated approach of lipidomics,transcriptomics and proteomics[J]. PLoS One,2013,8(9):e74283.
[10]Xu H F,Luo J,Zhao W S,et al. Overexpression of SREBP1(sterol regulatory element binding protein 1)promotes de novo fatty acid synthesis and triacylglycerol accumulation in goat mammary epithelial cells[J].Journal of Dairy Science,2016,99(1):783-795.
[11]Li Z G,Yu Z C,Yu Y P,et al. Lysophosphatidic acid level and the incidence of silent brain infarction in patients with nonvalvular atrial fibrillation[J]. International Journal of Molecular Sciences,2010,11(10):3988-3998.
[12]Fullerton MD,Hakimuddin F,Bakovic M. Developmental and metabolic effects of disruption of the mouse CTP:phosphoethanolamine cytidylyltransferase gene(Pcyt2)[J]. Molecular and Cellular Biology,27(9):3327-3336.
[13]Krogager T P,Nielsen L V,Bak S,et al. Identification of a potential biomarker panel for the intake of the common dietary trans fat elaidic acid(transΔ 9-C18∶1)[J]. Journal of Proteomics,75(9):2685-96.
[14]Niu S L,Mitchell D C,Litman B J. Trans fatty acid derived phospholipids show increased membrane cholesterol and reduced receptor activation as compared to their cis analogs[J]. Biochemistry,2005,44(11):4458-4465.
[15]Dashti N,Feng Q,Franklin FA. Long-term effects of cis and trans monounsaturated(18∶1)and saturated(16∶0)fatty acids on the synthesis and secretion of apolipoprotein AI-and apolipoprotein B-containing lipoproteins in HepG2 cells[J]. Journal of Lipid Research,2000,41(12):1980-1990.
[16]Kumashiro N,Yoshimura T,Cantley J L,et al. Role of patatin-like phospholipase domain-containing 3 on lipid-induced hepatic steatosis and insulin resistance in rats[J]. Hepatology,2013,57(5):1763-1772.
[17]Owen O E,Kalhan S C,Hanson R W. The key role of anaplerosis and cataplerosis for citric acid cycle function[J]. Journal of Biological Chemistry,2002,277(34):30409-30412.
Effect of elaidic acid on the metabolomic changes of human HepG2 cells
LIU Ying,LIU Hui-chang,SHI Jian-xin*
(School of Life sciences and Biotechnology,Shanghai Jiao Tong University,Shanghai 200240,China)
The human HepG2 cells were used to investigate the metabolomic responses of HepG2 cells to the exposure of elaidic acid,with the aim to reveal the molecular mechanisms underlying its harmful effects on human health. Based on the preliminary result of toxicological assay,HepG2 cells were treated with 1.2 mmol/L and 1.5 mmol/L elaidic acid for 6 and 12 h,and the metabolome changes of these cells were analyzed by using a non-targeted platform composing of UPLC-MS/MS and GC-MS. Statistic data revealed that the treatment of elaidic acid resulted in remarkable metabolome changes in HepG2 cells in a time-dependent way. Elaidic acid treatment accelerated the pathway of fatty acid synthesis,led to the significant changes in phospholipid metabolism,the reconstruction of cell membrane,and the increase of the levels of intermediates involved in cholesterol and acylglycerol metabolism. Eladic acid treatment also enhanced the sugar and amino acid pathways,which provided fuel for the accelerated synthesis of fatty acids. Theseinvitrometabolomic data provide novel insights into the detrimental effects of trans-fatty acids on human health.
elaidic acid;trans-fatty acids;metabolomics;cholesterol metabolism;HepG2 cells
2015-12-14
刘莹(1992-),女,硕士,研究方向:生物化学与分子生物学,E-mail:rouyuezuoban@163.com。
石建新(1966-),男,博士,副研究员,主要研究方向为生物化学与分子生物学,E-mail:jianxin.shi@sjtu.edu.cn。
国家基础研究项目(2012CB72804)。
TS201.6
A
1002-0306(2016)11-0332-06
10.13386/j.issn1002-0306.2016.11.060
