高效液相色谱法测定葡萄皮、籽中的15种单体酚
2016-09-10史红梅王恒振孙玉霞王咏梅
史红梅,王恒振,孙玉霞,王咏梅,周 攀
(1.山东省葡萄研究院,山东济南 250100;2.山东省农业科学院农产品研究所,山东济南 250100;3.烟台张裕卡斯特酒庄有限公司,山东烟台 264000)
高效液相色谱法测定葡萄皮、籽中的15种单体酚
史红梅1,王恒振2,*,孙玉霞2,王咏梅1,周攀3
(1.山东省葡萄研究院,山东济南 250100;2.山东省农业科学院农产品研究所,山东济南 250100;3.烟台张裕卡斯特酒庄有限公司,山东烟台 264000)
建立了葡萄皮、籽中15种单体酚的高效液相色谱(HPLC)分析方法,采用ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱,柱温30 ℃,流动相乙腈-甲酸水(2∶98 V/V)溶液,梯度洗脱,洗脱流速为1.0 mL/min,检测波长280 nm。15种单体酚在一定浓度范围内呈良好的线性关系,相关系数为0.9980~0.9999。方法检出限0.01~0.10 mg/L,加标回收率均大于85%。本方法快速、准确、灵敏度高,可用于葡萄皮、葡萄籽中15种单体酚的测定。
高效液相色谱,葡萄籽,葡萄皮,单体酚
多酚(Polyphenolics)是指分子结构中携带多个酚羟基的一大类植物次生代谢产物[1],主要有酚酸类(Phenolic acids)、黄酮(Flavones)、黄烷醇(Flavanols)、黄酮醇(Flavonols)、花色苷(Anthocyanins)、原花色素(Proanthocyanidins)、水解单宁(Hydrolysable tannins)等[2-6]。多酚类物质是酿酒葡萄中的一类重要物质,直接影响葡萄酒的感官品质如苦味、涩味、收敛性及风味等[7],而且具有极强的抗氧化性,具有广泛的生理功能,如清除自由基、抗发炎、抗血栓等[8]。研究表明,葡萄果实中多酚主要分布在果皮、种子和果梗中,果肉也存在一定量的多酚物质。果皮中含有酚酸、白藜芦醇、花色苷、黄酮醇、黄烷-3-醇等结构简单的多酚[9-10],还含有原花色素等结构复杂的多酚,如花色苷和芳香物质[11]。种子中多酚主要是黄烷醇类多酚[12],也有大量原花色素[13],还有没食子酸[9,12]、咖啡酸[14]等多酚类物质;果肉中的酚类物质主要是酚酸类。
近几年国内外对葡萄酒和葡萄中的酚类物质单体酚含量的测定研究逐渐增多,如韩国民等建立了葡萄酒中14种单体酚的HPLC测定方法[15],陈建业等建立葡萄酒中11种酚酸含量的测定方法[3],王美丽等测定了葡萄中6种单体酚的含量[16]。目前还未见采用一个方法分别测定葡萄皮和葡萄籽中15种单体酚含量的研究,本次实验通过高压液相色谱法测定葡萄皮、葡萄籽中15种单体酚的方法,测定了蓬莱产区三个主要红色品种中葡萄皮和葡萄籽中酚类物质的含量,比较近三年葡萄中酚类物质的变化情况。
1 材料与方法
1.1材料与仪器
葡萄品种为赤霞珠、品丽珠、小味儿多由蓬莱产区各大葡萄酒厂的葡萄园提供;乙腈、甲醇(均为色谱纯)由美国Honeywell公司生产;甲酸为分析纯;实验用水为超纯水;咖啡酸(Caffeic acid)、香豆酸(p-Coumaric acid)、阿魏酸(Ferulic acid)、没食子酸(Gallic acid)、香草酸(Vanillic acid)、水杨酸(Salicylic acid)、堪非醇(Kaemferol)、杨梅黄酮(Myricetin)、儿茶素没食子酸酯((-)-epicatechin gallate,ECG)、表棓儿茶素没食子酸酯((-)-epgallocatechin gallate,EGCG)、表儿茶素((-)-epicatechin,EC),均由美国Flulca公司生产;白藜芦醇(Resveratrol),由西安交大保赛生物技术股份有限公司生产;芦丁(Rutin)、槲皮素(Quercetin),均由中国药品生物制品鉴定所生产;儿茶素((+)-catechin, CAT)由上海顺勃生物工程技术有限公司生产。
Agilent 1200液相色谱仪美国安捷伦公司;RE-2000A旋转蒸发器上海亚荣生化仪器厂;SHZ-A水浴恒温振荡器上海博迅实业有限公司医疗设备厂;ML 204/02梅特勒-托利多仪器(上海)有限公司;TDL-5台式低速冷冻离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1样品预处理参照B.Girard等的方法[17],稍作修改。取-20 ℃冷冻的葡萄,将皮、籽、肉分开,将皮和籽用液氮研磨,研磨后置于冰箱(-18~-20 ℃)备用。取冻干研磨后的葡萄样品1.000 g于10倍体积的提取液(丙酮∶水∶甲酸=80∶19∶1)中。每个葡萄样品的皮、籽各取三个平行进行提取,记录每个平行称取样品的实际质量。将提取体系水浴(水浴温度45.0±0.5 ℃)震荡30 min后,离心(8000×g,20 min,4 ℃)取上清。将皮和籽的提取液采用旋转蒸发仪(45.0± 1.0 ℃)蒸干,再用2 mL色谱级甲醇重溶置于5 mL棕色样品瓶中,存放于-20 ℃避光保存待分析。测定样品前经0.45 μm微孔滤膜过滤。
1.2.2检验波长的选择用紫外分光光度计对没食子酸、儿茶素等15种单体酚标准样品溶液在波长200~400 nm区间内扫描。15种单体酚紫外吸收光谱图显示,其组分最大吸收峰均在280 nm处有最大吸收峰,故选择280 nm为检测波长。
1.2.3流动相条件的确定根据成宇峰[18]的研究,本实验选取流动相A:甲酸-水(2∶98,V/V),流动相B:乙腈,设计了10个不同浓度的洗脱实验,其中分离效果较好的两个梯度是:I.0~5 min,B相为2%~8%;5~8 min,B相为8%~15%;8~12 min,B相为15%~25%;12~17 min,B相为25%~35%;17~30 min,B相为35%~45%;30~40 min,B相为50%~50%,液相色谱图如图1a;流动相II. 0~7 min,B相为5%~10%;7~10 min,B相为10%~20%;10~15 min,B相为20%~30%;15~20 min,B相为30%~40%;20~30 min,B相为40%~50%;30~40 min,B相为50%~50%,液相色谱图如图1b。
1.2.4色谱条件Agilent ZORBAX SB-C18色谱柱(5 μm,4.6 mm×250 mm),紫外检验波长为280 nm,柱温30 ℃,进样量10 μL,以峰面积外标法定量。梯度洗脱:流动相A:甲酸-水(2∶98,V/V),流动相B:乙腈,流速为1.0 mL/min。洗脱程序:0~7 min,B相为5%~10%;7~10 min,B相为10%~20%;10~15 min,B相为20%~30%;15~20 min,B相为30%~40%;20~30 min,B相为40%~50%;30~40 min,B相为50%~50%。
1.2.5标准品的配制用万分子一天平分别准确称取咖啡酸等15个单体酚标准品1~10 mg移至10 mL的棕色容量瓶中,色谱级甲醇定容,作为混合标准母液,将此标准液稀释成不同浓度的标准溶液,-20 ℃保存备用。
2 结果与分析
2.1标准曲线的制备
分别配制10~100 mg/L 5个不同质量浓度的15种单体酚混合标准溶液,进样10 μL,按照上述确定的色谱条件进行测定,以峰面积为纵坐标、标准品浓度为横坐标,计算得到15条标准曲线。将单体酚标准品用色谱级甲醇不断稀释至谱图中信噪比为3,以此质量浓度为单体酚的最低检测限。结果表明15种多酚物质的浓度和检测响应值呈现出良好的线性关系,相关系数不小于0.9980,最低检测限都较低,表明此方法灵敏度较高、准确度高、可行性好。结果见表1。
2.2流动相条件确定
按照1.2.3设定的条件15种标准品的色谱图如图1所示。
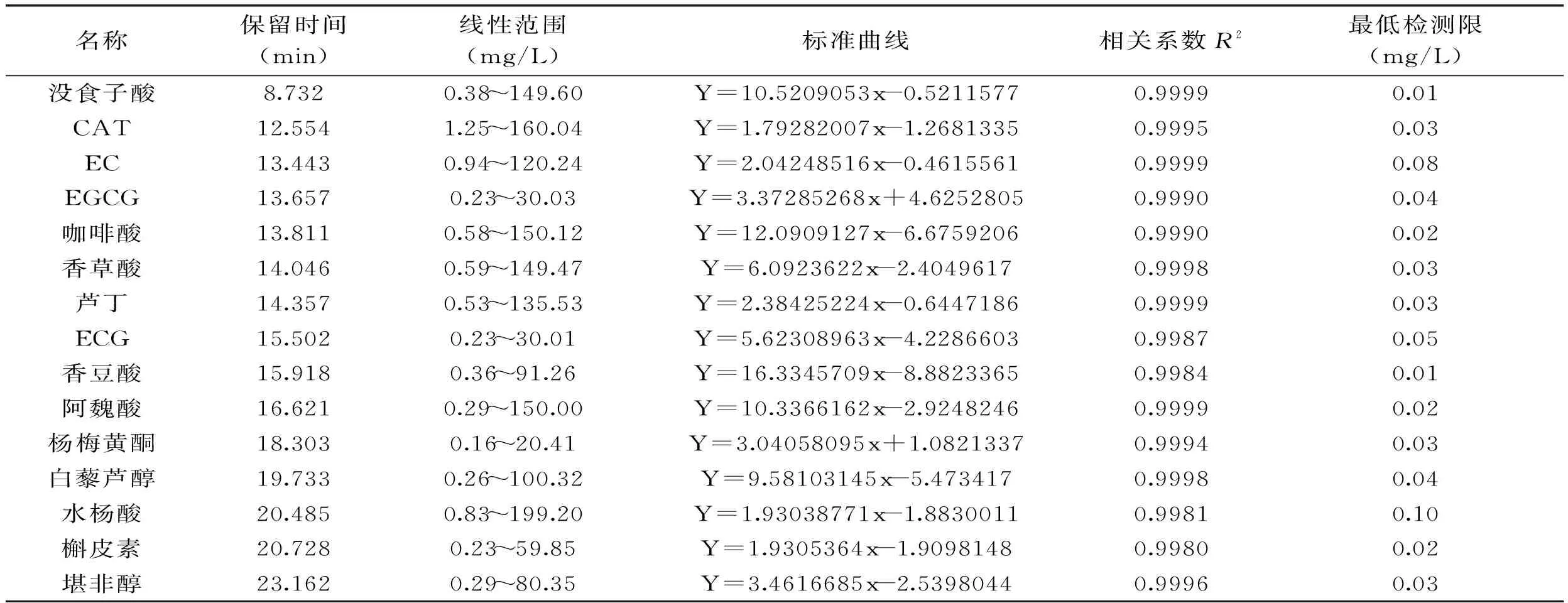
表1 15种酚类物质的回归方程及相关参数(n=5)

图1 采用流动相Ⅰ和Ⅱ下15种单体酚类液相色谱图a和bFig.1 Chromatogram of 15 mono-phonels standardsunder the first and second gradient program注:1.没食子酸,2.CAT,3.EC,4.EGCG,5.咖啡酸,6.香草酸,7.芦丁,8.ECG,9.香豆酸,10.阿魏酸,11.杨梅黄酮,12.白藜芦醇,13.水杨酸,14.槲皮素,15.堪非醇。
在梯度II条件下葡萄籽和葡萄皮样品的液相色谱图如图2和图3所示,从图中可以看出两种样品在这一洗脱条件下15种单体酚类能够有效的分离,可以作为测定这两种样品的洗脱条件。
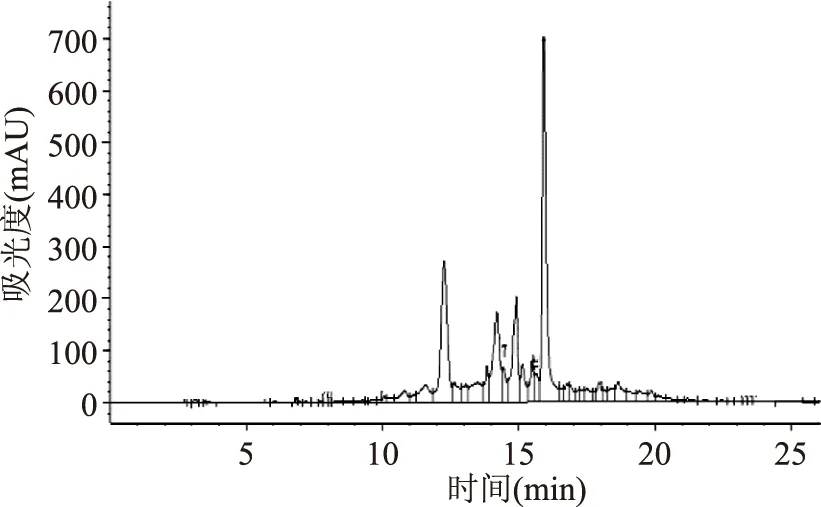
图2 葡萄籽样品液相色谱图Fig.2 Chromatogram of grape seeds
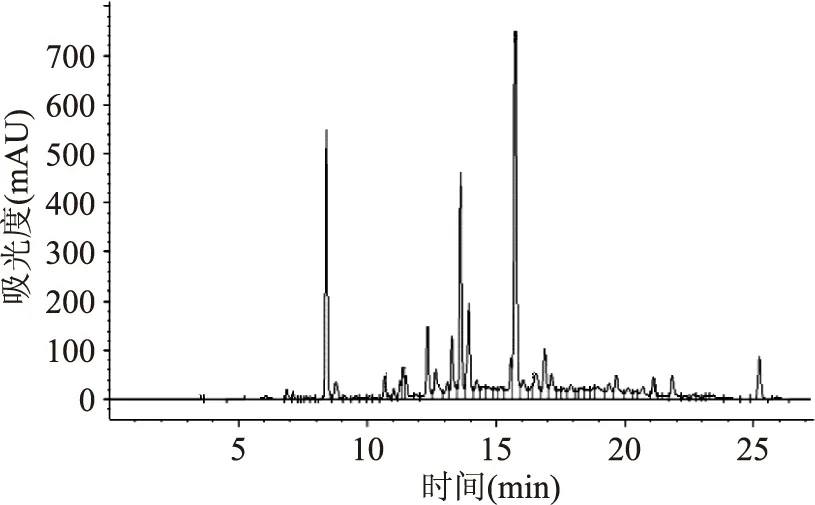
图3 葡萄皮样品液相色谱图Fig.3 Chromatogram of grape skin
2.3回收率和相对标准偏差
将已知15种单体酚浓度的葡萄皮、籽样品分别添加各标准品的混合标准溶液,按照1.2.1制备葡萄样品(n=5)。吸取10 μL进样,根据所测样品中的15种单体酚的含量计算相应的精确度和回收率,结果见表2。从表2中可以看出,样品回收率均大于85%,相对偏差也较低(在3%以内),方法精密度高,符合高压液相色谱测定要求。
2.4葡萄样品的测定
根据前述色谱条件,对蓬莱产区赤霞珠、小味儿多、品丽珠三个品种的葡萄样品葡萄皮和葡萄籽中的15种单体酚含量进行测定,结果见表3、表4。
从表3可以看出,三个葡萄品种的葡萄籽中共检测出12~15种单体酚,主要酚类是黄烷醇类,这与文献[12]报道的相吻合。在黄烷醇类中,CAT是主要成分,其次是EC,这与温鹏飞[2]等检测结果也相吻合。种子中其它成分如芦丁、阿魏酸、香草酸等含量也较高,咖啡酸、没食子酸、槲皮素、ECG、EGCG、白藜芦醇等也有检出。
葡萄籽中单体酚含量与葡萄品种和年份有关[11],从检测的三个品种中可以看出:小味儿多>赤霞珠>品丽珠,从年份来看2014>2013>2012,这与这三年的气候条件相符合。2012年7月下旬、8月份、9月上中旬雨水较集中,阴雨天较多;2013年雨水集中在6月、7月,8、9、10月份较少;2014年和2013年类似,但10月份收获季节下了些雨,因此果实品质是2014>2013>2012。
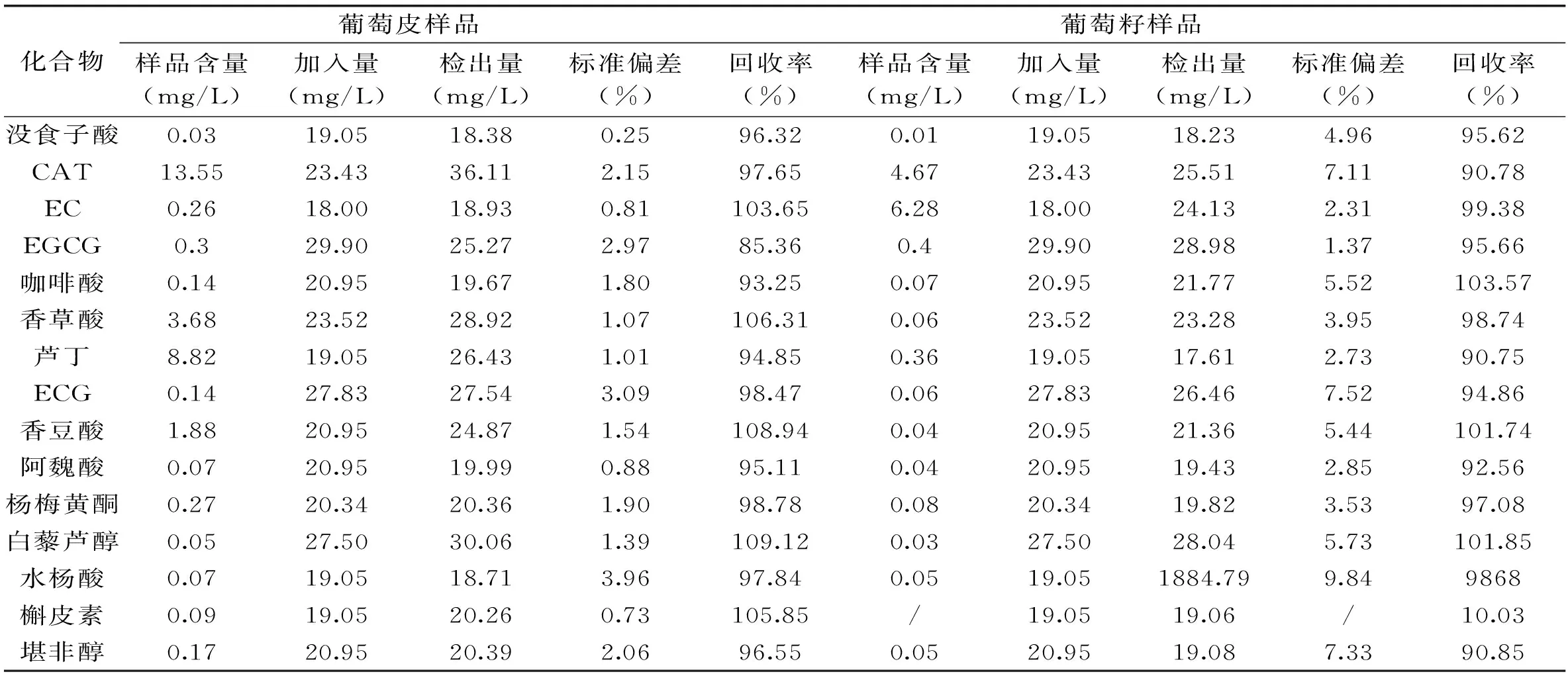
表2 样品和标样加标回收率及相对标准偏差(n=5)
注:/表示未检测出。
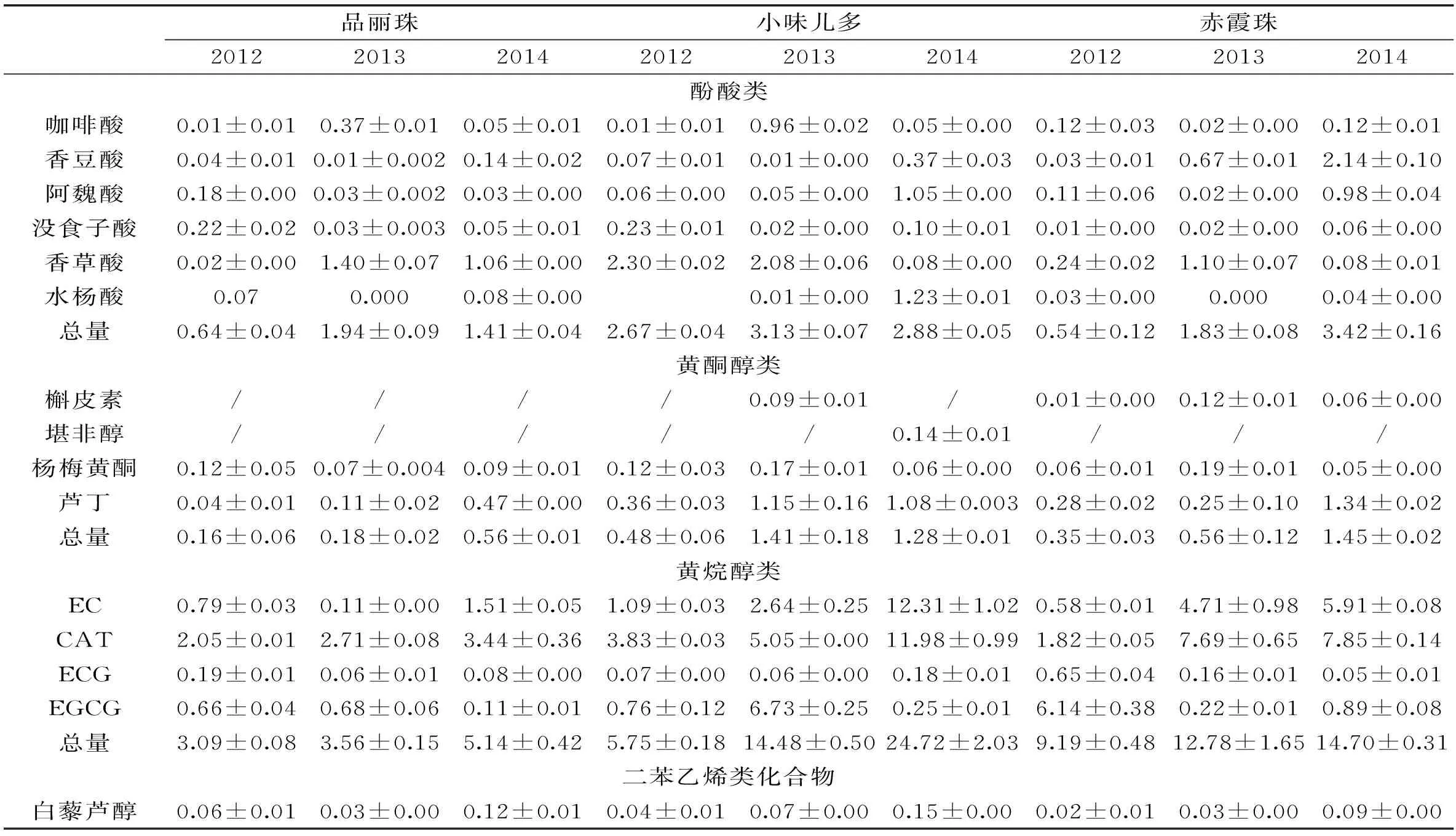
表3 蓬莱产区葡萄籽中15种单体酚的含量和均值(mg/100 g(干重))(n=3)
注:/表示未检测出。
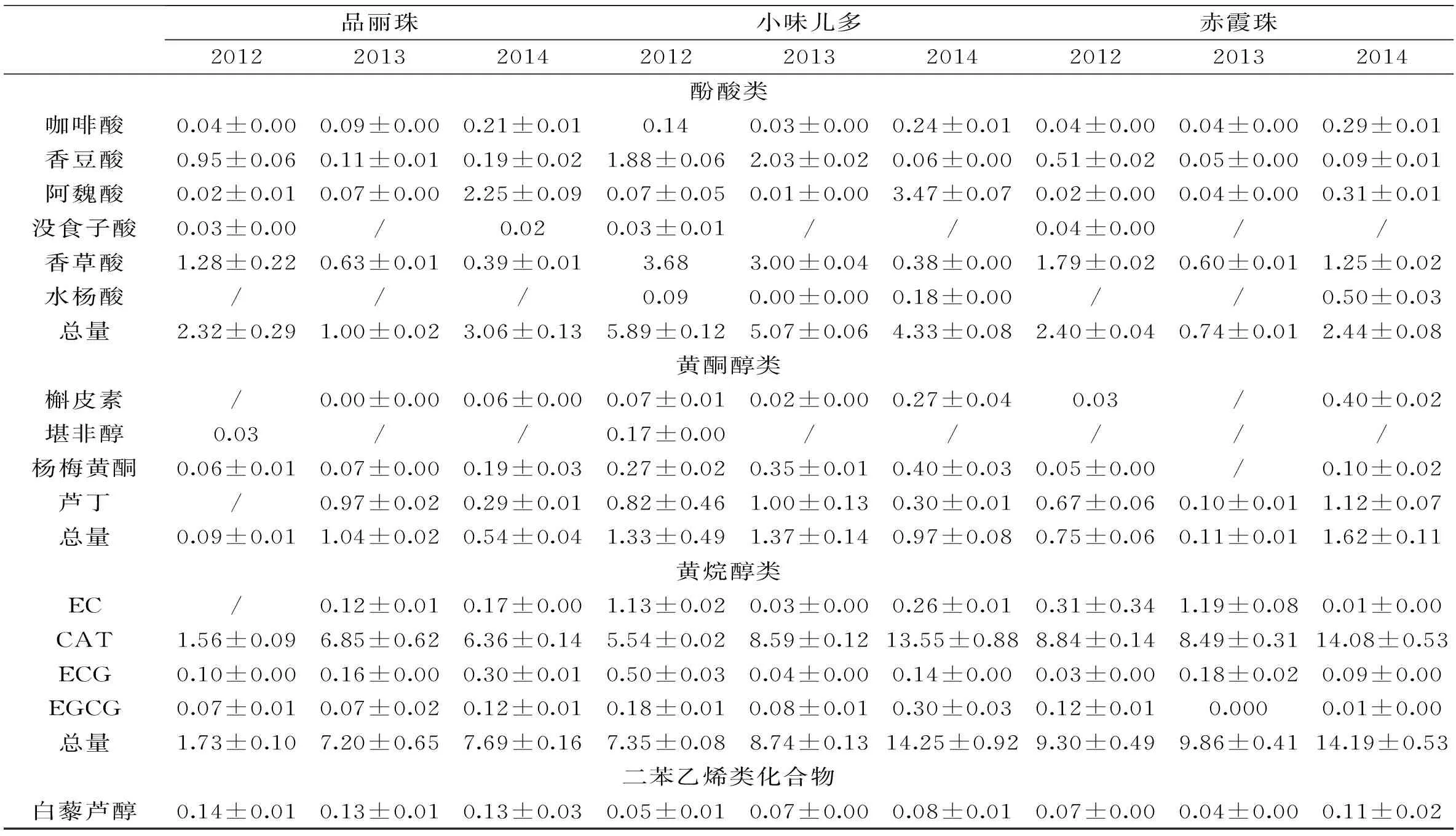
表4 蓬莱产区葡萄皮中15种单体酚的含量和均值(mg/100 g(干重))(n=3)
红色品种葡萄皮的主要多酚是花色苷,本方法是测定除花色苷外其它种类的酚类物质。从表4中可以看出,黄烷醇类是葡萄果皮的重要多酚之一,在这三个葡萄品种中都存在黄烷-3-醇单体及聚合体,其中EC和CAT是主要的单体,也有少量的ECG和EGCG。另外,在葡萄皮中酚酸类(咖啡酸、阿魏酸、没食子酸、香草酸等)、白藜芦醇、黄酮类(杨梅黄酮、芦丁、槲皮素等)等多酚也被检测出。从品种看,葡萄皮中单体酚含量最高的是小味儿多,其次是赤霞珠,然后是品丽珠。从年份看,三个品种都是以2014年单体酚含量最高。
3 结论与讨论
本文建立一种新的同时测定葡萄皮、葡萄籽中15种单体酚含量的HPLC方法。通过对流动相的选择和优化,在选定的液谱条件下,15种酚类物质在30 min内得到了很好地分离,且回收率均在85%以上,最低检测限也较低。该方法简单、实用,且准确度、灵敏度较高,重复性好。
针对3个葡萄品种连续三年对葡萄皮、葡萄籽中15种单体酚进行测定,通过比对本次实验结果与文献报道结果可以发现,本次实验数据与文献报道数据相吻合,进一步说明本实验方法能够对葡萄皮和葡萄籽中的15种酚类进行检测。在本方法对葡萄籽中酚类物质测定时发现,基线有点飘移,说明在前处理时有些杂质尚未被去除,在今后的工作中可以继续探索更有效的前处理方法。另外,本次实验只选取几种代表性的单体酚类,不能了解其他酚类的含量,为了更全面的测定葡萄中单体酚的含量,在今后工作中可以根据多酚类别有分步测定。
[1]Lu Y,Yeap Foo L. Polyphenolics of Salvia:a review[J]. Phytochemistry,2002,59:117-140.
[2]温鹏飞.葡萄与葡萄酒中黄烷醇类多酚和果实原花色素合成相关酶表达规律的研究[D].北京:中国农业大学,2005.
[3]陈建业.葡萄酒中酚酸及葡萄果实苯丙烷类代谢途径研究[D].北京:中国农业大学,2005.
[4]Skerget M,Kotnik P,Hadolin M,et al. Phenols,proanthocyanidins,flavones and flavonols in some plant materials and their antioxidant activities[J]. Food Chemistry,2005,89:191-198.
[5]李景明.葡萄采收后白藜芦醇的诱导与酿造工艺对葡萄酒中白藜芦醇的影响[D].北京:中国农业大学,2003.
[6]Hollman P C H,Arts I C W. Flavonols,flavones and flavanols:nature,occurrence and dietary burden[J].Journal of the Science of Food and Agriculture,2000,80:1081-1093.
[7]Garrido J,Borges F. Wine and grape polyphenols:a chemical perspective[J]. Food Research International,2011,doi:10.1016.
[8]Rasmussen S E,Frederiksen H,Krogholm K S,et al. Dietary proanthocyanidins:occurrence,dietary intake,bioavailability,and protection against cardiovascular disease[J]. Molecular Nutrition and Food Research,2005,49:21-40.
[9]Pinelo M,Arnous A,Meyer A S. Upgrading of grape skins:significance of plant cell-wall structural components and extraction techniques for phenol release[J]. Trends in Food Science & Technology,2006,17:579-590.
[10]姜寿梅,金赞敏,梁娜娜,等. 西拉葡萄果实成熟过程中果皮内非花色苷酚类物质的变化[J].中外葡萄与葡萄酒,2008,6:20-24.
[11]李华,王华,袁春龙,等.葡萄酒工艺学[M].北京:科学出版社,2007:24-30.
[12]Rodrigo R,Miranda A,Vergara L. Modulation of endogenous antioxidant system by wine polyphenols in human disease[J]. Clinica Chimica Acta,2011,412:410-424.
[13]Kennedy J A,Troup G J,Pilbrow J R,et al. Development of seed polyphenols in berries from Vitis vinifera L. cv. Shiraz[J]. Australian Journal of Grape and Wine Research,2000,6:244-254.
[14]Souquet J M,Labarbe B,Le Guernevé C,et al. Phenolic composition of grape stems[J]. Journal of Agricultural and Food Chemistry,2000,48:1076-1080.
[15]韩国民,陈锋,侯敏,等.葡萄酒中14种单体酚的高压液相色谱测定[J].食品科学,2011,32(2):180-183.
[16]王美丽,张振文,张予林. HPLC测定酿酒葡萄中单体酚的方法研究[J].酿酒科技,2006(6):91-93.
[17]B. Girard,L. Fukumoto,G. Mazza,et al. Volatile Terpene Constituents in Maturing Gewürztraminer Grapes from British Columbia[J]. Am. J. Enol. Vitic,2002,53(2):99-109.
[18]成宇峰,张振文,岳泰新,等. HPLC同时检测葡萄酒中10种单体酚的方法[J].食品科学,2008,29(4):287-290.
Determination of 15 mono-phenols in grape skin and seeds by high performance liquid chromatography
SHI Hong-mei1,WANG Heng-zhen2,*,SUN Yu-xia2,WANG Yong-mei1,ZHOU Pan3
(1.Shandong Academy of Grape,Ji’nan 250100,China;2.Institute of Agro-food Science and Technology,Shandong Academy of Agricultural Sciences(SAAS),Ji’nan 250100,China;3. Chateau changyu castel co.,LTD.Yantai,Yantai 264000,China)
A high performance liquid chromatograohic(HPLC)method was established for the determination of 15 mono-phenols in grape skin and grape seeds. The ZORBAX SB-C18(4.6 mm×250 mm,5 μm)was used as chromatographic column with column temperature of 30 ℃. Acetonitrile and formic acid aqueous solution was used as the mobile phase by gradient elution with a flow rate of 1.0 mL/min. The detection wavelength was set at 280 nm. A good linearity was obtained for 15 mono-phenols in the range of 0.01~0.10 mg/L. The correlation coefficients were in range of 0.9980~0.9999. The recoveries of standard samples were in the range of 93.25%~109.12%. The method was rapid,simple and high senstivity and was suitable for the determination of 15 mono-phenols in grape skin and grape seeds.
HPLC;grape seeds;grape skin;mono-phenols
2015-11-16
史红梅(1979-),女,硕士,高级工程师,研究方向:葡萄酒酿造新工艺及风味物质的分析测定,E-mail:hm.sh@163.com。
王恒振(1978-),男,硕士,农艺师,研究方向:葡萄栽培技术及风土条件和微域环境对葡萄品质的影响,E-mail:chinajinan@163.com。
TS201.2
A
1002-0306(2016)11-0318-06
10.13386/j.issn1002-0306.2016.11.057
