有机氮源对出芽短梗霉发酵普鲁兰多糖的影响
2016-09-10马赛箭薛文娇上官亦卿
马赛箭,安 超,薛文娇,常 帆,上官亦卿,丁 浩
(陕西省微生物研究所,陕西西安 710043)
有机氮源对出芽短梗霉发酵普鲁兰多糖的影响
马赛箭,安超,薛文娇*,常帆,上官亦卿,丁浩
(陕西省微生物研究所,陕西西安 710043)
以出芽短梗霉(Aureobasidiumpullulans)CGMCC. 11062为出发菌株,研究了六种有机氮源对普鲁兰多糖产量、结构、纯度及分子量的影响。结果表明:在不同有机氮源的发酵条件下,普鲁兰多糖产量由高到低依次为:酵母粉>牛肉膏>蛋白胨>胰蛋白胨>麦芽浸粉>尿素,其中以酵母粉为有机氮源时,普鲁兰多糖产量达到60.64 g/L;普鲁兰多糖的结构和纯度受有机氮源种类的影响很小,相对稳定,表明该菌株能够适用于各种有机氮源生产普鲁兰多糖,适合工业化生产;不同有机氮源所生成的普鲁兰多糖分子量由大到小的顺序依次为:麦芽浸粉>牛肉膏>蛋白胨>胰蛋白胨>尿素>酵母,重均分子量范围Mw在289039~604375 u之间,分子量分散指数在2.0~2.4。这些研究可为不同特性普鲁兰多糖的生产提供技术指导。
有机氮源,普鲁兰多糖,产量,纯度,分子量
普鲁兰多糖是由出芽短梗霉(Aureobacidiumpullulans)发酵产生的细胞外纯天然高分子多糖,是一种新型可降解生物材料。该多糖是以α-1,6-糖苷键连接的聚麦芽三糖,即3个葡萄糖以两个α-1,4-糖苷键连接形成麦芽三糖,两端再以α-1,6-糖苷键同另外两个麦芽三糖结合形成高分子多糖,一般没有分支结构,是直链多糖[1]。由于这种独特的连接方式,使得普鲁兰多糖具有高度的结构柔韧性及良好的水溶性,制成的膜具有优异的阻氧性能,经过化学改性能够改变其水溶性或提供活性反应基团。因此,普鲁兰多糖及其衍生物被广泛地用于食品、医药、化工及电子等众多领域,是一种具有极大开发价值和前景的多功能新型生物制品。
普鲁兰多糖的分子量在50~500 ku[2],主要受出芽短梗霉菌种差异、碳源种类、培养时间及发酵pH等因素的影响。目前,商业化的普鲁兰多糖的数均分子量大概在100~200 ku,重均分子量大概在362~480 ku,分子量分散指数一般在2.1~4.1之间[3-4]。分子量的分布范围决定了普鲁兰多糖的应用范围,例如30~90 ku大小的普鲁兰多糖分子片段可代替右旋糖酐作为血浆扩容剂[5-6]。

1 材料与方法
1.1材料与仪器
出芽短梗霉(Aureobasidiumpullulans)CGMCC 11062,保藏于中国微生物菌种保藏中心。活化培养基(g/L):马铃薯去皮去芽眼,洗净、切块,称200 g放入1000 mL蒸馏水中用文火煮沸30 min,双层纱布过滤,滤液加水补至1000 mL,加20 g蔗糖,15 g琼脂粉,121 ℃,20 min灭菌。种子培养基(g/L):葡萄糖50.0;MgSO4·7H2O 0.2;K2HPO45.0;酵母粉 1.7;(NH4)2SO40.6;NaCl 1.0;初始pH6.5,113~116 ℃,20 min灭菌。发酵培养基(g/L):蔗糖 50;MgSO4·7H2O 0.2;K2HPO45.0;(NH4)2SO40.6;NaCl 1.0,有机氮源(胰蛋白胨、牛肉膏、蛋白胨、麦芽浸粉、酵母粉、尿素)1.7。初始pH6.5,113~116 ℃,20 min灭菌。麦芽三糖标准品M106948-100 mg(阿拉丁),普鲁兰酶P1067-250U(Sigma),普鲁兰多糖标准品P4516-25G(Sigma),不同分子量普鲁兰多糖标准品(Mp范围9.6-2560 ku,96351-1KT,05287-25MG,04661-25MG,Sigma)。
恒温培养箱SPX-250北京科伟永兴仪器有限公司;控温摇床ZWY-2102上海智诚分析仪器制造有限公司;紫外可见分光光度计UV-1800岛津;傅立叶变换红外光谱仪Nicolet is 50Thermo Scientific;高效液相色谱仪(Waters 1515),示差检测器(Waters 2414),凝胶色谱柱(UltrahydrogelTMLinear 7.8×300 mm column),预柱型号(UltrahyfrogelTM6×40 mm Guard Column)。
1.2培养方法
活化培养方法:将菌种在28 ℃恒温培养箱培养5 d。
种子培养方法:将活化好的菌株接种在装有50 mL种子培养液的250 mL三角瓶中,置于恒温摇床上(230 r/min),28 ℃条件下培养48 h,即为种子液。
发酵培养方法:按照5%接种量将种子接种到装有20%培养液的三角瓶中,置于恒温摇床上(230 r/min),28 ℃条件下培养96 h。
1.3分析方法
1.3.1菌体生物量将发酵液30 mL装入50 mL离心管中,8000 r/min,离心10 min,取沉淀于105 ℃干燥至恒重,生物量计算公式如下:
生物量(g/L)=(M实重-M空重)×1000/30
1.3.2普鲁兰多糖产量取上清液15 mL加入2倍体积的95%乙醇,4 ℃静置12 h,8000 r/min离心10 min,收集沉淀,加水重溶,再次加入2倍体积95%乙醇进行沉淀,将沉淀于80 ℃烘至恒重,精确称重,多糖含量计算公式如下:
多糖含量(g/L)=(M实重-M空重)×1000/15
1.3.3残糖含量苯酚硫酸法[10]。
1.3.4结构测定应用傅里叶变换衰减全反射红外光谱法(ATR-FTIR)直接测定制备获得的普鲁兰多糖粉末[11]。
1.3.5纯度测定利用普鲁兰酶酶解产物,使其成降解为还原糖麦芽三糖,然后利用DNS法测定麦芽三糖的含量,从而计算普鲁兰多糖的纯度[12]。
1.3.6分子量测定利用高效液相色谱法(GPC)测定普鲁兰多糖分子量分布范围。以0.1 mol/L NaNO3作为流动相,流速0.5 mL/mim,柱温箱温度35 ℃,样品浓度1 g/L,进样量20 μL,数据处理使用Waters自带的Breeze软件积分获得[13]。
1.3.7数据统计分析使用SPSS软件进行数据统计分析。
2 结果与分析
2.1有机氮源种类对出芽短梗霉发酵普鲁兰多糖的影响

图1 有机氮源种类对普鲁兰发酵的影响Fig.1 The effects of organic nitrogen sources on pullulan by A. pullulans注:1.胰蛋白胨;2.牛肉膏;3.蛋白胨;4.麦芽浸粉;5.酵母粉;6.尿素。
由图1可以看出,有机氮源的种类对普鲁兰多糖产量及底物碳源转化率有显著性影响,而对菌体的产量影响不显著。其中,在以酵母粉为底物发酵时,普鲁兰多糖的产量最高,达到了60.64 g/L,其他依次分别为牛肉膏40.8 g/L、蛋白胨35.79 g/L、胰蛋白胨34.92 g/L、酵母浸粉30.56 g/L、尿素27.5 g/L;同时,以残糖含量为考核指标,残糖含量由小到大依次为酵母粉6.53 g/L、牛肉膏21.58 g/L、胰蛋白胨27.56 g/L、蛋白胨30.78 g/L、麦芽浸粉34.93 g/L、尿素42.12 g/L。有机成分比较复杂,除含有丰富的蛋白质、肽类、游离的氨基酸以外,还含有少量的糖类、脂肪和生长因子等,影响微生物的生长代谢及代谢产物合成。尿素虽然为有机氮源,但是其成分简单,不含有微生物必需的氨基酸类。因此,在以尿素为有机氮源时,普鲁兰多糖的产量和底物的利用率都较低,这可能是由于缺乏微生物的必需氨基酸,导致微生物自主合成相关氨基酸及生长因子,进而延长了微生物的代谢周期。
2.2有机氮源种类对普鲁兰多糖结构的影响
目前研究多糖结构的方法有很多种,如紫外光谱、红外光谱、核磁共振波谱、气相色谱-质谱联用以及多糖的分子修饰等。糖的红外光谱技术起源于上世纪七十年代,由于红外光谱技术的发展及糖化学的深入研究,红外光谱成为糖结构研究的重要手段之一,主要用于不同糖的鉴别、吡喃糖和呋喃糖的识别、糖苷键及糖构型的确定、糖键上主要取代基的识别[14]。
红外色谱分析的结果见图2所示:六种不同有机氮源的培养液发酵合成的普鲁兰多糖样品具有明显的多糖特征吸收峰,与普鲁兰多糖标准品具有一致的红外吸收。在3000~2800,1400~1200,1000~700 cm-1区域内显示出特征的吸收峰。普鲁兰多糖在4000~400 cm-1范围内大致可分为:3600~3200 cm-1出现一宽峰,是糖类存在的分子间或分子内的O-H伸缩振动产生的;3000~2800 cm-1存在吸收较弱的C-H的伸缩震动吸收峰;此两组吸收峰是糖类的特征峰[15]。1400~1200 cm-1的吸收峰是由两个C-O伸缩振动产生,其中一个属于C-O-H,另一个是糖环C-O-C;1000~700 cm-1包含着糖类特征吸收峰,主要表现为糖的吡喃环的振动谱[16],图谱的细微差别可能是由普鲁兰多糖的纯度差异引起的。不同种类的有机氮源对普鲁兰多糖的结构未产生显著性影响。
图2 普鲁兰多糖标准品的红外光谱曲线Fig.2 The curve on infrared ray spectreum of pullulan
2.3有机氮源种类对普鲁兰多糖纯度的影响
本研究中利用DNS法测定麦芽三糖的标准曲线如图3所示,在麦芽三糖浓度200~1000 mg/L范围内,回归方程Y=0.0008X+0.0386,R2=0.9951,具有很好的相关性。不同有机氮源对普鲁兰多糖纯度的影响结果如表1所示,普鲁兰多糖的纯度在95%~99%之间,纯度较高,这可能与本研究使用的菌株有关。另外,本研究中选用蔗糖为底物、有机氮源、酒精都为试剂级,杂质较少,同时,采用摇瓶发酵方式、避免了搅拌式发酵罐机械搅拌造成的细胞破碎,同时,发酵周期比较短,出芽短梗霉细胞活力较高,自溶不明显,离心效果好,上清液中胞内蛋白、细胞碎片等大分子残留比较少,从而获得的普鲁兰多糖纯度较高。其次,二次酒精沉淀起到洗涤的目的,洗涤次数对提纯得率和多糖纯度均有一定的影响,多糖得率随着洗涤次数的增加逐渐减少,而多糖纯度随洗涤次数的增加而增加,但两者的变化幅度都不是很大,多次洗涤虽然可以提高多糖纯度,但洗涤剂的用量及洗涤引起的多糖损失也会随之增多。

图3 麦芽三糖分光光度法测定标准曲线Fig.3 The standard curve of maltotriose spectrophotometry determination

项目胰蛋白胨牛肉膏蛋白胨麦芽浸粉酵母粉尿素纯度(%)97.4898.3298.1295.8799.1695.21
2.4有机氮源对普鲁兰多糖分子量的影响
普鲁兰多糖的分子量决定了普鲁兰多糖的应用范围及价值,高分子量的普鲁兰多糖更适用于商业用途。本研究中选用Sigma普鲁兰多糖分子量标准品,使用Waters 1515-2414(示差检测器)检测平台,获得了普鲁兰多糖分子量的标准曲线,如表2所示,分子量越大,出峰时间越早。通过GPC测定不同有机氮源条件下的普鲁兰多糖分子量大小,如图4所示,生成的普鲁兰多糖分子量由大到小依次为:麦芽浸粉>牛肉膏>蛋白胨>胰蛋白胨>尿素>酵母粉。通过Waters GPC自带的Breeze软件,依据普鲁兰多糖分子量标准生成标准曲线,进而对不同有机氮源制备的普鲁兰多糖的分子量积分计算,具体参数见表3所示,其中以麦芽浸粉为有机氮源生产的普鲁兰多糖分子量最大,重均分子量Mw为604375 u,属于高分子量的普鲁兰多糖制品,适用于水凝胶、药物载体等领域,而以酵母粉为有机氮源生产的普鲁兰多糖分子量最低,重均分子量Mw为289039 u,与国内外同类产品的分子量相当。分散系数在2.0~2.4之间,相对较窄,这可能与发酵周期短,未被水解酶水解有关。
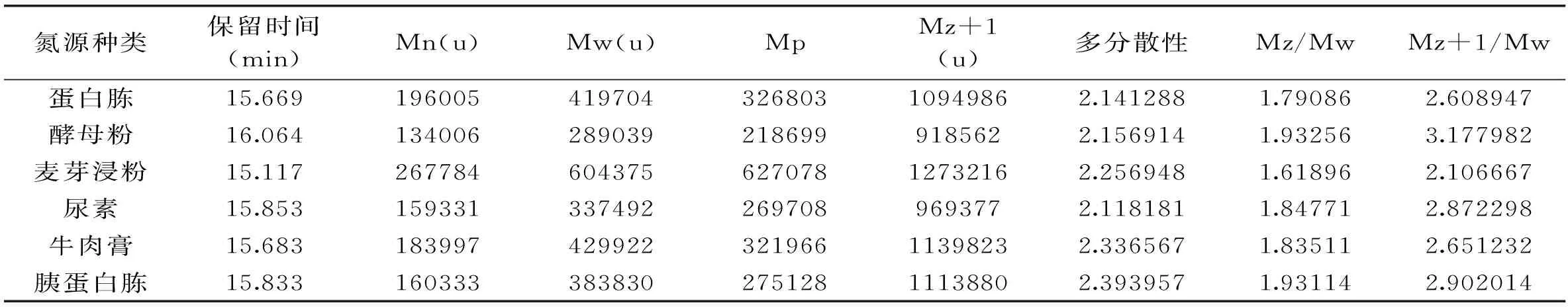
表3 有机氮源种类对普鲁兰多糖分子量分布的影响

表2 不同分子量普鲁兰多糖标准曲线测定

图4 有机氮源种类对普鲁兰多糖分子量大小的影响Fig.4 The organic nitrogen on the influence of pullulan molecular weight size
3 讨论
有关普鲁兰多糖发酵方面的研究主要集中在优化培养条件、缩短发酵时间、降低生产成本,提高产品纯度以满足食品、化妆品和医药品的需求,并提升产品附加值。普鲁兰多糖的纯度主要受菌株类型、发酵方式及后处理工艺的影响。West和Strohfus[17]利用琼脂和藻酸钙珠固定化出芽短梗霉细胞发酵生产普鲁兰多糖,结果产生的普鲁兰多糖纯度只有36%。可能是由于这些材料相对较小的孔径阻碍了大分子普鲁兰多糖的释放。于航[18]通过研究最终获得普鲁兰多糖的产量约为20 g/L,提取得率为89.2%,最终产品纯度为95.2%。Cheng[19]等人研究表明:75 g/L蔗糖,3 g/L酵母粉和5 g/L的硫酸铵组合下,普鲁兰多糖的产量最高,培养7 d后,收获25.8 g/L的普鲁兰多糖,纯度达到94.5%。高璇璇[20]等研究了脱色和干燥方式对普鲁兰多糖品质的影响,结果表明选用ZY-24×48-B型活性炭,添加量为1.0%(w/v)、pH5.0,时间40 min,温度40 ℃,此时脱色率为94.98%,多糖得率为91.24%,通过喷雾干燥,所得样品纯度为91.07%。王长海[21]等在实验室制备的短梗霉多糖纯度为96.8%,与本实验结果相接近。
氮源的水平和种类对菌体形态和代谢产物的合成起关键性作用,是一个重要且复杂的因素[22],也是一个严格调控的过程,赋予真菌能够利用有限的氮源满足细胞的生存所需[23]。目前,系统地研究有机氮源种类对普鲁兰多糖发酵影响的并不是很多,而且主要集中在无机氮源,特别是铵盐对普鲁兰多糖合成的影响。Wiley和Lin等[24]人研究了碳源、氮源和磷酸盐对普鲁兰多糖分子量分布的影响,其中氮源是影响分子量的最大因素,铵离子被证实比硝酸根离子更有利于生产高分子量的普鲁兰多糖。Catley等人[25]研究了氮源限制效应下出芽短梗霉合成普鲁兰多糖的情况,发现伴随着相同的碳源消耗率,葡萄糖是流向胞内物质的合成还是普鲁兰多糖的合成取决于硫酸铵的浓度。盛龙等人[8]的研究表明,吐温80的增加会降低普鲁兰多糖分子量的大小,这表明吐温80确实影响到了普鲁兰从胞内向胞外的分泌。
4 结论
本文选择实验室常见的有机氮源,研究了有机氮源对出芽短梗霉CGMCC 11602发酵生产普鲁兰多糖的产量、结构、纯度、分子量的影响,结果表明:在相同发酵条件下,不同有机氮源所生成的普鲁兰多糖产量由高到低依次为:酵母粉>牛肉膏>蛋白胨>胰蛋白胨>麦芽浸粉>尿素,以酵母粉为有机氮源时,普鲁兰多糖产量达到60.64 g/L;普鲁兰多糖的结构和纯度受有机氮源种类的影响不显著,表明该菌株能够适用于各种有机氮源生产普鲁兰多糖,相对稳定,适合工业化生产;不同有机氮源所产生的普鲁兰多糖分子量由大到小的顺序依次为:麦芽浸粉>牛肉膏>蛋白胨>胰蛋白胨>尿素>酵母,重均分子量范围Mw在289039~604375 ku之间,分子量分散指数在2.0~2.4,其中由麦芽浸粉生产的高分子量普鲁兰多糖适用于水凝胶、药物载体的领域,而由酵母粉生产的普鲁兰多糖分子量与同类产品基本一致。
[1]崔玉海. 出芽短梗霉G-58的发酵条件及动力学研究[D].无锡:江南大学,2008.
[2]刘畅. 出芽短梗霉的发酵条件及其糖酵解研究[D]. 无锡:江南大学,2012.
[3]杨西江,徐田华,徐玲,等.普鲁兰多糖的应用及研究生产现状[J].发酵科技通讯,2010,39(4):25-28.
[4]Roukas T,Mantzouridou F J. Effect of aeration rate on pullulan production and fermentation broth rheological properties in an airlift reactor[J]. Journal of Chemical Technology & Biotechnology,2001,76(4):371-376.
[5]Igarashi T,Nomura K,Naito K,et al. Plasma extenders[P]. US Patent Office,Pat. No. 4370472,1983.
[6]Kulicke W M,Heinze T. Improvements in Polysaccharides for use as Blood Plasma Expanders[J]. Macromolecular Symposia,2005,231(1):47-59.
[7]卢辉官. 出芽短梗霉的胞外多糖在氮源作用下的积累及其应用[D].扬州:扬州大学,2010.
[8]盛龙. 普鲁兰多糖生物合成的关键影响因素及其机理研究[D].无锡:江南大学,2015.
[9]Kudryashova O A,Yurlova N A. Effect of the nitrogen source on the biosynthesis,composition,and structure of the exopolysaccharides of Aureobasidium pullulans(de Bary)Arnaud[J]. Microbiology,2000,69(4):428-435.
[10]Sena R F,Costelli M C,Gibson L H,et al. Enhanced production of Pulllulan by two strains of A.pullulans with Different concentrations of soybean oil in sucrose solution in batch fermentations[J]. Brazilian Journal of Chemical Engineering,2006,23(4):507-515.
[11]Zou J,Zhang F,Chen Y,et al. Responsive organogels formed by supramolecular self assembly of PEG-block-allyl-functionalized racemic polypeptides intoβ-sheet-driven polymeric ribbons[J]. Soft Matter,2013,9(25):5951-5958.
[12]Wu S J,Kim J M,Chao Z,et al. Estimation of pullulan by hydrolysis with pullulanase[J]. Biotechnology Letters,2010,32
(8):1143-1145.
[13]Sugumaran K R,Sindhu R V,Sukanya S,et al. Statistical studies on high molecular weight pullulan production in solid state fermentation using jack fruit seed[J]. Carbohydrate Polymers,2013,98(1):854-860.
[14]赵瑛,程建新,李红玉,等. 茁霉多糖的结构分析及含量测定[J]. 食品与发酵工业,2009,35(6):162-164.
[15]夏朝红,戴奇,房韦,等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报,2007,29(1):45-47.
[16]林雨露.多糖的化学结构及构效关系的研究[J]. 江汉大学学报:人文科学版,2000(6):34-37.
[17]West T P,Strohfus B. Polysaccharide production by immobilized Aureobasidium pullulans cells in batch bioreactors[J]. Microbiological Research,2001,156(3):285-288.
[18]于航. 低色素出芽短梗霉的选育及其培养条件优化[D]. 无锡:江南大学,2007.
[19]Cheng K C,Demirci A,Catchmark M J. Evaluation of medium composition and cultivation parameters on pullulan production by Aureobasidium pullulans[J]. Food Science and Technology International,2011,17(2):99-109.
[20]高璇璇,郑志达,孟迪,等. 脱色和干燥方式对普鲁兰多糖品质的影响[J]. 食品工业科技,2014,35(14):250-255.
[21]王长海,李焰红,鞠宝,等.短梗霉多糖在海产品保鲜方面的应用研究[J].烟台大学学报:自然科学与工程版,1999,12(2):148-152.
[22]Auer,Desmond P F,Seviour R J. Influence of varying nitrogen sources on polysaccharide production by Aureobasidium pullulans in batch culture[J]. Applied Microbiology & Biotechnology,1990,32(6):637-644.
[23]Donofrio N M,Oh Y,Lundy R,et al. Global gene expression during nitrogen starvation in the rice blast fungus,Magnaporthe grisea[J]. Fungal Genetics & Biology Fg & B,2006,43(9):605-617.
[24]Lin Y,Zhang Z,Thibault J. Aureobasidium pullulans batch cultivations based on a factorial design for improving the production and molecular weight of exopolysaccharides[J]. Process Biochemistry,2007,42(5):820-827.
[25]Catley B J,Ramsay A,Servis C. Observations on the structure of the fungal extracellular polysaccharide,pullulan[J]. Carbohydrate Research,1986,153(1):79-86.
Effects of organic nitrogen sources on the fermentation of Pullulan byAureobasidiumpullulans
MA Sai-jian,AN Chao,XUE Wen-jiao*,CHANG Fan,SHANGGUAN Yi-qing,DING Hao
(Microbiology institute of Shaanxi,Xi’an 710043,China)
The effect of six organic nitrogen sources on pullulan yield,structure,purity and molecular weight was studied by usingAureobasidiumpullulansCGMCC 11062. The results showed that the pullulan yield was different by using different organic nitrogen source,the highest yield was yeast extract,which can reach 60.64 g/L,then was beef extract,peptone,trypton,malt extract and the least was urea. The structure and purity of pullulan by different organic nitrogen species were consistent,which indicated that this strain can be applied to a variety of organic nitrogen to produce pullulan,and it was suitable for industrial production. The molecular weight of produced pullulan under different organic nitrogen was also great difference. The highest molecular weight was the one produced from malt extract,then were beef extract,peptone,trypton,urea and the lowest was yeast. Their weight average molecular weight(Mw)were between 289039~604375 u,molecular weight distribution was 2.0~2.4. These studies could provide technical guidance for the different characteristics of pullulan production.
organic nitrogen sources;pullulan;yield;purity;molecular weight
2015-12-08
马赛箭(1982-),女,硕士,助理研究员,主要从事微生物代谢产物研究,E-mail:masaijian@163.com。
薛文娇(1976-),女,博士,副研究员,主要从事微生物发酵及代谢产物研究,E-mail:x-wenjiao@163.com。
西部之光(2013DF01);陕西省自然科学基金(2014JM2-2015);陕西省科学院科技计划项目(2013K-06);陕西省科学院科技计划重点项目(2014K-01)。
TS201.3
A
1002-0306(2016)11-0169-05
10.13386/j.issn1002-0306.2016.11.027
