胶原肽及其产业发展
2016-09-10刘海英
刘海英
(江南大学食品学院,江南无锡 214122)
胶原肽及其产业发展
刘海英
(江南大学食品学院,江南无锡 214122)
近年来,我国的胶原肽产业得到了跨越式发展。胶原肽来源于动物胶原,有着独特的性质和广泛的用途。胶原肽常被制成保健品,在保健食品和化妆品领域有着良好的应用前景。本文就胶原肽的基本组成、性质、功能性、产业发展前景做一综述,希望对胶原肽的研究有所裨益。
胶原,胶原肽,功能,吸收
日常生活中提到的胶原蛋白即胶原肽。胶原蛋白(以下称胶原肽)一词进入大多数中国普通民众的视线中比较晚,严格地说,应该是2013年的“胶原蛋白事件”增加了胶原肽的知名度。当时很多主流媒体争相报道并参与了胶原肽有用和无用的争论,在全社会引起了重大反响,同时也对我国的胶原肽产业的发展发生了巨大的影响。如今时过境迁,但是人们对于胶原肽有用与无用的争论仍然存在。产生争论与疑问的原因无非有两点,一是中国的胶原肽市场不规范,产品良莠不齐,公众对其信任度低。另外,我国科研领域对胶原肽的研究积累少,造成公众对胶原肽基本知识缺失,这对胶原肽的研究和产业发展均有不利影响。本文仅对胶原肽的功能和产业发展略作补遗,希望对解决上述问题有所帮助。
1 胶原肽简介
胶原是动物体最主要的蛋白质之一,主要存在于动物的皮、骨、软骨、牙齿、肌腱和血管等中,是结缔组织最重要的结构蛋白质[1]。胶原是哺乳动物体内含量最多的蛋白质,含量可以达到蛋白质总量的25%~30%[2]。现已发现的胶原种类为18种或19种,其中I型胶原是组成皮肤胶原纤维的主要成分[1]。I型胶原的结构和含量的变化,是引起皮肤老化的主要原因[3]。动物皮、骨中的I型胶原也是商业明胶制造的主要原料来源。
将动物的皮、骨,或者明胶通过酸碱水解和酶法水解[4]降解为小分子肽段,当其单条肽链的组成在两个氨基酸以上,而且分子量小于10000 u时,可以称之为胶原肽。胶原肽具有一般蛋白水解肽的性质,其本身也具有一些独特的生物活性。现今市场上的宣传的所谓胶原蛋白产品,其本质就是胶原肽。在工业领域,胶原肽的生产工艺及设备已经相当成熟,日本的新田明胶公司及法国的罗塞洛明胶公司都是世界著名的胶原肽生产商。
2 胶原肽的生理功能
胶原肽具有某些生理功能,这是其作为保健品的物质基础。胶原肽是由胶原水解得到的小肽,具有小肽的一些生理功能。
2.1降血压
血管紧张素转化酶(ACE)抑制剂是治疗高血压、心力衰竭等疾病的理想药物,但是其会使人体产生不良反应,而许多经过生物酶水解制备的胶原肽都具有ACE抑制剂作用。Fahmi[5]、Yesim[6]从海鲷鱼的鱼骨和鱼鳞中制备了具有降压作用的胶原肽;Alemán从乌贼胶原[7]和明胶[8]水解物中分离出降压肽;Zhang[9]利用猪骨明胶水解制备了降压肽;Banerjee[10]利用牛跟腱的胶原酶解制备ACE(血管紧张素转化酶)抑制肽。
2.2抗氧化
自由基的氧化作用是人体衰老和诸多疾病产生的主要原因,而抗氧化剂可以捕获或者淬灭自由基,进而延缓机体的衰老。研究证明,以胶原、明胶为原料,通过水解可制备具有抗氧化功能的胶原肽。Eresha Mendis 等[11]制备了鱼明胶抗氧化肽;Pei等[12]酶解大马哈鱼皮制取的抗氧化胶原肽,可以缓解小鼠的氧化应激反应;Shi等[13]发现,酶解后的鸡蛋壳膜胶原肽可以缓解 Caco-2 细胞的氧化损伤;Cai等[14]从草鱼皮酶解物中分离出3条具有抗氧化活性的胶原肽。
2.3有益关节功能
胶原肽本身具有独特的生理功能。近年来的动物实验和临床研究显示胶原肽具有明显改善骨骼和关节的健康效应[15]:刺激增加成骨细胞数量,减少破骨细胞活性减少;维持骨密度,增加骨骼的坚固性;避免骨吸收;改善骨关节炎患者或高危人群关节疼痛和关节功能等。Moskowitz[16]报道了胶原的水解物对关节炎症具有一定治疗作用。以上研究都表明,摄入胶原肽对机体皮肤的衰老具有一定缓解作用。
2.4促进软骨再生作用
关节软骨是覆盖在关节表面的复杂组织,能起到降低关节的机械磨损的作用。Nakatani等[17]发现胶原2肽Pro-Hyp 具有保护关节软骨作用。新田明胶公司的Kumar等[18],发现猪皮、骨来源的胶原肽,经志愿者口服后,有助于修复软骨组织,缓解其膝骨关节炎的症状。Parmar等[19]用透明质酸和硫酸软骨素修饰胶原肽,摄入其可以促进软骨细胞再生,
2.5抑制肿瘤作用
王静凤[20]等发现鱿鱼皮胶原蛋白肽对小鼠B16黑素瘤细胞黑素含量及酪氨酸酶基因表达的影响。进一步研究表明,鱿鱼皮胶原肽具有抑制B16黑素瘤细胞黑素合成的作用。
2.6胶原肽的营养作用
根据传统理论分析,胶原中缺乏人体代谢必需的色氨酸,它在营养上为不完全蛋白质,所以其营养价值不高。因此,很多学者认为口服原本营养构成就不太理想的胶原肽对身体没有益处。而实际上,胶原肽来源于胶原,因此可以直接食用。胶原肽混合物一般由18种氨基酸组成[21],氨基酸组成比较丰富。虽然由于胶原肽混合物不含色氨酸,而常被认为没有营养,但不能否认胶原肽混合物含有其他蛋白鲜有的大量脯氨酸、羟脯氨酸和羟赖氨酸,而这些氨基酸都是组成胶原的原料,定期食用胶原肽对人体有一定补益作用。
2.7胶原肽对皮肤的作用
在日本和中国,胶原肽经常被宣传为女性美容产品。很多人认为口服胶原肽是完全无效的,最多起到安慰剂的作用,而其对皮肤有改善作用完全是因为里面添加了激素等违禁品。
抛开违法添加不谈,诸多研究已经表明,口服胶原肽对人体皮肤的衰老具有改善作用。Tomoko等[22]研究表明口服胶原三肽CTP,对丙酮诱导造成的皮肤干燥及瘙痒有明显的缓解作用,并提高透明质酸合成酶HAS2的表达,进而提高皮肤中透明质酸的含量;Takashi等[23]研究表明口服胶原肽可以缓解裸鼠皮肤光老化作用。而在临床上,胶原肽的应用效果也得到了证实。美国的 Skovgaard[24]通过实验证明,口服鱼胶原水解物可以提高受试者皮肤的密度,减少受试者前额、口周和眼角皱纹。日本学者Matsumoto等[25]认为,口服胶原肽可以提高皮肤含水量,使其更加富有弹性。因为口服胶原肽对皮肤状况确有改善作用,因此胶原及其水解产物胶原肽已经被录入日本和美国的化妆品原料手册[26]。
综上所述,经过多领域科验工作者的实验证明,胶原肽经过消化后,可以以二肽和三肽等形式吸收进入血液。同时,所吸收的胶原肽可以促进皮肤成纤细胞的生长和迁移,增加皮肤弹性,减少眼角和口周皱纹,减缓皮肤的炎症和衰老。这说明,长期口服无违禁添加物的单纯胶原肽可以对皮肤有改善作用。
3 胶原肽的吸收
3.1胶原肽的肠道吸收
传统蛋白质代谢理论认为,外源蛋白质进入体内,总是先经过水解作用变为游离氨基酸才能被机体吸收并利用。因而,口服的胶原肽经过消化后完全变成游离氨基酸,而后才经消化道吸收。即胶原肽不能以肽的形式吸收,只能以游离氨基酸的形式吸收,所以胶原肽的功能性没有任何意义。
但实际上,经过多年的研究表明,包括胶原肽在内的一些小肽可以通过肠道直接吸收。Adibi用同位素示踪法在血液中检测到肠道中吸收的肽[22],并认为蛋白质消化后主要以肽的形式吸收。上世纪九十年代,Fei等[28]克隆出兔小肠肽转运体,可以转运二肽、三肽甚至四肽。之后,Rong等[29]克隆出人的肽转运体,可以转运二肽和三肽。至此,小肽直接吸收的理论已经基本形成,并被大部分研究者接受。胶原肽是胶原的水解物,在人体内降解至合适的分子量同样可以被直接吸收。小肽在肠道中的吸收过程见图1。
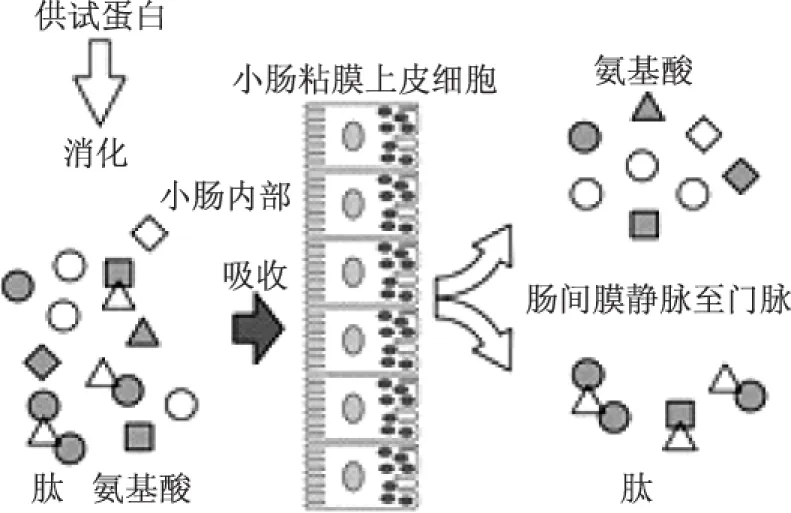
图1 肽在小肠内吸收示意图Fig.1 Diagram of peptide absorption in intestine
3.2胶原肽的血液吸收
有很多学者认为目前没有任何证据证明,三肽经过消化、进入血液以后,还继续保持三肽本身的状态,也不能证明胶原肽到底能不能从血液进入纤维母细胞进而合成胶原。
实际上,因为成本问题,在工业生产中一般不会直接制取二肽和三肽。二肽和三肽的吸收实际是指胶原肽进入人体后,经过消化分解成二肽和三肽后再经过肠道直接吸收入血液。对于胶原肽的吸收过程,日本研究者做了大量研究工作。日本东北大学Watanabe-Kamiyama等[30]用C14标记鸡爪胶原蛋白水解物中的脯氨酸,然后喂食给大鼠。结果表明,大鼠血浆中的短肽的浓度迅速增加,而且在血浆和肾脏中都发现了Gly-Pro-Hyp,而且在14 d后,放射性在皮肤内仍有较高残留。上述实验结果证明,至少胶原肽可以直接由肠道吸收进入血液,而且这些肽具有靶向性,可以富集于皮肤。后续的研究者逐渐鉴别了机体能够吸收的主要胶原肽段。日本明治制果公司的Ichikawa等[31]经研究发现,机体食用胶原肽后,在血液中可检测到以下二肽和三肽:Pro-Hyp、Pro-Hyp-Gly、Ala-Hyp、Ala-Hyp-Gly、Ser-Hyp-Gly、Leu-Hyp、Ile-Hyp、Phe-Hyp。Sugihara等[32]报道了在食用猪皮胶原肽后1 h后,志愿者血清中出现了胶原二肽Hyp-Gly。其研究结果还认为不同含有羟脯氨酸的肽段之间具有比例关系,Hyp-Gly与 Pro-Hyp的比例为0.063~0.221。Shigemura Y[33]也发现食用胶原肽后,志愿者血清中会出现Hyp-Gly,但其与Pro-Hyp的比例为0.00~5.04。以上研究表明,胶原肽可以以二肽形式被人体直接吸收并进入血液,并存在实验依据。
不同来源的胶原肽在人体内的吸收有所区别。Ohara[34]等研究表明(见表1),在志愿者口服来源于鱼鳞、鱼皮、猪皮的 I型明胶水解物2 h后,口服鱼鳞来源明胶水解物的志愿者的血浆中发现了较高浓度的含羟脯氨酸肽段。但是鱼鳞胶原肽吸收后,志愿者血液中含羟脯氨酸(Hyp)的肽段分布较广。而相对于鱼鳞、鱼皮胶原肽,猪皮胶原肽经吸收后的含Hyp肽段比较集中,如下表所示,因为不同的吸收效果,不同来源的胶原肽的作用效果也可能不同。
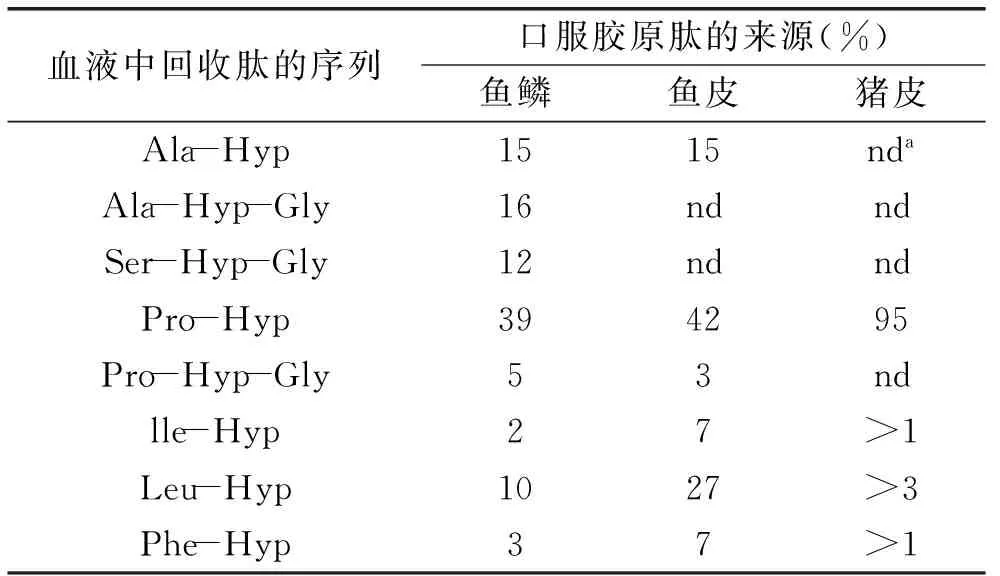
表1 口服明胶水解物(胶原肽)后人血清中
注:a,未检出。
3.3胶原肽的细胞吸收
另外,虽然没有确切研究表明小肽可以进入细胞内部,但已知分子量小于600 u的小分子物质可以直接穿过细胞膜[35],进入细胞内部。而胶原二肽和三肽的分子量通常小于600 u。张伟欣等[36]研究认为二肽和三肽,甚至更高分子量的肽可以通过转运因子穿过细胞膜,进入细胞内部。Laskin等[37]研究表明,胶原肽对人体外周血液中性粒细胞有类似药物的作用。Shigemura等[38]报道了在人体外周血内发现的胶原2肽Pro-Hyp可以促进小鼠皮肤成纤细胞的迁移和生长。发现浓度为200 nmol/mL的Pro-Hyp能显著促进成纤细胞的迁移,浓度为0~1000 nmol/mL的Pro-Hyp与鼠皮成纤细胞的增值率有显著的剂量效应关系。日本明治制果公司的研究人员Ohara等[39]发现2肽Pro-Hyp可以刺激人体成纤细胞的增值,并刺激透明质酸的合成。浓度为200 nmol/mL的Pro-Hyp促进成纤维细胞增殖1.5倍,增强透明质酸的合成3.8倍。而中性粒细胞、成纤细胞等在伤口愈合与消除炎症的过程中有重要作用[40],对于延缓皮肤的衰老有益。
4 胶原肽产业发展趋势
4.1胶原肽产业发展现状
近年来,胶原肽在国际市场的比重迅速增加。特别是近10年来,世界主要保健食品公司将多肽应用在营养保健食品中,并不断提升胶原肽在其保健食品的比例,并推出了含胶原肽的美容产品。全世界整体年销售量已经达到25000 t,已经形成了集美容、关节和骨骼保健、运动保健以及外用品等多个应用领域。在日本市场,胶原肽销售规模达到6000 t。在台湾、韩国和东盟国家,胶原肽的市场规模已经达到16600 t,主要用于皮肤美容和其他保健功能。印度的胶原肽销量也很高,主要用于骨和关节保健。而在北美洲,胶原肽的年销量已经超过6000 t,主要用于改善关节状况和治疗骨质疏松。在中国,胶原肽主要用于女性美容产品,其市场成长迅速,年销量超过1000 t。
4.2胶原肽产业未来发展趋势
4.2.1胶原肽的精确制备随着对胶原肽作用机理研究的不断深入,发现不同的胶原肽的作用效果不同。同时,不同来源、不同分子量的胶原肽在吸收后血液中的短肽序列不同。因此,不同来源、不同分子量的胶原肽对人体的作用效果不同。利用生物酶解技术,精确制备规定分子量范围的胶原肽,可准确发挥作用效果,形成不同作用程度的细分产品。
4.2.2胶原肽产品的多样化现今的胶原肽产品多以可冲调的粉剂形式出现,产品形式单一。随着社会快速发展和居民保健意识的增强,人们对胶原蛋白的需求量会增大,对产品的多样性要求也会迅速增加。针对于不同人群,根据不同的作用目的,将胶原肽与具备一定生理功能的物质如VC、膳食纤维、乳酸杆菌等混合,制成品种多样化的含胶原蛋白产品,将是一项长期和富有挑战性的工作。
5 展望
胶原肽是一类具有安全性的生物源制品,并且具有多种有益的性能,将得到更广泛地应用。但是值得注意的是,胶原肽作为国内美容保健品市场上的主要销售产品,其标准尚需规范。同时,胶原肽的吸收和作用机制及其构效关系也需要进一步探讨和阐明,为其更广泛的应用提供理论依据。
[1]蒋挺大,张春平. 胶原蛋白[M].北京:化学工业出版社,2001.
[2]Birk D E,Bruckner P. Collagen suprastructures[M]. Germany:Verlag Berlin Heidelberg,2005:185-205.
[3]汤克勇.胶原物理与化学[M]. 北京:科学出版社,2012.
[4]Nikoo M,Benjakul S,Xu X M. Antioxidant and cryoprotective effects of Amur sturgeon skin gelatin hydrolysate in unwashed fish mince[J]. Food Chemistry,2015,181:295-303.
[5]Fahmi A,Morimura S,Guo H C,et al. Production of angiorensin I converting enzyme inhibitory peptides from sea bream scales[J]. Process Biochemistry,2004,39(10):1195-1200.
[6]Akagündüz Y,Mosquera M,Giménez B,et al. Sea bream bones and scales as a source of gelatin and ACE inhibitory peptides[J]. LWT-Food Science and Technology,2014,5:579-585.
[7]Alemán A,Gómez-Guillén M C,Montero P. Identification of ace-inhibitory peptides from squid skin collagen afterinvitrogastrointestinal digestion[J]. Food Research International,2013,54:790-795.
[8]Alemán A,Giménez B,Pérez-Santin E,et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry,2011,125:334-341.
[9]Zhang Y H,Olsen K,Grossi A,et al. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J].Food Chemistry,2013,141:2343-2354.
[10]Banerjee P,Shanthi C. Isolation of novel bioactive regions from bovine Achilles tendon collagen having angiotensin I-converting enzyme-inhibitory properties[J]. Process Biochemistry,2012,47:2335-2346.
[11]Mendis E,Rajapakes N,Kim S K. Antixoidant properties of a radical-scavenging peptide purified from enzymatically prepare fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry,2005,53:581-587.
[12]Pei X R ,Yang R Y,Zhang Z F,et al. Marine collagen peptide isolated from Chum Salmon(Oncorhynchus keta)skin facilitates learning and memory in aged C57BL/6J mice[J]. Food Chemistry,2010,118:333-340.
[13]Shi Y N,Kovacs-Nolan J,Jiang B,et al. Peptides derived from eggshell membrane improve antioxidant enzyme activity and glutathione synthesis against oxidative damage in Caco-2 cells[J]. Journal of Functional Foods,2014,11:571-580.
[14]Cai L Y,Wu X S,Zhang Y H,et al. Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp(Ctenopharyngodon idella)skin[J]. Journal of Functional Foods,2015,16:234-242.
[15]周建烈. 中国营养学会老年营养分会第七次全国营养学术交流会“营养与成功老龄化”暨国家级继续教育项目“神经系统疾病医学营养治疗”资料汇编[C]. 上海:2010.
[16]Moskowitz R W. Role of collagen hydrolysate in bone and joint disease[J]. Seminars in arthritis and rheumatism,2000,30:87-99.
[17]Nakatani S,Mano H,Sampei C,et al. Chondroprotective effect of the bioactive peptide prolyl-hydroxyproline in mouse articular cartilageinvitroandinvivo,Osteoarthr[J]. Cartil,2009,17:1620-1627.
[18]Kumar S,Sugihara F,Suzuki K,et al. A double-blind,placebo-controlled,randomised,clinical study on the effectiveness of collagen peptide on osteoarthritis[J]. Journal of the science of food and agriculture,2015,95:702-707.
[19]Parmar P A,Chow L W,St-Pierre J P,et al. Collagen-mimetic peptide-modifiable hydrogels for articular cartilage regeneration[J]. Biomaterials,2015,54:213-225.
[20]王静凤,王奕,崔凤霞,等. 鱿鱼皮胶原蛋白多肽对B16黑素瘤细胞黑素合成的影响中国药理学通报[J]. 2007,23(9):1181-1184.
[21]《明胶科学与技术》编辑部信息组.食用明胶的营养价值及明胶食品[J].明胶科学与技术,2006,26(3):135-145.
[22]Okawa T,Yamaguchi Y,Takada S,et al. Oral administration of collagen tripeptide improves dryness and pruritus in the acetone-induced dry skin model[J]. Journal of Dermatological Science,2012,66:136-143.
[23]Fujii T,Okuda T,Yasui N,et al. Effects of amla extract and collagen peptide on UVB-induced photoaging in hairless mice[J]. Journal of functional foods,2013,5:451-459.
[24]Skovgaard GRL,Jensen AS,Sigler ML. Effect of a novel dietary supplement on skin aging in post-menopausal women[J]. European Journal of Clinical Nutrition,2006,60:1201-1206.
[25]Matsumoto H,Ohrar H,Ito K,et al. Clinical effect of fish type I collagen hydrolysate on skin properties[J]. ITE Lett Batter New Technol Med,2006,7(3):386-390.
[26]裘炳毅.化妆品化学与工艺技术大全[M].北京:中国轻工业出版社,1997:197-198.
[27]Adibi S A. The oligopeptide transporter(Pept-1)in human intestine:biology and function[J]. Gastroenterology,1997,113(1):332-340.
[28]Fei Y J,Kanai Y,Nussberger S,et al. Expression cloning of a mammalian proton-coupled oligopeptide transporter[J]. Nature,1994,368:563-566.
[29]Rong L,Fei Y J,Prasad P D,et al. Human intestinal H+/peptide cotransporter Cloning,functional expression,and chromosomal localization[J]. Journal of Biological Chemistry,1995,270(12):6456-6463.
[30]Watanabe-Kamiyama M,Shimizu M,Kamiyama S,et al. Absorption and Effectiveness of Orally Administered Low Molecular Weight Collagen Hydrolysate in Rats[J]. Journal of agricultural and food chemistry,2010,58:835-841.
[31]Ichikawa S,Morifuji M,Ohara H,et al. Hydroxyproline-containing dipeptides and tripeptides quantified at high
concentration in human blood after oral administration of gelatin hydrolysate[J]. International journal of food sciences and nutrition,2010,61:52-60.
[32]Sugihara F,Inoue N,Kuwamori M,et al. Quantification of hydroxyprolyl-glycine(Hyp-Gly)in human blood after ingestion of collagen hydrolysate[J]. Journal of Bioscience and Bioengineering,2012,113(2):202-203.
[33]Shigemura Y,Akaba S,Kawashima E,et al. Identification of a novel food-derived collagen peptide,hydroxyprolyl-glycine,in human peripheral blood by pre-column derivatisation with phenyl isothiocyanate[J]. Food Chemistry,2011,129(3):1019-1024.
[34]Ohara H,Matsumoto H. Comparison of Quantity and Structures of Hydroxyproline-Containing Peptides in Human Blood after Oral Ingestion of Gelatin Hydrolysates from Different Sources[J]. Journal of agricultural and food chemistry,2007,55:1532-1535.
[35]严世荣.穿膜肽携带的目的蛋白穿膜效应的研究[D].武汉:华中科技大学,2006.
[36]张伟欣,李春阳,陈秀兰.细菌肽转运蛋白的研究进展[J].微生物学通报,2014,41(9):1856-1863.
[37]Laskin D L,Kimura T,Sakakibara S,et al. Chemotactic activity of collagen-like polypeptides for human peripheral blood nutrophils[J]. Journal of leukocyte biology,1986,39:255-266.
[38]Shigemura Y,Wai K,Morimatsu F,et al. Effect of Prolyl-hydroxyproline(Pro-Hyp),a Food-Derived Collagen Peptide in Human Blood,on Growth of Fibroblasts from Mouse Skin[J]. Journal of Agricultural and Food Chemistry,2009,57:444-449.
[39]Ohara H,Ichikawa S,Matsumoto H,et al.Collagen-derived dipeptide,proline-hydroxyproline,stimulates cell proliferation and hyaluronic acid synthesis in cultured human dermal fibroblasts[J]. Journal of Dermatology 2010,37:330-338.
[40]Martin P,Leibovich S J. Inflammatory cells during wound repair:the good,the bad and the ugly[J]. Trends in cell Biology,2005,15:599-607.
Progress in collagen peptide and its applications
LIU Hai-ying
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In recent years,the collagen peptide industry in our country develops rapidly. Collagen peptide is derived from collagen and widely used for its unique properties. Collagen peptide is usually sold as health product,and it will have good prospect of application in health-care food and cosmetics industry. In this paper,the basic component,properties,biological activities and applications of collagen and collagen peptide were reviewed. The paper was expected to be beneficial to the studies of collagen peptide.
collagen;collagen peptide;biological activity;absorb
2015-11-09
刘海英(1973-),男,博士,副教授,研究方向:食品科学,E-mail:liuhaiying@jiangnan.edu.cn。
TS201.6
A
1002-0306(2016)12-0391-05
10.13386/j.issn1002-0306.2016.12.066
