高速逆流色谱法分离纯化艾叶中的异绿原酸A
2016-09-10邱细敏任达兵秦燕华
李 熹,邱细敏,*,任达兵,秦燕华
(1.湖南师范大学医学院,湖南长沙 410000; 2.中南大学化学化工学院,湖南长沙 410083)
高速逆流色谱法分离纯化艾叶中的异绿原酸A
李熹1,邱细敏1,*,任达兵2,秦燕华2
(1.湖南师范大学医学院,湖南长沙 410000; 2.中南大学化学化工学院,湖南长沙 410083)
应用制备型高速逆流色谱法(HSCCC)分离纯化艾叶中的异绿原酸A。选用弱极性溶剂体系正己烷-乙酸乙酯-乙醇-水(3∶7∶4∶6,V/V)为两相溶剂系统,上相为固定相,下相为流动相,在流速2 mL/min,转速900 r/min,检测波长280 nm的条件下对粗提物进行制备分离,一次进样25 mg,可得到11 mg样品。利用高效液相色谱(HPLC)检测样品的纯度为99.01%。将得到的样品进行高效液相-离子阱-飞行时间质谱(LCMS-IT-TOF)、核磁共振氢谱(1H-NMR)检测确定其化学结构,并确定该样品为异绿原酸A。实验表明制备型高速逆流色谱可以成功地将艾叶中的异绿原酸A进行分离纯化,该方法分离效率高,对异绿原酸A在食品医疗领域的应用具有重要意义。
艾叶,异绿原酸A,高速逆流色谱法,分离纯化
Separation and purification of isochlorogenic acid A
2.College of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China)
艾叶(Artemisiaargyifolium)为菊科(Compositae)艾属(Artemisia)多年生草本植物[1],又名冰台、遏草、艾青等,是中医临床常用药之一,在全国均有生长。《中国药典》记载其具有散寒止痛、温经止血、祛湿止痒之功效[2]。目前对艾叶化学成分的研究主要集中在挥发油及黄酮类化合物上,而对酚酸类成分的研究报道甚少。有研究发现,艾叶中的酚酸类成分——异绿原酸A具有多种生物活性,包括抗溃疡[3]、抗乙肝[4]、抗贾第虫[5]、抗HIV[6]等,其结构式见图1。目前,对异绿原酸A的分离纯化主要采取硅胶柱层析等方法,但其得率低,分离过程耗时复杂,限制了其进一步药理活性及临床研究。

图1 异绿原酸A的化学结构Fig.1 Chemical structure of isochlorogenic acid A
高速逆流色谱(high-speed counter-current chromatography,HSCCC)是20世纪80年代发展起来的一种新型液-液分配色谱技术。与传统的固液分配色谱技术相比,它具有制备量大、无固定相的非特异性吸收、样品回收率高、分析时间短、重现性好等显著优点[7],经过三十多年的发展,已广泛应用于中药成分分离、天然产物化学、保健食品等领域。
本实验通过高效液相色谱法(high performance liquid chromatography,HPLC)测定待测组分在不同溶剂体系中的分配系数K,筛选出最佳溶剂体系,运用高速逆流色谱法分离纯化艾叶中的异绿原酸A,为全面研究艾叶中的活性成分提供依据,以期建立高效快速制备艾叶中异绿原酸A的方法。
1 材料与方法
1.1材料与仪器
艾叶购于北京同仁堂,湖南师范大学医学院生药教研室鉴定为菊科植物艾(ArtemisiaargyiLévl,etVant)的干燥叶;正己烷、乙酸乙酯、乙醇、冰乙酸(分析纯)上海泰坦科技股份有限公司;乙腈(色谱纯)瑞典欧普森公司;水超纯水;氘代DMSO(0.03% TMS)瑞士ARMAR公司。
SHB-Ⅲ型循环水式多用真空泵河南郑州长城科工贸有限公司;KQ5200DE型数控超声波清洗器江苏昆山市超声仪器有限公司;TBE300B型高速逆流色谱仪(HSCCC,配有HX-1050恒温循环器、TBP-50A泵、TBD-2000紫外检测器、BSZ-100自动部分收集器)上海同田生化技术有限公司;UltiMate3000型高效液相色谱仪(HPLC)赛默飞世尔科技(中国)有限公司;Spherigel C18(250 mm×4.6 mm,5 μm)色谱柱 天津市泰斯特仪器有限公司;BOC005高效液相-离子阱-飞行时间质谱仪(LCMS-IT-TOF)岛津企业管理(中国)有限公司;AVANCE Ⅲ 400MHZ型核磁共振波谱仪瑞士布鲁克公司
1.2实验方法
1.2.1艾叶粗样的提取与纯化将烘干的艾叶用粉粹机粉碎,过60目筛。精确称取50 g粉末,加入10倍体积80%的甲醇溶液,用超声波提取法(超声功率200 W,40 min,40 ℃)提取2次,合并悬干。用适量水溶解悬干样,以1∶1的料液比用正己烷萃取两次脱脂后,同样以1∶1的料液比用乙酸乙酯萃取2次,将乙酸乙酯层合并,在45 ℃下减压浓缩悬干得到艾叶粗样,供高速逆流色谱使用。
1.2.2高效液相色谱(HPLC)条件HPLC色谱仪:Thermo Fisher Ultimate 3000;色谱柱:Spherigel C18(250 mm×4.6 mm,5 μm);柱温:25 ℃;流速:1.0 mL/min,进样质量:2 mg样品溶于1 mL甲醇中;进样体积:20 μL;检测器:二极管阵列检测器(Diode array detector,DAD,200~800 nm);流动相:A(乙腈),B(0.4%冰乙酸):0 min,10% A;13 min,25% A;20 min,35% A;23 min,40% A。检测波长为254、280、325、360 nm,以280 nm为输出波长。
1.2.3分配系数(K)的测定称取4 mg粗提样品,分别溶于不同体积比的正己烷-乙酸乙酯-乙醇-水体系中,取等体积的上下相(2 mL)悬干,用等体积(2 mL)甲醇溶解后按照1.2.2中的HPLC方法进行检测,记录各样品的峰面积,按照公式(1)计算分配系数[8]。
式(1)
式中,K为分配系数;AU为组分在上相的峰面积(mAU·s);AL为组分在下相的峰面积(mAU·s)。
1.2.4高速逆流色谱(HSCCC)分离纯化异绿原酸A根据高速逆流色谱法分离异绿原酸的相关报道[10-11],选择5种溶剂体系测定目标物的分配系数K,结合上机结果选出最优溶剂体系。按照不同的体积比在分液漏斗中配制1000 mL溶剂,充分振摇后静置分层,以上相为固定相(有机相),下相为流动相(水相),超声脱气30 min,用等体积的上下相(5 mL)溶解悬干后的粗样。打开高速逆流色谱系统,当恒温循环器温度达到设定温度(25 ℃)时,以20.0 mL/min的流速泵入固定相,等到色谱柱已充满,接样尾端流出20 mL左右液体时,开启转速调至900 r/min,待稳定后以2.0 mL/min的流速泵入流动相,当接样量筒中出现液体分层,此时显示已达到流体力学平衡,把样品注入系统,在280 nm下对流出组分进行检测并根据高速逆流色谱图设定每管3 min、2 mL/min对流出液进行自动接样。
1.2.5纯度检测及结构鉴定按照1.2.2的高效液相色谱条件,将HSCCC分离收集得到的流分用HPLC进行检测,对相同组分进行浓缩合并,并根据面积归一化法确定化合物的纯度[10]。采用高效液相-离子阱-飞行时间质谱(LCMS-IT-TOF)、核磁共振氢谱(1H-NMR)对分离得到的样品进行结构鉴定,核磁共振氢谱以氘代二甲基亚砜(DMSO)为溶剂,以四甲基硅烷(TMS)为内标物。
2 结果与分析
2.1分配系数K的测定及溶剂系统的选择
研究表明[9],若目标化合物在溶剂体系中的K值在0.5~2之间,则能得到较好的分离。本文选取应用较为广泛的四元体系正己烷-乙酸乙酯-乙醇-水,对不同配比溶剂体系中目标化合物的K值进行考察。由表1可知,溶剂体系1和5的K值较小,目标成分出峰太快,峰之间的分离度较差;而溶剂体系4的K值过大,出峰太迟,且峰形易变宽,溶剂体系2和3的K值符合要求。
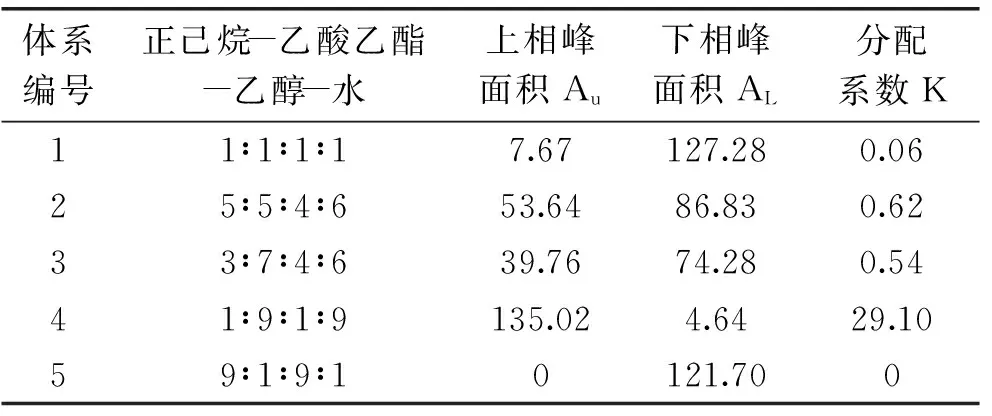
表1 不同溶剂体系的分配系数
根据分配系数的测定结果对体系2和3进行上机实验,通过图2对比可知,在体积比为5∶5∶4∶6时,目标化合物A没有与杂质分开,分离度较差,且基线不平稳;而在体积比为3∶7∶4∶6时,基线平稳,组分A分离较好,所以选择正己烷-乙酸乙酯-乙醇-水(3∶7∶4∶6,V/V)作为分离目标化合物的溶剂体系。

图2 异绿原酸A的高速逆流色谱图Fig.2 HSCCC chromatograms of crude extract of isochlorogenic acid A注:a:两相溶剂体系为正己烷-乙酸乙酯-乙醇-水(3∶7∶4∶6,V/V);b:两相溶剂系统为正己烷-乙酸乙酯-乙醇-水(5∶5∶4∶6,V/V)。
2.2HSCCC分离结果及纯度测定
根据方法1.2.4的分离条件,用正己烷-乙酸乙酯-乙醇-水(3∶7∶4∶6,V/V)对目标化合物进行分离纯化,固定相保留率为57.7%。进样25 mg得到目标组分11 mg,进入HPLC中进行分析,DAD检测器在254、280、325、360 nm下都显示所分得产物为单一化合物。对比艾叶粗提物及HSCCC分离得到化合物的HPLC图,可知大量杂质在HSCCC分离过程中已被除去,得到了高纯度的目标化合物,根据面积归一化法测得纯度为99.01%,目标化合物得到了很好的分离。

图3 艾叶粗提物的HPLC图谱(280 nm)Fig.3 HPLC chromatogram of the crude extract from Artemisia argyi(280 nm)
2.3结构鉴定
将HSCCC分离得到的组分A收集,经冷冻干燥后进行LCMS-IT-TOF、1H-NMR检测,确定其化学结构。组分A(3,5-di-O-caffeoylquinic acid):MS(Neg)m/z:515.1[M-1]-,353.1,335.1,191.1,173.0。1H-NMR(DMSO-d6,400 MHz)δ:7.56(1H,d,J=16.0Hz,H-7′),7.55(1H,d,J=16.0Hz,H-7″),7.06(2H,d,J=7.5Hz,H-2′,H-2″),7.01(2H,d,J=7.0Hz,H-6′,H-6″),6.78(2H,d,J=7.2Hz,H-5′,H-5″),6.37(1H,d,J=15.6Hz,H-8′),6.26(1H,d,J=15.6Hz,H-8″),5.31(1H,brs,H-3),5.13(1H,m,H-5),3.76(1H,m,H-4),2.10(2H,d,J=13.0Hz,H-6),1.85(1H,m,H-2)。质谱与核磁数据与文献[10-11]数据吻合,故鉴定化合物为异绿原酸A。

图4 组分A的HPLC色谱图Fig.4 HPLC chromatogram of peak A
3 结论
采用高速逆流色谱法,通过正己烷-乙酸乙酯-乙醇-水(3∶7∶4∶6,V/V)的溶剂体系从艾叶中分离纯化得到异绿原酸A,该体系固定相保留率较高,一次进样25 mg可得到异绿原酸A 11 mg,产率为44%,经HPLC检测其纯度为99.01%。本实验建立了高速逆流色谱法分离纯化异绿原酸A的方法,与传统的大孔吸附树脂分离方法相比,具有操作简便,重现性高,分离快速,价格低廉等显著优点,可用于异绿原酸A的大量制备。
[1]陈小露,梅全喜. 艾叶化学成分研究进展[J]. 药学进展,2013,23(12):848-851.
[2]国家药典委员会. 中华人民共和国药典[M]. 2010年版一部.北京:化学工业出版,2010:82-83.
[3]Juliane Carlotto,Luisa M da Silva,Nessana Dartora,et al. Identification of a dicaffeoylquinic acid isomer from Arctium lappa with a potent anti-ulcer activity[J].Talanta,2015(135):50-57.
[4]Bing-Jie Hao,Yi-Hang Wu,Jian-Guo Wang,et al. Hepatoprotective and antiviral properties of isochlorogenic acid A from Laggera alata against hepatitis B virus infection[J].Journal of Ethnopharmacology,2012(144):190-194.
[5]Yan-Hong Zhang,Mei-Qin Xue,Yuan-Chao Bai,et al.3,5-Dicaffeoylquinic acid isolated from Artemisia argyi and its ester derivatives exert anti-Leucyl-tRNA synthetase of Giardia lamblia(GlLeuRS)and potential anti-giardial effects[J]. Fitoterapia,2012(83):1281-1285.
[6]Heino Martin Heyman,François Senejoux,Isabell Seibert,et al.Identification of anti-HIV active dicaffeoylquinic-and tric-affeoylquinic acids in Helichrysum populifolium by NMR-based metabolomic guided fractionation[J].Fitoterapia,2015(103):1155-1164.
[7]欧霞,李劲平,佘志坚,等. 高速逆流色谱法在天然药物研究中的应用概况[J].中南药学,2014,12(3):246-250.
[8]朱力杰,孟宪军,李斌,等. 高速逆流色谱分离制备北五味子中科罗索酸[J].食品科学,2014,35(2):1-4.
[9]A Berthod,N Mekaoui,Distribution Ratio.Distribution Constant and Partition Coefficient Countercurrent Chromatography Retention of Benzoic Acid[J].Journal of Chromatography A,2011(1218):6024-6030.
[10]石伯阳,李佳银,周桥,等. 紫甘薯中绿原酸及异绿原酸的高速逆流色谱分离[J].食品科学,2013,34(13):87-90.
[11]Wei Guo,Liang Wang,Yan Gao,et al.Isolation of isochlorogenic acid isomers in flower buds of Lonicera japonica by high-speed counter-current chromatography and preparative high performance liquid chromatography[J].Journal of Chromatography B,2015(981):27-32.
fromArtemisiaeargyifoliumby high-speed counter-current chromatography
LI Xi1,QIU Xi-min1,*,REN Da-bing2,QIN Yan-hua2
(1.College of Medicine,Hunan Normal University,Changsha 410000,China;
Isochlorogenic acid A was separated and purified fromArtemisiaeargyifoliumby preparative high-speed counter-current chromatography(HSCCC)using a weak polarity solvent system consisting of n-hexane-ethyl acetate-ethanol-water(3∶7∶4∶6,v/v/v/v),the upper phase acted as stationary phase and the lower phase served as mobile phase. The separation process was performed at a flow rate of 2 mL/min,the rotation rate of the apparatus was set at 900 r/min,and the effluents were detected at 280 nm,a total of 11 mg of target compound was obtained in one step separation from 25 mg of crude extract. The results from HPLC analysis showed that the compound with 99.01% purity and the chemical structure was characterized as Isochlorogenic A by high performance liquid chromatography-mass spectrum(LCMS-IT-TOF)and Nuclear Magnetic Resonance Spectroscopy(1H-NMR). It showed that preparative high-speed counter-current chromatography could separate and purify Isochlorogenic acid A successfully fromArtemisiaeargyifolium. The method was of high separation efficiency,and great importance for isochlorogenic acid A applications in the food and medical fields.
Artemisiaeargyifolium;isochlorogenic acid A;high-speed counter-current chromatography(HSCCC);preparative isolation
2015-11-09
李熹(1990-),女,硕士研究生,研究方向:分析化学,E-mail:sixi4527058@163.com。
邱细敏(1954-),女,教授,研究方向:分析化学,E-mail:qiuximin@tom.com。
湖南省科技厅科研专项项目(2014sk4040);长沙市科技管理局项目(K1401010-31)。
TS201.2
B
1002-0306(2016)10-0295-04
10.13386/j.issn1002-0306.2016.10.051
