香肠乳杆菌(Lactobacillusfarcimini)FM-MM4产细菌素发酵条件和培养基优化
2016-09-10胡彦新刘小莉董明盛周剑忠
胡彦新,刘小莉,王 英,董明盛,周剑忠,*
(1.南京农业大学食品科技学院,江苏南京 210095,2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
香肠乳杆菌(Lactobacillusfarcimini)FM-MM4产细菌素发酵条件和培养基优化
胡彦新1,2,刘小莉2,王英2,董明盛1,周剑忠1,2,*
(1.南京农业大学食品科技学院,江苏南京 210095,2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
为提高香肠乳杆菌FM-MM4(lactobacillusfarciminisFM-MM4)乳酸菌素的产量,以金黄色葡萄球菌为指示菌,抑菌圈直径为考察目标,对香肠乳杆菌FM-MM4所产细菌素的发酵条件和培养基成份进行优化。利用单因素实验和正交实验优化发酵温度、发酵时间和起始pH;在Plackett-Burman实验基础上,利用响应面法优化酵母粉、葡萄糖和乙酸钠。获得最佳的发酵条件:发酵温度30 ℃、发酵时间24 h、发酵起始pH7,最佳培养基配方:葡萄糖24.40 g/L、酵母粉4.34 g/L、乙酸钠5.05 g/L,其他成分保持不变。在此条件下,细菌素抑菌圈直径达18.64 mm,较优化前提高了40.13%。
细菌素,香肠乳杆菌,响应面,发酵条件,培养基优化
发酵酸肉是侗族传统发酵肉制品的代表,它是经过乳酸菌、酵母菌、葡萄球菌等多种微生物自然发酵而成,风味独特,营养丰富,保质期可达数年之久。研究表明,发酵酸肉具有较长保质期的原因主要是酸肉中的乳酸菌发酵产酸形成较低的pH,另外,乳酸菌代谢过程中能够产生抑制其它细菌生长的抑菌物质细菌素[1],也有利于延长保质期。前期从侗族酸肉中分离出一株对金黄色葡萄球菌、大肠杆菌、志贺氏菌等均有抑菌作用的香肠乳杆菌FM-MM4,该菌具有良好的热、酸稳定性,为鲜鱼保鲜和食品生物防腐剂方面提供良好的应用前景。
众多因素影响乳酸菌产细菌素的能力和产量,除了乳酸菌自身的遗传特性的影响外,还受发酵条件的影响,如发酵温度、初始pH、发酵时间[2-3]、培养基成分[4]等。本研究对香肠乳杆菌FM-MM4产细菌素的发酵条件和培养基成份进行优化,通过单因素实验和正交实验优化发酵条件[5],通过Plackett-Burman实验和响应面法优化发酵培养基[6-8],得到该菌产细菌素的最优发酵参数,为该细菌素和同类抑菌物质的工业化生产提供技术参考。
1 材料与方法
1.1材料与仪器
香肠乳杆菌FM-MM4(lactobacillusfarciminisFM-MM4)分离于侗族酸肉;指示菌金黄色葡萄球菌(StapHylococcusaureus)江苏省农业科学院农产品加工所食品生物工程研究室保藏;NaOH、HCl国产分析纯;MRS 培养基、LB 培养基北京奥博星生物技术责任有限公司。
DSX-280B立式压力蒸汽灭菌器上海申安医疗器材厂;SW-CJ-2G超净工作台苏州净化设备有限公司;LRH-150生化培养箱苏州净化设备有限公司;3K15高速冷冻离心机美国Sigma公司。
1.2香肠乳杆菌FM-MM4的发酵流程
1.3发酵条件的确定
1.3.1单因素实验发酵温度、发酵时间、培养基初始pH、接种量[2-5]等影响乳酸菌产细菌素的能力和产量主要因素进行单因素实验,以选取正交实验的因素和水平。
采用1.2方法下的流程培养香肠乳杆菌FM-MM4,固定反应条件为接种量2%、发酵时间28 h、培养基初始pH7,考察不同发酵温度(20、25、30、37、42 ℃)对细菌素产量的影响;固定反应条件为接种量2%、发酵温度30 ℃、培养基初始pH7,考察不同发酵时间(4、6、8、10、12、14、16、18、20、22、24、26、28、32、36 h)对细菌素产量的影响;固定反应条件为接种量2%、发酵温度30 ℃、发酵时间24 h,考察不同培养基初始pH(4.0、5.0、5.5、6.0、6.5、7.0、8.0)对细菌素产量的影响;固定反应条件为发酵温度30 ℃、发酵时间24 h、培养基初始pH7,考察不同接种量(1%、2%、4%、6%、8%)对细菌素产量的影响;
1.3.2正交实验设计根据单因素实验结果,选取发酵温度、发酵起始pH、发酵时间3个因素,并选取适当的3水平,设计L9(33)正交实验(表1),优化香肠乳杆菌FM-MM4产细菌素的发酵条件。

表1 正交实验因素水平表
1.4发酵培养基的确定
1.4.1Plackett-Burman实验参照Chadha[9]的实验方法,应用Plackett-Burman设计实验确定发酵培养基的主要影响因子,实验变量数为19,其中包括10个培养基成分和9个虚拟因素,10个因素编码水平见表2,应用Design Expert进行数据分析,响应值为细菌素的抑菌圈直径Y。

表2 Plackett-Burman实验因素水平及编码
1.4.2响应面法优化培养基成分根据Plackett-Burman实验结果,由于培养基初始pH在1.3.2部分已优化,故选取选葡萄糖(X1)、酵母粉(X2)、乙酸钠(X3)3个因素为自变量,以细菌素的抑菌圈直径为响应值,进行Box-Benhnken实验,实验因素水平及编码见表3。
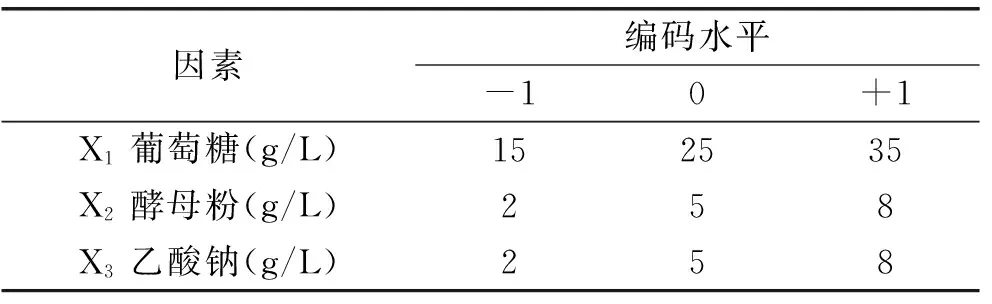
表3 实验因素水平及编码
1.5抑菌活性的测定
发酵液10000 r/min离心10 min取上清液,用0.22 μm滤膜过滤去除菌体,用1 mol/L NaOH调上清液的pH为6.0,采用琼脂扩散牛津杯法[9-10]测定排酸后上清液抑菌活性,以抑菌圈直径为考察目标,每个样品设三个重复,取均值。
1.6数据处理
采用SAS 8.0软件进行单因素方差分析和差异显著性分析,采用Design-Expert 8.0.6软件进行响应面分析。
2 结果与分析
2.1发酵条件的确定
2.1.1单因素实验
2.1.1.1发酵温度的影响温度对微生物代谢产物合成主要体现在两个方面:温度较低时,微生物生长缓慢,发酵周期延长。温度过高时,会影响菌体代谢过程中某些酶的活性,降低细菌素的产生。由图1可知,发酵温度对细菌素的产量影响显著(p<0.05),香肠乳杆菌FM-MM4在发酵温度为30 ℃时,抑菌活性最高(15.85 mm)。

图1 不同发酵温度对香肠乳杆菌FM-MM4产细菌素的影响Fig.1 Effect of culture temperature on bacteriocin produced by Lactobacillus farciminis FM-MM4注:图中a、b、c等字母不同,表示差异显著 (p<0.05);图2~图4同。
2.1.1.2发酵时间的影响由图2可知,发酵时间对细菌素的产量影响显著(p<0.05),香肠乳杆菌FM-MM4在8 h左右开始产生细菌素,随着发酵时间的延长,细菌素的产量持续增加,在24 h产量达到最大值,此后,细菌素的产量不断下降。细菌素在生长后期抑菌活性降低可能由两个方面造成,其一,菌体生长进入衰亡期,菌体大量死亡和自溶,细菌素部分被分解。其二,部分细菌素吸附在菌体细胞表面[12],导致发酵上清液抑菌活性降低。

图2 不同发酵时间对香肠乳杆菌FM-MM4产细菌素的影响Fig.2 Effect of culture time on bacteriocin produced by Lactobacillus farciminis FM-MM4
2.1.1.3发酵液初始pH的影响由图3可知,初始pH对该菌株产细菌素的影响显著(p<0.05),香肠乳杆菌FM-MM4在pH7左右时细菌素抑菌活性最大,过酸和过碱都会导致细菌素抑菌活性的降低,其原因可能是过酸、过碱可能会导致某些酶失活,也会影响菌体细胞对细菌素的吸附能力。
2.1.1.4接种量的影响由图4可知,接种量为4%时,细菌素的抑菌活性较高,但方差分析结果显示不同接种量对该细菌素的合成影响不显著(p>0.05)。接种量的大小主要影响微生物的生长周期,接种量大时,会缩短微生物发酵培养周期,但细菌素的合成受菌体细胞群体感应调节[13]。采用不同的接种量培养24 h后,各处理的菌体数量基本一致,所合成的细菌素的量也基本一致。
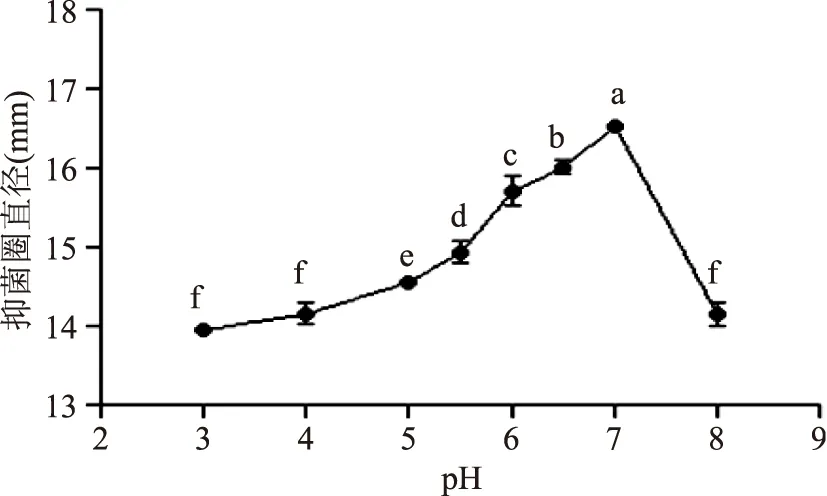
图3 不同初始pH对香肠乳杆菌FM-MM4产细菌素的影响Fig.4 Effect of initial pH on bacteriocin produced by Lactobacillus farciminis FM-MM4
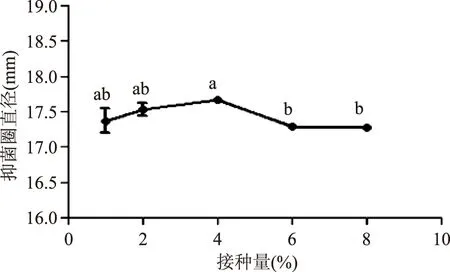
图4 不同接种量对香肠乳杆菌FM-MM4产细菌素的影响Fig.4 Effect of inoculum amount on bacteriocin produced by Lactobacillus farciminis FM-MM4
2.1.2正交实验由表4可以看出,产细菌素的最佳发酵条件为A2B2C2。极差分析显示,pH对细菌素抑菌活性影响最大。验证实验表明,最优条件下的抑菌圈直径达17.50 mm。相关研究表明,细菌素在低于菌体最适生长温度条件下产量较高[14-16],这与细菌素的合成机制有关,并且不同菌株产细菌素最适温度不一样[17-18]。
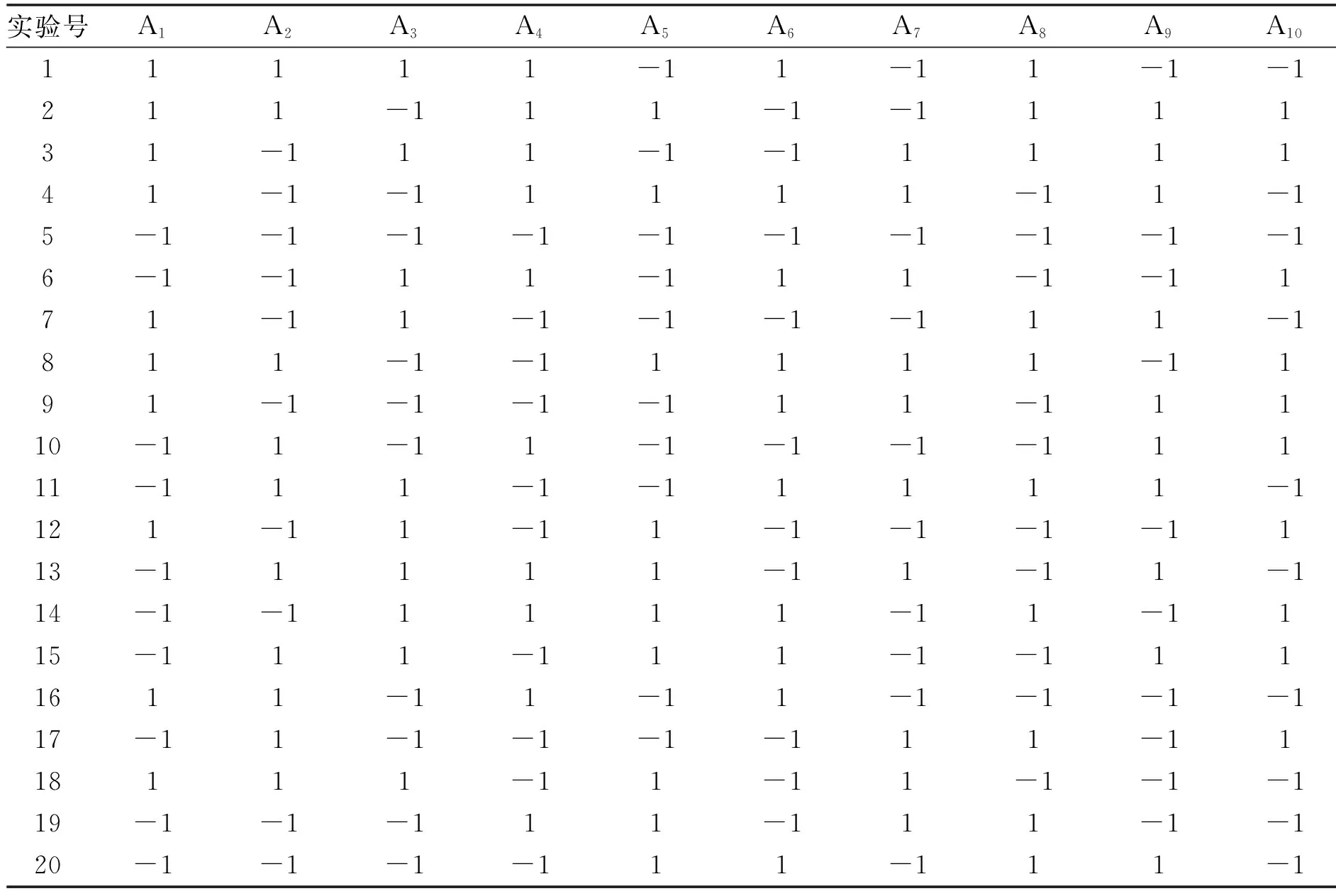
表5 Plackett-Burman实验结果
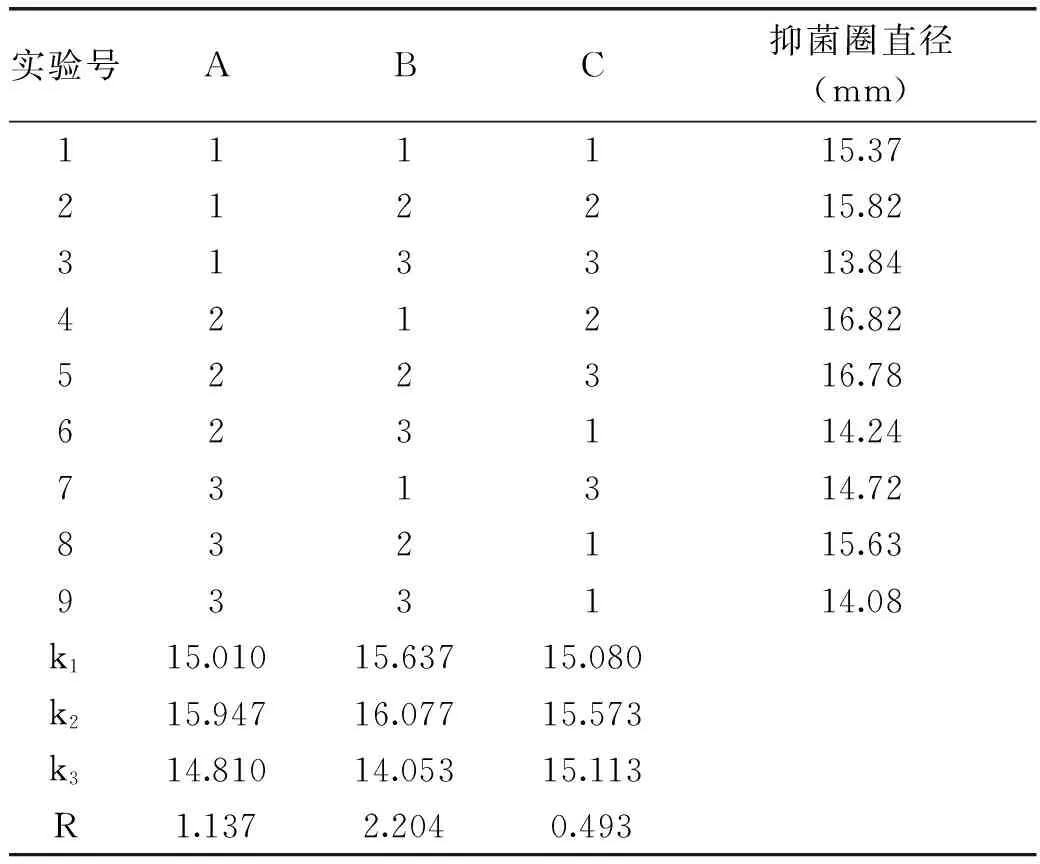
表4 正交实验分组及结果
2.2发酵培养基的确定
2.2.1Plackett-Burman实验结果分析采用Design-Expert 8.0.6软件对Plackett-Burman(虚拟项未列出)进行回归分析,结果见表5。得到各影响因子的偏回归系数及其显著性,结果见表6。根据各因素对响应值显著性检验结果的p值来判断各因子对实验影响的程度,由表6可知,A3(酵母粉)、A4(葡萄糖)、A5(乙酸钠)为主要影响因子,其中葡萄糖差异极显著,从表中回归系数值可以看出酵母粉对响应值的影响为负效应,葡萄糖和乙酸钠为正效应,对于不显著的因素在之后的实验中浓度保持初始水平。
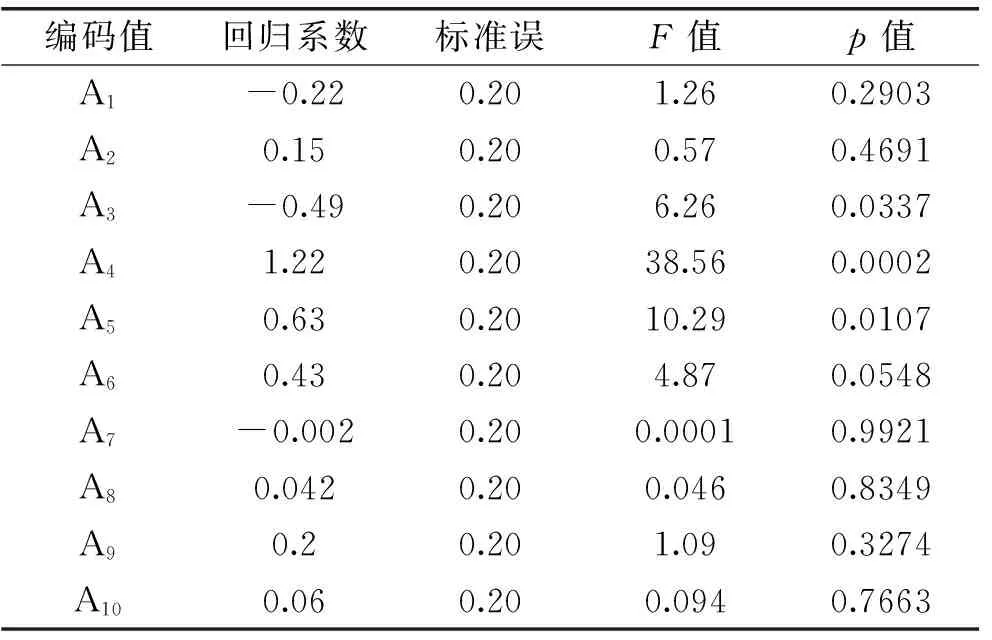
表6 回归系数及影响因子的显著性分析
2.2.2响应面模型的建立及其方差分析采用Box-Behnken实验设计及结果见表7,利用Design Expert 8.0.6对其进行多元回归拟合,获得响应值抑菌圈直径(Y)对自变量X1、X2、X3的二次多项回归方程Y=18.56-0.17X1-0.71X2+0.12X3+0.075X1X2+0.44X1X3+0.25X2X3-1.48X12-1.62X22-1.29X32。
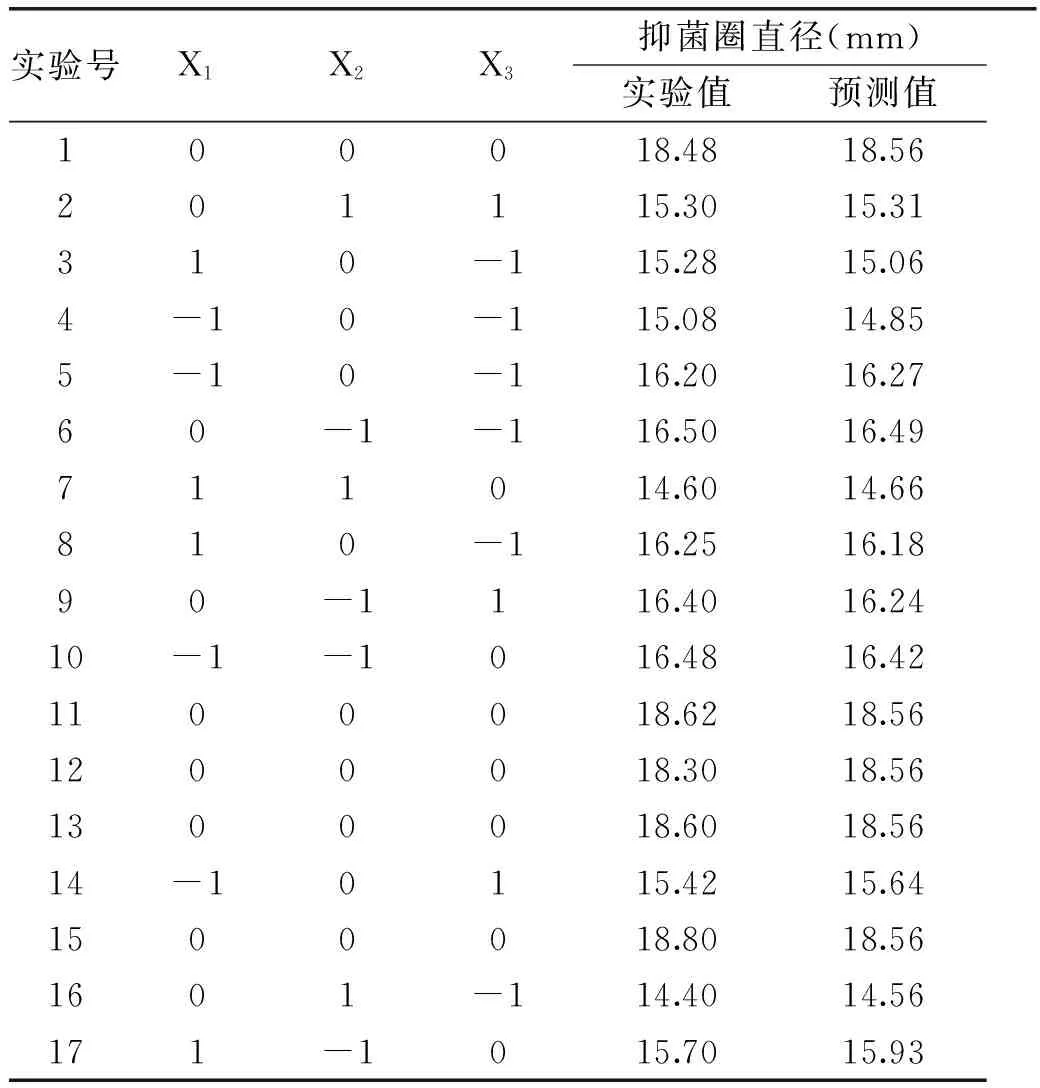
表7 响应面设计及结果
对上述回归模型进行方差分析,结果见表8,结果表明,模型是极显著的(p<0.0001),失拟项不显著(p=0.1792),回归模型的决定系数为0.9885,说明该模型能解释99.85%的变化,该模型拟合程度良好,实验误差小,用该模型对香肠乳杆菌FM-MM4发酵条件进行优化是合适的。
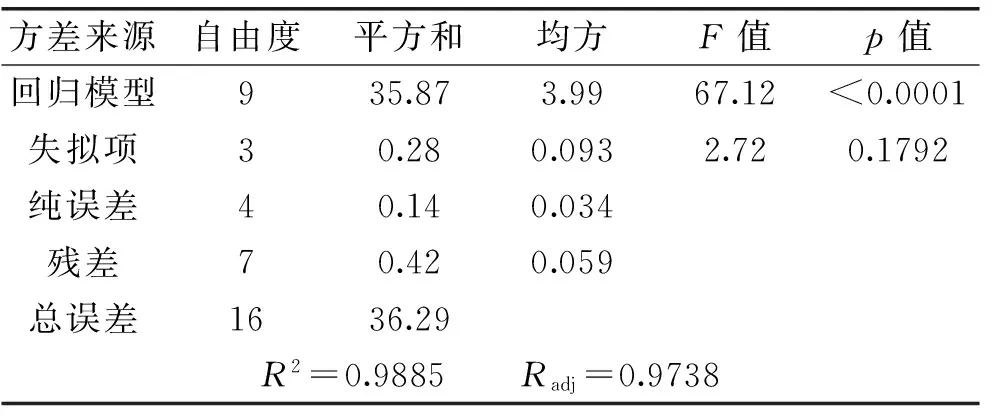
表8 回归模型方差分析表
模型回归系数显著性分析见表9,由回归方程系数显著性检验可知;模型一次项X2极显著,X1、X3不显著,二次项X12、X22、X32均极显著,交叉项X1X3显著,X1X2、X2X3不显著,二次项系数显著性明显高于一次项系数和交叉项系数,说明该模型呈现出抛物面的可能在最高,由二次项系数的p值可知,X1、X2、X3在极值可能性都高达99.99%。
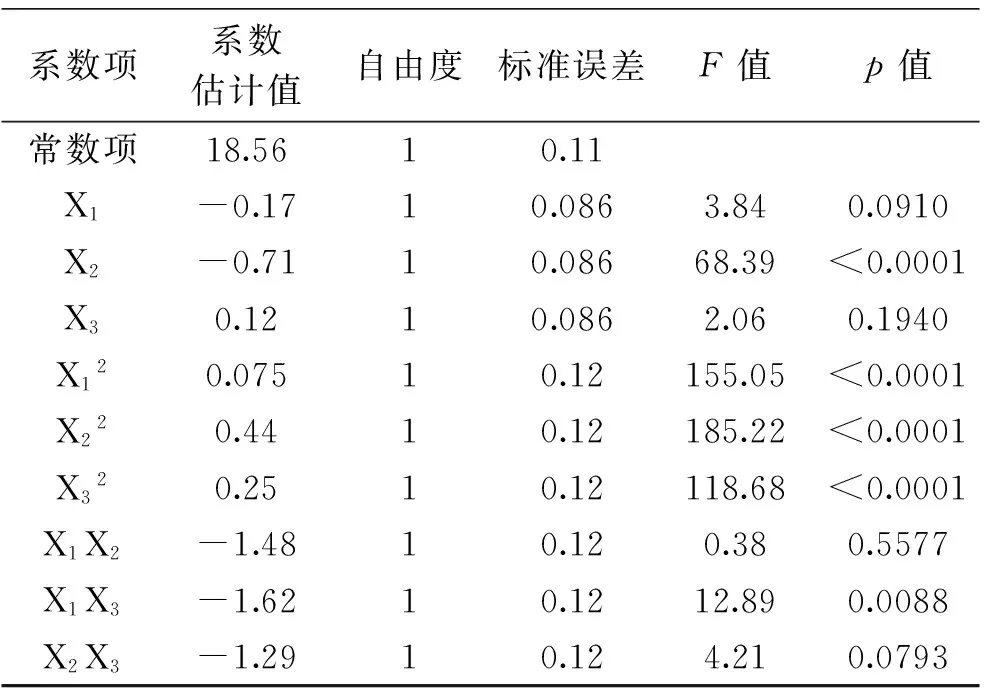
表9 回归方程系数显著性检验表
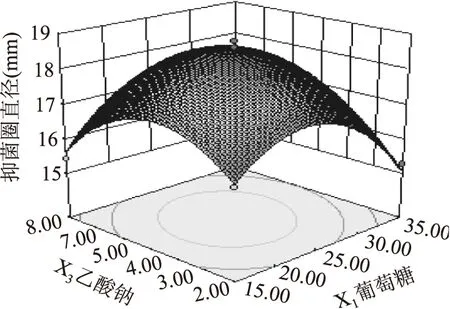
图5 葡萄糖和乙酸钠对抑菌圈直径影响的响应面图Fig.5 Response surface for the effect of cross-interaction between glucose and sodium acetate on diameter of antibacterial circle
2.2.3响应面分析通过二次多项回归方程所得到的响应面见图5(X1X2和X2X3不显著,未列出),由图5可知,X1X3两个因素的交叉项显著,葡萄糖约在(15,25),乙酸钠约在(2,4),二者存在显著增效作用,呈现正相关;而葡萄糖约在(25,35),乙酸钠约在(4,8),该菌的抑菌活性随二者的增长而降低,最大抑菌圈直径约为18.60 mm。
2.2.4发酵条件的优化及模型验证当葡萄糖、酵母粉、乙酸钠的取值范围分别设定在15~35、2~8、2~8 g/L,并将目标值即抑菌圈直径设定为最大值,软件给出5组最优组合,并提供了预测值(表10),从表可以看出,最优组合为葡萄糖24.40 g/L、酵母粉4.34 g/L、乙酸钠5.05 g/L,按照优化后的参数进行发酵,发酵液抑菌圈直径为18.64 mm,与预测值相接近,说明优化后的预测模型可靠,较优化前提高了40.13%。

表10 各成分最佳组合及预测结果
3 结论
3.1通过单因素实验和正交实验确定香肠乳杆菌FM-MM4产细菌素的最佳发酵条件:发酵温度30 ℃、发酵时间24 h、接种量4%、起始pH7。
3.2利用Plackett-Burman实验筛选出培养基中对细菌素抑菌活性具有显著影响的主要是葡萄糖、酵母粉和乙酸钠。
3.3在Plackett-Burman实验的基础上,利用响应面法对培养基成分进行优化,建立抑菌圈直径与葡萄糖、酵母粉和乙酸钠3个因素的二次多项式回归模型,并验证这个模型是合理可靠的。确定香肠乳杆菌FM-MM4产细菌素的最佳培养基配方:葡萄糖24.40 g/L、酵母粉4.34 g/L、乙酸钠5.05 g/L,其他成分保持不变。在此条件下,细菌素抑菌圈直径达18.64 mm,较优化前提高了40.13%。
[1]Reviriego C,Fernández L,Rodríguez JM. A food-grade system for production of pediocin pa-1 in nisin-producing and non-nisin-producinglactococcuslactisstrains:application to inhibit listeria growth in a cheese model system[J]. Journal of Food Protection®,2007,70(11):2512-2517(6).
[2]Thangamani,Anthony,Thangamani,et al. Influence of medium components and fermentation conditions on the production of bacteriocin(s)byBacilluslicheniformisAnBa9[J]. Bioresour Technol,2009,100(2):872-877.
[3]胡敏,郝林,贾丽艳. 枯草芽孢杆菌产细菌素发酵条件的优化[J]. 食品科学,2014,35(9):198-202.
[4]魏晋梅,周玉春,张丽,等. 干酪乳杆菌产细菌素培养基的优化[J]. 食品工业科技,2015(7):177-181.
[5]陈琳,盂祥晨. 响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J]. 食品科学,2011,32(3):176-180.
[6]梁红敏. 发酵香肠中高产细菌素乳酸菌的筛选鉴定及发酵条件研究[D]. 济南:齐鲁工业大学,2013.
[7]安俊莹,刘颖,朱雯娟,等. 响应面法优化BacillusamyloliquefaciensZJHD-06产类细菌素发酵培养基[J].食品工业科技,2014,35(1):191-195.
[8]党静. 杨凌浆水中棒状乳杆菌XN8细菌素的分离纯化及其特性研究[D]. 杨凌:西北农林科技大学,2014.
[9]Xuan Z,Zhao Y,Sun Y,et al. Purification and characterisation of plantaricin ZJ008,a novel bacteriocin against StapHylococcus spp. fromLactobacillusplantarumZJ008[J]. Food Chemistry,2014,165(3):216-223.
[10]郭晨,闵钟熳,李振华,等. 产Ⅱa类细菌素乳酸菌的筛选、鉴定与生物学特性的研究[J]. 中国酿造,2010,29(3):56-59.
[11]Chadha B S,Harmeet G,Mandeep M,et al. PHytase production by the thermopHilic fungus Rhizomucor pusillus[J]. World Journal of Microbiology & Biotechnology,2004,20(1):105-109.
[12]李亚玲,周志江,韩烨,等. 乳酸片球菌细菌素的分离纯化及理化性质[J]. 食品工业科技,2007(8):94-97.
[13]满丽莉,孟祥晨,王辉,等. 群体感应系统在乳酸菌产细菌素中的作用[J]. 食品科学,2011(13):360-364.
[14]Verellen T L J,Bruggeman G,Reenen C A V,et al. Fermentation optimization of plantaricin 423,a bacteriocin produced byLactobacillusplantarum423[J]. Journal of Fermentation & Bioengineering,1998,86(98):174-179.
[15]Hwanhlem N,Chobert J M,H-Kittikun A. Bacteriocin-producing lactic acid bacteria isolated from mangrove forests in southern Thailand as potential bio-control agents in food:Isolation,screening and optimization[J]. Food Control,2014,41(2):202-211.
[16]Leroy F,Vankrunkelsven S,Greef J D,et al. The stimulating effect of a harsh environment on the bacteriocin activity by Enterococcus faecium RZS C5 and dependency on the environmental stress factor used.[J]. International Journal of Food Microbiology,2003,83(1):27-38.
[17]Zamfir M,Callewaert R,Cornea P C,et al. Purification and characterization of a bacteriocin produced by Lactobacillus acidopHilus IBB 801[J]. Journal of Applied Microbiology,1999,87(6):923-931.
[18]吴燕利,祁克宗,涂健,等. 乳杆菌源抗菌肽的代谢条件优化及其特性研究[J]. 食品工业科技,2014(21):140-145.
Optimization on fermentation conditions and medium for bacteriocin produced byLactobacillusfarcimini
HU Yan-xin1,2,LIU Xiao-li2,WANG Ying2,DONG Ming-sheng1,ZHOU Jian-zhong1,2,*
(1.College of Food Science and Technology,Nanjing Agriculture University,Nanjing 210095,China; 2.The Research Institute of Agricultural Product Processing,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China)
In order to improve the production of bacteriocin ofLactobacillusfarciminisFM-MM4,the fermentation conditions and components of medium were optimized.Staphylococcusaureuswas used as indicator bacteria and diameter of inhibition zone was used as evaluation index of antibacterial activity. The single factor test and orthogonal test were used to optimize the culture temperature,culture time and initial pH. Based on the Plackett-Burman experiment,the optimal condition for producing antibacteria components was obtained by response surface methodology with three variables of yeast powder,glucose and sodium acetate. The optimized fermentation conditions and medium component were fermentation temperature 30 ℃,initial pH7,fermentation time 24 h,glucose 24.40 g/L,yeast powder 4.34 g/L,sodium acetate 5.05 g/L. Under these optimal conditions,the diameter of inhibition zone reached up to 18.64 mm,raised by 40.13% compared that produced under the original fermentation conditions.
bacteriocin;Lactobacillusfarcimini;response surface methodology;fermentation condition;medium optimization
2015-11-24
胡彦新(1990-),男,在读硕士,研究方向:食品微生物,E-mail:2014108085@njau.edu.cn。
周剑忠(1965-),男,博士,研究员,研究方向:食品生物技术,E-mail:zjzluck@126.com。
江苏省农业科技自主创新项目(CX(14)2118)。
TS201.1
A
1002-0306(2016)10-0255-06
10.13386/j.issn1002-0306.2016.10.043
