α-淀粉酶基因在肠膜明串珠菌基因表达中的应用
2016-09-10田云飞刘晓莉成文玉金红星
田云飞,刘晓莉,成文玉,金红星
(河北工业大学化工学院,天津 300130)
α-淀粉酶基因在肠膜明串珠菌基因表达中的应用
田云飞,刘晓莉,成文玉,金红星*
(河北工业大学化工学院,天津 300130)
目的:为了验证α-amy(α-淀粉酶基因)在肠膜明串珠菌中应用的可行性,构建重组质粒并建立了肠膜明串珠菌的三亲杂交体系。方法:以大肠杆菌-明串珠菌的穿梭载体pCW4为基础,构建了携带α-amy标记的重组质粒pCW7。肠膜明串珠菌ATCC8293(Leuconostocmesenteroides)的g6ph(6-磷酸葡萄糖脱氢酶基因)表达盒插入到pCW7,并通过三亲杂交转化肠膜明串珠菌而获得重组菌株。结果:重组菌株的甘露醇产量比原始菌株提高了7%。三亲杂交中可以通过α-amy标记筛选重组子。结论:证实了α-amy标记在肠膜明串珠菌中应用的可行性。
肠膜明串珠菌,α-淀粉酶基因,三亲杂交,6-磷酸葡萄糖脱氢酶
在基因工程中通常以抗生素抗性基因作为正筛选标记,进行转化子的筛选与鉴定,是因为抗生素的抗性基因表达盒一般都比较小,只有1.0 kb左右,便于利用。乳酸细菌的转基因中普遍应用的抗生素是红霉素[1-5],但它有一些不足之处,比如,以大肠杆菌为受体菌在平板上进行筛选时,较低浓度容易产生诱导抗性而长出一大片菌落,而使用较高浓度时转化子生长缓慢且菌落数量锐减。因此,本研究欲利用α-淀粉酶基因(α-amy)标记解决这一难题。另外,α-amy是可应用于食品和药物生产的安全标记。
明串珠菌是泡菜、腌菜等发酵蔬菜中的优势菌株[6],是能产生乳酸、甘露醇、双乙酰、细菌素的革兰氏阳性乳酸细菌,还应用于乳制品的加工过程中,因此近年来在内地对其研究比较活跃[7]。明串珠菌通常采用电穿孔法进行转化,但是它对仪器要求严格,不但成本高且维修周期长,给实验研究带来诸多不便。三亲接合转移(三亲杂交)是在细菌中广泛应用的转化手段[8],不需要特殊的仪器设备,拓宽了革兰氏阳性细菌的基因转化途径,然而在肠膜明串珠菌中尚未建立相应的方法,因此本研究构建肠膜明串珠菌的三亲杂交体系。
6-磷酸葡萄糖脱氢酶(g6ph)催化PPK途径中的6-磷酸葡萄糖转化为6-磷酸葡萄糖酸,并产生NADH。蔗糖通过透性酶进入肠膜明串珠菌的胞内,经蔗糖磷酸化酶裂解为1-磷酸葡萄糖和果糖,果糖最终加氢还原为甘露醇,这一氢来源于NADH。因此,本研究通过g6ph的过表达,验证了α-amy标记和三亲杂交体系的可行性。
1 材料与方法
1.1材料与仪器
肠膜明串珠菌CGMCC1.10327、携带pRK2013(kanr)的大肠杆菌(辅助菌)和pSET152(Eryr)本实验室保藏,肠膜明串珠菌ATCC8293、食淀粉乳杆菌CGMCC1.3395中国普通微生物菌种保藏管理中心;pTA2载体TOYOBO;Taq酶、内切酶、连接酶大连宝生物公司;质粒小量提取试剂盒Axygen公司。
KF960 PCR仪Heal Force;UV-1100紫外-可见分光光度计Mapada。
1.2实验方法
1.2.1培养基与培养条件大肠杆菌用LB液体培养基于37 ℃、180 r/min振荡培养,肠膜明串珠菌、食淀粉乳杆菌用MRS液体培养基于30 ℃、120 r/min振荡培养。发酵产甘露醇的液体培养基:蔗糖20 g、蛋白胨5 g、酵母浸粉2.5 g、硫酸锰0.02 g、磷酸氢二钾1 g、柠檬酸铵1 g、乙酸钠2.5 g,溶于1 L双蒸水中。在大肠杆菌的培养中红霉素(Ery)用量为300 μg/mL,在肠膜明串珠菌的培养中氨苄青霉素(Amp)用量为5 μg/mL。
1.2.2引物合成与载体构建本研究中使用的引物列于表1。根据GenBank的相关核苷酸序列,用Oligo6.0设计引物并由华大基因公司合成。

表1 本研究中使用的引物
以大肠杆菌-明串珠菌的穿梭质粒pCW4[9]为基础,插入Ampr后切除Eryr并插入了oriT,最后再插入α-amy而成为pCW7。构建过程见图1。
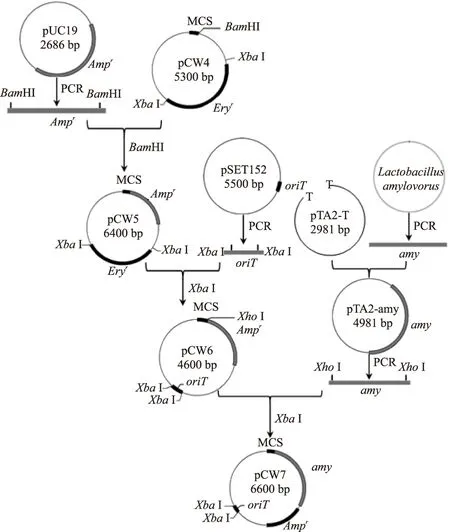
图1 pCW7质粒的构建流程Fig.1 The process for construction of the pCW7 plasmid
1.2.3三亲本杂交过夜培养的供体菌(大肠杆菌,含携带oriT基因的pCW7-g6ph)、辅助菌分别以1%的接菌量转接到新鲜的LB液体培养基中,受体菌(肠膜明串珠菌CGMCC1.10327)按1%的接菌量转接到新鲜的MRS液体培养基中。分别培养到OD600为0.6时,将三者按体积比例(mL)0.4∶0.4∶0.6混匀,菌体用MRS培养基洗涤2次,溶于100 μL MRS培养基中。均匀涂布于含0.005%(W/V)锥虫蓝、1%可溶性淀粉和0.1 mol/L CaCl2的MRS转化平板中,30 ℃培养5 h后,用含5 mg/mL Amp和50 mg/mL萘啶酮酸的水溶液1 mL均匀覆盖平板培养基表面[10],培养72 h,得到的蓝色菌落即为重组菌株。
为了优化受体菌的三亲杂交条件,分别就受体菌的OD值、三种菌的混合比例、Amp的浓度和抗生素覆盖时期等单因素条件进行三亲杂交实验,并统计转化后平板上长出的蓝色菌落个数,即为接合转移子数目。进行对照实验,将三种菌混合液100 μL以一定倍数稀释后取100 μL,涂布于转化平板上,覆盖平板培养基表面时用只含萘啶酮酸而不含Amp的水溶液,获得的菌落个数乘以其稀释倍数作为受体菌落形成单位。
每个单因素实验做3组平行实验,统计每个平板上的菌落数,算出其数值平均值作为最终数据。按照公式(接合转移频率=接合转移子数目/受体菌落形成单位(cfu)[11])算出结合转移频率,采用Origin8.0数据处理软件作图,根据图线的趋势选出最佳条件。
1.2.4发酵产甘露醇原始菌和重组菌用发酵培养基进行摇瓶发酵20 h,根据张晓卿的方法[12]测定甘露醇含量。
2 结果与讨论
2.1重组载体构建
本研究以pCW4为基础构建了pCW7。其中所有的目标插入片段都采用PCR扩增,其琼脂糖凝胶电泳结果见图2。在图2中,与DNA marker条带相比较而得知,PCR产物的大小合适,通过测序获得的序列与GeneBank的相关序列比对也证实了它们的正确性。通过琼脂糖凝胶电泳,筛选了重组子,根据质粒DNA在琼脂糖凝胶电泳中的迁移率的不同,选出疑似重组子,然后通过酶切验证,结果见图3。由图可知,疑似重组子经过特定酶切可以切为两条带,一条与目的片段的PCR产物大小一致,另一条与载体在相同酶切下的产物大小一致,证明其确实为重组子。又通过PCR再次验证了重组子。

图2 PCR产物电泳图Fig.2 PCR amplified product注:1,4,5,8为DNA Marker,2为Ampr,3为oriT,6为amy(模板为食淀粉乳杆菌染色体),7为amy(模板为pTA2-amy)。

图3 重组质粒酶切验证电泳图Fig.3 Result of recombinant plasmid verified by digestion注:1为Amp PCR产物;2为重组子pCW5的BamHI酶切产物;3为载体pCW4的BamHI酶切产物;4为重组子pCW6的XbaI酶切产物;5为DNA marker;6为载体pCW5的XbaI酶切产物;7为α-Amy PCR产物;8为重组子pCW7的XhoI酶切产物;9为载体pCW6的XhoI酶切产物;10为g6ph PCR产物;11为重组子pCW7-g6ph的SalI酶切产物;12为载体pCW7的SalI酶切产物。
利用g6ph-u/g6ph-d引物,以肠膜明串珠菌ATCC8293的总DNA为模板,克隆了g6ph表达盒,经SalI酶切后插入到pCW7中,成为pCW7-g6ph。
2.2三亲杂交体系的优化
2.2.1受体菌OD600值对接合转移频率的影响考察了受体菌的OD600值对三亲杂交的影响,结果见图4。从图4可以看出,OD600为0.6时接合转移频率最高。
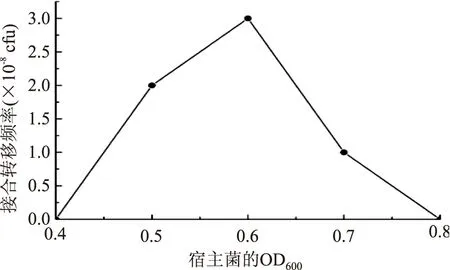
图4 宿主菌OD600对接合转移频率的影响Fig.4 Effect of OD600 of recipient cell on conjugation efficiency
2.2.2三种菌混合比例对接合转移频率的影响比较了供体菌、辅助菌和受体菌三者不同比例的三亲杂交实验,结果见图5。由图5可知,当比例为1∶1∶1.5时,接合转移频率最高。
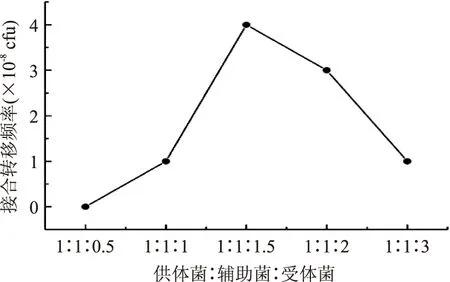
图5 三种菌株比例对接合转移频率的影响Fig.5 Effect of ratio of three types strain on conjugation efficiency
2.2.3抗生素Amp浓度的选择不同Amp浓度条件下进行了三亲杂交实验,接合转移效果见图6。由图6可知,当Amp为5 mg/L时,接合转移频率最高。Amp低于5 mg/L时,因诱导抗性而产生大量的假阳性菌落,而抗生素浓度过高,抑制接合子的生长。

图6 Amp浓度对接合转移频率的影响Fig.6 Effect of concentration of ampicillin on conjugation efficiency
2.2.4覆盖时期的选用3种菌株混合物涂布于MRS平板后,不同时期用Amp和萘啶酮酸覆盖平板,结果见图7。由图7可知,培养5 h是最佳的覆盖时期,超过6 h时,长出大量假阳性菌落,而时间过早抑制接合子的生长。
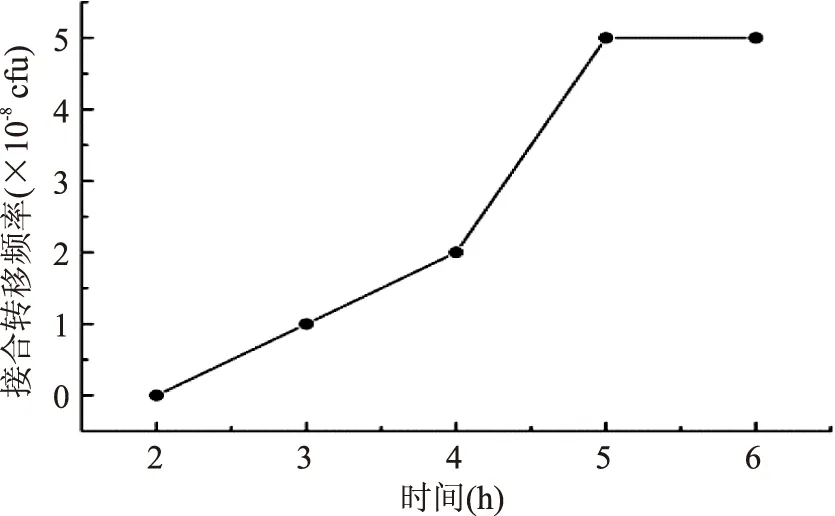
图7 覆盖时间对接合转移频率的影响Fig.7 Effect of time on conjugation efficiency
受体菌的OD600值和三种菌混合比例的探索,是用CaCl2洗涤混合菌2次后置于平板的滤纸上而进行三亲本杂交的[13],其接合转移频率非常低,且十分不稳定。可能是由于微孔滤纸阻隔菌吸收营养物质、CaCl2的处理时期和时间不适而造成的。采用药物覆盖法[10]优化了Amp浓度和药物覆盖时期,接合转移频率大大提高。
2.3利用α-淀粉酶基因标记筛选重组子
含0.005%(W/V)锥虫蓝、1%可溶性淀粉的MRS平板中接合子菌落的颜色为蓝色,见图8。用溶菌酶处理肠膜明串珠菌菌体后,采用小量提取试剂盒提取了接合子的质粒,进行琼脂糖凝胶电泳,结果见图9。电泳结果表明,该蓝色菌落含有与供体菌的pCW7-g6ph大小一致的重组质粒,证明该蓝色菌落就是接合子。随着时间的推移,蓝色平板的颜色越来越淡,而接合子菌落的颜色越来越深。由此可知,菌落的颜色是接合子吸附蓝色的锥虫蓝而导致的,但是含淀粉酶基因标记的菌落变蓝的机理还不清楚。

图8 接合子Fig.8 Conjugant
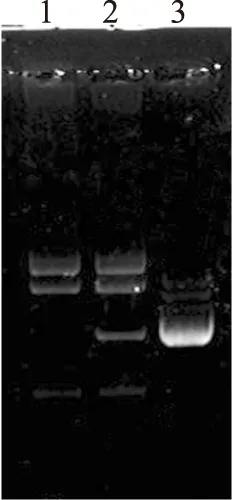
图9 接合子鉴定Fig.9 Identification of conjugant注:1.原始菌株;2.接合子;3.pCW7-g6ph。
马向东等[14]认为,含淀粉的平板中加入锥虫蓝时,更容易观察到枯草芽孢杆菌分泌的淀粉酶溶解淀粉而出现的透明圈。但本研究中并没有观察到明显的透明圈,可能是淀粉酶基因在肠膜明串珠菌中表达缓慢且活性低的缘故。于是用液体培养接合子12 h后,取菌液1 μL滴于含淀粉的MRS平板中,放置18 h后用I2-KI溶液喷洒平板,发现有明显的透明圈产生,见图10。由图10可知,接合子确实有淀粉酶活性。

图10 接合子的淀粉酶溶解淀粉实验Fig.10 Starch test of amylase from conjugant
本研究克隆的α-amy片段为2.0 kb,包括启动子和信号肽序列,但只含有部分的3′端重复序列。Eric[15]分离的食淀粉乳杆菌α-amy基因表达盒为2862 bp,其3′端有5个273 bp重复序列,Eric认为此重复序列与淀粉酶活性无关。陈孝礼[16]分析了食淀粉乳杆菌的α-amy基因结构,也认为其3′端重复序列对淀粉酶的异源表达活性没有影响。综上所述,3′端的重复序列与与淀粉酶活性无关。
筛选重组子时利用菌落的颜色非常简便,例如Li等[17]利用了靛蓝素基因、Takahashi等[18]利用了非核糖体肽合成酶催化产生的一种蓝色染料。但是这些产生颜色的基因,其表达盒都很大,不利于应用,如靛蓝素基因为4.9 kb、非核糖体肽合成酶基因4.8 kb。淀粉酶基因只有2.0 kb,因此在实际应用中占优势。
2.4摇瓶发酵产甘露醇
利用发酵培养基培养20 h后,重组菌的甘露醇含量为10.1 g/L,比原始菌(9.4 g/mL)提高了约7%。这一数据与预期相符,说明6-磷酸葡萄糖脱氢酶基因的过表达可以提高NADH通量,进而对终产物甘露醇的合成起促进作用。Gaspar等[19]在乳球菌中通过敲除乳酸脱氢酶基因而减少NADH的消耗,使甘露醇产量得到了提高。由此可见,增加NADH通量的手段,可以提高甘露醇的产量。
3 结论
α-淀粉酶基因作为筛选标记可以应用于肠膜明串珠菌的基因工程中,并消除红霉素应用中的不利影响。供体菌、辅助菌和受体菌OD600为0.6时,将三者按体积比(mL)0.4∶0.4∶0.6比例混匀,用MRS培养基洗涤混合菌2次,涂布于含0.005%(W/V)锥虫蓝、1%可溶性淀粉、0.1 mol/L CaCl2的MRS平板中,培养5 h后用1 mL含5 mg/L的Amp、50 mg/mL萘啶酮酸的水溶液覆盖,培养至72 h,平板上长出蓝色菌落。通过表达6-磷酸葡萄糖脱氢酶基因的重组菌,甘露醇产量比原始菌提高了约7%。
[1]Johannes A,Niklas W,Kent R. Metabolic Engineering of Lactobacillus fermentum for Production of Mannitol and Pure L-Lactic Acid or Pyruvate[J]. Biotechnology and Bioengineering,2003,82(6):653-663.
[2]Platteeuw C,Hugenholtz J,Starrenburg M,et al. Metabolic Engineering of Lactococcus lactis:Influence of the Overproduction of a-Acetolactate Synthase in Strains Deficient in Lactate Dehydrogenase as a Function of Culture Conditions[J]. Applied and Environmental Microbiology,1995,61(11):3967-3971.
[3]O’Connora E B,O’Sullivana,O’Stanton C,et al. pEOC01:A plasmid from Pediococcus acidilactici which encodes an identical streptomycin resistance(aadE)gene to that found in Campylobacter jejuni[J]. Plasmid,2007,58(2):115-126.
[4]Marcellin E,Chen W Y,Nielsen L K. Understanding plasmid effect on hyaluronic acid molecular weight produced byStreptococcusequi subsp. zooepidemicus[J]. Metabolic Engineering,2010,12(1):62-69.
[5]Lee J H,Yoon S H,Namc S H,et al. Molecular cloning of a gene encoding the sucrose phosphorylase from Leuconostoc mesenteroides B-1149 and the expression in Escherichia coli[J]. Enzyme and Microbial Technology,2006,39(4):612-620.
[6]Cogan T M,Jordan K N. Metabolism of Leuconostoc bacteria[J]. Journal of Dairy Science,1994,77(9):2704-2717.
[7]成文玉,金红星,胡炎华,等.明串珠菌筛选与分类的研究进展[J]. 中国酿造,2010(3):7-9.
[8]Bierman M,Logan R,O’brien K,et al. Plasmid cloning vectors for the conjugal transfer of DNA from Escherichia coli to Streptomyces spp[J]. Gene,1992,116(1):43-49.
[9]Woo J P,Kwan H L,Jung M L,et.al. Characterization of pC7 from Lactobacillus paraplantarum C7 derived from Kimchi and development of lactic acid bacteria-Escherichia coli shuttle vector[J]. Plasmid,2004,52(2):84-88.
[10]余姣姣,陶美凤. 无机盐对阿维链霉菌接合转移及异源表达放线紫红素的影响[J]. 微生物学报,2010,50(11):1556-1561.
[11]Kieser T,Bibb M J,Buttner M J,Chater K F,et al. Practical Streptomyces Genetics[M]. Norwich,United Kingdom:The John Innes Foundation,2000:197.
[12]张晓卿. 微生物转化制备甘露醇的研究[D]. 南宁:广西大学,2004.
[13]Wilson K J,Sessitsch A,Corbo J C,et al. Beta-Glucuronidase(GUS)transposons for ecological and genetic studies of rhizobia and other gram-negative bacteria[J]. Microbiology,1995,141(7):1691-1705.
[14]马向东,马立新,薛征峰,等. 一种鉴定α-淀粉酶活性及其产生菌的新方法[J]. 华中农业大学学报,2000,19(5):456-460.
[15]Giraud E,Cuny G. Molecular characterization of the a-amylase genes of Lactobacillus plantarum A6 and Lactobacillus amylovorus reveals an unusual 3’ end structure with direct tandem repeats and suggests a common evolutionary origin[J]. Gene,1997,198:149-157.
[16]陈孝礼,赵文锋,张玉彬. 食淀粉乳杆菌淀粉酶基因在E. coli中的克隆表达[J]. 药物生物技术,2012,19(4):283-286.
[17]Li P W,Li J,Guo Z Y,et al. An efficient blue-white screening based gene inactivation system for Streptomyces[J]. Applied Microbiology and Biotechnology,2015,99(4):1923-1933.
[18]Takahashi H,Kumagai T,Kitani K,et al. Cloning and characterization of a Streptomyces single module type non-ribosomal peptide synthetase catalyzing a blue pigment synthesis[J]. The Journal of Biological Chemistry,2007,282(12):9073-9081.
[19]Gaspar P,Neves A R,Gasson M J,et al. High yields of 2,3-butanediol and mannitol in Lactococcus lactis through engineering of NAD+cofactor recycling[J]. Applied and Environmental Microbiology,2011,77(19):6826-6835.
Study on application ofα-amylase gene in the gene expression ofLeuconostocmesenteroides
TIAN Yun-fei,LIU Xiao-li,CHENG Wen-yu,JIN Hong-xing*
(School of Chemical Engineering & Technology,Hebei University of Technology,Tianjin 300130,China)
Objective:To verify the effect of theα-amy(α-amylase gene)used inLeuconostocmesenteroides,construction of recombined plasmid and triparental mating system inLeuconostocmesenteroideswere performed. Methods:The recombined plasmid pCW7,containingα-amy,was constructed based onE.coli-Leuconostoc shuttle vectors pCW4. 6-Phosphoglucose dehydrogenase gene(g6ph)expression cassettes fromLeuconostocmesenteroidesATCC8293 was cloned into pCW7 and introduced intoLeuconostocmesenteroidesby triparental mating. Results:Compared with the wild type,the recombination strain increased 7% yield of mannitol. The recombinant can be successfully selected byα-amylase gene markers. Conclusion:It showed the practicability ofα-amylase gene markers used in improving the gene expression ofLeuconostocmesenteroides.
Leuconostocmesenteroides;α-amylase gene;triparental mating;6-Phosphoglucose dehydrogenase
2015-11-30
田云飞(1989-),女,硕士,研究方向:细菌遗传育种学,E-mail:tian_yunfei@163.com。
金红星(1968-),男,博士,副教授,研究方向:细菌遗传育种学,E-mail:jinhx87@126.com。
TS201.3
A
1002-0306(2016)10-0203-05
10.13386/j.issn1002-0306.2016.10.033
