罗非鱼下脚料酶解液特定腐败菌的分离和鉴定
2016-09-10沈志华潘子强
沈志华,崔 春,潘子强
(1.华南理工大学轻工与食品学院,广东广州 510640;2.电子科技大学中山学院化学与生物工程学院,广东中山 528400)
罗非鱼下脚料酶解液特定腐败菌的分离和鉴定
沈志华1,2,崔春1,*,潘子强2
(1.华南理工大学轻工与食品学院,广东广州 510640;2.电子科技大学中山学院化学与生物工程学院,广东中山 528400)
采用PCR-DGGE和PCR-RFLP技术研究了罗非鱼下脚料酶解液冷藏过程中的特定腐败菌。结果表明:酶解液在冷藏条件下,在20 d左右腐败,细菌总数在0~12 d里逐渐增加(8.71×102~8.13×107cfu/g),12 d之后趋向稳定。16S rRNA的PCR-RFLP及序列比对分析结果显示,随机挑取的18株细菌分成三个分型,其中分型1占61%,与Genbank核酸数据库的假单胞菌(Pseudomonassp.)有最大相似性;PCR-DGGE图谱显示酶解液的细菌菌相随时间的延长而逐渐减少,腐败终点菌相单一。DGGE主要条带测序结果表明,酶解液存在三个类群的细菌,分别是假单胞菌属、气单胞菌属(Aeromonas)和不动杆菌属(Acinetobacter),其中在酶解液腐败终点,荧光假单胞菌(Pseudomonasfluorescens)占绝对优势,与RFLP结果相符。
罗非鱼下脚料,酶解液,特定腐败菌,RFLP,PCR-DGGE
水产品加工过程中所使用的原料、加工方法和产品的贮藏条件不同的差异会导致残存不同的腐败细菌,产生不同的腐败类型。据报道,未冷藏鲜鱼的特定腐败菌(Specific Spoilage Organism,SSO)为弧菌科(Vibrionaceae)等革兰氏阴性细菌,而冷藏后优势腐败菌则变为革兰氏阴性嗜冷菌或肠细菌(Enterobactericeae)[1],其中热带淡水鱼的SSO多为假单胞菌,海洋温带水域鱼的SSO多为腐败希瓦氏菌[2]。冷藏贝类和甲壳类的SSO多为假单胞菌(Pseudomonassp.)或者腐败希瓦氏菌(Shewanellaputrefaciens)[3]。而经过真空或气调包装冷藏后水产品的SSO多为磷发光杆菌(Photobacteriumphosphoreum)、乳酸菌(Lactobacillus)和热杀索氏菌(Brochothrixthermosphacta)[1]。许钟等报道,冷藏养殖罗非鱼、大黄鱼、三文鱼片等货架期终点的特定腐败菌为假单胞菌[4-8]。徐丽敏等[9]发现4 ℃冷藏南美白对虾的优势腐败菌是假单胞菌与气单胞菌(Aeromonassp.)。
在加工后的水产品中,特定腐败菌为乳酸菌如乳杆菌(Lactobacillus)、肉食杆菌(Carnobacillus),以及发酵型革兰氏阴性细菌如磷发光杆菌、适冷的肠杆菌等居多。在半保藏产品如醋渍鱼或暴腌鱼中,乳酸菌和酵母菌居多。轻度加热处理制作的真空蒸煮袋产品在贮藏中,芽袍杆菌属(Bacilus)或梭菌属芽抱杆菌(Clostridium)多为优势腐败菌[10]。许钟等[11]报道淡腌大黄鱼5 ℃保藏,缺陷短波单胞菌(Brevundimonasdiminute),10 ℃和15 ℃贮藏时,微小球菌(Micrococcusrose)为优势腐败菌。
目前,以罗非鱼下脚料为原料,通过控制酶解制备呈味基料、功能性肽和改性蛋白已成为国内外研究的热点之一[12-13]。但是酶解液的保鲜防腐、酶解液的菌相及特定腐败菌的研究鲜有报道,研究和了解不同加工条件及贮藏条件下的酶解液的菌相及腐败菌,可为蛋白水解物的保存和防腐提供理论依据。因此本实验采用PCR-DGGE和PCR-RFLP技术研究冷藏条件下罗非鱼下脚料酶解液的特定腐败菌可为其保鲜技术提供研究基础,为优化罗非鱼下脚料酶解液冷藏链技术参数和快速预测产品品质提供依据。
1 材料与方法
1.1材料与仪器
罗非鱼购于中山市厚兴市场;Taq DNA聚合酶(5 U/μL)、100 bp和500 bp DNA Ladder Marker、MspⅠ限制性内切酶(10 U/μL)、27F和1492R引物大连宝生物工程有限公司;琼脂糖、PCA培养基、EDTA、Tris北京鼎国生物技术有限公司;E.Z.N.A. Cycle-Pure kitOmega Bio-tek,USA;胰蛋白酶(2×105U/g)、Flavourzyme500MG风味蛋白酶(5×104U/g)诺维信。
LRH-250-GB型培养箱韶关市泰宏医疗器械有限公司;TD5A-WS型离心机湖南赛特湘仪公司;T100型PCR仪、DCode型突变检测系统美国BIO-RAD公司;DYY-6C电泳仪及DYCP-31DN型水平电泳槽北京六一仪器厂。
1.2实验方法
1.2.1材料及样品前处理方法罗非鱼新鲜宰杀后取鱼头、鱼骨、鱼尾下脚料捣碎后,料液比1∶2,pH7.5,于50 ℃的恒温水浴锅中,先加入胰蛋白酶水解2 h后再加入风味蛋白酶继续酶解2 h(酶用量均为700 U/g原料),然后于90 ℃水浴灭酶10 min,冷却后,8000 r/min离心15 min,去除上层油脂与下层残渣,取中间层酶解液备用[14]。
1.2.2微生物培养及细菌生长总数变化分别取0、2、4、6、8、12、16、20 d的样品,将含菌体的样液低速离心,除去固体杂质后取中间清液在PCA培养基中进行稀释涂布,倒置于25 ℃的恒温培养箱中培养16~24 h,然后进行菌落计数。
将冷藏20 d(腐败终点)的酶解液按上述方法培养细菌,挑选出形态色泽一致且占优势的菌株分离纯化后,保存于甘油中备用。
1.2.3DNA的提取细菌DNA的粗提:取各菌种的细菌培养液1 mL于离心管中进行高速离心(转速12000 r/min)5 min,弃上清液,在离心管中加入100 μL无菌水,振荡成悬液。将离心管置于100 ℃沸水浴中反应10 min后,再于冰浴中冷却2 min。最后进行高速离心(转速12000 r/min)5 min,取上清液作细菌16S rDNA基因扩增的模板。
酶解液细菌总DNA的提取:操作方案参照江芸[15]文献完成,该DNA将用于PCR-DGGE技术分析。
1.2.4限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术分析以1.2.3中获得的细菌DNA的粗提液作模板,利用细菌通用引物27F和1492R扩增16S rRNA基因。上游引物27F:5′-AGA GTT TGA TCC TGG CTC AG-3′,下游引物1492R:5′-GGT TAC CTT GTT ACG ACT T-3′。50 μL的PCR反应体系成分参照潘子强文献[16]操作。
PCR反应条件:94 ℃,5 min;94 ℃,45 s;53 ℃,45 s;72 ℃,1.5 min;循环30次;最后72 ℃延伸10 min。
PCR产物直接用5 U MspⅠ限制性内切酶消化,反应条件为37 ℃恒温水浴6 h。酶切产物用3%琼脂糖凝胶电泳来分析酶切图谱。
1.2.5PCR-变性梯度凝胶电泳(DGGE)技术分析把1.2.3中获得的DNA进行16S rDNA扩增。用细菌通用引物B338f和B518r扩增酶解液中腐败菌的16S rRNA V3可变区。引物B338f带GC夹:5′-ACT CCT ACG GGA GGC AGC AG-3′,5′GC夹:5′CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G,引物B518r:5′-ATT ACC GCG GCT GCT GG-3′,PCR反应体系及条件同1.2.4中。
配制凝胶:按照DGGE说明书组装梯度制胶器。PCR结束后,取出PCR产物,用PCR产物纯化试剂盒进行纯化。将PCR产物进行电泳。
电泳:预电泳电压20 V,时间30 min。正式电泳电压70 V,时间16~18 h。
染色:加入250 mL固定液中,放置在摇床上摇荡,脱色15 min。倒掉固定液,用去离子水冲洗2次,倒掉后加入250 mL银染液中,放置在摇床上摇荡,染色15 min。倒掉银染液,用去离子水冲洗2次,倒掉后加入250 mL显色液,待条带出现后停止显色。倒掉显色液,用去离子水冲洗2次,加固定液终止5 min。倒掉固定液,用去离子水冲洗2次。
1.2.6PCR产物纯化、测序及序列分析采用E.Z.N.A. Cycle-Pure kit(Omega Bio-tek,USA)纯化DGGE主要条带的PCR产物和RFLP不同分型的16S rRNA PCR产物。纯化产物送上海英骏生物技术有限公司测序,测序结果用Vector NTI Advance 11.0中的ContigExpress拼接,去掉两端质量低于40 bp的序列,将得到的16S rDNA序列用blastn比对NCBI的核酸数据库。

表1 各分型16S rDNA序列比对分析结果
2 结果与分析
2.1酶解液细菌生长总数变化
实验样品腐败时间共20 d,在第20 d,酶解液呈黄色且表面发粘,并发出恶臭味。通过气味、颜色和粘稠度可基本判断酶解液已经腐败。
细菌生长总数变化如图1所示。酶解液初始带菌量为8.71×102cfu/g,细菌总数变化随着冷藏时间延长逐渐增加,在第12 d细菌总数达到8.13×107cfu/g,随后在12~20 d细菌总数趋向稳定,在8.13×107~9.77×107cfu/g之间。参照国际食品微生物标准委员会(International Commission of Microbiological Specializations on Food,ICMSF)的水产品货架期终点细菌总数参考值(7.0×107cfu/g),本实验在第8 d即达到7.0×107cfu/g,但此时的酶解液在气味、颜色和质感还没有达到感官评价的腐败现象,直到第20 d才达到ICMSF标准的参考水平。因此我们根据ICMSF的标准及感官评价确定在4 ℃冷藏条件下,酶解液在第20 d时腐败。
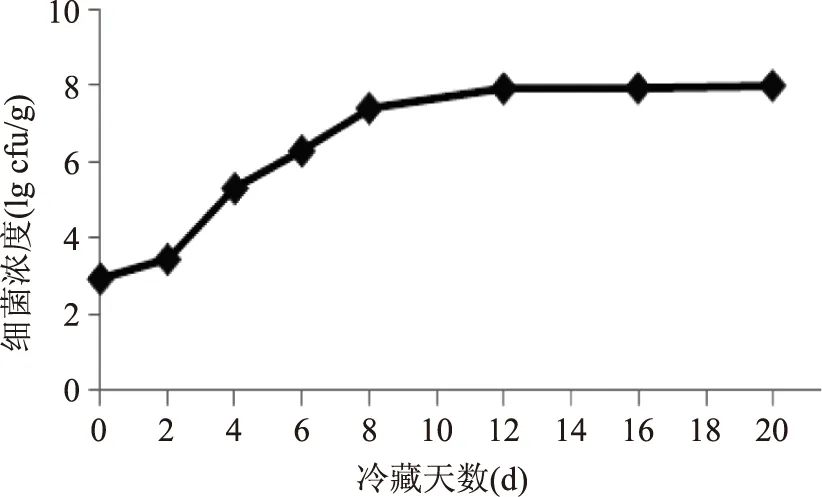
图1 罗非鱼下脚料酶解液在4 ℃冷藏过程中细菌生长总数变化Fig.1 The number of bacteria from Tilapia wastes enzymatic hydrolysates storaged at 4 ℃
2.2特定腐败菌的16S rDNA RFLP分析
冷藏的第20 d,将酶解液匀浆液梯度稀释后涂布在PCA平板培养基中,培养过夜后,随机从平板上挑选18株细菌,经微生物方法分离纯化得到纯种后,提取细菌DNA,利用通用引物27F/1492R进行PCR扩增,其PCR产物用Msp I酶切,进行RFLP分析。RFLP结果(图2)显示18株细菌的16S rDNA被分成3种RFLP分型,编号1、3、4、5、6、7、8、9、10、11、17作为分型1,共11个,占总数的61%;编号2、12、15、16作为分型2,共4个,占总数的22%;编号13、14、18作为分型3,共3个,占总数的17%。结果表明分型1的细菌是酶解液在4 ℃冷藏条件下的优势菌。

图2 酶解液的16S rDNA基因Msp I酶切图谱Fig.2 Profiles of 16S rDNA gene enzymed by Msp I
2.3RFLP序列分析
将RFLP不同分型的菌株的16S rDNA序列用blast比对NCBI的核酸数据库,结果见表1。
从表1中可以看出,分型1的细菌与荧光假单胞菌(Pseudomonasfluorescensstrain Y1)有最大的相似性,分型2的细菌与气单胞菌属的Aeromonassp. REm-amp_42、Aeromonasveroniistrain A7、Aeromonasallosaccharophilastrain S5-33有最大的相似性,而分型3的细菌则与芽孢杆菌Bacillussp. TF1-3有最大的相似性。已有研究表明,假单胞菌、气单胞菌及芽孢杆菌都是可以作为潜在的腐败菌。因此,这三种菌是酶解液在冷藏条件下的腐败菌,而占总体61%的分型1则是在这种条件下的优势菌,即特定腐败菌。
2.4酶解液中细菌的DGGE图谱分析及主要条带测序分析
DGGE电泳图谱上不同条带代表不同的细菌,条带颜色越重反映细菌的数量越多。从图3中可以看出,随着储存时间的延长,细菌菌相也不断变化,条带b出现在第2 d。条带c在第2 d被微弱检出,到第4 d为主要优势菌,然后随冷藏时间的增加而逐渐减弱。条带f从第16~20 d菌相变得单一,且颜色变得非常浓,明显处于优势地位,但是在第16 d之前条带f都是处于劣势地位的,说明条带f所代表的菌种是酶解液在冷藏条件下的特定腐败菌。
从DGGE凝胶上切下5个主要条带,经过重新PCR及DGGE的确定、测序,5个条带的序列经Genbank比对后的结果列于表2。

表2 DGGE主要条带序列比对分析结果

图3 酶解液在4 ℃冷藏过程中细菌的DGGE图谱Fig.3 The DGGE profiles of bateria from enzymatic hydrolysates storaged at 4 ℃注:a~f表示条带位置。
从表2比对的结果看,酶解液存在三个类群的细菌,分别是假单胞菌属(d、f条带)、气单胞菌属(a和c条带)和不动杆菌属(b条带),其中f条带荧光假单胞菌(Pseudomonasfluorescens)在酶解液腐败终点占绝对优势,而这个菌常常是多种水产品的特定腐败菌。这与前面RFLP分析结果是相符的。
3 结论
运用PCR-DGGE和RFLP分析技术对罗非鱼下脚料酶解液特定腐败菌进行了分析鉴定。结果显示:酶解液在20 d腐败。在RFLP分析中,发现酶解液在4 ℃冷藏条件下的腐败菌有3种,其中分型1有11个,占总数的61%,分型2有4个,占总数的22%,分型3有3个占总数的17%,表明分型1的细菌是酶解液4 ℃冷藏下的优势腐败菌。测序及序列比对分析显示分型1、2、3分别与假单胞菌(Pseudomonassp.)、气单胞菌(Aeromonassp.)和芽孢杆菌(Bacillussp.)的序列有最大的相似性。DGGE主要条带测序结果表明,酶解液存在三个类群的细菌,分别是假单胞菌属、气单胞菌属和不动杆菌属(Acinetobacter),其中在酶解液腐败终点,荧光假单胞菌(Pseudomonasfluorescens)占绝对优势。假单胞菌属是一类好氧且适应能力极强的革兰氏阴性致腐菌,生长率相对于其他菌有明显的优势,在有氧条件下分解蛋白质的能力极强,是水产加工产品类的特定腐败微生物。
[1]DALGAARD P. Fresh and lightly preserved seafood[C]//MAN C M D,JONESA A. Shelf life evaluation of foods. Gaithersburg Maryland,USA:Aspen Publishers Inc,2000:110-139.
[2]GENNARIM,TOMASELLI S,COTRONA V. The microflora of fresh and spoiled sardines(Sardinapilcharddus)caught in Adriatic(Mediterraneas)Sea and stored in ice[J]. Food Microbiology,1999,16(1):15-28.
[3]LUND B M,BAIRD-PARKER T C,GOULD G W. The microbiological safety and quality of food[M]. Gaithersburg Maryland,USA:Aspen Publishers Inc,2000.
[4]许钟,肖琳琳,杨宪时. 罗非鱼特定腐败菌生长动力学模型和货架期预测[J]. 水产学报,2005,29(4):540-546.
[5]郭全友,许钟,杨宪时. 冷藏罗非鱼特定腐败菌的鉴定和生长动力学[J]. 渔业科学进展,2009,30(4):117-123.
[6]曹荣. 太平洋牡蝠在冷藏和冻藏过程中细菌菌相及品质变化[D]. 青岛:中国海洋大学,2006.
[7]朱天祥,许钟,蔡述秋,等. 冰鲜大黄鱼加工过程中的细菌学分析及关键控制点[J]. 海洋渔业,2007,29(1):68-72.
[8]李婷婷,丁婷,邹朝阳,等. 0 ℃冷藏下三文鱼片菌相变化规律及特定腐败菌的分离鉴定[J]. 现代食品科技,2015(4):36-41.
[9]徐丽敏,薛长湖,李兆杰,等. 水溶性壳聚糖对南美白对虾品质及腐败菌相变化的影响[J]. 食品工业科技,2008,29(6):107-110.
[10]罗庆华. 水产品特定腐败菌研究进展[J]. 食品科学,2010,31(23):468-472.
[11]许钟,郭全友. 淡腌大黄鱼贮藏中的品质变化及腐败菌分析[J]. 食品科学,2008,29(12):697-700.
[12]陈军,熊彬.罗非鱼下脚料酶解液美拉德反应制备肉类风味物工艺研究[J].广西轻工业,2011,4(4):38-39,43.
[13]吴燕燕,李来好,岑剑伟,等. 酶法由罗非鱼加工废弃物制取调味料的研究[J]. 南方水产,2006,2(1):49-53.
[14]李琳,沈志华,李伟明,等. 低值鱼的深度酶解及海鲜复合调味料的生产[J]. 中国调味品,2014,39(2):67-71.
[15]江芸,高峰,徐幸莲,等. 冷却猪肉不同前处理对细菌DNA提取及PCR-DGGE的影响[J]. 食品科学,2010,31(6):258-262.
[16]潘子强,陈彦,李彬,等. 冷藏真空包装脆肉鲩鱼特定腐败菌的分析[J]. 食品科技,2013,38(9):109-113.
Isolation and identification of specific spoilage organism from Tilapia wastes enzymatic hydrolysates
SHEN Zhi-hua1,2,CUI Chun1,*,PAN Zi-qiang2
(1.College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China; 2.Zhongshan Institute,University of Electronic Science and Technology,Zhongshan 528400,China)
Specific spoilage organism of Tilapia Wastes enzymatic hydrolysates during chilled storage was studied by PCR-DGGE and PCR-RFLP. Results indicated that Tilapia enzymatic hydrolysates spoilaged about 20 days at 4 ℃,and the total number of bacteria increased during 0~12 days(8.71×102~8.13×107cfu/g)gradually,became stable during 12~20 days. There were three types of bacteria by PCR-RFLP analysis of 16S rRNA from 18 strains of bacteria selected randomly. Type one which dominated 61% of the total bacteria was highly similar withPseudomonas. The maps of PCR-DGGE showed that the bacteria reduced gradually before spoilaged,and there was only one single band of bacteria at last. Sequencing analysis results of DGGE bands showed that there were three types of bacteriaPseudomonassp.,AeromonasandAcinetobacterin the Tilapia Wastes enzymatic hydrolysates,Pseudomonasfluorescenswas the predominant bacteria when spoilaged,this conclusion was consistent with RFLP.
Tilapia wastes;enzymatic hydrolysates;specific spoilage organism;restriction fragment length polymorphism(RFLP);PCR-DGGE
2015-11-09
沈志华(1982-),男,硕士研究生,研究方向:食品工程,E-mail:shenzhihua123@126.com。
崔春(1978-),男,博士,教授,研究方向:食品生物技术,E-mail:cuichun@scut.edu.cn。
国家863项目(2014AA093602)。
TS264.9
A
1002-0306(2016)10-0199-04
10.13386/j.issn1002-0306.2016.10.032
