硒化大米蛋白抗氧化性活性研究
2016-09-10隋春红金玉姬
王 程,王 悦,隋春红,罗 军,李 妍,张 巍,金玉姬
(吉林医药学院基础医学院,吉林吉林 132013)
硒化大米蛋白抗氧化性活性研究
王程,王悦,隋春红,罗军,李妍,张巍,金玉姬*
(吉林医药学院基础医学院,吉林吉林 132013)
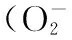
大米蛋白,硒,抗氧化活性
大米蛋白(rice protein,RP)因其低抗原性一直受到广泛关注[1]。近年来,富硒大米因其具有抗氧化、抗肿瘤、抗衰老及提高和调节免疫力等作用更是成为学者们研究的热点[2]。然而我国大部分地区的土壤的硒(selenium,Se)含量并不丰富,水稻对硒的吸收率也较低[3],因此仅靠富硒地区生产的大米还不能满足广大人民群众的补硒需求。有研究发现富硒大米中有机硒的主要存在形态是硒蛋白(占53.4%)[4],且主要以硒代甲硫氨酸(selenomethionine,Se-Met)形式存在[5]。而植物硒蛋白中还有硒代半胱氨酸(selenocysteine,Se-Cys)这种更重要的存在形式[6]。化学修饰法可以将分子羟基(hydroxyl,-OH)中的氧(oxygen,O)原子被Se原子取代而变成硒氢基(selenyl,-SeH),常用于小分子有机硒化合物的制备[7]。研究中发现修饰反应所需的条件相对温和(温度在20 ℃以上即可进行反应[8]),因此有学者尝试采用化学修饰法将蛋白质分子中丝氨酸(serine,Ser)的-OH转变为-SeH,从而制备含硒多肽或含硒蛋白并获得成功[9]。如能通过化学修饰法大量制备大米源硒化蛋白并检验其安全性,则可能会在保健、医疗等方面具有重要的社会意义,并带来经济效益。
本研究以大米为原料,酶法提取大米总蛋白(total RP,RPt),凝胶层析获得RP组分,再将RP中的Ser化学修饰为Se-Cys,探索植物源硒化蛋白的制备方法,以提高RP中的硒含量,并通过检测硒化大米蛋白(selenide rice protein,Se-RP)的抗氧化活性,为合理开发大米资源,制备新型抗氧化剂提供理论依据。
1 材料与方法
1.1材料与仪器
东北有机大米吉林市永鹏农副产品开发有限公司(蛋白含量7.8%);新鲜牛心吉林市东清真寺牛羊屠宰场;胃蛋白酶(Pepsin,1.5 AU/g)、中性蛋白酶(Neutrase,0.5 AU/g)、碱性蛋白酶(Alcalase,2.4 AU/g)丹麦诺维信公司;Sephadex G-25瑞典Pharmacia公司;透析袋3500美国Spectium公司;四甲基二乙胺(TEMED)、考马斯亮蓝R-250、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒上海碧云天生物技术有限公司;蛋白分子量Marker美国Transgen公司;牛血清白蛋白(BSA)、甘氨酸、半胱氨酸、硒粉、巯基乙醇、邻苯三酚、依布硒(Ebselen)、抗坏血酸(VC)、三羟甲基氨基甲烷(Tris)、苯甲基磺酰氟(PMSF)、二硫二硝基苯甲酸(DTNB)、还原型谷胱甘肽(GSH)、GSH还原酶、还原型烟酰胺腺嘌呤二核苷磷酸(NADPH)、1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、氯化硝基四氮唑蓝(NBT)、三氯乙酸(TCA)、硫代巴比妥酸(TBA)美国Sigma公司;硒标准液国家标准物质研究中心;水杨酸、无水乙醇、过氧化氢(H2O2)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、硫酸亚铁(FeSO4)、硼氢化钠(NaBH4)国药集团化学试剂有限公司。
DS-Y1000型高速粉碎机上海顶帅电器有限公司;SL-2001N型电子天平上海民桥精密科学仪器有限公司;SZCL-2型控温磁力搅拌器巩义予华仪器有限责任公司;TG16-WS型台式离心机长沙湘仪离心机仪器有限公司;BHW-IN恒温水浴北京医疗设备厂;PHS-2C精密酸度计上海雷磁仪器厂;LGJ-18型冷冻干燥机军事医学科学院实验仪器厂;HD-4核酸蛋白检测仪上海沪西分析仪器厂;UV-2550紫外分光光度计、AA-6300型原子吸收分光光度计、Se空心阴极灯日本岛津公司;AFS-230E型双道原子荧光光度计北京海光仪器公司;LDI-1700基质辅助激光解析电离飞行时间质谱仪(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)美国Linear Scientific公司。
1.2实验方法
1.2.1RPt的提取大米磨粉,过80目筛,称取100 g米粉,加入600 mL蒸馏水搅拌均匀,于90 ℃水浴中处理15 min,冷却至室温后再调至蛋白酶的最适温度及pH(胃蛋白酶pH=2,37 ℃,中性蛋白酶pH=7,50 ℃碱性蛋白酶pH=9,60 ℃),按1%的加酶量向溶液中加入各种蛋白酶水解反应4 h,反应过程中以1 mol/L HCl溶液或0.1 mol/L NaOH溶液维持pH恒定(中性和碱性的条件下采用pH-Stat法测定水解度[10],酸性的条件下采用甲醛滴定法测定水解度[11]),待反应完毕,将酶解液置于100 ℃水浴中5 min使酶灭活。而后迅速流水冷却,7000 r/min离心15 min后取上清液,调节pH至7.5后用0.45 μm微孔滤膜过滤,冻干后即为RPt。用Lowry法[12]测定提取的RPt含量,计算提取率,蛋白质提取率(%)=提取的RPt质量(g)/大米原料中蛋白质质量(g)×100。
1.2.2RP组分的分离与分子量测定采用Suphedex G-25凝胶层析分离RPt各组分,凝胶柱100 cm×2.6 cm,用20 mmol/L,pH=7.5的磷酸盐缓冲液(phosphate buffered saline,PBS)洗脱。将RPt提取过程中过滤后的上清液pH调至7.5,取3 mL上样,洗脱流速0.8 mL/min,280 nm波长下检测流出液,收集吸光度值大于0.15的组分,蒸馏水透析3次,脱盐后的RP各组分冻干备用。另收集峰尖蛋白溶液,进行SDS-PAGE(5%浓缩胶、15%分离胶)鉴定[13],MALDI-TOF-MS测定RP分子量[14]。
1.2.3RP的化学修饰按Klayman[15]方法制备1 mol/L NaHSe,氮气保护下备用。用50 mmol/L PBS(pH=7.4)溶解各纯化后RP组分,制备浓度0.25 g/L RP溶液,每1 mL RP溶液加入12.5 μL PMSF(20 g/L乙腈溶液),密闭容器中25 ℃温水浴3 h,而后通入高纯氮气20 min以排除体系内氧气,加入15 μL NaHSe溶液,氮气保护下37 ℃反应40 h,反应完成后空气中放置4 h充分氧化,12000 r/min离心20 min除去硒,经SephadexG-25凝胶层析柱除盐后冻干,即得Se-RP。
1.2.4RP和Se-RP硒含量和GPX活力测定采用氢化物原子荧光光谱法检测硒含量[16]。采用Wilson的酶偶联方法测定Se-RP和RP的谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活力[17]。以150 mmol/L PBS(pH=7.4)作为空白对照,分别在340 nm处测定NADPH吸光度值变化。酶活力定义为1 min氧化1 μmol/L NADPH所需的酶量为1 U,比活力用U/g表示。
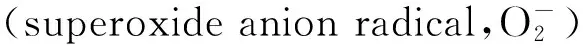
DPPH·清除率的测定[19]:样品管中取1.5 mL样品,空白管中取1.5 mL H2O,分别加入1.5 mL DPPH·乙醇溶液(0.1 mmol/L);参比管中取1.5 mL样品,加入1.5 mL无水乙醇。各管充分混匀,25 ℃避光水浴30 min后取出,在517 nm处测定各管吸光度值。DPPH·清除率(%)=[1-(A1-A2)/A0]×100,其中A1为样品管吸光度值,A2为参比管吸光度值,A0为空白管吸光度值。
OH·清除率的测定[20]:样品管中取1 mL样品,空白管中取1 mL蒸馏水,分别依次加入1 mL FeSO4(9 mmol/L)和1 mL水杨酸(9 mmol/L);参比管中取1 mL样品,加入1 mL FeSO4(9 mmol/L)和1 mL蒸馏水。各管充分混匀,加入1 mL H2O2(8.8 mmol/L)启动反应,37 ℃水浴1 h后在510 nm处测定各管吸光度值。OH·清除率(%)=[1-(A1-A2)/A0]×100,其中A1为样品管吸光度值,A2为参比管吸光度值,A0为空白管吸光度值。
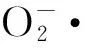
1.2.6Se-RP对线粒体损伤保护作用的测定按Lansman[22]方法制备牛心线粒体。新鲜牛心去除脂肪和结缔组织,加入2倍质量预冷的提取缓冲液(25 mmol/L HEPES-NaOH,pH=7.4、250 mmol/L蔗糖和10 mmol/L EDTA),组织捣碎机捣碎,3800 r/min离心20 min,上清液过滤,弃沉淀。4 ℃条件下12000 r/min离心30 min,弃上清液,沉淀用提取缓冲液悬浮得到线粒体,于0 ℃保存。以BSA为标准,考马斯亮蓝法测定线粒体浓度[23]。
配制100 mg/L各组分Se-RP、RP样品及10 μmol/L Ebselen样品。用pH=7.4的测定缓冲液(125 mmol/L KCl、1 mmol/L MgCl2、5 mmol/L谷氨酸盐、1 μmol/L GSH)配制终浓度0.5 g/L的线粒体溶液。37 ℃保温30 min后,加入终浓度为0.5 mmol/L VC和12.5 μmol/L FeSO4,即为线粒体损伤模型。模型建立后立即加入各待测样品,37 ℃振荡并计时,在0、2、4、6、8、10、15、20 min时间点测定线粒体膨胀度,在0、5、10、15、20、30、40、50 min时间点测定丙二醛(malondialdehyde,MDA)含量。线粒体膨胀会使溶液浑浊度增加,其520 nm波长下的光吸收值降低,因此以A520值可直接判断浑浊度变化,间接评价线粒体膨胀度,A520值与线粒体膨胀度成反比[24]。采用TBA法[25]测定MDA含量,取1 mL反应液中加入1 mL 100 g/L TCA、1 mL 6.7 g/L TBA,沸水浴20 min,冷却后3000 r/min离心10 min,取上清液测535 nm处的光吸收值,MDA含量(nmol/L)=A535×E×l,E为消光系数1.56×105L/(mol·cm),l为样品池的光路长度(1 cm)。同时测定未进行模型损伤的线粒体样品作为空白对照。
1.3数据处理
所有实验数据均测定3次,并以平均值±标准差(±SD)表示。采用SPSS 11.5软件进行方差分析。
2 结果与讨论
2.1RPt的提取率
利用胃蛋白酶、中性蛋白酶、碱性蛋白酶三种蛋白酶在不同条件下水解大米原料,每100 g大米原料所提取的RPt质量分别为:(2.89±0.13)、(2.60±0.14)、(4.12±0.19) g。按大米原料7.8%的蛋白质含量计算,胃蛋白酶对RPt的提取率为37.0%,中性蛋白酶为33.2%,碱性蛋白酶为52.8%。由于采用碱性蛋白酶水解所提取RPt的提取率最高,因此进一步的实验均选用碱性蛋白酶水解所提取RPt。这一结果与以往的研究相似[10],但由于实验中并未对提取过程进行优化处理,因此所获RP量相对较低。
2.2RP的SDS-PAGE和MALDI-TOF-MS分析
由Suphedex G-25凝胶层析可将RPt分离成5个组分(峰Ⅰ~峰Ⅴ),结果见图1。收集各组分峰尖进行SDS-PAGE(图2)和MALDI-TOF-MS分析(图3),结果发现小分子量的RP更不易分离。且由图3可知各分离峰所含主要蛋白的分子量,并根据测定的分子量将分离峰中的主要蛋白分别命名为RP33、RP28、RP24、RP16、RP13(表1)。

图1 大米蛋白的凝胶色谱洗脱曲线Fig.1 Elution curve of RP using gel chromatography注:a为峰Ⅰ,b为峰Ⅱ,c为峰Ⅲ,d为峰Ⅳ,e为峰Ⅴ。
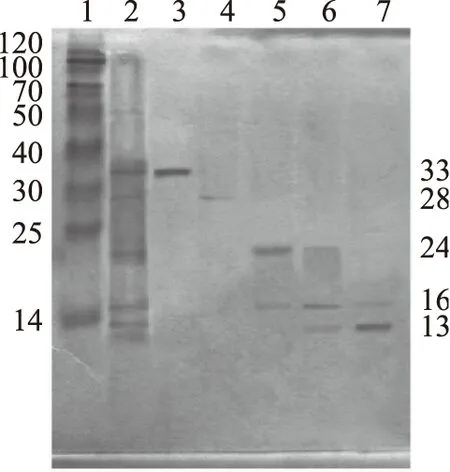
图2 大米蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of RP注:1为Marker,2为大米总蛋白(RPt),3为峰Ⅰ,4为峰Ⅱ,5为峰Ⅲ,6为峰Ⅳ,7为峰Ⅴ。

图3 大米蛋白的MALDI-TOF-MS分析Fig.3 MALDI-TOF MS analysis of RP注:(A)为峰Ⅰ,(B)为峰Ⅱ,(C)为峰Ⅲ,(D)为峰Ⅳ,(E)为峰Ⅴ,(F)大米总蛋白(RPt)。
2.3RP和Se-RP的硒含量和GPX活力
由于GPX是机体内重要的含硒酶,通常以测定GPX活力作为衡量硒蛋白抗氧化活力的重要指标[26]。各组分RP和Se-RP的硒含量和GPX活力见表1。由表1可知,实验中没有提取到天然的含硒蛋白,并且这些RP也不具有GPX活力,但经硒化修饰的Se-RP表现出明显的GPX活力,其中Se-RP24的GPX活力最高。通过对Se-RP中硒含量与GPX活力分析发现,Se-RP的GPX活力大小与蛋白的硒含量无明显量效关系,因此可以推测硒蛋白的GPX活力不仅与硒含量有关,还可能与硒蛋白的空间结构密切相关。

表1 各组分大米蛋白和硒化大米蛋白的理化性质和抗氧化酶活性
注:ND:未测定。
2.4RP和Se-RP对自由基的清除作用

图4 不同物质对DPPH·的清除作用Fig.4 Scavenging effects of different chemicals on the DPPH·注:(A)Ebselen,(B)RP和Se-RP;图5、图6同。
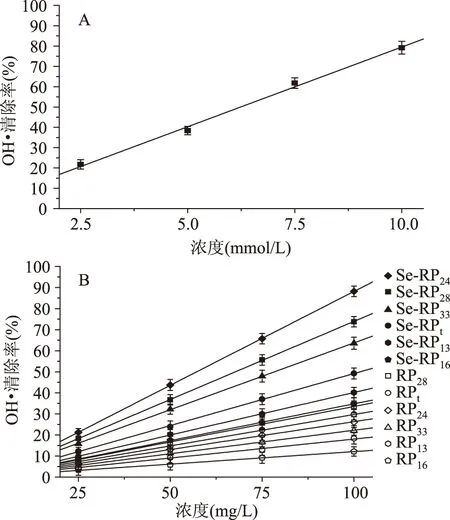
图5 不同物质对OH·的清除作用Fig.5 Scavenging effects of different chemicals on the OH·
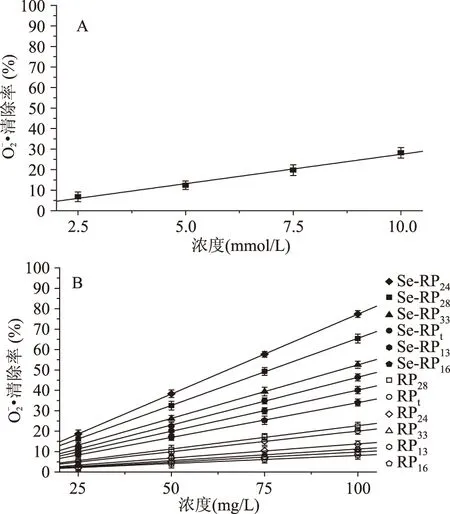
图6 不同物质对·的清除作用Fig.6 Scavenging effects of different chemicals on the ·
2.5RP和Se-RP对线粒体损伤的保护作用
为深入研究Se-RP的抗氧化活性,建立了VC/Fe2+诱导牛心线粒体损伤模型,检测Se-RP对损伤线粒体的保护作用。当线粒体发生损伤时,大量产生的OH·和H2O2攻击线粒体中的生物分子,导致线粒体的形态、结构改变和功能被破坏。由图7、图8可知,RP和Se-RP可以有效清除OH·和H2O2,对损伤线粒体的膨胀率及脂质过氧化产物MDA的产生均有一定的抑制作用,从而保护线粒体。结果发现Se-RP对损伤线粒体的保护作用明显高于RP,其中Se-RP24的作用最强,可推测化学修饰增加了蛋白中的供氢基团-SeH,极大的提高了蛋白提供氢质子的能力,有效终止自由基链式反应,起到了抑制自由基对机体损伤的目的。

图7 不同物质对线粒体膨胀的抑制作用Fig.7 Inhibition effects of different chemicals on swelling of mitochondria
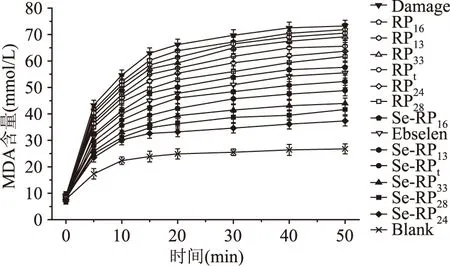
图8 不同物质对损伤线粒体中MDA含量的抑制作用Fig.8 Inhibition effects of different chemicals on MDA content in damaged mitochondria
3 结论
成功采用酶解法提取出RPt,并以化学修饰法将多种经Suphedex G-25凝胶层析分离的蛋白制备成Se-RP,经该法可在100 g大米原料中制备出约1 g的Se-RP。而且这套工艺操作简单、条件温和、对营养成分破坏低,并可提高蛋白溶解性和稳定性。
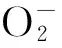
[1]Brahim AC,Addou S,Merzouk A,et al. Antigenicity of hydrolyzed rice formula in animal model(BALB/C MICE)[J]. Int J Pharm Pharm Sci,2014,6(9):352-354.
[2]Han S W,Chee K M,Cho S J. Nutritional quality of rice bran protein in comparison to animal and vegetable protein[J]. Food Chemistry,2015,172:766-769.
[3]石爱华,彭祚全,张妍艳,等.我国富硒大米的研究与开发[J].微量元素与健康研究,2015,32(1):31-32.
[4]Carey AM,Lombi E,Donner E,et al.A review of recent developments in the speciation and location of arsenic and selenium in rice grain[J].Anal Bioanal Chem,2012,402(10):3275-3286.
[5]Terry N,Zayed AM,De Souza MP,et al. Selenium in higher plants[J]. Annual Review of Plant Biology,2000,51(1):401-432.
[6]Mangiapane E,Pessione A,Pessione E. Selenium and selenoproteins:an overview on different biological systems[J]. Curr Protein Pept Sci,2014,15(6):598-607.
[7]Mugesh G,du Mont WW,Sies H.Chemistry of biologically important synthetic organo selenium compounds[J]. Chem Rev,2001,101(7):2125-2179.
[8]Krief A,Derock M. Synthesis of diselenides and selenides from elemental selenium[J]. Tetrahedron Lett,2002,43(16):3083-3086.
[9]Lin F,Liu L,Ni J. Selection,Expression and Purification of Human Abzyme Containing Selenium with Type I Thyroxine Deiodinase Activity[J]. Chem Res Chinese U,2011,27(4):619-622.
[10]Liu K,Zhao Y,Chen F,et al. Purification and identification of Se-containing antioxidative peptides from enzymatic hydrolysates of Se-enriched brown rice protein[J]. Food Chemistry,2015,187:424-430.
[11]Venuste M,Zhang X,Shoemaker CF,et al.Influence of enzymatic hydrolysis and enzyme type on the nutritional and antioxidant properties of pumpkin meal hydrolysates[J]. Food Funct,2013,4(5):811-820.
[12]Lowry OH,Rosebrough NJ,Farr AL,et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem,1951,193(1):265-275.
[13]Neilson KA,George IS,Emery SJ,et al. Analysis of rice proteins using SDS-PAGE shotgun proteomics[J].Methods Mol Biol,2014,1072:289-302.
[14]Wang C,Shen N,Yan GL,et al. The protective effect of a metallic selenopeptide with superoxide dismutase and glutathione peroxidase activities against alcohol induced injury in hepatic L02 cells[J]. Int J Pept Res Ther,2014,20(3):307-324.
[15]Klayman DL,Griffin TS. Reaction of selenium with sodium borohydride in protic solvents. A facile method for the introduction of selenium into organic molecules[J]. J Am Chem Soc,1973,95(1):197-199.
[16]Sanchez-Rodas D,Mellano F,Morales E,et al. A simplified method for inorganic selenium and selenoaminoacids speciation based on HPLC-TR-HG-AFS[J].Talanta,2013,106:298-304.
[17]Wilson SR,Zucker PA,Huang RRC,et al. Development of synthetic compounds with glutathione peroxidase activity[J]. J Am Chem Soc,1989,111(15):5936-5939.
[18]Azad GK,Singh V,Mandal P,et al.Ebselen induces reactive oxygen species(ROS)-mediated cytotoxicity in Saccharomyces cerevisiae with inhibition of glutamate dehydrogenase being a target[J]. FEBS Open Bio,2014(4):77-89.
[19]李佳南,王静,张慧娟,等.大米蛋白抗氧化肽的活性以及组成鉴定研究[J].食品工业科技,2013,34(23):53-57.
[20]Zuo LL,Wang ZY,Fan ZL,et al. Evaluation of antioxidant and antiproliferative properties of three Actinidia(Actinidiakolomikta,Actinidiaarguta,Actinidiachinensis)extractsinvitro[J]. Int J Mol Sci,2012,13(5):5506-5518.
[21]Sen Gupta S,Ghosh M.InVitroAntioxidative Evaluation ofα-andβ-Carotene,Isolated from Crude Palm Oil[J]. J Anal Methods Chem,2013,2013:351671.
[22]Lansman RA,Shade RO,Shapiro JF,et al.The use of restriction endonucleases to measure mitochondrial DNA sequence relatedness in natural populations. III. Techniques and potential applications[J]. J Mol Evol,1981,17:214-226.
[23]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Bio Chem,1976,72:248-254.
[24]Quinsay MN,Lee Y,Rikka S,et al.Bnip3 mediates permeabilization of mitochondria and release of cytochrome c via a novel mechanism[J]. J Mol Cell Cardiol,2010,48(6):1146-1156.
[25]Moukette BM,Pieme CA,Njimou JR,et al.Invitroantioxidant properties,free radicals scavenging activities of extracts and polyphenol composition of a non-timber forest product used as spice:Monodoramyristica[J].Biol Res,2015,48:15.
[26]Ibrahim M,Muhammad N,Naeem M,et al.Invitroevaluation of glutathione peroxidase(GPx)-like activity and antioxidant properties of an organoselenium compound[J]. ToxicolInVitro,2015,29(5):947-952.
[27]Li F,Lutz PB,Pepelyayeva Y,et al.Redox active motifs in selenoproteins[J].Proc Natl AcadSci U S A,2014,111(19):6976-6981.
Preparation of selenide rice proteins and their antioxidant activity
WANG Cheng,WANG Yue,SUI Chun-hong,LUO Jun,LI Yan,ZHANG Wei,JIN Yu-ji*
(School of Basic Medicine,Jilin Medical University,Jilin 132013,China)
Selenide rice proteins(Se-RP)were prepared via rice proteins obtained by enzymatic hydrolysis were chemically modified,then their antioxidant activities were identified. The results showed that Se-RPs possessed certain antioxidant activity of glutathione peroxidase(GPX),wherein GPX activity of Se-RP24was highest,approximately 116 U/g. Andvarious kinds of Se-RPs could play a scavenging role in free radical such as 1,1-diphenyl-2-three nitrophenylhydrazine(DPPH·),hydroxyl radical(OH·)and superoxide anion(O). Furthermore,Se-RP could effectively maintain the normal function of cardiac mitochondria,inhibit swelling of damaged mitochondria induced by ascorbic acid/divalent iron ions(VC/Fe2+),and decrease content of the lipid oxidation product MDA in mitochondria.Se-RP sobtained successfully laid the experimental foundations for large scale preparation of plant-derived selenide protein,and also provided new insight for the development of new albuminoidal antioxidant drugs.
rice protein;selenium;antioxidant activity
2015-10-26
王程(1979-),男,博士,副教授,研究方向:抗氧化剂研究与开发,E-mail:wangcheng1040@163.com。
金玉姬(1965-),女,博士,教授,研究方向:生殖系统氧化应激损伤,E-mail:yujijin901@163.com。
吉林省教育厅“十二五”科学技术研究项目(2015-405);吉林省科技厅科技发展计划自然科学基金项目(20150101131JC)。
TS201.1
A
1002-0306(2016)10-0165-07
10.13386/j.issn1002-0306.2016.10.025
