核桃青皮果蔬酵素的成分组成及体外抗氧化活性研究
2016-09-10赵声兰陈朝银
李 杰,赵声兰,陈朝银,*
(1.昆明理工大学,生命科学与技术学院,云南昆明 650500;2.云南中医学院中药学院,云南昆明 650500)
核桃青皮果蔬酵素的成分组成及体外抗氧化活性研究
李杰1,赵声兰2,陈朝银1,*
(1.昆明理工大学,生命科学与技术学院,云南昆明 650500;2.云南中医学院中药学院,云南昆明 650500)
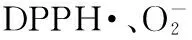
化学成分,活性酶,抗氧化功效,核桃青皮果蔬酵素
核桃青皮,作为核桃的一种主要废弃物,含有大量的没食子酸、胡桃醌、鞣质、α-氢化胡桃醌-4-葡萄糖苷、胡桃醌生物碱和萘醌等活性成分,具有抗自由基、抑菌、镇痛、抗肿瘤等功效[1],在民间被广泛用于治疗癌症,配制药酒和利口酒等。在植物酵素研究如火如荼的背景下,将核桃青皮经微生物发酵制成核桃青皮酵素,是核桃产业颇具前景和新意的方向,同时,也将显现出其优良的环保和经济价值。酵素中含有丰富的矿物质、维生素、低聚糖、多酚、黄酮、酶和次生代谢产物等营养成分,具有美白抗氧化、抗菌消炎、润肠通便、解酒护肝、增强机体免疫力、修复机体损伤等保健功能[2-7]。淀粉酶、脂肪酶、蛋白酶和超氧化物歧化酶是植物酵素的主要功效酶[8],因此微生物酵素还具有助消化、降脂减肥、抗自由基的功效。探究核桃青皮果蔬酵素的化学组成、功能成分和抗氧化活性,对于开发优质酵素和科学评估酵素质量具有一定的指导意义。
1 材料与方法
1.1材料与仪器
乙二胺四乙酸(EDTA)、没食子酸、芦丁、硫辛酸、抗坏血酸(VC)、原花青素、福林酚、邻菲咯啉、1,1-二苯基-2-三硝基苯肼(DPPH)、2,6-二溴苯醌氯亚胺(DBQC)西格玛奥德里奇贸易有限公司;乙醇、盐酸、葡萄糖、碳酸钠、硝酸铝、香草醛、氯化铁分析纯,天津市风船化学试剂科技有限公司;蛋白试剂盒、淀粉酶试剂盒、矿物质(钾、钠、镁、铁、钙、锌、磷、氯)试剂盒长春汇力生物技术有限公司;超氧化物歧化酶(SOD)试剂盒南京建成生物工程研究所;核桃青皮云南省漾濞彝族自治县;果蔬云南省昆明市呈贡新区尚优玛特超市。
紫外分光光度计Amersham Biosciences公司;Multiskan Mk3型酶标仪赛默飞世尔仪器有限公司;半自动生化分析仪吉林维尔医疗器械有限公司;电子分析天平上海天平仪器厂;电子恒温水浴锅郑州长城科工贸有限公司;pH计上海精密仪器仪表有限公司;涡旋振荡器上海纳兹仪器有限公司。
1.2实验方法
1.2.1核桃青皮果蔬酵素制备的主要流程

1.2.2化学成分分析总糖含量测定采用蒽酮硫酸法[9],通过葡萄糖标曲回归方程(y=6.375x-0.0249,R2=0.9969)计算;酸度测定采用电位滴定法[10],以酒石酸计量;可溶性固形物测定按照GB 12295-1990《水果、蔬菜制品可溶性固形物含量测定》;蛋白质含量测定使用蛋白质试剂盒,测定步骤按说明书进行;矿物质(钾、钠、镁、铁、钙、锌、磷)含量测定使用相应试剂盒,测定步骤按说明书进行。
1.2.3功效酶活性测定
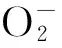
式中:A样品为不加ddH2O和Dilutionbuffer的吸光值;A空白1为不加样品液和Dilutionbuffer的吸光值;A空白2为不加样品液和酶工作液的吸光值;A空白3为不加ddH2O和酶工作液的吸光值。
SOD活力(U/mL)=SOD抑制率÷50%×反应体系稀释倍数×样品测试前稀释倍数
1.2.3.2淀粉酶活性测定采用碘-淀粉比色法:按照淀粉酶测定试剂盒说明书在半自动生化分析仪上进行。
1.2.4主要抗氧化成分分析
1.2.4.1总酚含量测定总酚含量采用改良的Folin-Ciocaltu比色法测定[12],没食子酸为标准品。移取1mL样品液与5mL超纯水和2.5mL10%Folin-Ciocaltu试剂混合,混匀静止3min后加入1mL12%碳酸钠溶液,最后用超纯水定容至25mL,45 ℃水浴反应0.5h,在696nm处测定吸光值,整个实验过程避光操作。总酚含量通过没食子酸标曲回归方程(y=0.07243x-0.00091,R2=0.99967)计算。
1.2.4.2总黄酮含量测定总黄酮含量采用NaNO2-Al(NO3)3比色法测定[13],芦丁为标准品。2mL样品液与3mL超纯水、0.3mL5%的NaNO2充分混匀,静置反应6min后,加入0.3mL10%AlNO3,再静置反应6min,加入4mL4%的NaOH溶液和0.4mL30%乙醇,充分混匀,室温静置15min,在510nm处测吸光值。总黄酮含量通过芦丁标曲回归方程(y=12.93x-0.0123,R2=0.9996)计算。
1.2.4.3VC含量测定VC含量采用紫外分光光度法测定[14],基于VC对碱的不稳定性。碱处理前:1mL样品液与2mL10%盐酸混合,然后用超纯水稀释至50mL,在243nm处测吸光值;碱处理后:1mL样品液与10mL超纯水和4mLNaOH(1mol/L)混匀,静置反应20min,加入4mL10%盐酸,最后用超纯水定容至50mL,在243nm处测吸光值。VC含量以碱处理前后的吸光度差值代入标曲回归方程(y=0.1108x+0.0013,R2=0.999)并结合下式计算:
式中:C为依标准曲线计算得到的VC浓度;V总为样品液定容总体积;V1为测吸光度时吸取样品液体积。
1.2.4.4总花青素测定总花青素含量采用香草醛-盐酸法测定[15],原花青素为标准品。实验中,显色剂由等体积的2%香草醛和20%的盐酸配制。1mL样品液与5mL显色剂混合,30 ℃水浴反应8min,在496nm处测吸光值。总花青素含量通过原花青素标曲回归方程(y=0.0017x+0.0049,R2=0.9928)计算。
1.2.5核桃青皮果蔬酵素的抗氧化活性
1.2.5.1核桃青皮果蔬酵素对DPPH·清除作用2.0mL样品液与2.0mLDPPH溶液(0.1mol·L-1于乙醇中)混匀,暗室静置反应30min,在517nm处测吸光值[16]。DPPH·清除率用下式计算:

式中:A1为DPPH+样品液的吸光值:A0为样品液+乙醇的吸光值;A2为DPPH+乙醇的吸光值。
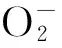
式中:A1为不加样品液的吸光值;A2为超纯水代替邻苯三酚的吸光值;A3为加样品液的吸光值。
1.2.5.3核桃青皮果蔬酵素对·OH清除作用1 mL邻菲咯啉(0.75 mmol/L)、3.8 mL磷酸盐缓冲液(0.2 mol/L,pH7.4)和1.5 mL Fe2SO4(0.75 mmol/L)混匀,而后1 mL样品液和1 mL 0.01% H2O2加入到该混合物中,37 ℃水浴反应60 min,在536 nm处测吸光值[18]。·OH清除率通过下式计算:
式中:A1为样品的吸光值;A2为不加样品的吸光值;A3为不加样品和H2O2的吸光值。
1.2.5.4核桃青皮果蔬酵素的总抗氧化性总抗氧化能力由钼酸铵还原法测定[19],VC做参照。1 mL样品液与1 mL反应试剂(4 mmol/L钼酸铵,0.6 mol/L H2SO4和28 mmol/L Na3PO3)混匀,90 ℃水浴反应90 min,待冷却至室温后,在695 nm处测吸光值。
1.2.5.5核桃青皮果蔬酵素的还原力VC作参照,1 mL样品液与2.5 mL磷酸盐缓冲液(0.2 mol/L,pH6.6)、2.5 mL 1% K3Fe(CN)6混合,50 ℃水浴反应20 min后,加入2.5 mL 10%三氯乙酸终止反应。然后3000×g离心10 min,取2.5 mL上清液与2.5 mL超纯水、0.5 mL 0.1% FeCl3混合,静置反应10 min后在700 nm处测吸光值[20]。
1.2.5.6核桃青皮果蔬酵素的金属螯合能力EDTA作参照。取1 mL样品液与0.5 mL FeCl2(1.0 mmol/L)混合,充分混匀后,加入1 mL菲洛嗪(5.0 mmol/L)并用超纯水定容至5 mL,静置反应10 min,在562 nm处测吸光值[21]。核桃青皮果蔬酵素金属螯合能力通过下式计算:
式中:A为加样品吸光值;A0为不加样品的吸光值。
1.2.6数据分析每个样品设3个平行,采用Origin Pro8.0和Excel 2013软件进行数据分析。成分测定结果以平均值±相对标准偏差表示。抗氧化活性测定结果以平均值表示。
2 结果与分析
2.1化学成分、功效酶活、主要抗氧化成分分析结果
核桃青皮果蔬酵素基本成分分析结果见表1。由表1可知,核桃青皮果蔬酵素的可溶性固形物、酸度和总糖含量分别为29.3%、1.959%和11.8 mg/mL,据贾丽丽报道冬枣酵素的可溶性固形物和酸度含量分别为7.97%和0.4%[22],可看出核桃青皮果蔬酵素的可溶性固形物和酸度均高于冬枣酵素,通过感官品尝,核桃青皮果蔬酵素液酸甜适口,伴有浓郁的果醋香,这显示了酵素良好食用特性。核桃青皮果蔬酵素的总蛋白含量为39.0 mg/mL,是树莓酵素总蛋白含量的10倍多[23],可以看出核桃青皮果蔬酵素是蛋白质摄取的不错来源。由2013版《中国居民膳食营养素参考摄入量(DRIs)》可知,K、Na、Ca、P、Mg、Cl是需要量较多的宏量元素,Fe和Zn是需要量较少的微量元素,其中K、Na、Ca、P、Mg、Fe、Zn的推荐摄入量(RNIs)分别为2000、2200、800、700、350、15~20、11.5~15.5 mg/d。由表2看出,核桃青皮果蔬酵素含有这8种矿物元素,且宏量元素K、Na、Ca、P、Mg的含量相较微量元素Fe、Zn更为丰富,可作为矿物质摄取较为全面的理想来源。
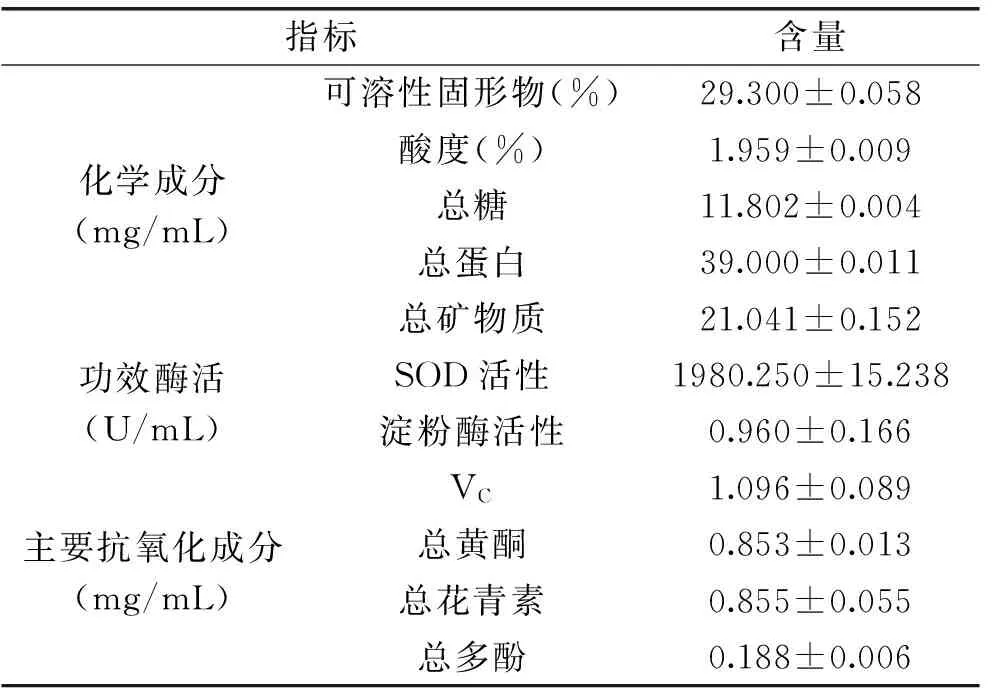
表1 核桃青皮果蔬酵素化学成分、功效酶活、主要抗氧化成分分析结果

用WST-1法测定了核桃青皮果蔬酵素中SOD活性,当浓度为10%时,抑制率达到了95.6%,由稀释倍数算出酵素内SOD活性达到1980.25 U/mL,淀粉酶活性为0.96 U/mL。据报道火龙果酵素内SOD和淀粉酶活性分别为300 U/mL和33.2 U/mL[8],可看出核桃青皮果蔬酵素相比火龙果酵素发酵具有更强的SOD活性和较低的淀粉酶活性,这显示核桃青皮果蔬酵素具有更优的清除自由基能力,同时也有一定的助消化功效。

表2 核桃青皮果蔬酵素矿物质成分分析结果
由表1可以看出,核桃青皮果蔬酵素的4种主要抗氧化成分中,VC、总黄酮和总花青素含量相比总多酚较高,分别达到了1.096、0.853和0.855 mg/mL,其总黄酮含量与冬枣酵素的总黄酮含量相当[22]。然而,总多酚含量仅为0.188 mg/mL,远远小于葡萄酵素的多酚含量[2],可能是由于发酵过程中多酚与其他大分子物质结合成了大分子复合物。
2.2核桃青皮果蔬酵素的抗氧化功效
Table 3IC50values of walnut green husk fruit and vegetable
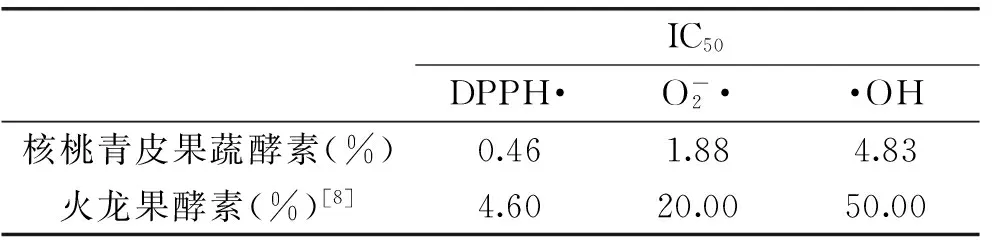
IC50DPPH·O-2··OH核桃青皮果蔬酵素(%)0.461.884.83火龙果酵素(%)[8]4.6020.0050.00
DPPH·以氮为中心,是短时间内评判物质抗氧化活性较为稳定和广泛的方法[24]。不同浓度的核桃青皮果蔬酵素对DPPH·清除率见图1。由图1看出,随着浓度的增加,清除率逐渐增大。1%的核桃青皮果蔬酵素对DPPH·清除率达到93.62%,与董银卯报道的10%的火龙果酵素对DPPH·清除率相当[8],这表明核桃青皮果蔬酵素对DPPH·具有更强的清除能力,分析原因可能是由于核桃青皮果蔬酵素中VC、黄酮、总花青素和多酚协同作用的结果。
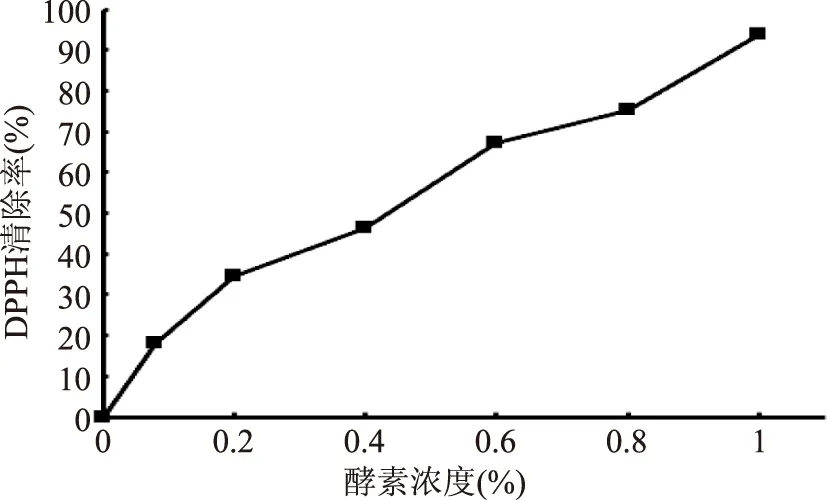
图1 不同浓度的核桃青皮果蔬酵素对DPPH·的清除能力Fig.1 Scavenging activity of the walnut green husk fruit and vegetable compound ferment on DPPH· at different concentration

图2 不同浓度的核桃青皮果蔬酵素对·自由基的的清除能力Fig.2 Scavenging activity of the walnut green husk fruit and vegetable compound ferment on · radicals at different concentration

图3 不同浓度的核桃青皮果蔬酵素对·OH自由基的的清除能力Fig.3 Scavenging activity of the walnut green husk fruit and vegetable compound fermenton ·OH radicals at different concentration
2.2.2核桃青皮果蔬酵素的总抗氧化性总抗氧化性的测定是基于抗氧化剂可使Mo(Ⅵ)还原为Mo(Ⅴ),并在酸性条件下产生绿色Mo(V)的磷酸盐。以吸光值评价总抗氧化性,吸光值越大表示总抗氧化性越强。从图4得出,核桃青皮果蔬酵素浓度为3.5%时,其吸光值为0.248。140 μg/mL VC吸光值为0.528,2.5%的核桃青皮果蔬酵素的总抗氧化性约相当于20 μg/mL VC的总抗氧化性。
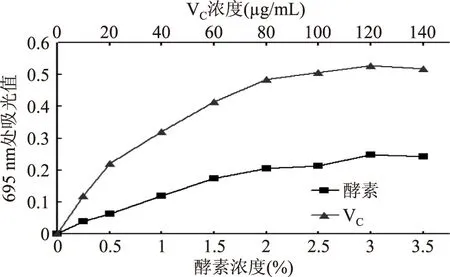
图4 不同浓度的核桃青皮果蔬酵素和VC的总抗氧化性Fig.4 Total antioxidant activity values ofthe walnut green husk fruit and vegetable compound ferment and VC at different concentration
2.2.3核桃青皮果蔬酵素的还原力从还原力测定结果(图5)可知,核桃青皮酵素和VC的还原力均表现出浓度依赖效应,两者的还原力均随浓度的增加而增大。核桃青皮果蔬酵素浓度为7%时,其吸光值为0.766。140 μg/mL VC吸光值为0.778,可见,7%的核桃青皮果蔬酵素还原力与140 μg/mL VC的还原力近似相当。

图5 不同浓度的核桃青皮果蔬酵素和VC的还原力Fig.5 Reducing power values of the walnut green husk fruit and vegetable compound ferment and VC at different concentration
2.2.4核桃青皮果蔬酵素的金属螯合能力过渡金属作为反应催化剂的活性中心,可通过抑制其与催化剂底物的结合来达到抗氧化作用。核桃青皮果蔬酵素对Fe2+的螯合作用见图6。从图6中看出,EDTA浓度在10~70 μg/mL时,其对Fe2+的螯合作用在21.68%~92.17%。而核桃青皮果蔬酵素原液对Fe2+的螯合作用最大仅为8.4%,由此看出桃青皮果蔬酵素的金属螯合能力较差。

图6 不同浓度的核桃青皮果蔬酵素和EDTA对Fe2+的螯合作用Fig.6 The chelating activity for the walnut green husk fruit and vegetable compound ferment and EDTA to Fe2+ at different concentration
3 结论
[1]仲军梅,刘玉梅. 核桃青皮的开发利用研究进展[J]. 食品工业科技,2014,35(19):396-400.
[2]蒋增良,毛健卫,黄俊,等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报,2014,14(10):29-34.
[3]董银卯,于晓艳,潘妍,等. 微生物酵素抑菌功效研究[J]. 香料香精化妆品,2008(4):27-29.
[4]赵金凤,曲佳乐,皮子凤,等. 植物酵素润肠通便保健功能研究[J]. 食品与发酵科技,2012,48(3):54-56.
[5]曲佳乐,赵金凤,皮子凤,等. 植物酵素解酒护肝保健功能研究[J]. 食品科技,2013,38(9):51-54.
[6]赵金凤,宿秀芹,曲佳乐,等. 敖东酵素对披淋巴细胞增殖作用的影响[J]. 食品与发酵科技,2014,50(3):50-52.
[7]蔡爽. 人参术苓酵素的制备及改善肠胃功能研究[D]. 长春:吉林大学,2013.
[8]董银卯,何聪芬,王领,等. 火龙果酵素生物活性的初步研究[J]. 食品科技,2009(3):192-196.
[9]廖夫生,韦国兵. 栀子中总糖的含量测定研究[J]. 广州化工,2013,40(24):116-117.
[10]李艳霞,宣亚文,秦珠红,等. 自动电位滴定法测定红葡萄酒总酸度[J]. 周口师范学院学报,2007,24(2):73-74.
[11]Peskin A V,Winterbourn C C. A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt(WST-1)[J]. Clinica Chimica Acta,2000,293(2):157-166.
[12]Medina-Remón A,Barrionuevo-González A,Zamora-Ros R,et al. Rapid Folin-Ciocalteu method using microtiter 96-well plate cartridges for solid phase extraction to assess urinary total phenolic compounds,as a biomarker of total polyphenols intake[J]. Analytica Chimica Acta,2009,634(1):54-60.
[13]陈建国,李雪,李金霞,等. 西沙诺尼果汁总皂苷含量的测定[J]. 安徽农业科学,2014,42(27):9525-9526.
[14]孙荣欣,杨灵. 黄瓜中 VC含量测定的方法研究[J]. 农产品加工:学刊(下),2014(5):61-62.
[15]姚开,何强. 葡萄籽提取物中原花青素含量的测定[J]. 食品与发酵工业,2002,28(3):17-19.
[16]Islam F,Quadery T M,Chowdhury S R,et al. Antioxidant and cytotoxic activities ofMussaendamacrophylla[J]. Bangladesh Pharm J,2012,15(1):69-71.
[17]Hu T T,Liu D,Chen Y,et al. Antioxidant activity of sulfated polysaccharide fractions extracted fromUndariapinnitafidainvitro[J]. International Journal of Biological Macromolecules,2010,46(2):193-198.
[18]Chen N,Yang H M,Sun Y,et al. Purification and identification of peptides from walnut(JuglansregiaL.)protein hydrolysates[J]. Peptides,2012,38(2):344-349.
[19]Chaouche T M,Haddouchi F,Ksouri R,et al. Antioxidant activity profiling by spectrophotometric methods of phenolic extract of Prasium majus L[J]. Free Radicals and Antioxidats,2013,3(1):43-46.
[20]Lue B M,Nielsen N S,Jacobsen C,et al. Antioxidant properties of modified rutin eaters by DPPH,reducing power,iron chelation and human low density lipoprotein assays[J]. Food Chemistry,2010,123(2):221-230.
[21]Wang L L,Xiong Y L. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry,2005,53(23):9186-9192.
[22]贾丽丽,冀利,孙曙光,等. 冬枣酵素发酵过程中生物学特性和抗氧化活性研究[J]. 食品与发酵科技,2014,50(4):30-33.
[23]蒋增良. 天然微生物酵素发酵机理,代谢过程及生物活性研究[D]. 杭州:浙江理工大学,2013.
[24]Sroka Z,Cisowski W. Hydrogen peroxide scavenging,antioxidant and anti-radical activity of some phenolic acids[J]. Food and Chemical Toxicology,2003,41(6):753-758.
[25]Siriwardhana S S K W,Shahidi F. Antiradical activity of extracts of almond and its by-products[J]. Journal of the American Oil Chemists Society,2002,79(9):903-908.
Chemical composition andinvitroantioxidant properties of walnut green husk fruit and vegetable compound ferment
LI jie1,ZHAO Sheng-lan2,CHEN Chao-yin1,*
(1.Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China;2.Faculty of Chinese Traditional Medicine,Yunnan University of Chinese Traditional Medicine,Kunming 650500,China)
Using the walnut green husk,fruit and vegetable as raw materials,the ferment of walnut green husk with fruits and vegetables was made through twice fermentation and filtration. In this study,chemical composition,bioactive enzymes and the major antioxidant components of the ferment were determined,and simultaneously antioxidant activities was investigated. The results indicated that the content of soluble solids,acidity,total sugar and protein in the ferment of walnut green husk with fruit and vegetable were 29.300%,1.959%,11.802 mg/mL and 39.000 mg/mL,respectively. After fermentation,the ferment of walnut green husk with fruit and vegetable became mellow,with a sweet-sour flavor. Moreover,the ferment was rich in the species of minerals which showed K>Cl>Mg>Na>Ca>P>Fe>Zn. SOD activity reached 1980.250 U/mL,while the activity of amylase was lower. The major antioxidant components had different levels with a descending amount of ascorbic acids,proanthocyanidin,total flavonoids and total polyphenol,the content of total flavonoids was similar to winter-jujube ferment,while the content of total polyphenol was far below the grape ferment. In addition,compared with pitaya ferment,the ferment of walnut green husk with fruit and vegetable possessed higher anti-free radical activity,at the same time showed good reducing power,total antioxidant capacity and poor metal ion-chelating activity.
chemical composition;bioactive enzymes;antioxidant activities;ferment of walnut green husk with fruit and vegetable
2015-09-08
李杰(1989-),女,硕士研究生,研究方向:食品生物技术与工程,E-mail:s2009140347@163.com。
陈朝银(1948-),男,教授,研究方向:云南特色优势生物资源的研究与开发,E-mail:13700693357@163.com。
科技部支撑计划项目(2011BAD46B00);国家自然科学基金(21466037);云南教育厅科技重大专项(ZD2014009)。
TS201.2
A
1002-0306(2016)10-0117-06
10.13386/j.issn1002-0306.2016.10.014
