流化床与沸腾床内部微生物群落演变与分析
2016-09-10丁逸宁韦朝海吴海珍林柱东
丁逸宁,韦朝海,吴海珍,林柱东
(1.华南理工大学环境与能源学院,广东广州510006;2.华南理工大学生物科学与工程学院,广东广州510006)
流化床与沸腾床内部微生物群落演变与分析
丁逸宁1,韦朝海1,吴海珍2,林柱东1
(1.华南理工大学环境与能源学院,广东广州510006;2.华南理工大学生物科学与工程学院,广东广州510006)
用流化床反应器和沸腾床反应器处理焦化废水,对两种反应器运行效能及微生物群落变化进行对比研究。结果表明,提高污泥负荷后流化床COD去除率优于沸腾床反应器。提高进水污泥负荷对沸腾床内微生物的冲击更大,致使其种群丰富程度下降明显。研究结果证明,流化床在宏观去除率、维持菌种丰富度方面具有较大优势。
流化床;沸腾床;微生物群落
流化床是目前国内外一致公认的高效有机废水生物处理技术。生物流化床内污泥在气体的冲击下处于良好的流化态,加速了有机污染物由废水中向微生物内的传质过程,使得污泥能够保持高活性,因此可以承受较高的负荷〔1〕。相比于流化床,沸腾床反应器内部未设置导流筒,污泥呈沸腾状。
反应器的处理效率与其内部微生物群落结构和丰富程度有着密切的联系〔2-3〕。微生物种群丰富意味着其内部贮存着可以在不同环境下生长、具有不同特性的微生物,因此可以抵抗环境的剧烈变化。微生物种群丰富强化了其对特定功能的保持以及对冲击负荷的快速恢复能力,同时丰富了能源利用途径〔4〕。影响生物处理工艺中微生物群落结构的因素包括污泥龄〔5〕、毒性物质〔6〕、温度〔7〕、溶解氧〔8〕等。
笔者将自行研制的高效新型三相生物流化床组合工艺应用于宝钢集团广东韶钢焦化厂焦化废水的工程处理,实现了较好的处理效果和良好的经济效益。该生物流化床反应器是将流化态技术和活性污泥法相结合,COD有机负荷达到4.5 kg/(m3·d)以上,远高于普通活性污泥法。目前针对流化床的研究主要集中在废水处理效果、反应器设计、宏观传质性能方面以及利用计算流体力学(CFD)技术解析流体力学特性等,文献中没有发现针对流化床与微生物驯化和培养之间关系的研究报道。生物流化床内良好的传氧和传质条件有利于微生物的生长和代谢,微生物在流化床内有序循环的污泥流态下得到驯化,而沸腾床内部污泥作无序运动,两种反应器对微生物的培养和驯化会有所差异。笔者选取流化床和沸腾床反应器作为研究对象。实验以焦化废水作为实际运行废水,在相同运行条件下对比两种反应器的运行效果及其内部微生物群落结构的变化。探究此差异有利于深入理解流化床反应器在微生物培养方面的特性。通过对两种反应器内部微生物群落结构的对比分析,从微生物层面展示流化床的优越性能,初步探索反应器内部结构对微生物群落的影响,为将来通过反应器的优化设计实现微生物种群丰度的调控和微生物强化提供参考。
1 实验部分
1.1实验污泥和原水的采集
实验所用的废水与活性污泥均采自宝钢集团广东韶钢焦化厂酚氰废水处理站,该废水处理站的工程始建于2004年,处理水量为70~80m3/h。实验废水采自该处理站集水调节池,废水pH=9.64、COD 2 360mg/L、氨氮61.7mg/L、氰化物16.1mg/L、硫氰化物544mg/L。从一级好氧池底部排泥口采集活性污泥,接种污泥SV 53.0%、SVI65mL/g、MLSS 8 203 mg/L、MLVSS 5 332mg/L、MLVSS/MLSS=0.65。污泥取回后先闷曝24 h。
1.2实验装置与运行方式
实验装置如图1所示。
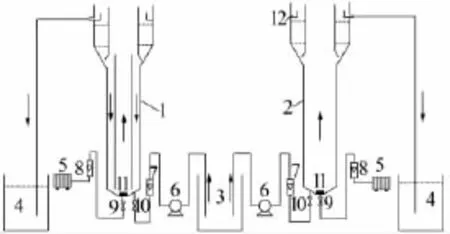
图1 流化床与沸腾床运行装置
流化床和沸腾床均为圆柱形,由有机玻璃加工而成,有效体积均为7.9 L,两个反应器外部尺寸相同。流化床为内循环式,内部设置导流筒,依靠空气提升力实现三相的流态化。沸腾床内部未设置导流筒。水流方向如箭头所示,正常运行后流态稳定。采用蠕动泵将实验废水从反应器底部泵入,在顶部分离区实现泥水分离,出水从顶部自然排出。
反应器在常温下运行,温度为(23±2.0)℃,DO控制在2~3mg/L,pH控制在6~8。同时启动两台反应器,首先采用序批式培养方法,将接种污泥投加入反应器中,接种量为反应器容积的20%,添加实验废水后闷曝23 h,静置1 h,然后排出约占反应器1/4体积的上清液,用实验废水补足,该过程持续7 d。然后采用动态培养方法驯化污泥,连续进水,并逐步增加废水浓度,直至满负荷运行,该过程持续7 d。两台反应器均采用连续进水的方式,控制其水力停留时间为36 h,运行过程中MLSS为3 000~3 700mg/L,投加K2HPO4(0.2 g/L)作为磷源。反应器正常运行分为两个阶段,第一阶段进水采用按1∶1的比例稀释焦化废水获得的实验废水,共运行45 d,该阶段进水COD、氨氮、硫氰化物平均质量浓度分别为1 050、25、263mg/L,污泥负荷(以COD/MLSS计,下同)为0.21~0.23 kg/(kg·d)。第二阶段进水采用焦化废水原水,共运行48 d,该阶段进水COD、氨氮、硫氰化物平均质量浓度分别为2 410、57、537mg/L,污泥负荷为0.54~0.58 kg/(kg·d)。
1.3测试方法
对进出水COD、氨氮、硫氰化物进行检测,以此来考察反应器宏观运行效能。pH的测定采用电极法,COD的测定采用重铬酸钾法,氨氮的测定采用纳氏试剂比色法,硫氰化物的测定采用铁离子显色分光光度法〔9〕,MLSS的测定采用重量法。
1.4微生物群落结构分析
1.4.1基因组DNA的提取
使用Ezup柱式土壤基因组DNA抽提试剂盒(上海生工)提取样品DNA。取100.0mg污泥样品,通过Buffer SCL裂解,释放基因组DNA,然后通过Buffer SP和氯仿去除蛋白质的干扰。抽提获得的DNA样品贮存于-20℃冰箱,用于后续PCR扩增。DNA样品用1.5%琼脂糖凝胶进行检测。通过测定在260 nm/280 nm和260 nm/230 nm下的吸光度来确定样品DNA浓度,由此保证PCR及变性梯度凝胶电泳(DGGE)中所添加DNA模板浓度一致。
1.4.2PCR扩增
总细菌的PCR扩增采用对大多数细菌和古细菌16SrDNA基因V3区都具有特异性的引物对F341-GC(5′-CGCCCGCCGCGCGCGCGGGCGGGGGCGGG GGCACGGGGGGCCTACGGGAGGCAGCAG-3′)和R534(5′-ATTACCGCGGCTGCTGG-3′)〔10〕。反应采用50μL体系:2μLDNA模板,2μL上游引物,2μL下游引物,25μLTaq PCRMasterMix,19μL无核酸双蒸水。PCR反应的产物用1.5%琼脂糖凝胶进行检测。
1.4.3变性梯度凝胶电泳(DGGE)
采用Bio-rad公司Dcode突变检测系统对PCR反应产物进行分离,凝胶质量分数为8%,变性剂质量分数为30%~60%,温度60℃,在60 V的电压下电泳12 h。结束后,将凝胶进行银染,待条带出现后拍照,在凝胶成像系统上成像检测,获得DGGE图谱。随后用75%酒精消毒后的手术刀切下DGGE凝胶条带,回收保存于200μL薄壁管,送至生工生物工程(上海)股份有限公司进行克隆测序。将测序结果进行处理后提交到GenBank数据库,采用BLAST进行目标序列和基因库中所含序列的相似性分析,得到同源性最近的序列。
1.4.4DGGE图谱条带分析
利用Quantity One软件对DGGE图谱中条带的位置以及强度进行模拟分析,得到各条带的波峰面积。利用Shannon指数(H)来评价污泥样品的微生物丰富程度〔11〕。
2 结果与讨论
2.1反应器运行效能比较
反应器出水效果如图2、图3所示。
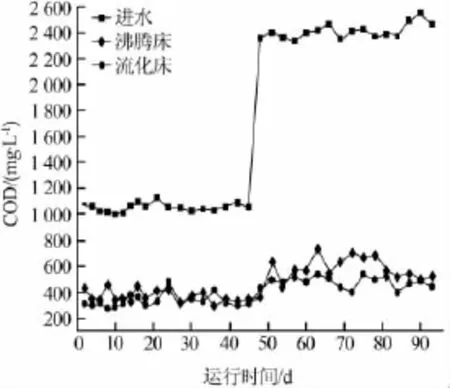
图2 反应器出水COD变化
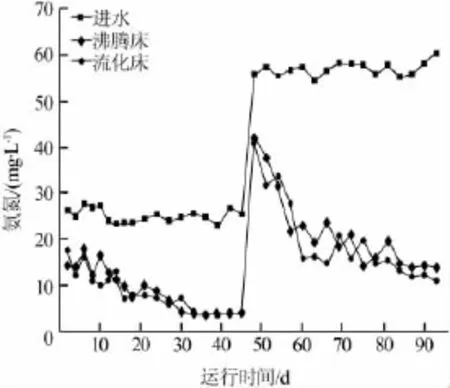
图3 反应器出水氨氮变化
第一阶段流化床的COD、氨氮平均去除率为70%、71%,沸腾床的COD、氨氮平均去除率为69%、67%,两种反应器差别较小。第二阶段污泥负荷提高为0.54~0.58 kg/(kg·d)时,两种反应器COD去除率均有所升高,但流化床COD平均去除率为81%,较之沸腾床的73%提高得更多些。第二阶段COD去除率升高的主要原因为第一阶段反应器污泥负荷较低,有机物过少,活性污泥长时间处于贫营养状态下,提高负荷后有机物充足,污染物得到高效降解。
第一阶段和第二阶段进水硫氰化物平均质量浓度分别为263、537mg/L,两个反应器在整个运行过程中出水硫氰化物质量浓度均降到了2mg/L以下。在运行初期,由于废水中氰化物、硫氰化物被氧化为氨氮,同时有机氮发生形态改变〔12〕,因此出水的氨氮较高。此阶段异养菌对碳源的竞争使得硝化细菌的生长受到抑制。在低负荷条件下硝化细菌繁殖迅速,在反应器运行20 d后硝化作用明显增强,氨氮质量浓度降至5mg/L以下。在提高污泥负荷后,氨氮依旧呈现先升高后降低的趋势,两种反应器的出水氨氮浓度差异不大,流化床略好于沸腾床。
2.2反应器内部微生物群落结构变化
将PCR扩增产物进行变性梯度凝胶电泳分离,DGGE图谱如图4所示。图中M代表Marker。

图4 反应器污泥样品DGGE图谱
根据DGGE技术原理,图谱中分离出来的条带都是不同种类的微生物16S rDNA基因V3区的DNA片段,每个条带原理上可以代表一个微生物菌属,条带信号强度越大表示该细菌在污泥中的优势地位越大,因此可以认为该DGGE图谱显示了反应器内细菌种群的演变和更替〔13〕。
根据条带的变化情况可以将主要条带所代表的细菌种类大致分为五类。第一类为在整个运行过程中始终保持稳定的、占优势地位的顶级优势菌属,如Band L24、L25、F3、F5,其所代表的微生物对反应器的运行环境有很强的适应能力,即使在高污泥负荷的冲击下依然保持优势地位,对于反应器的稳定运行、生物处理能力的提高起着至关重要的作用。第二类为整个运行过程中始终存在但不占优势的菌属,如Band L1、L21、F2、F4。其所代表的微生物丰度虽然较低,但不受运行污泥负荷和有毒物质浓度的影响,虽不占优势地位但对反应器的稳定运行同样起到了重要作用。第三类为反应器运行初期存在,后期逐渐消失的菌属,如Band L4、L6、F12、F13。这类微生物的生长对反应器进水水质和运行条件等环境的变化较为敏感。它们在低污泥负荷下发挥着重要的作用,但随着污泥负荷以及毒性物质浓度的升高逐渐被淘汰。此类微生物在沸腾床反应器中所占的比例较高,以至于沸腾床反应器在运行后期微生物种类减少较为明显。第四类为当进水浓度升高其丰度逐渐提高的菌属,如Band L10、L14、L19。这类微生物在正常运行状态下稳定生长,较高的有机物刺激了这类微生物的生长,进而演变为占优势的菌属。第五类为异常行为的菌属,例如Band L2、L3、F19、F23。图5显示了DGGE图谱中各类菌属条带数所占比例,流化床与沸腾床在第三类和第四类菌属上差异较大,表明沸腾床中在运行后期逐渐消失的菌属所占的比例较高,而流化床在运行后期丰度逐渐提高的菌属比例高于沸腾床,污泥负荷的提高对流化床内部微生物生长的刺激作用更为明显。
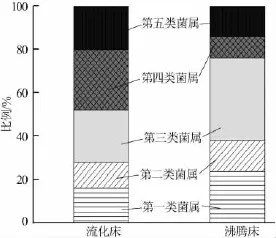
图5 DGGE图谱中各类菌属条带数所占比例
微生物群落Shannon指数如图6所示。
两个反应器在第一阶段运行过程中微生物种群丰富程度变化不大,但提高污泥负荷以后,多环芳烃和氰化物等毒性物质的浓度相应增加,部分微生物难以抵抗特征污染物浓度变化而逐渐消失,此现象在沸腾床反应器中尤为明显。因此,反应器运行后期Shannon指数有所下降。在其他运行条件相同的情况下,两种反应器内部微生物群落结构的差异主要是由污泥的流态和混合程度造成的。再提高进水污泥负荷对沸腾床内微生物种群的冲击更大,致使其种群丰富程度下降较大,第52天时Shannon指数为1.38,提高进水负荷后,第62天Shannon指数降为1.17,这预示着其内部微生物种群数目在减少。第二阶段后期,总细菌Shannon指数均有所升高,表明微生物逐渐适应高浓度废水,微生物种群数目增多。
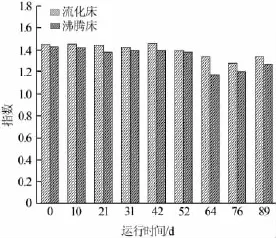
图6 总细菌Shannon指数
运用quantityone软件分析流化床反应器和沸腾床反应器DGGE图谱各泳道的相似性,结果表明,随着反应器的运行,内部微生物群落结构在不断发生变化,运行后期反应器中的微生物群落结构与接种污泥的相似性系数不断降低。反应器运行第二阶段相似性降低尤为明显。流化床反应器第89天时污泥样品的相似性为55.1%,而沸腾床反应器第89天时污泥样品的相似性仅为34.4%。由此可以看出,沸腾床内部微生物群落结构变化更大,初步推出该反应器抗冲击负荷的能力相对较弱,主要是由污泥的分配不均所造成的。沸腾床内污泥受水流冲击做无序运动,污泥多集中于反应器下部和中部,反应器顶部污泥浓度较低。污泥分配不均匀影响传质效率,从而影响微生物生长。
3 两种反应器内部微生物群落结构对比及种群鉴定
对反应器第一阶段末期和第二阶段末期的污泥样品进行DGGE图谱分析,并将图谱中条带切胶处理后测序,所得结果提交到BLAST在NCBI基因库中进行检索,获得条带所对应的菌种同源性信息,对比结果显示:经测序鉴定与Band 2同源性最高的是Uncultured Thiobacillus sp.clone PII12A,该菌种属于硫化细菌,能将还原态硫化物氧化为硫酸盐。第一阶段污泥负荷较低,废水中有机物较少。微生物由于碳源受限,少部分异养菌活性受到抑制不能够进行正常的代谢及增殖,从而导致两种反应器内种群数量减少。硫化细菌是专性化能自养菌,低负荷条件下更有利于其生长,而当进水浓度增加后逐渐消失,未出现在泳道D和E中。Band 4与Uncultured Methyloversatilis sp.clone NBA-11的同源性达到99%,该菌种是从农药厂废水处理池的活性污泥中分离鉴定得到,以有机杂环类物质为碳源生长的菌种〔14〕。焦化废水中同样含有杂环类物质,因此该菌株在第二阶段丰度略有提高。与Band 8和9同源性最高的Uncultured bacterium cloneWu-C105和Uncultured bacterium cloneWu-C62都是从石油化工废水处理系统中鉴定得到。Band 24自始至终都存在于DGGE图谱中,与其同源性最高的Uncultured bacterium clone B-vesi-9-g5-f是在石油污染的土壤中鉴定得到的。对比运行末期两个反应器微生物DGGE图谱发现,Band 9、19、21所代表的菌种在流化床内丰度更高。其中,Band 19在基因数据库中与Uncultured bacterium clone F1Q32TO04EDBNQ的同源性达到99%,该菌是在生物膜过滤系统中鉴定得到的。可知,沸腾床在运行后期某些功能性菌群的丰度相比于流化床更低,因此流化床反应器更有利于降解优势菌群的繁殖。
4 结论
(1)流化床内部污泥在气流的带动下有规律地循环流动,使得污泥分布更为均匀,创造了良好的传质条件。当提高污泥负荷后,流化床的出水效果优于沸腾床,二者COD平均去除率分别为81%、73%。
(2)污泥负荷对反应器内微生物群落结构有很大影响。两种反应器在提高污泥负荷后微生物群落均发生了较大变化,并在运行后期形成了不同的微生物群落结构。沸腾床中在运行后期逐渐消失的菌属所占的比例较高,而流化床在运行后期丰度逐渐提高的菌属比例高于沸腾床,污泥负荷的提高对微生物生长的刺激作用更为明显。
(3)在其他运行条件相同的情况下,微生物群落结构的差异主要是由污泥的流态和混合程度造成的。运行后期流化床中的微生物群落结构与接种污泥的相似性系数高于沸腾床,二者分别为55.1%、34.4%。提高进水污泥负荷对沸腾床内微生物种群的冲击更大,致使其种群丰富度下降较快,Shannon指数由1.38降为1.17。沸腾床在运行后期某些功能性菌群的丰度相比于流化床更低,这与两种反应器运行效率差异和抗冲击负荷能力有直接的联系。流化床在宏观去除率,维持菌种丰富度方面具有较大优势。
[1]韦朝海,朱家亮,张涛.新型流化床内流体重构的流体力学特性变化及其数值模拟[J].化工学报,2012(10):3062-3069.
[2]WinklerM H,Kleerebezem R,de Bruin LMM,etal.Microbialdiversity differenceswithin aerobic granular sludge and activated sludge flocs[J].Applied Microbiology and Biotechnology,2013,97(16):7447-7458.
[3]Pholchan M K,Baptista JDC,DavenportR J,etal.Systematic study of theeffectofoperating variableson reactor performanceandmicrobialdiversity in laboratory-scale activated sludge reactors[J].Water Research,2010,44(5):1341-1352.
[4]von Canstein H,Kelly S,Li Y,et al.Species diversity improves the efficiencyofmercury-reducingbiofilmsunderchangingenvironmental conditions[J].Applied and Environmental Microbiology,2002,68(6):2829-2837.
[5]AkarsubasiA T,Eyice O,Miskin I,etal.Effectof sludge age on the bacterial diversity of bench scale sequencing batch reactors[J].Environmental Science&Technology,2009,43(8):2950-2956.
[6]Falk MW,Wuertz S.Effectsof the toxin 3-chloroaniline at low concentrations onmicrobial community dynamics andmembrane bioreactor performance[J].Water Research,2010,44(17):5109-5115.
[7]Kundu K,Sharma S,Sreekrishnan TR.Effectof operating temperatureson themicrobialcommunityprofilesin ahigh celldensityhybrid anaerobic bioreactor[J].Bioresource Technology,2012,118:502-511.
[8]于皓,陈川,张莉,等.溶解氧对碳氮硫共脱除工艺中微生物群落影响解析[J].环境科学,2013(6):2368-2374.
[9]潘霞霞,李媛媛,黄会静,等.焦化废水中硫氰化物的生物降解及其与苯酚、氨氮的交互影响[J].化工学报,2009,60(12):3089-3096.
[10]Zhou Sheng,WeiChaohai,Ke Lin,etal.PCR-DGGE asa supplementalmethod verifying dominance of culturable microorganisms from activated sludge[J].JournalofMicrobiology and Biotechnology,2010,20(11):1592-1596.
[11]张斌,孙宝盛,季民,等.MBR中微生物群落结构的演变与分析[J].环境科学学报,2008(11):2192-2199.
[12]易欣怡,韦朝海,吴超飞,等.O/H/O生物工艺中焦化废水含氮化合物的识别与转化[J].环境科学学报,2014,34(9):2190-2198.
[13]郭洪娜,田一梅,赵彩云,等.再生水处理过程微生物种群分析[J].工业水处理,2013,33(3):25-28.
[14]钱丽花,陈立伟,任倩,等.1株草除灵高效降解菌的分离鉴定与降解特性研究[J].环境科学,2011,32(6):1805-1811.
——————
Succession and analysis ofm icrobial flora of the fluidized bed reactorand the boiling bed reactor
Ding Yining1,WeiChaohai1,Wu Haizhen2,Lin Zhudong1
(1.College ofEnvironmentand Energy,South China University of Technology,Guangzhou 510006,China;2.CollegeofBioscienceand Bioengineering,South China University of Technology,Guangzhou 510006,China)
The fluidized bed reactor and the boiling bed reactor have been used for treating cokingwastewater.The operation efficiency and microbial flora change of the two kinds of reactors are compared.The results indicate that the COD removing rate of the fluidized bed reactor ishigher than thatof the boiling bed reactor after sludge loading has been increased.Increasing the influent sludge loading has greater impact on themicroorganisms in the boiling bed reactor,resulting in obvious decrease of species abundance of boiling bed reactor.The results prove that the fluidized bed reactorhasgreater superiority inmacroscopic removing rate and keeping the abundance ofstrains.
fluidized bed reactor;boiling bed reactor;microbial flora
X703
A
1005-829X(2016)03-0030-05
国家自然科学基金项目(51278199,21037001);中央高校基本科研业务费培育项目(2013ZP0017)
丁逸宁(1990—),硕士。电话:13826067645,E-mail:536587450@qq.com。
2016-01-15(修改稿)
