黄河鲤金属硫蛋白基因的克隆及表达分析
2016-09-09左鹏举王春秀高春生
左鹏举,王春秀,高春生
(河南农业大学 牧医工程学院,河南 郑州 450002)
黄河鲤金属硫蛋白基因的克隆及表达分析
左鹏举,王春秀,高春生*
(河南农业大学 牧医工程学院,河南 郑州 450002)
采用RT-PCR方法克隆获得黄河鲤(Cyprinus carpio)金属硫蛋白基因的编码区(CDS)序列,该序列长183bp,编码60个氨基酸,不含芳香族氨基酸,其中20个半胱氨酸(Cys)集中分布在肽链的N端和C端,具有MT典型的Cys-X(1~3个)-Cys结构,预测分子量为6013D,理论等电点为8.38。经多序列比对,黄河鲤与高身鲫(Carassius cuvieri)的同源性最高,达94%。采用RT-qPCR进行黄河鲤MT的组织表达分析,结果表明:黄河鲤MT基因的表达存在组织性差异,其相对表达量表现为肝脏>肾脏>腮>脑>肌肉。
金属硫蛋白基因;黄河鲤;实时荧光定量;表达分析
金属硫蛋白(MetaIIothionein,MT)是一类低分子量、富含半胱氨酸,能被金属离子、氧化损伤以及免疫刺激等多种因素诱导产生的分泌型蛋白[1]。MT在生物进化上较为保守[2],目前已知的分离出来的MT的分子大小和形状基本一致。MT广泛存在于动物体内,具有很强的金属结合能力和氧化还原能力,除维持金属动态平衡和重金属解毒外,还可参与清除自由基、拮抗电离辐射和抗应激等[3]。
黄河鲤(Cyprinus carpio)属鲤形目、鲤科,是我国北方重要的经济鱼类,其分布广泛、生命力强,对水环境变化反应灵敏[4]。我们以黄河鲤为研究对象,克隆了它的MT编码区序列,并监测了其MT基因的组织表达差异,以期明确其MT基因的功能及表达,为将MT作为黄河鲤养殖水环境污染监测的生物标志的研究提供理论基础[5]。
1 材料与方法
1.1材料与试剂
1.1.1试验动物黄河鲤取自河南省水产研究所,体长(13.37±1.09)cm,尾均重(32.70±8.76)g。试验前暂养7d,挑选健康活泼的个体进行试验[6]。饲养池水温(19±1)℃,pH(7.1±1.0)。暂养和试验用水均为曝气48h的自来水。
1.1.2试剂Trizol、DEPC水、pMD19-TVector、反转录试剂盒、凝胶回收试剂盒、质粒提取试剂盒、SYBRGreenⅡ均购自TAKARA公司;CuSO4·5H2O、氯仿、异丙醇、无水乙醇均为国产分析纯试剂:宿主菌株为DH5a,购自天根生化科技有限公司。
1.2方法
1.2.1总RNA的提取及反转录按照Trizol试剂盒说明书提取黄河鲤肝脏、肾脏等5个组织的总RNA;用紫外分光光度计测定总RNA的纯度和浓度;用1%琼脂糖凝胶电泳检测RNA的完整性;提取的总RNA于-80 ℃保存[7]。
1.2.2引物设计及反转录用DNAstar软件通过比对NCBI上已登录的青鱂(NC019864)、罗非鱼(S75042)、鲫鱼(S75039)、鲤鱼(AF002162)等鱼类的MT基因编码区序列,获得高度保守的序列,再用软件Primer5.0设计1对特异性引物:上游5′-ATGGATCCGTGCGAATGC-3′;下游5′-TCACTGGCAGCAGCTGGTG-3′。取1000ng总RNA,根据反转录试剂盒说明书合成cDNA,反应条件为37 ℃ 15min,85 ℃ 5s。
1.2.3MT基因的克隆及测序所得PCR产物经1%琼脂糖凝胶电泳,用凝胶回收试剂盒对目的片段进行纯化回收;将纯化产物与pMD19-T载体连接,转化到大肠杆菌(Escherichia coli)的DH5a感受态细胞中,于37 ℃培养过夜;挑单菌落(蓝白斑筛选)扩大培养,提取质粒送上海生工测序[8]。
1.2.4MT基因的序列分析通过BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)在线比对,寻求高度同源的序列;用PortParam(http://web.expasy.org/cgi-bin/protparam/protparam)计算蛋白分子量、等电点、不稳定系数等;用SignalP3.0Server(http://www.cbs.dtu.dk/services/SignalP-3.0/)检测其有无信号肽序列;用ProScale(http://web.expasy.org/protscale/)以默认算法进行疏水性分析;用MEGA5.0软件以邻位相连法构建进化树,进行分子进化分析[9-10]。
1.2.5实时荧光定量PCR检测MT基因的组织表达提取黄河鲤肾脏、肝脏、肌肉、脑和腮组织的总RNA,采用TAKARA反转录试剂盒进行反转录。根据已克隆的MT编码区序列,用软件Primer5.0按照qPCR的引物设计原则设计两对引物:目的基因MT上游5′-AGACTGGAACTTGCAACTGTG-3′,下游5′-CTTACACACGCAGCCAGAG-3′,产物128bp;内参基因Actin-β上游5′-CAGACTACCTCATGAAGATCC-3′,下游5′-CGAAGTCAAGAGCCACATAGC-3′,产物114bp。
RT-qPCR反应体系为20μL:SYBRGreenⅡ10μL、上下游引物各1μL、模板cDNA2μL、DEPCH2O6μL。反应条件为:95 ℃ 10min、95 ℃ 15s、60 ℃ 1min,40个循环;60~95 ℃熔解曲线,15 ℃ 1min终止。
2 结果与分析
2.1黄河鲤MT基因及氨基酸序列分析
黄河鲤MT基因编码区长183bp,编码60个氨基酸(如图1所示),其中半胱氨酸(Cys)含量最高,达33.3%,赖氨酸(Lys)和丝氨酸(Ser)均占11.7%,不含芳香族氨基酸。Portparam预测蛋白分子式为C220H374N72O82S21,分子量6013D,理论等电点8.38,半衰期30h,不稳定系数34.46,脂溶指数9.83;经信号肽检测为非分泌性蛋白,无信号肽结构;ProScale预测MT中部偏右有较强的疏水区,两端为亲水区。
该MT氨基酸序列富含典型的Cys-X(1~3个)-Cys结构(X为半胱氨酸以外的其他氨基酸),其中含6个C-X-C结构,即CEC、CNC、CKC、CQC、CPC、CVC;3个C-XX-C结构,即CTNC、CKTC、CSKC;5个C-XXX-C结构,即CGASC、CKKSC、CPSGC、CASGC、CGTSC;3个CC结构,且具有与其他鱼类相同的特征序列CSKCXXXCCXCX(CSKCASGCVCK)[11]。
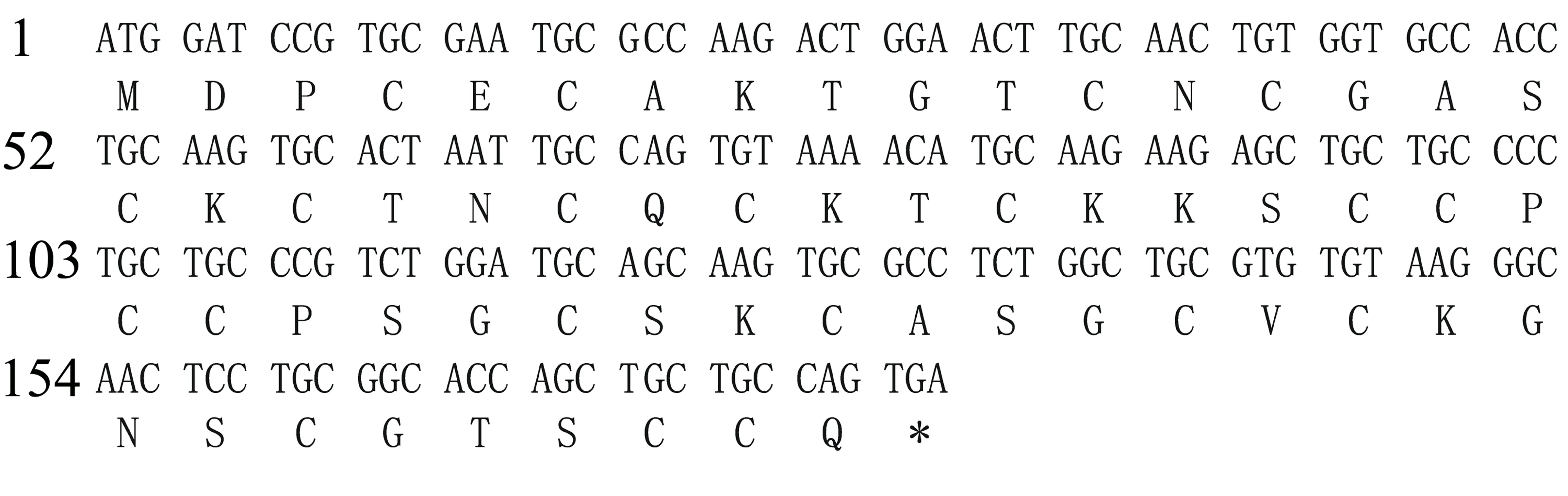
图1 黄河鲤MT基因CDS序列及其编码的氨基酸序列
2.2同源性及分子进化分析
经NCBI上Blast在线比对,黄河鲤MT基因序列与其他鱼类具有高度的同源性,其中与高身鲫(Carassius cuvieri)的同源性最高,达94%;与花斑裸鲤(Gymnocypris eckloni)的同源性为93%;与斑马鱼(Danio rerio)的为92%;与稀有鮈鲫(Gobiocypris rarus)的为90%;与北方条鳅(Nemacheilus barbatulus)的为88%;与条石鲷(Oplegnathus fasciatus)的为84%。经氨基酸同源性比对, 黄河鲤与稀有鮈鲫、斑马鱼、大头鮈(Gobio)、家鼠(Musculus)、人(Homo sapiens)的同源性分别为95%、93%、92%、67%、62%。
用MEGA5.0采用NJ法(Neighbor-joining)构建黄河鲤MT的系统进化树,采用Bootstrap进行检验[12],结果如图2所示。由图2可见:黄河鲤与高身鲫、花斑裸鲤的亲缘关系最近;与金鱼、斑马鱼的亲缘关系较近;与暗纹东方鲀、棘蚌的亲缘关系较远;与马的亲缘关系最远。黄河鲤MT的分子进化地位与黄河鲤的生物分类地位基本一致。
2.3MT的组织表达量
经优化,参与RT-qPCR的两对引物的扩增效率均达90%~110%,扩增曲线呈理想的“S”形,熔解曲线呈尖锐的单峰,表明建立了良好的黄河鲤MT基因的相对荧光定量监测方法。采用2-△△Ct方法监测到MT在黄河鲤的肝脏、肾脏、肌肉、腮和脑中均有表达,但表达量存在差异,其中在肝脏中的表达量最高,其次是在肾脏、腮、脑和肌肉中的(图3)。
3 讨论
MT的分类方法有多种,主要参照氨基酸序列中Cys的排列方式,将其分为MT-Ⅰ、MT-Ⅱ两种类型;MT-Ⅰ类型根据Cys残基的排列特征又分为1型和2型两种亚型。1型MT中Cys的排列方式一般为C-X-C,而2型MT的Cys排列方式具有C-X-C、C-X-X-C、C-X-X-X-C的特征[13],所以黄河鲤MT应该属于MT-Ⅰ的2亚型。已有研究证明,鱼类MTs基因在结构和功能上具有高度的相似性。本研究利用基因组学方法,根据鱼类MT保守区域设计引物,克隆了黄河鲤MT的编码区序列;经多序列比对,该基因的核苷酸同源性和氨基酸同源性存在差异,可能是由比对动物基因全长不一致和空缺位导致的;同源性分析表明该MT在鱼类中是高度保守的[14];经分析,黄河鲤MT编码区共编码60个氨基酸,为稳定的碱性蛋白质。
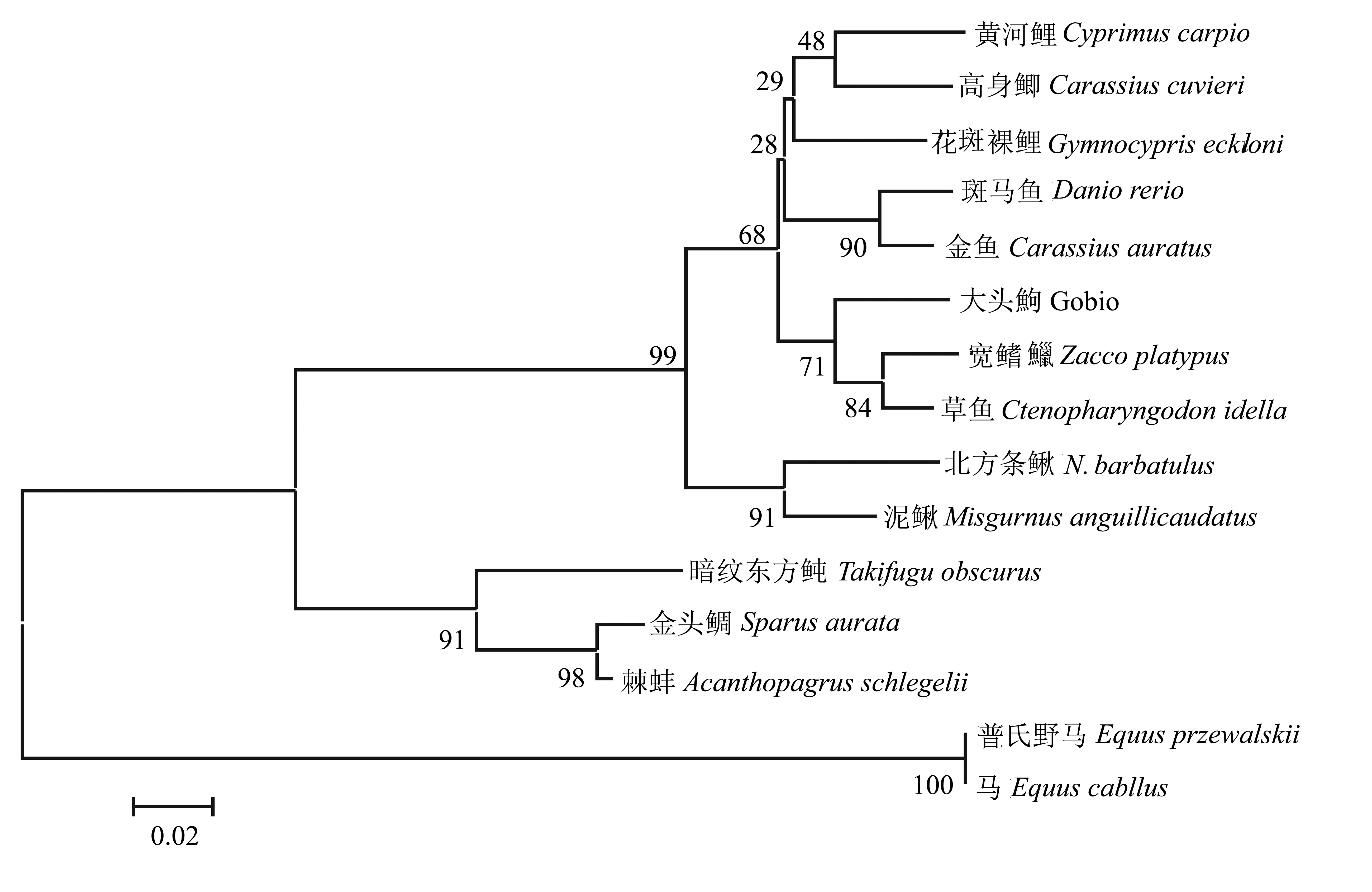
图2 基于黄河鲤MT基因的系统进化树
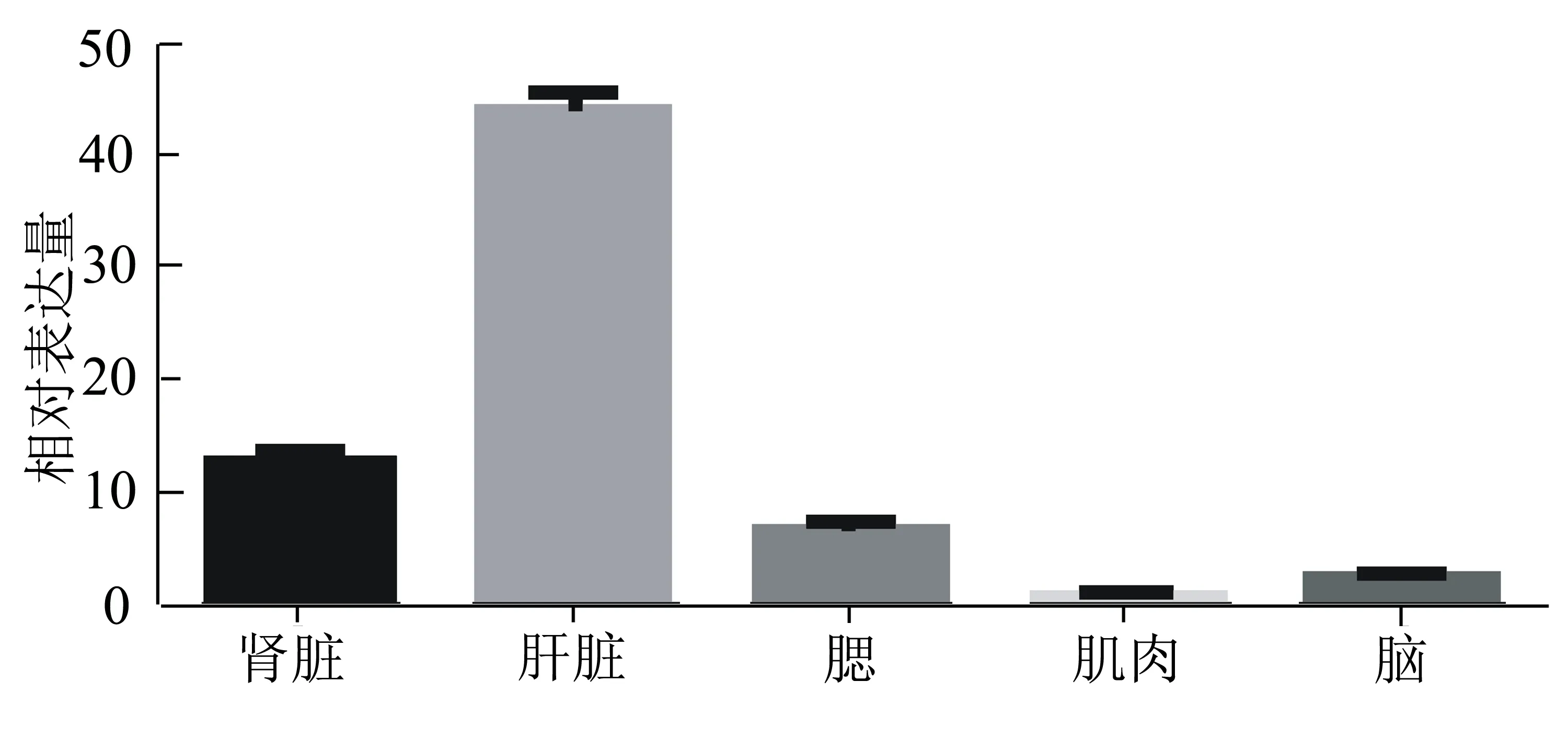
图3 黄河鲤MT基因的组织表达量
关于MT在水生动物组织中的分布情况,不同研究者得出的结果有所差异[15]。在本研究中,MT表达量在肝脏中最高,其次是在肾脏、腮和脑中的,而在肌肉中的表达量最少。这与Chavez-Cooker[16]和周彦锋等[17]的研究结果相似。这是因为肝脏和肾脏是机体主要的解毒和排毒器官,是MT合成的主要部位,所以在这两个组织中MT表达量较高;而腮组织具有呼吸和过滤功能,较先接触外界刺激,脑部含有中枢神经系统,所以MT含量也较高,可能是保护脑免受氧化应激的影响[15]。
[1] 吕新芳,毛伟腾,滑朝阳,等.海洋无脊椎动物金属硫蛋白研究进展[J].海洋通报,2015,34(3):241-246.
[2] 李诗逸,孙继鹏,易瑞灶,等.金属离子对水生动物体内金属硫蛋白应激诱导研究进展[J].水产科学,2014,33(9):594-600.
[3] 王磊,杨联,吴建平,等.山羊金属硫蛋白-Ⅲ基因克隆及序列分析[J].中国畜牧兽医,2010,37(12):92-95.
[4] 安立会,郑丙辉,付青,等.以梭鱼金属硫蛋白基因表达监测海洋重金属污染[J].中国环境科学,2011,31(6):1383-1389.
[5]HöcknerM,DallingerR,StürzenbaumSR.Metallothioneingeneactivationintheearthworm(Lumbricus rubellus) [J].BiochemicalandBiophysicalResearchCommunications, 2015, 460(3): 537-542.
[6]NorioM,RenHW.Inductionoftwomajorinfusionsofmetallothioneinincarp[J].ComparativeBiochemistryandPhysiology:PartC, 1999, 122: 75-82.
[7] 王诚远,胡芳琴,刘国凤,等.池碟蚌金属硫蛋白基因的原核表达及活性分析[J].南昌大学学报,2014,38(2):161-165.
[8] 石壮壮,毛勇,乔莹.日本囊对虾金属硫蛋白基因cDNA的克隆及组织表达分析[J].厦门大学学报,2015,54(4):444-448.
[9]EatonDL,BrianFT.EvaluationoftheCd/hemoglobinaffinityassayfortherapiddeterminationofmetallothioneininbiologicaltissues[J].ToxicologyandAppliedPharmacology, 1982, 66(1): 134-142.
[10] 许凡凡,贺丹,孙晓红,等.白假丝酵母荧光定量PCR鉴定方法的建立[J].中国实验诊断学,2015,19(4):528-531.
[11]CoudrayMC.AcomparativestudyofdigitalRT-PCRandRT-qPCRforquantificationofhepatitisAvirusandNorovirusinlettuceandwatersamples[J].InternationalJournalofFoodMicrobiology, 2015, 201: 17-26.
[12] 李彩娟,王磊,凌去非.镉胁迫对泥鳅金属硫蛋白基因表达的影响[J].水生态学杂志,2014,35(3):88-93.
[13] 王雪莹,吉菩忠,马琦.天祝白牦牛金属硫蛋白基因的克隆及表达[J].甘肃农业大学学报,2014,49(4):12-17.
[14]PeynotN,VéroniqueD,DaulatRK.GeneexpressionanalysisinearlyembryosthroughreversetranscriptionquantitativePCR(RT-qPCR) [J].NuclearReprogrammingSpringerNewYork, 2015: 181-196.
[15] 郑丽明,周发林,杨其彬,等.斑节对虾金属硫蛋白cDNA克隆及表达分析[J].水生生物学报,2011,35(6):913-919.
[16]TuzelE.Associationofmetallothioneinexpressionandclinicalresponsetocisplatinbasedchemotherapyintesticulargermcelltumors[J].CentralEuropeanJournalofUrology, 2015, 68(1): 45.
[17] 周彦锋,吴伟,胡庚东,等.镉锌联合诱导金属硫蛋白在鲫鱼肝脏和肾脏中的表达[J].生态环境学报,2009,18(3):811-816.
(责任编辑:黄荣华)
CloningandExpressionAnalysisofMetallothioneinGeneinCyprinus carpio
ZUOPeng-ju,WANGChun-xiu,GAOChun-sheng*
(CollegeofAnimalHusbandryandVeterinaryScience,HenanAgriculturalUniversity,Zhengzhou450002,China)
TheCDSsequenceofmetallothionein(MT)geneinCyprinus carpiowasclonedbyusingRT-PCR.Thissequencewas183bpinfulllength,encoded60aminoacidresidues,anddidnotcontainanyaromaticaminoacids.Twentycysteine(Cys)wereconcentratedlydistributedattheNterminalandCterminalofthepeptidechainwiththetypicalstructureofCys-X(1~3individuals)-Cys.Itsmolecularweightwaspredictedtobe6013D,andtheoreticalisoelectricpointwas8.38.Inaddition,themultiplesequencealignmentshowedthattheMTgeneinCyprinus carpiosharedthehighestidentity(94%)withthatinCarassius cuvieri.ThetissueexpressionofMTgeneinCyprinus carpiowasanalyzedbyusingRT-qPCR,theresultsindicatedthattherelativeexpressionlevelofMTgeneinvarioustissueswasdifferent,andshowedthefollowingorder:liver>kidney>gill>brain>muscle.
Metallothioneingene; Cyprinus carpio;Real-timeqPCR;Expressionanalysis
2016-02-11
河南省科技攻关项目(30601204)。
左鹏举(1990─),男,河南新郑人,硕士研究生,主要从事水产养殖方面的研究工作。*通讯作者:高春生。
S965.116
A
1001-8581(2016)08-0066-04
