苦参碱对胰腺癌吉西他滨耐药及Aurora-A表达的影响
2016-09-09朱锦辉陈燕叶清煌占小莉王跃东
朱锦辉 陈燕 叶清煌 占小莉 王跃东
苦参碱对胰腺癌吉西他滨耐药及Aurora-A表达的影响
朱锦辉 陈燕 叶清煌 占小莉 王跃东
目的 探讨苦参碱对胰腺癌吉西他滨耐药及Aurora-A表达的影响。方法 不同浓度苦参碱联合吉西他滨处理PANC-1及其耐药细胞株PANC-1/R2,流式细胞技术检测细胞株凋亡情况;qPCR法测定Aurora-A mRNA表达。结果 流式细胞技术显示苦参碱和吉西他滨不同给药方式在PANC-1组和合PANC-1/R2组内凋亡率差异无统计学意义,但两组间比较差异有统计学意义。qPCR结果,PANC-1组在空白对照、吉西他滨(400μg/ml)、苦参碱(8μg/ml)及吉西他滨(400μg/ml)联合苦参碱(8μg/ml)处理后,Aurora-A mRNA表达分别是(1.001±0.041),(0.884±0.063),(0.884±0.063)和(0.957±0.084),与对照组比较差异均无统计学意义(P>0.05);PANC-1/R2组分别是(1.835±0.072),(1.761±0.052),(1.879±0.068)和(1.910±0.086),与对照组比较差异无统计学意义(P>0.05)。结论 苦参碱与吉西他滨联合作用具有诱导胰腺癌细胞凋亡的抗肿瘤作用,但不能逆转胰腺癌吉西他滨耐药的作用,不能增加化疗敏感性,也不具有调节Aurora-A表达的作用。提示苦参碱可通过诱导凋亡途径发挥抗胰腺癌作用,但其作用不十分显著。
苦参碱 胰腺癌 Aurora-A 吉西他滨 耐药
现代医学研究表明,苦参类生物碱具有较高的抗肿瘤活性[1],同时又具有免疫调节作用﹑升高白细胞[2]﹑止痛等常规化疗药物所不具备的优势,近来还发现其能逆转肿瘤对化疗药物的耐药性。研究[3,4]认为苦参碱可通过诱导胰腺癌细胞凋亡﹑下调VEGF表达等方式发挥抗肿瘤作用。虽有研究表明苦参碱具有逆转化疗药物耐药的报道,但是否能逆转胰腺癌吉西他滨的耐药及调节Aurora-A表达尚缺乏研究。2015年3月至9月作者通过实验研究,探讨苦参碱对胰腺癌吉西他滨耐药及Aurora-A表达的影响。
1 材料与方法
1.1材料与试剂 实验动物:鼠龄4周,体重18~20g的雄性BALB/c裸小鼠(浙江中医药大学动物实验中心提供和饲养)。细胞株:人胰腺癌细胞株PANC-1及耐药株PANC-1/R2(浙江大学医学院附属第二医院外科研究所提供)。戊巴比妥钠:中国医药集团上海化学试剂公司产品。qPCR仪:Biorad公司。
1.2细胞凋亡检测 用不含EDTA 的胰酶消化细胞,取1E+5个细胞量的悬液,加入5μl Annexin V-APC,混匀后,再加入5μl 7-AAD染液,混匀,室温,避光,反应5~15min后置于冰上。<1h进行流式细胞仪机检测。GFP的绿色荧光:FITC通道筛选GFP阳性细胞进行Annexin V-APC/7-AAD荧光检测。Annexin V-APC的红色荧光:激发波长633nm,最大发射波长660nm。7-AAD红色荧光:激发波长Ex=546nm;发射波长Em=647nm。
1.3qPCR检测 qPCR实验所用AMV和Tag聚合酶为 TaKaRa公司产品,dNTP和引物由上海生工生物工程公司提供及合成。取约50mg组织,加入1ml Trizol试剂(Gibco),按试剂说明书抽提总RNA,对获得的RNA进行分析和定量,取2 μg RNA逆转录,合成cDNA。实验所用引物序列经GeneBank网上验证,引物序列及目的片段长度见表 l。然后进行PCR扩增,扩增产物于1.2%琼脂糖凝胶电泳,用DNA Marker确定产物。
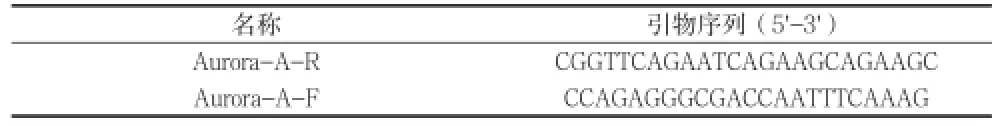
表1 Aurora -A引物序列
1.4统计学分析 采用SPSS14.0软件。计数资料用%表示,用χ2检验,P<0.05为差异有统计学意义。
作者单位:310009 浙江大学医学院附属第二医院 外科
2 结果
2.1不同浓度苦参碱和吉西他滨联合处理对两组细胞凋亡的影响 PANC-1组的无苦参碱无吉西他滨作用﹑吉西他滨400μg/ml而无苦参碱作用﹑吉西他滨400μg/ml联合浓度4μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度8μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度16μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度32μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度64μg/ml苦参碱作用下凋亡细胞 占15.7%﹑15.7%﹑15.2%﹑12.1%﹑17.4%﹑16% 和14.2%,PANC-1/R2组的无苦参碱无吉西他滨作用﹑吉西他滨400μg/ml而无苦参碱作用﹑吉西他滨400μg/ml联合浓度4μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度8μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度16μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度32μg/ml苦参碱作用﹑吉西他滨400μg/ml联合浓度64μg/ml苦参碱作用下凋亡细胞占5.9%﹑6.1%﹑8.3%﹑10.0%﹑7.0%﹑7.6%和3.9%,两组间凋亡细胞差异有统计学意义(P<0.05),见图1﹑2。
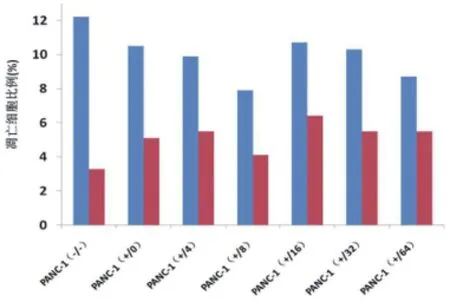
图1 流式细胞技术检测PANC-1不同处理下细胞凋亡情况

图2 流式细胞技术检测PANC-1/R2不同处理下细胞凋亡情况
2.2苦参碱和吉西他滨对Aurora-A表达的影响 通过qPCR技术检测PANC-1和PANC-1/R2细胞株Aurora-A mRNA的表达情况,发现PANC-1组在空白对照﹑吉西他滨(400μg/ml)﹑苦参碱(8μg/ml)及吉西他滨(400μg/ml)联合苦参碱(8μg/ml)处理后,Aurora-A mRNA表达分别是(1.001±0.041)﹑(0.884±0.063)﹑(0.884±0.063) 和(0.957±0.084),与对照组比较差异均无统计学意义(P>0.05);PANC-1/R2组分别是(1.835±0.072),(1.761±0.052),(1.879±0.068)和(1.910±0.086),与对照组比较差异无统计学意义(P>0.05)。见图3﹑4。

图3 PANC-1在苦参碱和吉西他滨不同处理后Aurora-A mRNA的表达
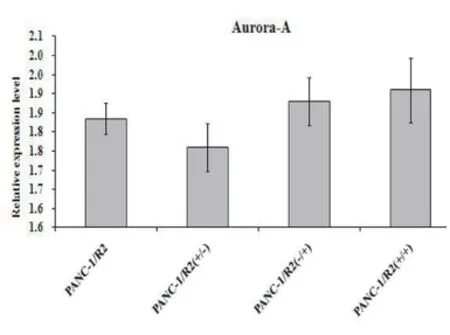
图4 PANC-1/R2在苦参碱和吉西他滨不同处理后Aurora-A mRNA的表达
3 讨论
苦参碱是我国传统中药-苦参根提取物中的纯成分之一。苦参碱是豆科植物苦参﹑苦豆子﹑广豆根等中草药活性成分的提取物,其化学式为C15H24 N20,属于四环的噻嗪啶类,分子骨架为2个噻嗪啶的杂体[5]。现代研究表明苦参碱具有广泛的抗肿瘤特性,涵盖消化﹑呼吸﹑耳鼻咽喉﹑神经﹑血液﹑内分泌等几乎全身的各个系统肿瘤[6],如在体外其有抗鼠移植性肿瘤的作用;可诱导K562和SMMC-7721细胞分化;临床也有苦参及苦参碱(如吗特灵注射液)对白血病﹑肝癌和胃癌治疗有效的报道[7]。各种研究表明苦参碱的抗肿瘤作用可以通过抑制肿瘤细胞增殖﹑诱导肿瘤细胞分化﹑促进肿瘤细胞凋亡﹑抑制肿瘤细胞粘附转移﹑逆转肿瘤细胞耐药性和调节宿主免疫功能等方面发挥作用[8~11]。目前认为临床效果较确切的是血液系统及神经内分泌系统,对胰腺癌的作用研究较少。侯武卫[12]将不同浓度的苦参碱作用于培养的SW1990细胞,通过MTI"比色法﹑流式细胞仪和DNA凝胶电泳﹑电子显微镜技术观察检测细胞凋亡,研究分析其对SW1990细胞的生长抑制和诱导凋亡作用。通过结果分析认为苦参碱能抑制SW1990细胞增殖,诱导其凋亡。
本资料中浓度0﹑4﹑8﹑16﹑32﹑64μg/ml的苦参碱联合400μg/ml吉西他滨作用于PANC-1和耐药株PANC-1/R2,流式细胞技术检测PANC-1/R2在不同浓度苦参碱和吉西他滨及不同处理方式作用下的凋亡情况,结果显示PANC-1组的各种处理下凋亡细胞比例为12.1%~17.4%,而PANC-1/R2组为3.9% ~8.3%,两组间凋亡细胞差异有统计学意义(P<0.05),但组内的抑制率差异无统计学意义。表明吉西他滨耐药细胞株筛选成功,但两组中均可见不同浓度苦参碱作用下,细胞凋亡率变化不大,不具有明显的逆转耐药的作用。研究认为多药耐药MDR的发生,主要以肿瘤细胞多药耐药mdrl基因表达的膜糖粘蛋白P170过度表达﹑肺耐药蛋白LRP水平升高﹑肿瘤细胞DNA拓扑异构酶Ⅱ(TOPO Ⅱ)等相关酶活性增加[13]。文献报道,苦参碱口服给药可抑制化疗诱导的获得性多药耐药小鼠S180肿瘤细胞耐药相关基因P170﹑LRP的表达及TOPOⅡ活性[11];又有研究用苦参碱作用于K562长春新碱耐药株(K562Pvin)和K562阿霉素耐药株(K562Pdox),其抑制率约70%,同时伴有P糖蛋白表达的下调,表明苦参碱可能通过下调糖蛋白诱导细胞凋亡而达到杀伤多药耐药肿瘤细胞的作用[14]。但本资料结果未发现耐药逆转的现象,可能苦参碱的逆转化疗耐药作用具有肿瘤属性,对不同肿瘤发挥不同的作用。进一步的研究苦参碱作用下,PANC-1/R2细胞株耐药相关基因P170﹑LRP的表达﹑TOPOⅡ活性及P糖蛋白等的表达可进一步明确苦参碱对胰腺癌吉西他滨耐药的无逆转作用。
Aurora-A激酶是新近发现的调节中心体﹑微管功能的丝氨酸/苏氨酸蛋白激酶,在中心体成熟﹑纺锤体形成﹑染色体分离,即有丝分裂的正常进行中发挥至关重要的作用。Aurora-A认为是与肿瘤预后相关的基因之一,其表达的异常可引起细胞的过度增殖﹑与侵袭转移﹑肿瘤细胞凋亡抑制﹑调节自噬诱导耐药等[15~17]。本资料通过qPCR技术检测PANC-1和PANC-1/R2细胞株Aurora-A mRNA的表达情况,发现PANC-1组在空白对照﹑吉西他滨(400μg/ml)﹑苦参碱(8μg/ml)及吉西他滨(400μg/ml)联合苦参碱(8μg/ml)处理后,Aurora-A mRNA表达分别是(1.001±0.041),(0.884±0.063),(0.884±0.063) 和(0.957±0.084),与对照组比较差异均无统计学意义(P>0.05);对应的PANC-1/R2组分别是(1.835±0.072),(1.761±0.052),(1.879±0.068) 和(1.910±0.086),与对照组比较差异无统计学意义(P>0.05)。结果表明Aurora-A在敏感和耐药细胞间存在表达差异,但苦参碱和吉西他滨作用下在两组中其表达无明显改变,即使两者联合作用,Aurora-A表达亦无明显改变,提示苦参碱和吉西他滨不具有直接调节Aurora-A激酶的作用。可见苦参碱联合吉西他滨作用胰腺癌可增强诱导细胞凋亡的作用,但这种诱导凋亡的作用不十分强烈,更多的是吉西他滨的细胞毒作用,同时两者联合作用也不能改变Aurora-A激酶的表达。
1罗明,贺平,吴孟超,等. 苦参碱对二乙基亚硝胺诱发大鼠肝癌的预防作用.肿瘤,2001,21(4):239~241.
2CCNSC. Cancer chemotheraphy Screening Data. Cancer-Res, 1996,24(12):1499~1453.
3侯武卫, 徐玉生, 苗金红. 苦参碱诱导胰腺癌细胞凋亡的实验研究.医药论坛杂志,2007, 28(5): 20~21.
4冀润利,夏时海,李飞,等. 氧化苦参碱对人胰腺癌细胞血管内皮生长因子表达的影响.世界华人消化杂志,2010,18(32):3402~3406.
5Lai J P,He XW,Jiang Y,et al.Preparative Separation and detemination of matrine from the Chinese medicinal plant Sophora flavescens Ait by molecularly imprinted solid phase extraction.Anal Bioanal Chem,2003,375(2):264.
6肖硕.苦参碱多种抗癌功效研究进展.实用医学杂志,2010,26(24):4605~4606.
7申晓东,宋关斌,严润彬,等.苦参碱和氧化苦参碱抗肿瘤作用的研究进展.重庆大学学报(自然科学版),2005,28(6):125~128.
8Shiratori H,Koshino T,Uesμgi M,et al.exceleration of lung metastasis by up-regulation of CD544 expression in osteosar coma derived cell ransplanted mice.Cancer Lett,2001,170:177~182.
9朱宁希,罗文纪,虞荣喜,等.苦参碱对自血病细胞诱导分化作用和机理研究.上海中医药大学学报,2001,15(1):43~44.
10李伏娥,朱陵群,叶红军,等.苦参碱诱导人胃癌细胞凋亡及对端粒酶活性的影响.中国现代医学杂志,2005,15(12):1809~1812.
11孙付军,王宁,李贵海,等.苦参碱对获得性多药耐药小鼠S180肿瘤细胞基因表达产物P170、LRP及TOPOⅡ表达的影响.中药材,2004, 27(11):838~840.
12侯武卫,徐玉生,苗金红.苦参碱诱导胰腺癌细胞凋亡的实验研究.医药论坛杂志,2007,28(5):20~21.
13BracBcy G.Mechanism of multi-drug resistance.Bio-chim Biophys Acta,1988:9488~9487.
14丁艳芳,谢霞,赵瑾瑶,等.苦参碱逆转人白血病K562/ADM细胞对阿霉素耐药性的研究.大连医科大学学报,2004,26(4):256~260.
15Borges K S, Castro-Gamero A M , Moreno D A ,et al. Inhibition of Aurora kinases enhances chemosensitivity to temozolomide and causes radiosensitization in glioblastoma Cells. J Cancer Res Clin Oncol,2012,138:405~414.
16Terakawa T, Miyake H, Kumano M,et al. Growth inhibition and enhanced chemosensitivity induced by down-regulation of Aurora-A in human renal cell carcinoma Caki-2 cells using short hairpin RNA. Oncol Let,2011, 2: 713~717.
17Okada T, Sawada T, Osawa T, et al. MK615 inhibits pancreatic cancer cell growth by dual inhibition of Aurora A and B kinases. World J Gastroenterol,2008,14(9): 1378~1382.
Objective To evaluate the effect of matrine on inducing apoptosis of pancreatic cancer cells,and regulating the expression of Aurora-A and reversing gemcitabine-resistance of pancreatic cancer. Methods Apoptosis of PANC-1 and PANC-1/R2 cells were analyzed by Flow Cytometry after treatment of matrine and gemcitabine. Aurora-A gene expression of PANC-1 / and PANC-1/R2 were analyzed by qPCR after treatment of matrine and gemcitabine. Results The outcome of Flow cytometry shows that apoptosis rates of pancreatic cells had no signifi cant difference in groups but signifi cant difference between the PANC-1 and PANC-1/R2 groups. The same phenomenon was found of Aurora-A mRNA expression in the two groups. Conclusions The combination of matrine andh gemcitabine can induce apoptosis of pancreatic cancer cells,but can not reverse the effects of gemcitabine-resistance of pancreatic cancer,can not increase sensitivity to chemotherapy,also has no impact on expression of Aurora-A. The results indicates that matrine can play a certain role of anti-pancreatic cancer by inducing apoptosis.
Matrine Pancreatic carcinoma Aurora-A Gemcitabine Resistance
浙江省中医药优秀青年人才基金项目(2013ZQ022);浙江省医药卫生科技计划项目(2012KYB018)
