HCY-2在正常人胚消化系统发育中的作用
2016-09-08张元元李耀康王光明大理大学临床医学院内科病理科云南大理67000
张元元,李耀康,王光明△(大理大学临床医学院:.内科;.病理科,云南大理67000)
HCY-2在正常人胚消化系统发育中的作用
张元元1,李耀康2,王光明2△(大理大学临床医学院:1.内科;2.病理科,云南大理671000)
目的研究同型半胱氨酸诱导基因2(HCY-2)在人胚消化系统发育的主要器官食管、胃、小肠和肝脏中的表达,探讨HCY-2在消化系统发育中的作用。方法收集不同时期正常发育的人胚食管、胃、小肠和肝脏,采用免疫组织化学卵白素-生物素-过氧化物酶复合物法和图像分析技术对食管、胃、小肠和肝脏HCY-2的表达进行半定量分析。结果HCY-2在人胚食管、胃、小肠和肝脏发育的整个过程中均表达,不同妊娠期表达强弱不等,表达蛋白主要分布在消化管黏膜上皮细胞和肝细胞内,并且分布在细胞质中。HCY-2在食管黏膜上皮细胞的表达,妊娠中期最强,妊娠早期最弱;HCY-2在胃黏膜上皮细胞的表达,近足月最强,妊娠中期最弱;HCY-2在小肠黏膜上皮细胞和肝细胞的表达随着胚胎的发育而逐渐减弱,妊娠早期最强,近足月最弱。结论HCY-2可能参与了人胚消化管和消化腺的发育。
高半胱氨酸;基因;消化系统/胚胎学;免疫组织化学;同型半胱氨酸诱导基因-2;人胚;消化管;消化腺
同型半胱氨酸诱导基因2(homocysteine induced gene-2,HCY-2)是用同型半胱氨酸刺激体外培养血管平滑肌时克隆的新基因[1-2],在成年大鼠肝脏、肺脏、肾脏、心脏、血管、脊髓和脑组织等器官,以及在人胚心脏发育过程中广泛表达[3-4],在畸形人体胚胎心脏中的表达异常[4]。王光明等[5]研究发现,用同型半胱氨酸刺激培养的心肌细胞增殖与HCY-2的表达密切相关,但HCY-2在人胚消化系统中的表达及HCY-2表达异常与消化系统发育畸形的关系尚鲜见报道。为探讨人胚消化系统发育中HCY-2的表达状态,本研究采用免疫组织化学方法分析发育不同时期正常人胚食管、胃、小肠和肝脏HCY-2的表达变化,旨在揭示HCY-2表达蛋白在人胚消化系统发育中的作用。
1 材料与方法
1.1材料(1)HCY-2抗体购自北京大学医学部心血管研究所。(2)正常人胚(胎龄以受精龄计算)20例,其中妊娠早期(4~8周)人胚6例,妊娠中期(3~4个月)人胚5例,妊娠晚期(5~6个月)人胚5例,近足月(8个月以上)人胚4例。以上人胚均来源于北京大学附属第三医院和北京市和平里医院,所有胚胎均因某种原因流产后已死亡。
1.2方法
1.2.1人胚食管、胃、小肠和肝脏的获得取正常发育不同时期的人胚食管、胃、小肠和肝脏,4%多聚甲醛固定、石蜡包埋后,以5 μm厚度组织切片。
1.2.2免疫组织化学卵白素-生物素-过氧化物酶复合物(ABC)法为显示正常发育不同时期人胚食管、胃、小肠和肝脏HCY-2的表达,按照免疫组织化学ABC法步骤进行染色,其中抗HCY-2抗体为1∶800(体积比),阴性对照组用0.1 mol/L、pH7.4的磷酸盐缓冲液代替一抗。
1.2.3图像分析用Q-500图像分析系统测定不同发育时期正常人胚食管、胃、小肠和肝脏HCY-2阳性反应部位的灰度值,同时测定无细胞区域的灰度值为本底值,然后换算为相对含量(任意单位),每张切片随机分析3个视野,每个样本取3张切片。
1.3统计学处理应用SPSS10.0统计软件进行数据分析,各组相对含量以±s表示,采用One-way ANOVA分析,P<0.05为差异有统计学意义。
2 结 果
2.1HCY-2在人胚食管的表达HCY-2在人胚食管发育的整个时期均有表达,其表达主要分布于食管黏膜上皮细胞的细胞质内(图1、表1)。阳性反应由于强度不同而呈现不同颜色,由弱至强为浅黄色、黄色或深棕色,妊娠早期表达最弱,妊娠中期最强;妊娠早期与其他3个时期比较,差异均有统计学意义(P<0.05),妊娠中期与妊娠晚期和近足月比较,差异有统计学意义(P<0.01)。
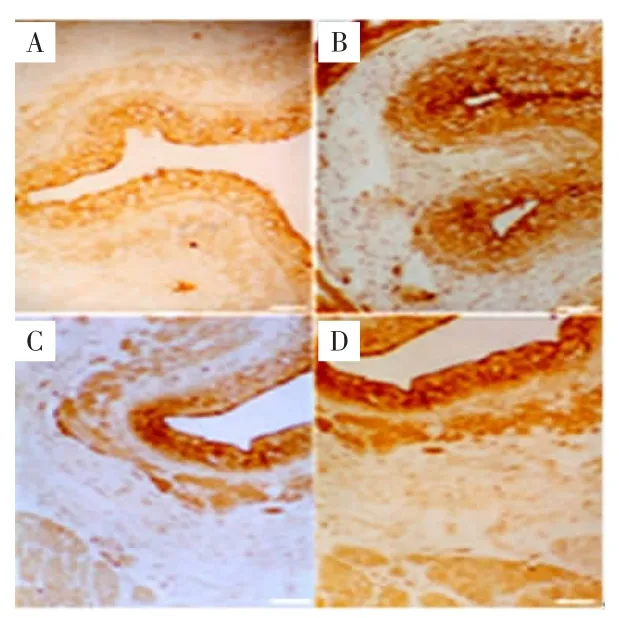
图1 HCY-2在人胚食管的表达(ABC法染色,200×)

表1 不同发育时期正常人胚食管黏膜上皮细胞HCY-2的表达比较
2.2HCY-2在人胚胃的表达HCY-2在人胚胎胃发育的整个时期均有表达,其表达主要分布于胃黏膜上皮细胞的细胞质内(图2、表2)。妊娠中期表达最弱,近足月最强;妊娠晚期与妊娠中期比较,差异有统计学意义(P<0.05),近足月与其他3个时期比较,差异均有统计学意义(P<0.01)。
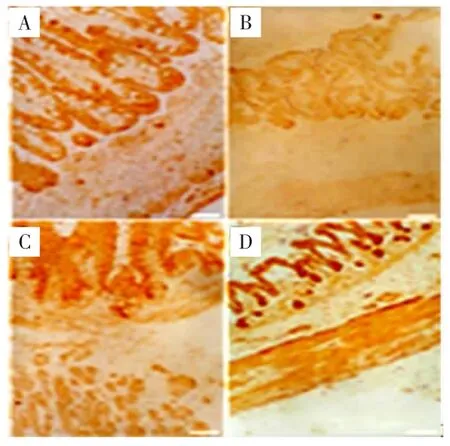
图2 HCY-2在人胚胃的表达(ABC法染色,200×)

表2 不同发育时期正常人胚胃黏膜上皮细胞HCY-2的表达比较
2.3HCY-2在人胚小肠的表达HCY-2在人胚小肠发育的整个时期均有表达,其表达主要分布于小肠黏膜上皮细胞和小肠腺细胞的细胞质内(图3、表3)。HCY-2在小肠黏膜上皮细胞的表达随胚胎的发育而逐渐减弱,妊娠早期最强,近足月最弱;妊娠早期与妊娠晚期和近足月比较,差异均有统计学意义(P<0.01),妊娠中期与妊娠晚期和近足月比较,差异也均有统计学意义(P<0.05)。

图3 HCY-2在人胚小肠的表达(ABC法染色,200×)

表3 不同发育时期正常人胚小肠黏膜上皮细胞HCY-2的表达比较
2.4HCY-2在人胚肝脏的表达HCY-2在人胚肝脏发育的整个时期均有表达,其阳性产物主要分布于肝细胞的细胞质内(图4、表4)。HCY-2在肝细胞的表达随着胚胎的发育而逐渐减弱,妊娠早期表达最强,近足月最弱;妊娠早期与其他3个时期比较,差异均有统计学意义(P<0.01),妊娠中期与妊娠晚期和近足月比较,差异均有统计学意义(P<0.01),妊娠晚期与近足月比较,差异有统计学意义(P<0.01)。

图4 HCY-2在人胚肝脏的表达(ABC法染色,200×)

表4 正常人胚发育不同时期肝脏细胞中HCY-2的表达比较
3 讨 论
HCY-2是陈光慧等[6]用同型半胱氨酸刺激培养的大鼠血管平滑肌细胞而得到的4个新的cDNA序列之一。有研究发现,HCY-2与细胞凋亡密切相关[1,6]。HCY-2在成年SD大鼠的肝脏、肺脏、肾脏、心脏、血管、脊髓和脑组织等器官,以及在人胚心脏发育的整个过程中均持续表达[3-4],但是除心脏外,在胚胎发育时期的其他脏器中是否表达及表达情况尚不清楚。
本研究发现,HCY-2在人胚食管、胃、小肠和肝脏发育的整个时期均表达,其表达蛋白主要分布在消化管的黏膜上皮细胞和肝细胞内,并且分布在细胞质中。李英等[3]研究发现,在成年SD大鼠中,HCY-2在功能活跃或分裂增殖能力强的细胞的器官中表达较高,而在培养的心肌细胞中给予不同剂量的同型半胱氨酸刺激的相关研究显示,HCY-2在培养的人胚心肌细胞内的表达与培养的心肌细胞的增殖呈正相关,其在心肌细胞内高表达,并伴随细胞的增殖率升高,从而说明高表达的HCY-2可以促进心肌细胞的生长和增殖;HCY-2在培养的心肌细胞低表达时,细胞生长率随之降低,从而说明低表达的HCY-2对心肌细胞的生长和增殖具有抑制作用[5]。在人胚食管、胃、小肠和肝脏发育的整个时期,参与构成食管、胃、小肠和肝脏的细胞数量逐渐增多,此时,HCY-2持续表达。推测在人胚食管、胃、小肠和肝脏发育过程中,HCY-2的表达与组成食管、胃、小肠和肝脏的细胞生长、增殖有关,可通过调节细胞增殖以影响或调节人胚消化器官的发育。
有研究在鸡胚中转HCY-2时发现,HCY-2的异常表达可以导致鸡胚包括心内膜垫缺损的心脏结构紊乱,同时还阻碍心室、心房的发育,以及心肌细胞在超微结构水平发生改变[7-9];在培养的人胚心肌细胞给予同型半胱氨酸刺激诱导HCY-2表达改变后,心肌细胞在超微结构水平也发生变化[10]。HCY-2异常表达时鸡胚心血管系统出现包括心脏过小、异位心和心外露等发育畸形。由此认为,HCY-2的异常表达与胚胎畸形密切相关。在内皮细胞的研究中发现,HCY-2的正常表达可以促进内皮细胞凋亡,然而,细胞凋亡对维持胚胎正常发育具有关键作用[11-12]。因此,推测HCY-2的表达产物通过介导细胞凋亡以调节人胚食管、胃、小肠和肝脏的发育。
陈光慧等[6]研究还发现,HCY-2为凋亡促进基因。而王光明等[4]在对室间隔膜部缺损的人胚心脏的研究中发现,HCY-2的表达出现异常,推测在胚胎心脏发育过程中,HCY-2可介导细胞凋亡而参与心脏的分隔。另有研究显示,HCY-2蛋白编码的基因与受体相互作用蛋白家族3(receptor interacting proteins 3,RIP3)基因高度同源[10],为RIP3的同源基因。RIP3基因可以激活半胱天冬酶-2,然后通过一系列的级联反应促进细胞凋亡[13]。在Hela细胞株中,当RIP3基因沉默后,由于环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)不能被激活,从而使有cAMP和cGMP参与的细胞信号转导受阻,细胞无法维持正常功能[14-15]。因此,在人体胚胎发育过程中,HCY-2的表达对食管、胃、小肠和肝脏正常结构的形成具有重要作用,但是还有待于进一步研究其具体作用机制:(1)在细胞水平分别研究食管、胃、小肠和肝脏HCY-2阳性细胞在HCY-2表达改变时细胞增殖、形态的改变;(2)研究在食管、胃、小肠和肝脏畸形的胚胎中HCY-2的表达变化规律;(3)在动物水平通过基因敲入和基因敲除技术使HCY-2表达异常,以研究食管、胃、小肠和肝脏的发育。这样有可能完全阐明HCY-2在胚胎食管、胃、小肠和肝脏发育中的作用及其机制。
[1]陈光慧,张晨辉,朱燕青,等.一个新的高血压病相关基因的克隆和表达[J].中华医学杂志,1997,77(11):823-828.
[2]陈光慧,朱燕青,张晨辉,等.同型半胱氨酸/半胱氨酸诱导血管平滑肌细胞中的新cDNA[J].中国生物化学与分子生物学报,1998,14(1):8-14.
[3]李英,吕丹瑜,毕振伍,等.高同型半胱氨酸诱导基因HCY-2在大鼠体内的表达与分布[J].北京大学学报:医学版,2002,34(4):333-336.
[4]王光明,张淑惠,李英,等.同型半胱氨酸诱导基因在正常和畸形人胚心脏中的表达[J].解剖学报,2004,35(1):96-99.
[5] 王光明,李英,吕丹瑜,等.同型半胱氨酸对人胚心肌细胞HCY-2表达的影响[J].解剖学报,2003,34(1):53-56.
[6]陈光慧,高炜,李勇,等.一种新的细胞凋亡相关基因——高同型半胱氨酸诱导基因HCY-2的功能初探[J].中国医学科学院学报,2000,22(4):383-387.
[7]李勇,陈星,齐佩文,等.同型半胱氨酸对鸡神经胚形成期胚胎的发育毒性和致畸作用初探[J].中国优生优育,1998,9(1):7-9.
[8]李勇,李松,陈光慧,等.HCY-2基因和同型半胱氨酸与鸡胚先天性心脏畸形发生的关系[J].中华医学杂志,2000,80(2):131-134.
[9]李勇,李竹,陈星,等.同型半胱氨酸对鸡胚早期心血管发育的影响[J].中华预防医学杂志,1999,33(3):137-139.
[10]Zhao LJ,Wang GM,Lu DY,et al.Homocysteine,hRIP3 and congenital cardiovascular malformations[J].Anat Embryol(Berl),2006,211(3):203-212.
[11]Jezek D,Kozina V.Apoptosis during embryo development[J].Acta Med Croatica,2009,63 Suppl 2:S37-41.
[12]Velkey JM,Bernanke DH.Apoptosis during coronary artery orifice development in the chick embryo[J].Anat Rec,2001,262(3):310-317.
[13]Sun X,Lee J,Navas T,et al.RIP3,a novel apoptosis-inducing kinase[J].J Biol Chem,1999,274(24):16871-16875.
[14]Wang Z,Jiang H,Chen S,et al.The mitochondrial phosphatase PGAM5 functions at the convergence point of multiple necrotic death pathways[J]. Cell,2012,148(1/2):228-243.
[15]Narayan N,Lee IH,Borenstein R,et al.The NAD-dependent deacetylase SIRT2 is required for programmed necrosis[J].Nature,2012,492(7428):199-204.
Role of HCY-2 in normal human embryonic digestive system development
Zhang Yuanyuan1,Li Yaokang2,Wang Guangming2△(1.DepartmentofInternalMedicine;2.DepartmentofPathology,ClinicalCollege,DaliUniversity,Dali,Yunnan671000,China)
ObjectiveTo research the expression of homocysteine induced gene(HCY-2)in the main organs of esophagus,stomach,small intestine and liver during the human embryonic digestive system development and its role in digestive system development.MethodsThe different periods of normal developmental human embryonic esophagus,stomach,small intestine and liver were collected and the HCY-2 expression in these organs was semi-quantitatively analyzed by adopting the immunohistochemical avidin-biodin-peroxidase compound method and image analysis technique.ResultsHCY-2 was expressed during the whole development process of human embryonic esophagus,stomach,small intestine and liver.Different pregnant stages had different expression intensities.The expression protein was mainly distributed in the mucosal epithelial cells of digestive tube and hepatocytes,moreover in the cytoplasm.The expression of HCY-2 in esophageal mucosal epithelial cells was strongest in middle stage of pregnancy and weakest in the early stage of pregnancy;the expression of HCY-2 in the stomach mucosal epithelial cells wasstrongestnearfullterm andweakestin the middle stage ofpregnancy;the expression ofHCY-2in smallintestine mucosalepithelial cells and liver cells was attenuated gradually following embryo developing,which was strongest in the early pregnancy and weakest near full term.ConclusionHCY-2 could participate in the development of human embryonic digestive tube and digestive glands.
Homocysteine;Genes;Digestive system/embryology;Immunohistochemistry;Homocysteine induced gene 2;Human embryo;Digestive tube;Digestive gland
10.3969/j.issn.1009-5519.2016.01.013
A
1009-5519(2016)01-0038-03
张元元(1974-),硕士研究生,副教授,主要从事内科学教学与研究工作。
△,E-mail:420869015@qq.com。
(2015-10-25)
